Зачем нужен анализ на скрытую кровь?
При подозрении на проблемы с кишечником при диагностике есть возможность обойтись малой кровью. Причем, в буквальном смысле – нужно просто сделать соответствующий лабораторный тест. Анализ кала на скрытую кровь уже больше полувека широко используется в медицине, поскольку является удобным и простым способом выявить незаметную кровопотерю к кишечнике. Как показали исследования, смертность от рака ободочной кишки, например, может быть снижена на 30% только благодаря ежегодному проведению такого анализа.
Но у этого теста есть ограничения – перед тем, как его сдать, нужно 3-4 дня соблюдать особую исключить мясо слабой прожарки, сырокопченые колбасы, так как тест- система может «увидеть» в пробе кала животный гемоглобин и дать так называемый «ложноположительный» результат.
Начинать – с простого
Наличие явно заметной крови в кале совсем необязательно говорит о чем-то страшном. Чаще всего она свидетельствует о банальном геморрое или анальной трещине.
Отставить панику!
Впадать в панику, получив положительный результат такого теста, не следует. Положительный результат теста – это повод для дополнительного обследования. Помимо рака толстой и прямой кишки у появления крови в кале могут быть и другие причины: также язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит, эрозивный эзофагит, паразитарная инфекция и другие.
Значимость исследования повышается, если делать его не эпизодически, а регулярно – раз в год. Особенно этот ежегодный анализ важен для пациентов в возрасте старше 40 лет.
Подготовка – дело серьезное
Трещина анального канала или геморрой могут приводить к появлению свежей крови в кале, видимой невооруженным глазом. Свежая кровь может не давать положительного результата в этом тесте. Тест- система настроена таким образом, что реагирует не на наличие клеток крови эритроцитов, а на белки, выпадающие из клеток крови при распаде гемоглобина. Именно это дает нам возможность видеть уже измененную кровь, а не свежую, которую видно и так. Тест позволяет заподозрить наличие источника кровотечения на протяжении всего желудочно- кишечного тракта.
Но главное – стул должен быть собран естественным путем, без применения слабительных средств (неважно каких – в виде препаратов или клизм). Еще одно существенное требование – не допускать попадания в собранный кал мочи и воды. Если проводилась рентгенодиагностика ЖКТ, то анализ можно проводить только спустя 2-3 дня. А после проведения инструментальных исследований желудочно-кишечного тракта нужно выждать две недели.
Если проводилась рентгенодиагностика ЖКТ, то анализ можно проводить только спустя 2-3 дня. А после проведения инструментальных исследований желудочно-кишечного тракта нужно выждать две недели.
Что касается соблюдения особой диеты перед сдачей анализа, то сегодня такой необходимости уже нет. Тест проводится высокоточным иммунохроматографическим методом с использованием специфических тел к гемоглобину и трансферрину, благодаря этому никаких ограничений в рационе соблюдать не нужно.
Поделиться статьей:
Остались вопросы?Скрытая кровь в кале (колоректальные кровотечения), количественный иммунохимический метод FOB Gold (quantitative immunochemical Fecal Occult Blood Test FOB Gold)
Исследуемый материал Кал
Метод определения
Иммунохимический (FOB Gold).
Анализ кала на скрытую кровь является классическим тестом, применяемым для ранней диагностики рака толстой и прямой кишки. На сегодняшний день это единственное лабораторное исследование, рекомендованное для ежегодного обследования всех людей в возрасте старше 50 лет для своевременной диагностики колоректального рака [3].
Предлагаемый тест на скрытую кровь в кале предназначен для диагностики скрытых кровотечений из нижних отделов желудочно-кишечного тракта. Этот метод лишен недостатков старых, менее специфичных химических методов (гваяковая, бензидиновая пробы). Указанные химические пробы на гемоглобин давали положительную реакцию не только на гемоглобин человека, но и на гемоглобин и миоглобин животного происхождения, поступающий с пищей, а также на некоторые химические вещества, содержащиеся в пищевых продуктах, витаминах, поэтому требовали строгой преаналитической подготовки к исследованию в течение нескольких дней перед исследованием.
Сосуды на поверхности колоректального полипа или злокачественного новообразования часто бывают хрупкими и легко повреждаются при прохождении каловых масс. При этом в фекалии выделяется небольшое количество крови, которое редко заметно на глаз. Результат теста не несет информацию о том, в какой части пищеварительного тракта имеет место кровотечение и чем оно вызвано. Поэтому в случае положительного результата теста рекомендуют провести колоноскопию, чтобы понять причину появления крови в кале (полип, рак, язвы, геморроидальные узлы, дивертикулез, воспалительные заболевания кишечника).
В иммунохроматографических тестах на скрытую кровь используют антитела к интактному человеческому гемоглобину и глобину (в отличие от пероксидазных проб, гваяковой и бензидиновой, в основе которых лежит реакция с гемом). Поэтому иммунохимический метод, проявляя более высокую чувствительность и специфичность в выявлении кровотечений на уровне ободочной и прямой кишки, в то же время нечувствителен к скрытым кровотечениям в верхних отделах желудочно-кишечного тракта, где белковая часть гемоглобина подвергается перевариванию.
Поэтому иммунохимический метод, проявляя более высокую чувствительность и специфичность в выявлении кровотечений на уровне ободочной и прямой кишки, в то же время нечувствителен к скрытым кровотечениям в верхних отделах желудочно-кишечного тракта, где белковая часть гемоглобина подвергается перевариванию.
Доказана целесообразность применения тестов на скрытую кровь в кале в скрининговых программах для раннего выявления колоректального рака, с рекомендацией последующей колоноскопии при положительном результате теста. Такой алгоритм скрининга населения, по оценкам, позволяет снизить смертность от этого заболевания на 25%. В возрасте после 50 лет (а в группе риска, в случае наследственной предрасположенности после 40-45 лет) такое исследование целесообразно проводить ежегодно. Более информативно 2-3-кратное взятие проб кала. По оценкам, около трети пациентов на стадии, когда опухоль еще не выходит за пределы слизистой оболочки (по классификации Dukes A) могут быть не обнаружены при единичном скрининговом тесте на скрытую кровь в кале.
Насколько срочно нужно делать колоноскопию у пациентов с положительным анализом кала на скрытую кровь
23.12.2017
Отсрочка более 12 месяцев значительно повышает вероятность наличия колоректального рака: вдвое для локализованного и втрое для распространенного
 При положительном результате гастроэнтерологи рекомендуют проведение колоноскопии для выявления и возможного удаления малигнизированных или предраковых полипов до появления каких-либо симптомов.
При положительном результате гастроэнтерологи рекомендуют проведение колоноскопии для выявления и возможного удаления малигнизированных или предраковых полипов до появления каких-либо симптомов.«В этом исследовании мы получили убедительные доказательства того, что колоноскопия должна проводиться в течение нескольких месяцев после положительного анализа кала на скрытую кровь», — сказал ведущий автор исследования, Дуглас Корли (Douglas A Corley), врач-гастроэнтеролог Kaiser Permanente, Северная Калифорния.
В исследовании, опубликованном в JAMA (Журнал американской медицинской ассоциации) проанализировали данные 70 124 человека в возрасте от 50 до 75 лет со средним риском развития колоректального рака, у которых были положительные результаты FIT с 2010 по 2013 год. В течение одного месяца колоноскопия была выполнена 40 процентам пациентов, в течение двух месяцев — 64 % и в течение трех месяцев — 74 %.
По сравнению с периодом наблюдения от восьми до 30 дней, исследование не выявило существенных различий в рисках развития колоректального рака при выполнении колоноскопии через два, три, четыре, шесть, семь или девять месяцев. Однако, при выполнении колоноскопии через 10-12 месяцам риск наличия рака толстой кишки увеличился примерно на 50 процентов, а риск наличия распространенного рака почти удвоился. Ожидание более 12 месяцев увеличивало риски еще больше: вдвое для локализованного и втрое для распространенного колоректального рака.
Однако, при выполнении колоноскопии через 10-12 месяцам риск наличия рака толстой кишки увеличился примерно на 50 процентов, а риск наличия распространенного рака почти удвоился. Ожидание более 12 месяцев увеличивало риски еще больше: вдвое для локализованного и втрое для распространенного колоректального рака.
Колоректальный рак выявили у 3% людей с положительными результатами FIT (2 191 случай). Менее у 1% из них (601 случаев) обнаружили распространенные опухоли. Результаты исследования скорректировали с учетом различий между пациентами, у которых проводились более ранние и поздние обследования.
«Данные выводы должны помочь снизить беспокойство людей с положительным результатом FIT», — сказал гастроэнтеролог Kaiser Permanente, доктор Теодор Р Левин (Theodore R Levin), старший автор исследования и глава отдела скрининга колоректального рака в Kaiser Permanente Северной Калифорнии.
«Пациенты тратят довольно много времени и усилий для выполнения колоноскопии, учитывая необходимость временного прекращения работы и невозможность самостоятельно добраться до дома после», — добавил Левин.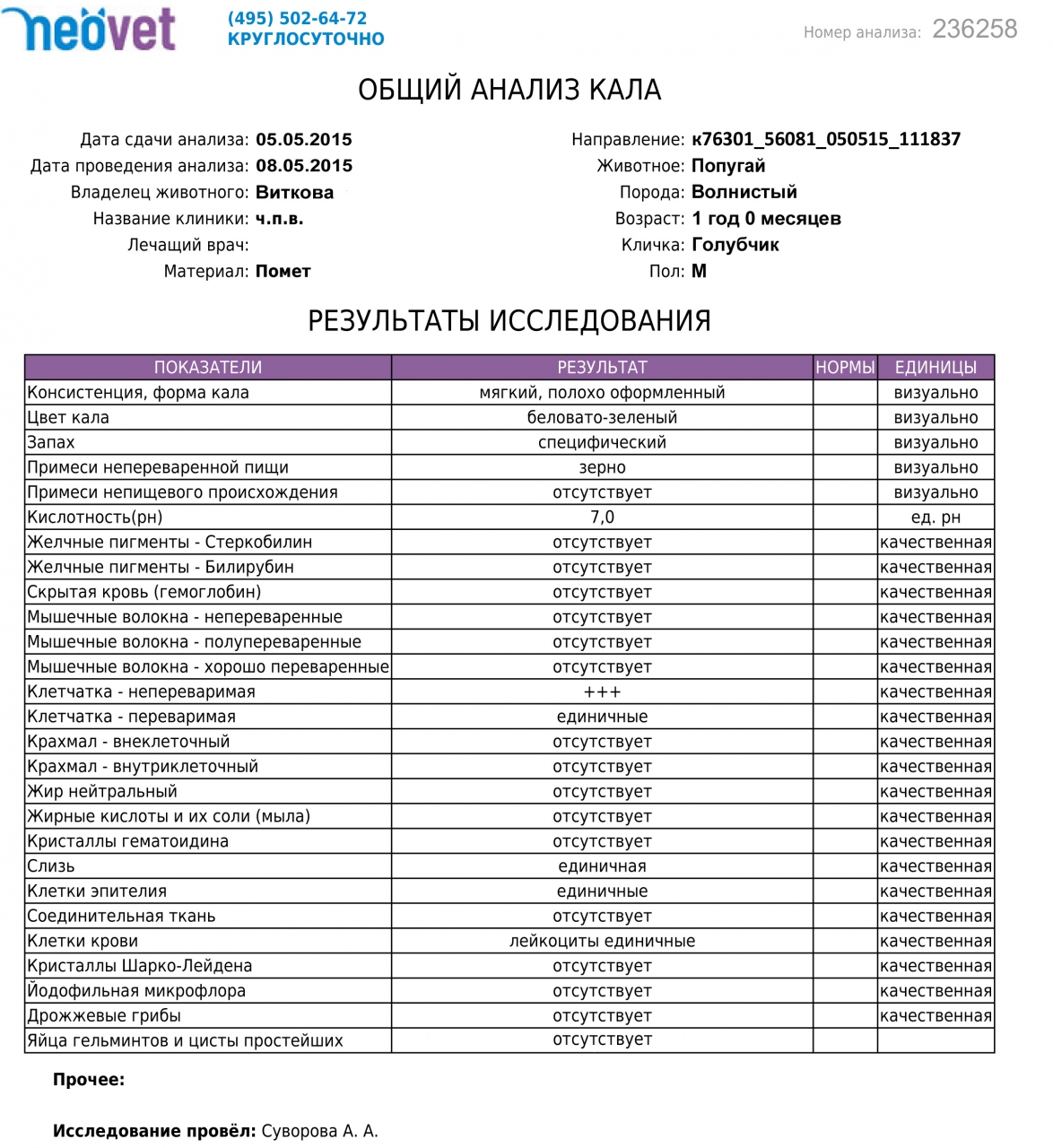 «Наше исследование показывает, что вы должны выполнить колоноскопию как только это будет возможно, но в любое время в течение нескольких месяцев».
«Наше исследование показывает, что вы должны выполнить колоноскопию как только это будет возможно, но в любое время в течение нескольких месяцев».
Колоректальный рак — вторая по значимости причина онкологической смертности в США, согласно данным Центров по контролю и профилактике заболеваний. Сотрудники данных центров рекомендуют людям в возрасте от 50 до 75 лет без достоверно высокого риска развития колоректального рака выполнять анализ кала на скрытую кровь ежегодно, колоноскопию каждые 10 лет, а сигмоидоскопию каждые пять лет.
Исследования кала — копрограмма, анализ на скрытую кровь, анализ на гельминтов. Где сделать платный срочный анализ кала в Москве?
Исследования кала
Исследования кала проводятся для выявления патологий желудочно-кишечного тракта. Общеклиническое исследование кала (копрологическое исследование или копрограмма) позволяет оценить способность органов ЖКТ переваривать пищу. В результате копрологического исследования могут быть обнаружены признаки нарушения функции печени, поджелудочной железы, тонкого кишечника и т.д. Другие виды исследований кала позволяют обнаружить паразитов. Востребованным видом исследования является анализ на скрытую кровь. Наличие скрытой крови в кале может указывать на желудочное или кишечное кровотечение.
В результате копрологического исследования могут быть обнаружены признаки нарушения функции печени, поджелудочной железы, тонкого кишечника и т.д. Другие виды исследований кала позволяют обнаружить паразитов. Востребованным видом исследования является анализ на скрытую кровь. Наличие скрытой крови в кале может указывать на желудочное или кишечное кровотечение.
Кал собирается в чистую и сухую посуду. Женщинам во время месячных сдавать анализ не рекомендуется. Кал должен быть получен без применения слабительных средств или клизмы, путем естественной дефекации. Иногда врач может назначить специальную диету, содержащую определенное содержание белков, жиров и углеводов, которой надо придерживаться в течение нескольких дней до сдачи анализа. При анализе на скрытую кровь за 3 дня до сдачи анализа следует исключить из диеты продукты, которые могут обусловить ложноположительный результат; это – мясо, рыба, зеленые овощи, помидоры, яйца. Если Вы принимаете какие-либо лекарственные препараты, сообщите об этом врачу, – возможно, Вам придется на время прекратить их приём или отложить сдачу анализа.
Сдать кал на исследование в Москве Вы можете в любой из поликлиник «Семейного доктора». Сделать срочный анализ кала (в режиме CITO) в Поликлинике № 15 (ст.м. Бауманская). Ниже указаны цены на исследования кала, выполняемые в собственной лаборатории «Семейного доктора».
Уважаемые пациенты!
Обращаем Ваше внимание, что стоимость визита к врачу не всегда совпадает с указанной ценой приёма.
Окончательная стоимость приема может включать стоимость дополнительных услуг.
Необходимость оказания таких услуг определяется врачом в зависимости от медицинских показаний непосредственно во время приёма.
Маркеры поражения желудочно-кишечного тракта | Медицинский центр ЛМД
Кальпротектин.
Кальпротектин представляет собой небольшой связывающий кальций белок, состоящий из двух тяжелых и двух легких полипептидных цепей, с молекулярным весом 36 kDa. Белок содержит в своем составе ионы кальция и цинка и обладает бактериостатическим и фунгицидным действием in vitro. Он присутствует в больших количествах в нейтрофилах, в которых составляет до 60% цитозольной фракции, а также в цитоплазме моноцитов и макрофагов. Кальпротектин является продуктом нейтрофильных гранулоцитов, обнаружение которых в кале указывает на воспаление в стенке кишки. Кальпротектин явялется стабильныи и медленно разлагающимся под действием протеаз микроорганизмов, что позволяет исследовать его концентрацию в стуле. Благодаря этому его относят к биомаркерам «фекального воспаления». Кальпротектин стабилен в кале свыше 7 дней при комнатной температуре и равномерно распределен в нем. При активном воспалительном заболевании кишечника наблюдается повышенная миграция лейкоцитов из сосудов в воспаленную слизистую кишки. Исследования выявили высокий уровень корреляции фекального кальпротектина с экскрецией меченых индием-111 лейкоцитов и с показателями интестинальной проницаемости. Наличие кальпротектина в кале отражает количество распавшихся лейкоцитов, таким образом, его концентрация в стуле прямо пропорциональна миграции нейтрофилов в желудочно-кишечный тракт.
Он присутствует в больших количествах в нейтрофилах, в которых составляет до 60% цитозольной фракции, а также в цитоплазме моноцитов и макрофагов. Кальпротектин является продуктом нейтрофильных гранулоцитов, обнаружение которых в кале указывает на воспаление в стенке кишки. Кальпротектин явялется стабильныи и медленно разлагающимся под действием протеаз микроорганизмов, что позволяет исследовать его концентрацию в стуле. Благодаря этому его относят к биомаркерам «фекального воспаления». Кальпротектин стабилен в кале свыше 7 дней при комнатной температуре и равномерно распределен в нем. При активном воспалительном заболевании кишечника наблюдается повышенная миграция лейкоцитов из сосудов в воспаленную слизистую кишки. Исследования выявили высокий уровень корреляции фекального кальпротектина с экскрецией меченых индием-111 лейкоцитов и с показателями интестинальной проницаемости. Наличие кальпротектина в кале отражает количество распавшихся лейкоцитов, таким образом, его концентрация в стуле прямо пропорциональна миграции нейтрофилов в желудочно-кишечный тракт. Хотя кальпротектин является чувствительным маркером воспаления в кишечнике, но это недостаточно специфичный маркер для подтверждения какого-либо диагноза.
Хотя кальпротектин является чувствительным маркером воспаления в кишечнике, но это недостаточно специфичный маркер для подтверждения какого-либо диагноза.
Выявление фекального кальпротектина позволяет дифференцировать больных с синдромом раздраженной толстой кишки от органических причин поражения желудочно-кишечного тракта (ЖКТ). Умеренно повышенные значения кальпротектина отмечаются при поражении слизистой (целиакии, лактозной недостаточности, аутоиммунного гастрита), значительно повышенные концентрации отмечаются при воспалительных заболеваниях кишечника (болезнь Крона, язвенный колит), бактериальных инфекциях ЖКТ, дивертикулах и онкологических заболеваниях, постоянном приеме нестероидных противовоспалительных средств (НПВС). Концентрация фекального кальпротектина выше у новорожденных и детей до 1 года превышает 500 мкг/гр, поэтому определение кальпротектина следует использовать с осторожностью у детей моложе 4 лет. Повышенные концентрации фекального кальпротектина отмечаются более чем у 95% больных с воспалительными заболеваниями кишечника. Концентрация фекального кальпротектина в стуле коррелирует с гистологической и эндоскопической активностью заболевания.
Концентрация фекального кальпротектина в стуле коррелирует с гистологической и эндоскопической активностью заболевания.
Фекальный кальпротектин является простым, неинвазивным и чувствительным маркером активности заболевания и ответа на терапию у тех пациентов, у которых имеется подтвержденный диагноз воспалительных заболеваний кишки. Преимуществом исследования фекального кальпротектина при болезни Крона является то, что повышенные концентрации могут отражать сегментарные поражение тонкой кишки, которая недоступна для эндоскопического и гистологического исследования. Сохраняющиеся повышенные уровни фекального кальпротектина могут указывать на неэффективность терапии, кроме того повышение содержания кальпротектина отмечается при приближающемся обострении заболевания.
В связи с низкой специфичностью, фекальный кальпротектин не может заменить инструментальные методы диагностики болезни Крона. Гистологическое исследование является «золотым стандартом» диагностики и комбинация эндоскопических и визуализационных методов позволяет уточнить объем и распределение поражения кишки. В определенной степени исследование фекального кальпротектина в сочетании с реацией стула на скрытую кровь и специфическими жалобами позволяет отобрать пациентов для проведения колоноскопии. Преимуществом исследования фекального кальпротектина при болезни Крона является то, что повышенные концентрации могут отражать сегментарные поражение тонкой кишки, которая недоступна для эндоскопического и гистологического исследования. Поскольку концентрация фекального кальпротектина в стуле непосредственно коррелирует с гистологической и эндоскопической активностью заболевания, стойко повышенные уровни фекального кальпротектина могут указывать на неэффективность терапии. Кроме того повышение содержания кальпротектина в динамике отмечается при приближающемся обострении заболевания.
В определенной степени исследование фекального кальпротектина в сочетании с реацией стула на скрытую кровь и специфическими жалобами позволяет отобрать пациентов для проведения колоноскопии. Преимуществом исследования фекального кальпротектина при болезни Крона является то, что повышенные концентрации могут отражать сегментарные поражение тонкой кишки, которая недоступна для эндоскопического и гистологического исследования. Поскольку концентрация фекального кальпротектина в стуле непосредственно коррелирует с гистологической и эндоскопической активностью заболевания, стойко повышенные уровни фекального кальпротектина могут указывать на неэффективность терапии. Кроме того повышение содержания кальпротектина в динамике отмечается при приближающемся обострении заболевания.
Анализ кала на скрытую кровь.
Иммунохимический метод определения скрытой крови в стуле (fecal occult blood test — FOBT) оказался крупным открытием и серьезно повлиял на врачебную практику. Его использование уже сегодня изменило выявление (скриниг) одной из самых частых опухолей в развитых странах – рака толстой и прямой кишки. Данное исследование позволяет не только заподозрить опухоль, но еще и ее предшествующие предраковые состояния. К ним в первую очередь относятся аденоматозные полипы на «ножке». Эффект внедрения оказался настолько велик, что Европейским Союзом рекомендовано внедрение иммунохимического метода FOBT вместо всех ранее используемых методов определения скрытой крови в кале.
Его использование уже сегодня изменило выявление (скриниг) одной из самых частых опухолей в развитых странах – рака толстой и прямой кишки. Данное исследование позволяет не только заподозрить опухоль, но еще и ее предшествующие предраковые состояния. К ним в первую очередь относятся аденоматозные полипы на «ножке». Эффект внедрения оказался настолько велик, что Европейским Союзом рекомендовано внедрение иммунохимического метода FOBT вместо всех ранее используемых методов определения скрытой крови в кале.
Белок (глобин), который определяется иммунохимически в кале, при поступлении из желудка переваривается в тонкой кишке. Поэтому скрытые кровотечения в желудке и 12-перстной кишке не выявляются этим методом. Метод не требует подготовки и исключения животных продуктов питания на время исследования по той же причине. Ряд исследователей не находят влияния и лекарственных препаратов на результаты метода FOBT, что позволяет не прерывать проводимого лечения.
Показнием для назначения анализа кала на скрытую кровь являются:
— подозрение на колоректальный рак. Среди особых показаний для регулярного скринига находятся лица с операциями на толстой кишке, лица с семейным анамнезом рака или рецидивирующего аденоматоза толстой кишки, лица пожилого возраста, страдающие сахарным диабетом, получающие НПВС или биологическую терапию, лица с воспалительными заболеваниями кишечника и псориазом. Ценность метода в том, что он позволяет выявить кровотечения только в толстой и прямой кишке то есть обладает избирательностью, в связи с чем метод FOBT показан в качестве основного скринингового метода выявления колоректального рака.
Среди особых показаний для регулярного скринига находятся лица с операциями на толстой кишке, лица с семейным анамнезом рака или рецидивирующего аденоматоза толстой кишки, лица пожилого возраста, страдающие сахарным диабетом, получающие НПВС или биологическую терапию, лица с воспалительными заболеваниями кишечника и псориазом. Ценность метода в том, что он позволяет выявить кровотечения только в толстой и прямой кишке то есть обладает избирательностью, в связи с чем метод FOBT показан в качестве основного скринингового метода выявления колоректального рака.
-воспалительные заболевания кишечника. Пациенты с воспалительными заболеваниями кишечника, манифестирующие в раннем возрасте и протекающие более 10 лет, из-за повышенной угрозы колоректального рака подлежат скринингу FOBT раз в два года. В случае положительного заключения FOB пациентам показана колоноскопия.
-внезапное появление аутоимунного заболевания с недостаточной реакцией на терапию для исключения паранеопластического синдрома, связанного с колоректальным раком.
-перед назначением аспирина или нестероидных противовоспалительных средств целесообразно провести FOBT и повторять его в первые годы приема для исключения патологических скрытых изменений, проявляющихся при назначении данных препаратов. При негативных результатах в связи с высокой специфичности теста можно ограничиться разовым определением. А при положительных результатах и необходимости проведения дальнейшей терапии аспирином проводить тест ежегодно или не реже раза в два года.
— необъяснимая железодефицитная анемия. Возможность скрытых кровопотерь из толстой кишки должна быть исключена в случаях необъяснимой железодефицитной анемии, как например, при целиакии, воспалительных забоелваний кишечника и колоректальном раке.
Точность исследования можно повысить, если одновременно с FOBT провести определение кальпротектина в кале. Кальпротектин повышается при воспалении в толстой кишке, в том числе, почти всегда при новообразовании. Но специфичность кальпротектинового теста для диагностики рака кишечника ниже из-за множества причин для развития воспаления.Поэтому комплексное исследование кальпротектина и FOBT повышает как чувствительность (за счет эффекта кальпротектина) , так и специфичность (за счет FOBT) скринига колоректального рака из одного образца. При получении одного и особенно двух положительных результатов тестах показано проведение неотложной колоноскопии.
Но специфичность кальпротектинового теста для диагностики рака кишечника ниже из-за множества причин для развития воспаления.Поэтому комплексное исследование кальпротектина и FOBT повышает как чувствительность (за счет эффекта кальпротектина) , так и специфичность (за счет FOBT) скринига колоректального рака из одного образца. При получении одного и особенно двух положительных результатов тестах показано проведение неотложной колоноскопии.
Концетрация альфа 1-антитрипсин в стуле.
Альфа-1 антитрипсин (А1АТ) является острофазным сывороточным белком, концентрация которого в крови составляет 1-2 г/л. Основной функцией А1АТ является ингибирование сериновых протеаз, протеолитических ферментов, вырабатываемых пищеварительным трактом, а также клетками иммунной системы. Благодаря этой уникальной функции молекулы А1АТ очень стабильны к деградации протеолитическими ферментами, поэтому могут длительное время сохраняться в содержимом кишки, в то время как другие сывороточные белки подлежат быстрому протеолизу.
Остаточная концентрация А1АТ в стуле является показателем проникновения плазмы в просвет кишечника при ряде патологических состояний, объединяющихся симптомокомплексом «протеин-теряющей энтеропатии». Протеин-теряющая энтеропатия связана с энтеритом, в том числе аллергическим энтеритом, целиакией, карциномой, псевдомембранозным колитом, амилоидозом, язвенным колитом, лимфатической обструкцией, язвенным повреждением слизистой и увеличенной проницаемостью слизистой кишечника. Показнием для проведения теста являются хроническая диарея, абдоминальная боль, прогрессирующая потеря веса, гипоальбуминемия с отечным синдромом, гипонатриемия, анемический синдром, гиповитаминоз.
Определение антигена Helicobacter pylori в стуле.
Выявление антигена H. pylori в кале (HpSA-тест) с использованием моноклональных антител представляет собой высокочувствительный (92%) и специфичный (98%) неинвазивный метод диагностики хеликобактериоза, который, согласно клиническим рекомендациям Маастрихт V/Флорентийского консенсуса по диагностике и лечению хеликобактерной инфекции, может применяться как при первичной диагностике инфекции H.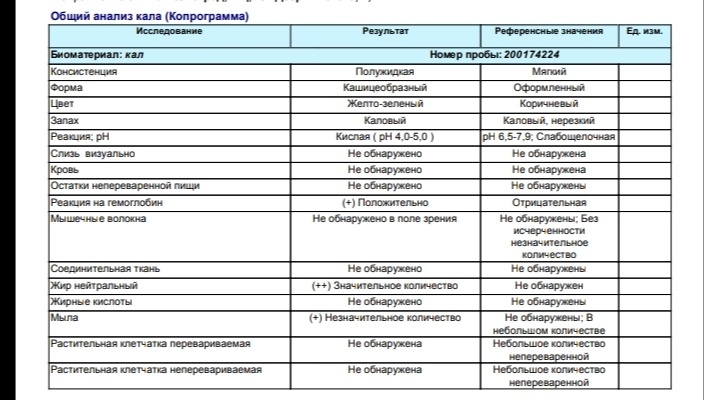 pylori, так и для контроля лечения (не ранее, чем через 4-6 недель после окончания курса антихеликобактерной терапии), а также прогнозирования эффективности антихеликобактерной терапии. Отрицательный результат HpSA-теста свидетельствует об отсутствии антигена H. pylori в кале, однако, при наличии у пациентов симптомов язвенной болезни желудка и двенадцатиперстной кишки, гастрита, дуоденита, рекомендуется повторное проведение исследования, а также использование альтернативных методов диагностики инфекции H. pylori. Факторы, снижающие чувствительность HpSA-теста: кровотечение из верхних отделов желудочно-кишечного тракта, прием ингибиторов протонной помпы и антибактериальных препаратов, состояния атрофии и метаплазии желудочного эпителия. Инфекция Helicobacter pylori напрямую ассоциирована с развитием хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы, аденокарциномы желудка кишечного типа, а также играет определенную роль в развитии ряда экстрагастродуоденальных заболеваний (железодефицитная анемия неуточненной этиологии, идиопатическая тромбоцитопеническая пурпура, дефицит витамина В12, нарушение всасывания лекарственных препаратов (тироксин, леводопа)).
pylori, так и для контроля лечения (не ранее, чем через 4-6 недель после окончания курса антихеликобактерной терапии), а также прогнозирования эффективности антихеликобактерной терапии. Отрицательный результат HpSA-теста свидетельствует об отсутствии антигена H. pylori в кале, однако, при наличии у пациентов симптомов язвенной болезни желудка и двенадцатиперстной кишки, гастрита, дуоденита, рекомендуется повторное проведение исследования, а также использование альтернативных методов диагностики инфекции H. pylori. Факторы, снижающие чувствительность HpSA-теста: кровотечение из верхних отделов желудочно-кишечного тракта, прием ингибиторов протонной помпы и антибактериальных препаратов, состояния атрофии и метаплазии желудочного эпителия. Инфекция Helicobacter pylori напрямую ассоциирована с развитием хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы, аденокарциномы желудка кишечного типа, а также играет определенную роль в развитии ряда экстрагастродуоденальных заболеваний (железодефицитная анемия неуточненной этиологии, идиопатическая тромбоцитопеническая пурпура, дефицит витамина В12, нарушение всасывания лекарственных препаратов (тироксин, леводопа)).
Определение антигена Giardia lamblia в стуле.
Тест определения антигена Giardia lamblia в кале представляет собой высокочувствительный и специфичный маркер для диагностики жиардиаза, особенно в случаях паразитирования лямблий в средних и дистальных отделах тонкой кишки. Лямблиоз (жиардиаз) – кишечная инвазия с преимущественным поражением тонкой кишки, вызываемая у человека одноклеточным паразитом, лямблией кишечной Lamblia intestinalis (синонимы: Giardia intestinalis, Giardia duodenalis, Giardia lamblia). Паразитируя в кишечнике, лямблии нарушают структуру и функцию тонкой кишки, приводя к рецидивирующим или упорным клиническим проявлениям, как правило, сочетающим болевые, диспепсические и астено-невротические симптомы. Признаки сходны с таковыми при других вариантах патологии гастродуоденальной зоны, кишечника, желчевыводящих путей, что делает клиническую диагностику практически невозможной, что, в свою очередь, требует обязательного лабораторного подтверждения диагноза.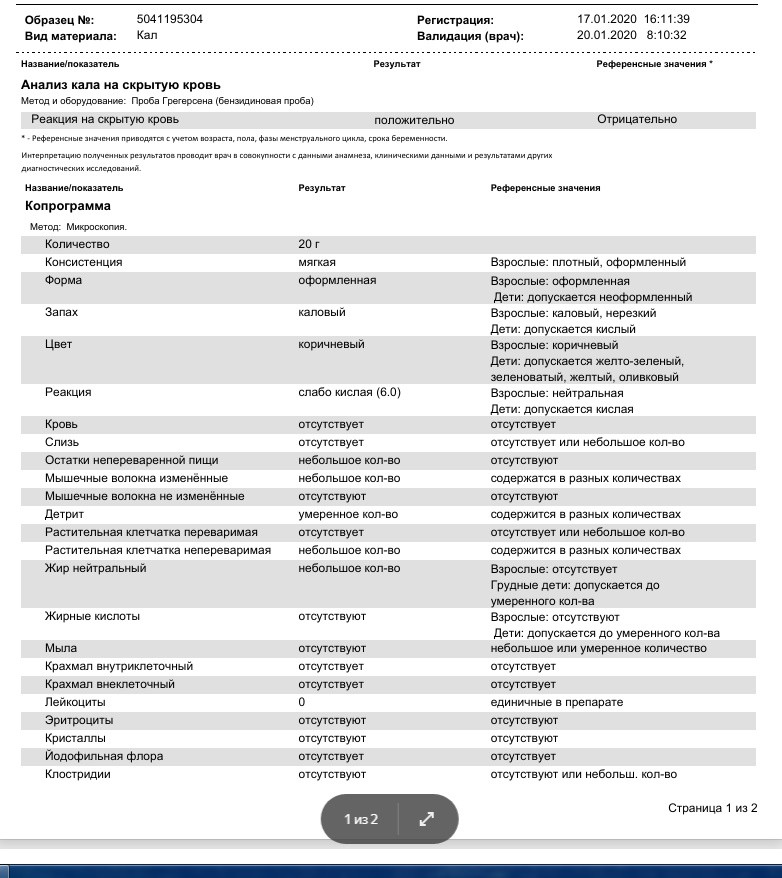
Исследование панкреатической эластазы в кале.
Панкреатическая эластаза I — протеолитический фермент, синтезируемый исключительно ацинарными клетками поджелудочной железы и экскретируемый в просвет двенадцатиперстной кишки вместе с другими ферментами. Панкреатическая эластаза-1 определяется как наиболее чувствительный и специфичный биомаркер в диагностике экзокринной панкреатической недостаточности. Низкие значения концентрации панкреатической эластазы-1 в стуле (<100 мкг/г) свидетельствуют о наличии тяжелой степени экзокринной недостаточности поджелудочной железы, которая может быть обусловлена различными заболеваниями желудочно-кишечного тракта: хроническими панкреатитами, муковисцидозом, карциномой пожелудочной железы, сахарным диабетом 1 типа, холелитиазом, аутоиммунным панкреатитом, целиакией, синдромом раздраженного кишечника, синдромом короткой тонкой кишки, воспалительными заболеваниями кишечника, а также синдромами Швахмана-Даймонда и Золлингера-Эллисона. Результаты определения панкреатической эластазы I не зависят от приема пациентами панкреатических ферментов и ингибиторов протеолиза. Фермент не подвержен воздействиям при прохождении через кишечник, выделяется с калом в неизмененном виде и поэтому может достоверно отражать реальную экзокринную способность поджелудочной железы. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение панкреатической эластазы-1, химотрипсина и кислотного стеатокрита в стуле.
Результаты определения панкреатической эластазы I не зависят от приема пациентами панкреатических ферментов и ингибиторов протеолиза. Фермент не подвержен воздействиям при прохождении через кишечник, выделяется с калом в неизмененном виде и поэтому может достоверно отражать реальную экзокринную способность поджелудочной железы. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение панкреатической эластазы-1, химотрипсина и кислотного стеатокрита в стуле.
Исследование активности химотрипсина в стуле.
Химотрипсин представляет собой специфический протеолитический фермент, продуцируемый в виде белка-предшественника поджелудочной железой и секретируемый в тонкий кишечник, где он активируется трипсином. По изменению уровня активности химотрипсина в стуле можно судить о нарушениях секреции панкреатических ферментов при внешнесекреторной недостаточности поджелудочной железы, в частности, при хроническом панкреатите, а также оценивать эффективность заместительной ферментной терапии. Результаты теста коррелируют с результатами тестов прямой оценки секреции поджелудочной железы после гуморальной стимуляции холецистокинином-секретином. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение химотрипсина, панкреатической эластазы-1 и кислотного стеатокрита в стуле.
Результаты теста коррелируют с результатами тестов прямой оценки секреции поджелудочной железы после гуморальной стимуляции холецистокинином-секретином. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение химотрипсина, панкреатической эластазы-1 и кислотного стеатокрита в стуле.
Оценка стеатокрита для исследование содержания жира в стуле.
Нормальные значения кислотного стеатокрита (0-10%) в большинстве случаев свидетельствуют о нормальном переваривании жиров в стенке кишечника и отсутствии нарушений экзокринной функции поджелудочной железы. При этом для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение кислотного стеатокрита, панкреатической эластазы-1 и химотрипсина в стуле. У детей в первые 6 месяцев и недоношенных детей отмечается «физиологическая стеаторея»: значения кислотного стеатокрита могут достигать до 80-100% без каких-либо различий между режимами кормления.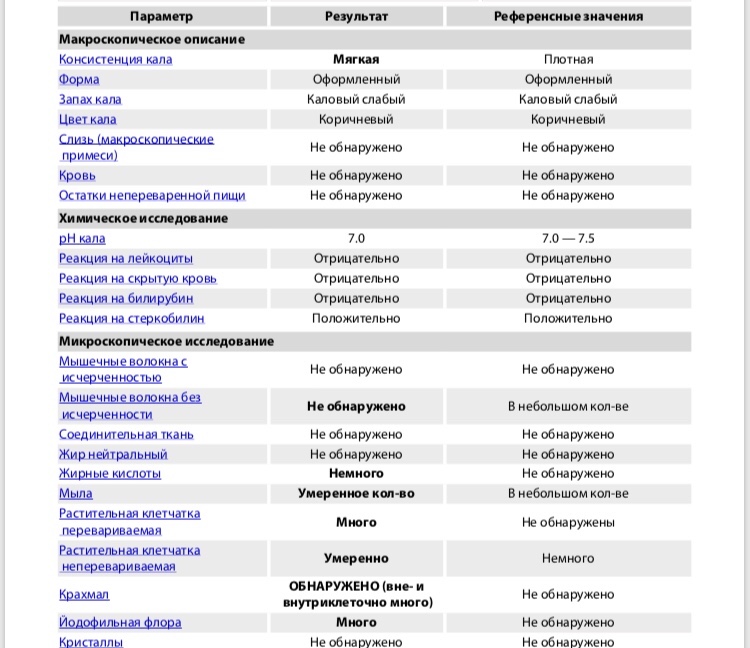 Кислотный стеатокрит – гравиметрический метод оценки процентного содержания жира в отдельном образце кала. Определение кислотного стеатокрита является более чувствительным и специфичным скрининговым тестом на стеаторею по сравнению с традиционным микроскопическим исследованием стула, а также сопоставимо с результатами определения содержания жира в 3-дневном стуле. Значения кислотного стеатокрита более 10% свидетельствуют о наличии стеатореи, которая может быть обусловлена экзокринной недостаточностью поджелудочной железы (хронический панкреатит, муковисцидоз, карцинома пожелудочной железы, сахарный диабет 1 типа, холелитиаз, аутоиммунный панкреатит), нарушениями всасывания жиров при повреждении слизистой тонкого кишечника (целиакия, язвенный колит, болезнь Крона, синдром короткой тонкой кишки, аутоиммунная энтеропатия), а также при избыточном употреблении в пищу жирной пищи.
Кислотный стеатокрит – гравиметрический метод оценки процентного содержания жира в отдельном образце кала. Определение кислотного стеатокрита является более чувствительным и специфичным скрининговым тестом на стеаторею по сравнению с традиционным микроскопическим исследованием стула, а также сопоставимо с результатами определения содержания жира в 3-дневном стуле. Значения кислотного стеатокрита более 10% свидетельствуют о наличии стеатореи, которая может быть обусловлена экзокринной недостаточностью поджелудочной железы (хронический панкреатит, муковисцидоз, карцинома пожелудочной железы, сахарный диабет 1 типа, холелитиаз, аутоиммунный панкреатит), нарушениями всасывания жиров при повреждении слизистой тонкого кишечника (целиакия, язвенный колит, болезнь Крона, синдром короткой тонкой кишки, аутоиммунная энтеропатия), а также при избыточном употреблении в пищу жирной пищи.
Исследование углеводов в стуле и рН стула.
Реакция (рН) отражает кислотно-щелочные свойства стула. В норме реакция является нейтральной или слабощелочной (6,8-7,5). Кислая или щелочная реакция в кале обусловлена активизацией деятельности тех или других типов бактерий, что происходит при нарушении ферментации пищи. Кислая реакция (pH 5,5–6,7) отмечается при нарушении всасывания в тонкой кишке жирных кислот; резко-кислая реакция (pH менее 5,5) имеет место при бродильной диспепсии, при которой в результате активации бродильной флоры (нормальной и патологической) образуются углекислый газ и органические кислоты. Щелочная реакция (pH 8,0–8,5) наблюдается при гниении белков пищи (не переваренных в желудке и тонкой кишке) и воспалительном экссудате в результате активации гнилостной флоры и образовании аммиака и других щелочных компонентов в толстой кишке, резкощелочная реакция (pH более 8,5) – при гнилостной диспепсии (колите).
В норме реакция является нейтральной или слабощелочной (6,8-7,5). Кислая или щелочная реакция в кале обусловлена активизацией деятельности тех или других типов бактерий, что происходит при нарушении ферментации пищи. Кислая реакция (pH 5,5–6,7) отмечается при нарушении всасывания в тонкой кишке жирных кислот; резко-кислая реакция (pH менее 5,5) имеет место при бродильной диспепсии, при которой в результате активации бродильной флоры (нормальной и патологической) образуются углекислый газ и органические кислоты. Щелочная реакция (pH 8,0–8,5) наблюдается при гниении белков пищи (не переваренных в желудке и тонкой кишке) и воспалительном экссудате в результате активации гнилостной флоры и образовании аммиака и других щелочных компонентов в толстой кишке, резкощелочная реакция (pH более 8,5) – при гнилостной диспепсии (колите).
Исследование углеводов в стуле предназначено для определения суммарного содержания простых сахаров (моно- и дисахаридов) в кале. Наличие углеводов в кале может быть обусловлено, как недостатком соответствующего фермента в просвете тонкого кишечника, так и нарушением всасывания моносахаров через стенку кишечника в кровь. Тест используется, в первую очередь, для выявления лактазной недостаточности у детей первого года жизни, находящихся на грудном вскармливании или получающих искусственные молочные смеси, содержащие лактозу, а также при наличии хронической диареи, нарушений пищеварения, недостаточной массы тела и выявленном ранее синдроме мальабсорбции у взрослых.
Тест используется, в первую очередь, для выявления лактазной недостаточности у детей первого года жизни, находящихся на грудном вскармливании или получающих искусственные молочные смеси, содержащие лактозу, а также при наличии хронической диареи, нарушений пищеварения, недостаточной массы тела и выявленном ранее синдроме мальабсорбции у взрослых.
Определение эозинофильного нейротоксина (EDN) для диагностики пищевой аллергии в стуле.
Эозинофильный нейротоксин (эозинофильный протеин X, EDN, EPX, RNASE2) — катионный гликопротеин, входящий в состав вторичных эозинофильных гранул, обладающий цитотоксическим и нейротоксическим действием, а также противовирусной и противопаразитарной активностью. EDN секретируется в основных местах скопления эозинофилов, включая кожу, легкие, мочеполовую систему, а также желудочно-кишечный тракт. Увеличение содержания фекального EDN может служить маркером текущего клинического или субклинического хронического воспаления гастроинтестинальной области и повышения проницаемости кишечника, а также для определения элиминационной диеты при пищевой непереносимости.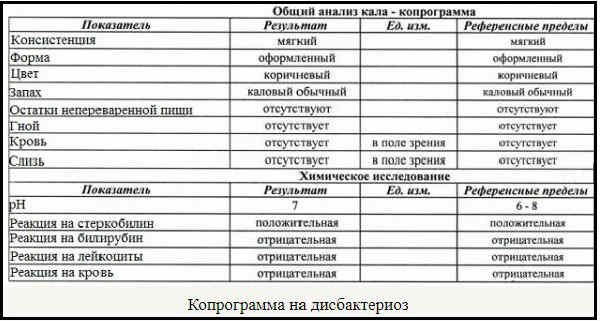 Выявление повышенных значений фекального эозинофильного нейротоксина (EDN) свидетельствуют о наличии эозинофильной инфильтрации в стенке кишечника, обусловленной различными заболеваниями ЖКТ, включая воспалительные заболевания кишечника, паразитарные инвазии, рак толстого кишечника, а также при не-IgE-опосредованных аллергических реакциях, в частности, к белкам коровьего молока, и при других видах пищевой непереносимости. Кроме того, увеличение содержания EDN в стуле служит неблагоприятным прогностическим фактором наличия коллагенозного колита у пациентов с хронической диареей без примесей крови, что требует проведения фиброколоноскопии. Для уточнения характера воспалительного процесса в кишечнике рекомендуется сочетанное определение содержания эозинофильного нейротоксина в стуле и фекального кальпротектина.
Выявление повышенных значений фекального эозинофильного нейротоксина (EDN) свидетельствуют о наличии эозинофильной инфильтрации в стенке кишечника, обусловленной различными заболеваниями ЖКТ, включая воспалительные заболевания кишечника, паразитарные инвазии, рак толстого кишечника, а также при не-IgE-опосредованных аллергических реакциях, в частности, к белкам коровьего молока, и при других видах пищевой непереносимости. Кроме того, увеличение содержания EDN в стуле служит неблагоприятным прогностическим фактором наличия коллагенозного колита у пациентов с хронической диареей без примесей крови, что требует проведения фиброколоноскопии. Для уточнения характера воспалительного процесса в кишечнике рекомендуется сочетанное определение содержания эозинофильного нейротоксина в стуле и фекального кальпротектина.
Токсин A/B Cl.difficile в стуле.
Выявление токсина Clostridium difficile указывает на инфекцию споро-образующей бактерией, которая вызывает поражение толстого кишечника, также называемое псевдомембранозным колитом. Инфекция C.difficile, часто вызываемая длительным назначением антибиотиков широкого спектра, может протекать скрыто с гриппоподобной картиной. Нередко колонизация микроорганизмом возникает в условиях стационара, а инфекция носит черты внутрибольничного и нозокомиального состояния. Продуция токсинов А и В приводит к типичной симптоматике, включая вздутие, газообразование, диаррею и боль в животе. Дифференциальный диагноз следует проводить с обострениями воспалительных заболеваний кишечника, которые дают сходную клиническую симптоматику. Тяжесть колита значительно варьирует, нередко отмечаются рецидивы клостридиального колита, даже несмотря на успешную терапию заболевания.
Инфекция C.difficile, часто вызываемая длительным назначением антибиотиков широкого спектра, может протекать скрыто с гриппоподобной картиной. Нередко колонизация микроорганизмом возникает в условиях стационара, а инфекция носит черты внутрибольничного и нозокомиального состояния. Продуция токсинов А и В приводит к типичной симптоматике, включая вздутие, газообразование, диаррею и боль в животе. Дифференциальный диагноз следует проводить с обострениями воспалительных заболеваний кишечника, которые дают сходную клиническую симптоматику. Тяжесть колита значительно варьирует, нередко отмечаются рецидивы клостридиального колита, даже несмотря на успешную терапию заболевания.
Кровь в кале у грудничка
Кровь в кале у грудничка всегда является грозным состоянием. Это может быть симптомом различных болезней, поэтому требует безотлагательного обращения к специалисту. При наличии любых изменений в испражнениях ребенка сразу нужно вспомнить, не кушал ли малыш накануне продукты, способные окрашивать стул. Например, если в прикорм входили свекла, помидоры или же шоколад, то это уже может стать причиной красного стула. Погрешности в питании матери также могут вызывать указанные изменения.
Например, если в прикорм входили свекла, помидоры или же шоколад, то это уже может стать причиной красного стула. Погрешности в питании матери также могут вызывать указанные изменения.
Кровь в кале у грудного ребенка обнаруживается в виде прожилок, вкраплений, сгустков и изменении цвета испражнений. Так, например, при кровотечениях из верхних отделов пищеварительного тракта кровь в стуле у грудничка окрашивает кал в черный цвет, а при патологии нижних отделов кишечника – ярко-алый цвет.
Что вызывает появление крови в испражнениях?Слизь и кровь в кале у грудничка всегда указывает на наличие воспалительного патологического процесса. Слизь появляется как следствие избыточной активности желез слизистой оболочки и «выпотевания» воспалительной экссудативной жидкости в полость кишки. Причины появления крови в кале у грудничка следующие:
- Трещины слизистой оболочки прямой кишки и в области анального отверстия. Такие травмы обычно возникают при наличии твердого стула, запорах и сильном натуживании во время дефекации.
 Повышает риск образования микротравм неокрепшая стенка кишечника.
Повышает риск образования микротравм неокрепшая стенка кишечника. - Инвагинация или более известное название – заворот кишечника. Это тяжелое состояние представляет собой один из видов кишечной непроходимости, при котором одна кишка внедряется в просвет другой. При этом испражнения слизистые и имеют вид малинового желе. Характерно то, что ребенок будет беспокоен, плаксив из-за наличия болевого синдрома. Данная ситуация требует госпитализации в хирургический стационар.
- Прожилки крови в кале грудничка могут быть следствием пищевой аллергии. Особенно часто такое наблюдается при искусственном вскармливании, когда патологическую реакцию вызывают белки коровьего или козьего молока. В ответ на аллерген слизистая оболочка кишечника отекает, воспаляется. А кровеносные сосуды, расположенные в стенке органа, могут давать небольшие кровотечения из-за того, что они становятся более ломкими. Иногда данный симптом может наблюдаться и при лактазной недостаточности.
- Кишечная инфекция и гельминтозы.
 Инфекции обычно сопровождаются обильным, жидким стулом и интенсивными болями в животе. Глистам свойственно внедряться в слизистую оболочку или повреждать ее. Соответственно нарушается целостность сосудов. При этом обычно у грудничков кровь в кале проявляется в виде красных вкраплений и тяжей.
Инфекции обычно сопровождаются обильным, жидким стулом и интенсивными болями в животе. Глистам свойственно внедряться в слизистую оболочку или повреждать ее. Соответственно нарушается целостность сосудов. При этом обычно у грудничков кровь в кале проявляется в виде красных вкраплений и тяжей. - Кровоточащие полипы в кишечнике.
- Язвенное поражение желудка и кишечника. В данной ситуации кровопотери могут быть незначительными, длительными, что способствует появлению анемии.
- Геморрагический диатез – заболевание крови, характеризующийся повышенной кровоточивостью. Одним из его проявлений являются желудочно-кишечные кровотечения.
- Если у кормящей матери имеются микротравмы на сосках, то малыш может заглатывать с молоком небольшое количество крови, что отражается на качественных характеристиках испражнений.
Выявление данного состояния обычно не вызывает трудностей. Натолкнуть на мысль о вероятной причине помогают дополнительные симптомы и анамнез заболевания. На ранних стадиях некоторых хронических заболеваний помощь в диагностике оказывает реакция Грегерсена. Данная проба показывает изменения, которые мы не можем увидеть невооруженным глазом. К примеру, положительная реакция на скрытую кровь в кале у грудничка свидетельствует о наличии потери крови из язвы желудка или кишечника, а также при глистной инвазии.
На ранних стадиях некоторых хронических заболеваний помощь в диагностике оказывает реакция Грегерсена. Данная проба показывает изменения, которые мы не можем увидеть невооруженным глазом. К примеру, положительная реакция на скрытую кровь в кале у грудничка свидетельствует о наличии потери крови из язвы желудка или кишечника, а также при глистной инвазии.
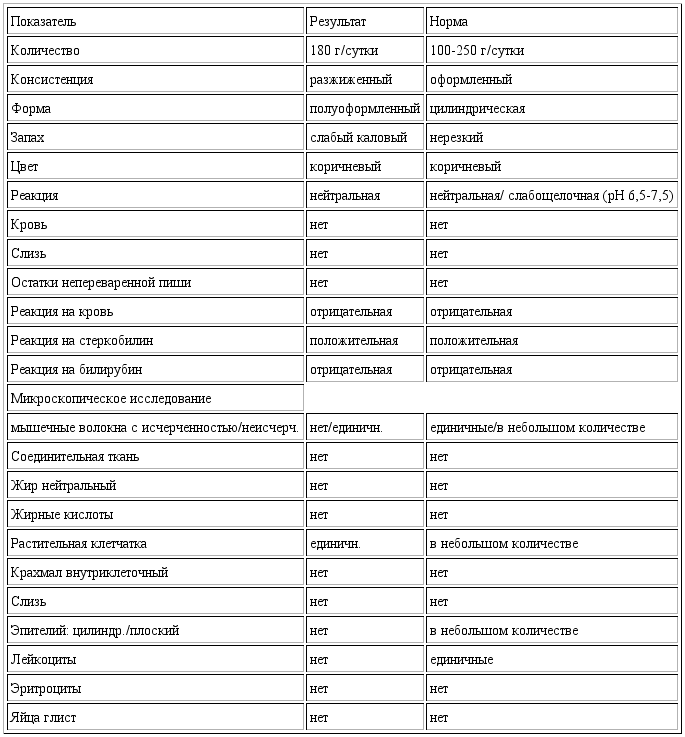
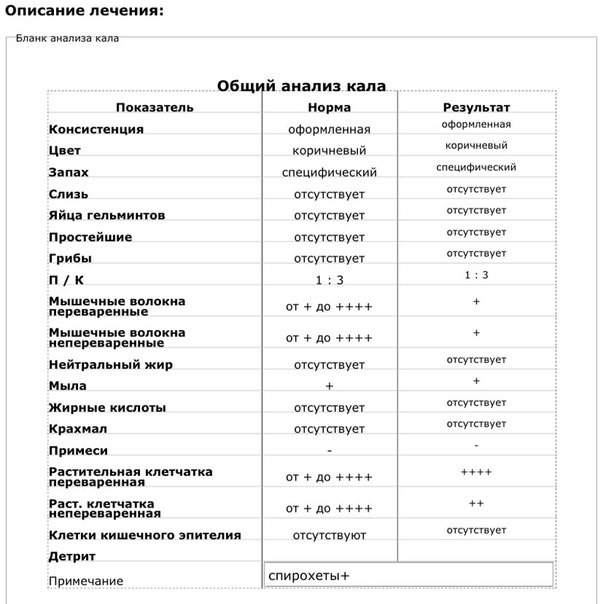
Копрограмма
Совокупное описание физического, химического и микроскопического исследования кала. Кал — конечный продукт, образующийся в результате сложных биохимических процессов расщепления пищи, всасывания продуктов переваривания в желудочно-кишечном тракте и выделения из кишечника продуктов обмена. Оценка испражнений (экскременты, фекалии, faeces) — выделений содержимого конечного отдела толстой кишки — имеет важное значение для диагностики и оценки эффективности терапии при заболеваниях желудочно-кишечного тракта (ЖКТ). Исследование кала позволяет диагностировать нарушение кислотообразующей и ферментативной функции желудка; нарушение ферментативной функции поджелудочной железы; нарушение функции печени; наличие ускоренной эвакуации из желудка и кишечника; нарушение всасывания в двенадцатиперстной и тонкой кишке; воспалительный процесс в ЖКТ; дисбактериоз; язвенный, аллергический, спастический колит. Цвет кала обусловлен, главным образом, пигментом стеркобилином. Изменение окраски является важным диагностическим признаком многих заболеваний. Так, при механической желтухе, когда прекращается поступление желчи в кишечник, кал обесцвечивается. Чёрный дёгтеобразный кал (мелена) признак кровотечения из верхних отделов пищеварительного тракта. Красный цвет чаще всего обусловлен примесью неизмененной крови при кровотечениях из толстой кишки. Из патологических примесей в кале можно обнаружить слизь, кровь, гной, а также гельминтов и др. При микроскопическом исследовании определяют основные элементы кала: мышечные волокна, растительную клетчатку, нейтральный жир, жирные кислоты и их соли, лейкоциты, эритроциты, клетки кишечного эпителия, клетки злокачественных новообразований, а также слизь, простейших, яйца гельминтов. Нормальный кал — аморфная масса из частиц пищевых остатков. У здоровых людей полупереваренные мышечные и соединительнотканные волокна, являющиеся остатками белковой пищи, содержатся в очень незначительном количестве.
Цвет кала обусловлен, главным образом, пигментом стеркобилином. Изменение окраски является важным диагностическим признаком многих заболеваний. Так, при механической желтухе, когда прекращается поступление желчи в кишечник, кал обесцвечивается. Чёрный дёгтеобразный кал (мелена) признак кровотечения из верхних отделов пищеварительного тракта. Красный цвет чаще всего обусловлен примесью неизмененной крови при кровотечениях из толстой кишки. Из патологических примесей в кале можно обнаружить слизь, кровь, гной, а также гельминтов и др. При микроскопическом исследовании определяют основные элементы кала: мышечные волокна, растительную клетчатку, нейтральный жир, жирные кислоты и их соли, лейкоциты, эритроциты, клетки кишечного эпителия, клетки злокачественных новообразований, а также слизь, простейших, яйца гельминтов. Нормальный кал — аморфная масса из частиц пищевых остатков. У здоровых людей полупереваренные мышечные и соединительнотканные волокна, являющиеся остатками белковой пищи, содержатся в очень незначительном количестве. Большое их количество (креаторея) — свидетельство недостаточности функции поджелудочной железы или снижения секреторной функции желудка. Обнаружение переваренной клетчатки и крахмала (амилорея) характерно для заболеваний тонкой кишки. Обнаружение в кале нейтрального жира (стеаторея) — свидетельство недостаточной липолитической функции поджелудочной железы, нейтральный жир и жирные кислоты характерны для нарушенного желчеотделения. Большое количество лейкоцитов в кале свидетельствует о воспалительном процессе в кишечнике (дизентерия, язвенный колит). Для выявления возбудителей кишечных инфекций необходимо провести бактериологическое исследование (см. тесты № 457 Посев на дизентерийную группу и чувствительность к антибиотикам, № 458 Посев на E.Coli O157:H7 и чувствительность к антибиотикам, № 460 Посев на иерсинии и чувствительность к антибиотикам, № 461 Посев на кампилобактер и чувствительность к антибиотикам, № 462 Посев на Clostridium difficile и чувствительность к антибиотикам).
Большое их количество (креаторея) — свидетельство недостаточности функции поджелудочной железы или снижения секреторной функции желудка. Обнаружение переваренной клетчатки и крахмала (амилорея) характерно для заболеваний тонкой кишки. Обнаружение в кале нейтрального жира (стеаторея) — свидетельство недостаточной липолитической функции поджелудочной железы, нейтральный жир и жирные кислоты характерны для нарушенного желчеотделения. Большое количество лейкоцитов в кале свидетельствует о воспалительном процессе в кишечнике (дизентерия, язвенный колит). Для выявления возбудителей кишечных инфекций необходимо провести бактериологическое исследование (см. тесты № 457 Посев на дизентерийную группу и чувствительность к антибиотикам, № 458 Посев на E.Coli O157:H7 и чувствительность к антибиотикам, № 460 Посев на иерсинии и чувствительность к антибиотикам, № 461 Посев на кампилобактер и чувствительность к антибиотикам, № 462 Посев на Clostridium difficile и чувствительность к антибиотикам).Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Референсные значения
Показатель | Значение |
Макроскопическое исследование | |
| Консистенция | плотная |
| Форма | оформленный |
| Цвет | коричневый |
| Запах | каловый, нерезкий |
| pH | 6 — 8 |
| Слизь | отсутствует |
| Кровь | отсутствует |
| Остатки непереваренной пищи | отсутствуют |
Химическое исследование | |
| Реакция на скрытую кровь | отрицательная |
| Реакция на белок | отрицательная |
| Реакция на стеркобилин | положительная |
| Реакция на билирубин | отрицательная |
Микроскопическое исследование | |
| Мышечные волокна с исчерченностью | отсутствуют |
| Мышечные волокна без исчерченности | ед. в препарате в препарате |
| Соединительная ткань | отсутствует |
| Жир нейтральный | отсутствует |
| Жирные кислоты | отсутствует |
| Соли жирных кислот | незначительное количество |
| Растительная клетчатка переваренная | ед. в препарате |
| Крахмал внутриклеточный | отсутствует |
| Крахмал внеклеточный | отсутствует |
| Йодофильная флора нормальная | ед. в препарате |
| Йодофильная флора патологическая | отсутствует |
| Кристаллы | отсутствуют |
| Слизь | отсутствует |
| Эпителий цилиндрический | отсутствует |
| Эпителий плоский | отсутствует |
| Лейкоциты | отсутствуют |
| Эритроциты | отсутствуют |
| Простейшие | отсутствуют |
| Яйца глистов | отсутствуют |
| Дрожжевые грибы | отсутствуют |
Клиническое значение положительного результата анализа кала на скрытую кровь у новорожденных
Реферат
Анализ кала на скрытую кровь (FOBT) — это инструмент скрининга на гематохезию.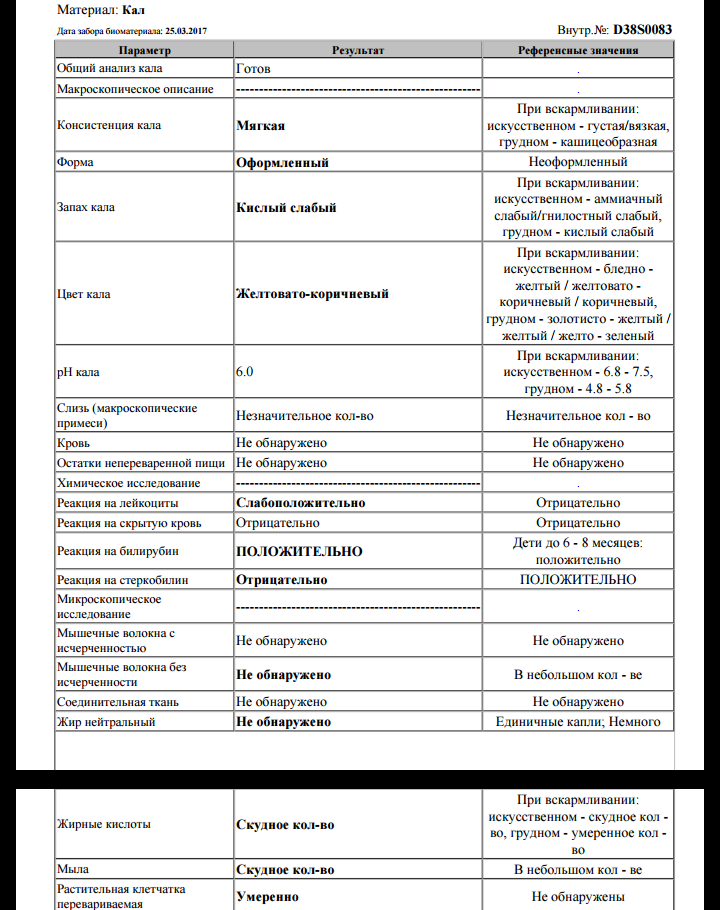 Это исследование направлено на обобщение клинических характеристик, связанных с положительным FOBT у новорожденных, и на изучение некоторых ключей к основным причинам. Комбинация с другой клинической информацией для определения возможной этиологии более вероятна и может быть полезна для выбора эффективной терапевтической стратегии. Были собраны и ретроспективно проанализированы медицинские карты 282 новорожденных с положительным диагнозом FOBT с 1 января по 31 июля 2016 г.Общая частота случаев положительной реакции на FOBT у новорожденных составила 6,2%. Среди этих пациентов у 71 (25,2%) новорожденного были ложноположительные FOBT, тогда как у 211 (74,8%) новорожденных были внутрикишечные источники гематохезии. Некротический энтероколит (NEC, 20,9%), структурные аномалии желудочно-кишечного тракта (SAGT, 12,4%) и подозрение на пищевую аллергию (sFA, 10,6%) были наиболее частыми причинами неонатальной гематохезии. Он показал, что FOBT-положительные новорожденные с НЭК чаще страдали из-за более молодого гестационного возраста, более низкого веса при рождении и меньшего веса при поступлении, чем новорожденные с другими заболеваниями.
Это исследование направлено на обобщение клинических характеристик, связанных с положительным FOBT у новорожденных, и на изучение некоторых ключей к основным причинам. Комбинация с другой клинической информацией для определения возможной этиологии более вероятна и может быть полезна для выбора эффективной терапевтической стратегии. Были собраны и ретроспективно проанализированы медицинские карты 282 новорожденных с положительным диагнозом FOBT с 1 января по 31 июля 2016 г.Общая частота случаев положительной реакции на FOBT у новорожденных составила 6,2%. Среди этих пациентов у 71 (25,2%) новорожденного были ложноположительные FOBT, тогда как у 211 (74,8%) новорожденных были внутрикишечные источники гематохезии. Некротический энтероколит (NEC, 20,9%), структурные аномалии желудочно-кишечного тракта (SAGT, 12,4%) и подозрение на пищевую аллергию (sFA, 10,6%) были наиболее частыми причинами неонатальной гематохезии. Он показал, что FOBT-положительные новорожденные с НЭК чаще страдали из-за более молодого гестационного возраста, более низкого веса при рождении и меньшего веса при поступлении, чем новорожденные с другими заболеваниями.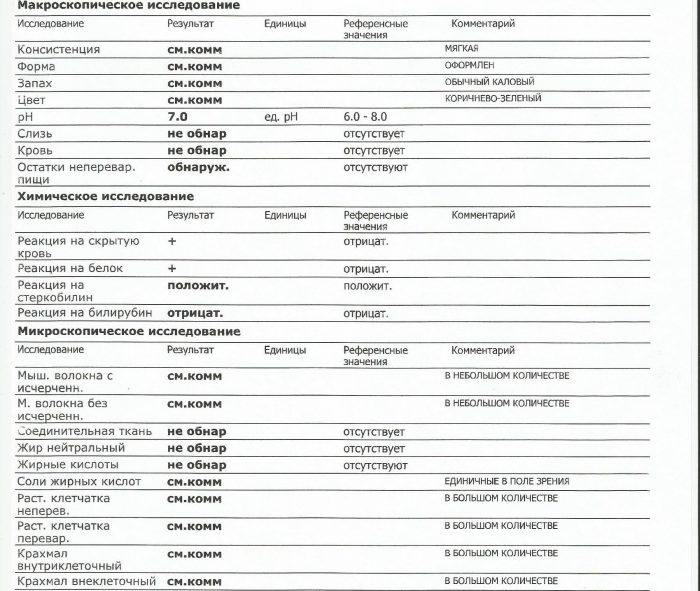 Доля новорожденных с кровавым стулом (90,0%) и диареей (63,3%) в группе sFA была заметно выше, чем в других группах. Однако в группе SAGT рвота (94,3%) и вздутие живота (80,0%) были явно выше, как правило, сопровождались относительно слабым ответом (60,0%) и ослаблением кишечных шумов (48,6%). Кроме того, в группе НЭК наблюдалась более высокая частота плохого ответа (72,1%), вздутия живота (71,2%), кровянистого стула (64,4%) и ослабления кишечных шумов (62,7%).Из-за сложной этиологии, связанной с положительным FOBT, проанализированные показатели были объединены с другими клиническими признаками для выявления вероятных причин неонатальной гематохезии. Поскольку NEC, sFA и SAGT демонстрируют схожие клинические проявления и иногда могут трансформироваться друг в друга, тщательное и частое наблюдение имеет решающее значение для своевременного вмешательства и достижения лучшего прогноза. Несмотря на то, что он не смог обеспечить раннее предупреждение о тяжелом заболевании с помощью FOBT, а раннее вмешательство для FOBT может не уменьшить NEC, sFA, структурные повреждения кишечника или любые другие осложнения, положительный результат FOBT у новорожденных напоминает медицинскому персоналу о необходимости осознавать связанные заболевания, включая NEC, SAGT и sFA, при более тщательном наблюдении и последующем наблюдении.
Доля новорожденных с кровавым стулом (90,0%) и диареей (63,3%) в группе sFA была заметно выше, чем в других группах. Однако в группе SAGT рвота (94,3%) и вздутие живота (80,0%) были явно выше, как правило, сопровождались относительно слабым ответом (60,0%) и ослаблением кишечных шумов (48,6%). Кроме того, в группе НЭК наблюдалась более высокая частота плохого ответа (72,1%), вздутия живота (71,2%), кровянистого стула (64,4%) и ослабления кишечных шумов (62,7%).Из-за сложной этиологии, связанной с положительным FOBT, проанализированные показатели были объединены с другими клиническими признаками для выявления вероятных причин неонатальной гематохезии. Поскольку NEC, sFA и SAGT демонстрируют схожие клинические проявления и иногда могут трансформироваться друг в друга, тщательное и частое наблюдение имеет решающее значение для своевременного вмешательства и достижения лучшего прогноза. Несмотря на то, что он не смог обеспечить раннее предупреждение о тяжелом заболевании с помощью FOBT, а раннее вмешательство для FOBT может не уменьшить NEC, sFA, структурные повреждения кишечника или любые другие осложнения, положительный результат FOBT у новорожденных напоминает медицинскому персоналу о необходимости осознавать связанные заболевания, включая NEC, SAGT и sFA, при более тщательном наблюдении и последующем наблюдении.
Термины темы: Желудочно-кишечное кровотечение, кишечные заболевания
Введение
Гематохезия, обычное явление среди новорожденных, определяется как желудочно-кишечное кровотечение, вызванное различными причинами, включая расстройства пищеварительного тракта и сопутствующие заболевания некоторых критических заболеваний, таких как некротические заболевания. энтероколит (НЭК), мальротация кишечника и заворот кишечника, болезнь Гиршпрунга, инфекционный колит и системная коагулопатия 1 , 2 900 15.
Анализ кала на скрытую кровь (FOBT), скрининговый тест на гематохезию, используется для обнаружения невидимой или скрытой (скрытой) крови в кале. Это просто и неинвазивно. У взрослых FOBT используется в качестве инструмента скрининга колоректального рака, связанного с повреждением слизистой оболочки кишечника 3 . Однако этиологические данные, связанные с положительными FOBT у новорожденных, немногочисленны из-за особенностей популяции новорожденных. Сообщалось, что частота положительных результатов FOBT у новорожденных составляет примерно 8.5% 4 , но он может быть выше у новорожденных с крайне низкой массой тела при рождении. Абрамо и др. . сообщили, что уровень заболеваемости скрытой кровью составлял 10% среди новорожденных с массой тела <1800 г при рождении 5 .
Сообщалось, что частота положительных результатов FOBT у новорожденных составляет примерно 8.5% 4 , но он может быть выше у новорожденных с крайне низкой массой тела при рождении. Абрамо и др. . сообщили, что уровень заболеваемости скрытой кровью составлял 10% среди новорожденных с массой тела <1800 г при рождении 5 .
Это исследование было направлено на ретроспективный анализ характеристик, связанных с положительными FOBT у новорожденных, поступивших в наше отделение интенсивной терапии новорожденных (NICU), путем сравнения клинических характеристик и окончательных диагнозов, а также попытки изучить некоторые подсказки для повышения эффективности диагностики и лечения.
Результаты
Основные причины положительных FOBT у новорожденных
Среди 282 новорожденных с положительными FOBT у 71 новорожденного (25,2%) были ложноположительные результаты, в то время как у оставшихся 211 новорожденных (74,8%) были внутрикишечные источники кровотечения. НЭК, структурные аномалии желудочно-кишечного тракта (SAGT) и подозрение на пищевую аллергию (sFA) были наиболее частыми причинами неонатальной гематохезии и встречались у 59 новорожденных (20,9%), 35 новорожденных (12,4%) и 30 новорожденных (10.6%) соответственно. Другая этиология включала острые стрессовые язвы у 29 новорожденных (10,3%), острую диарею у 27 новорожденных (9,6%), послеоперационное кишечное кровотечение у 12 новорожденных (4,3%), функциональное вздутие живота у 10 новорожденных (3,5%), непереносимость пищи у восьми. новорожденные (2,8%) и мекониевый запор у одного новорожденного (0,4%). Ложноположительные результаты FOBT были вызваны фекальным загрязнением (часто вызываемым псевдоменструацией и гематозом) или другими внекишечными источниками, включая проглоченную материнскую кровь (проглоченную во время родов или из разделенных сосков) и кровь новорожденных (катетер-индуцированная травма верхних дыхательных путей или желудка слизистая оболочка).
НЭК, структурные аномалии желудочно-кишечного тракта (SAGT) и подозрение на пищевую аллергию (sFA) были наиболее частыми причинами неонатальной гематохезии и встречались у 59 новорожденных (20,9%), 35 новорожденных (12,4%) и 30 новорожденных (10.6%) соответственно. Другая этиология включала острые стрессовые язвы у 29 новорожденных (10,3%), острую диарею у 27 новорожденных (9,6%), послеоперационное кишечное кровотечение у 12 новорожденных (4,3%), функциональное вздутие живота у 10 новорожденных (3,5%), непереносимость пищи у восьми. новорожденные (2,8%) и мекониевый запор у одного новорожденного (0,4%). Ложноположительные результаты FOBT были вызваны фекальным загрязнением (часто вызываемым псевдоменструацией и гематозом) или другими внекишечными источниками, включая проглоченную материнскую кровь (проглоченную во время родов или из разделенных сосков) и кровь новорожденных (катетер-индуцированная травма верхних дыхательных путей или желудка слизистая оболочка).
Клинические характеристики новорожденных с НЭК, SAGT и sFA
Была проанализирована клиническая информация по первым трем этиологиям у FOBT-положительных новорожденных. Во-первых, внимание было направлено на время начала положительного FOBT, и было обнаружено, что медиана (IQR) времени начала NEC (7 [3, 13] дней, данные представлены как Median [P25, P75]), SAGT (10 [4, 17] дней) и sFA (13 [8,75, 20,25] дней) значительно различались ( X 2 = 9,318, P = 0.009). Гестационный возраст (GA) (258 ± 20) дней и масса тела при рождении (BW) (2,70 ± 0,64) кг в группе SAGT были значительно ниже, чем в группе NEC (272 ± 13) дней и (3,17 ± 0,54) кг. соответственно, тогда как в группе sFA (270 ± 12) дней и (3,19 ± 0,42) кг соответственно ( P <0,001). Кроме того, вес при поступлении в группу NEC (2,60 ± 0,64) кг был явно ниже, чем в группах SAGT и sFA (3,00 ± 0,53) кг и (3,13 ± 0,45) кг соответственно ( P <0.001, таблица). Другие наблюдаемые элементы включали пол, эвтоцию, гравитацию и паритет, которые не имели статистических различий ( P > 0,05). Эти данные показали, что новорожденные с НЭК и положительными FOBT с большей вероятностью будут страдать от более молодого возраста, более низкого BW и более низкого веса при поступлении, чем дети с другими состояниями.
Во-первых, внимание было направлено на время начала положительного FOBT, и было обнаружено, что медиана (IQR) времени начала NEC (7 [3, 13] дней, данные представлены как Median [P25, P75]), SAGT (10 [4, 17] дней) и sFA (13 [8,75, 20,25] дней) значительно различались ( X 2 = 9,318, P = 0.009). Гестационный возраст (GA) (258 ± 20) дней и масса тела при рождении (BW) (2,70 ± 0,64) кг в группе SAGT были значительно ниже, чем в группе NEC (272 ± 13) дней и (3,17 ± 0,54) кг. соответственно, тогда как в группе sFA (270 ± 12) дней и (3,19 ± 0,42) кг соответственно ( P <0,001). Кроме того, вес при поступлении в группу NEC (2,60 ± 0,64) кг был явно ниже, чем в группах SAGT и sFA (3,00 ± 0,53) кг и (3,13 ± 0,45) кг соответственно ( P <0.001, таблица). Другие наблюдаемые элементы включали пол, эвтоцию, гравитацию и паритет, которые не имели статистических различий ( P > 0,05). Эти данные показали, что новорожденные с НЭК и положительными FOBT с большей вероятностью будут страдать от более молодого возраста, более низкого BW и более низкого веса при поступлении, чем дети с другими состояниями.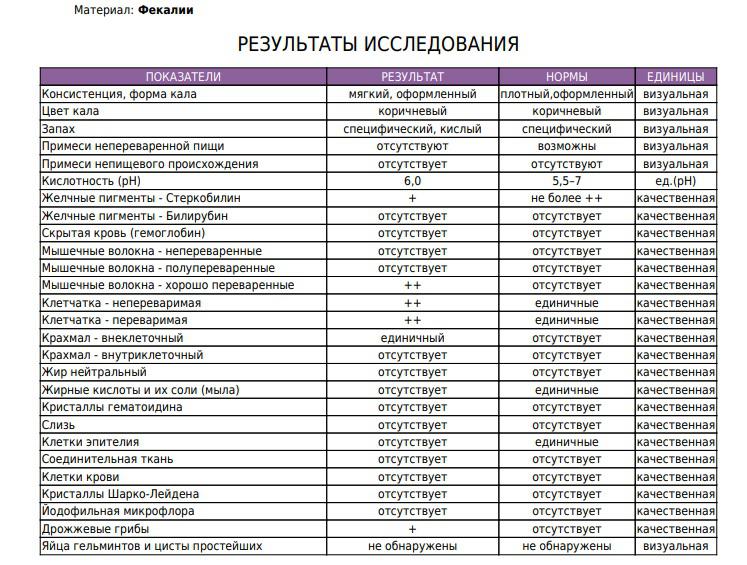
Таблица 1
Демографические данные FOBT-положительных новорожденных с NEC, SAGT и sFA.
| Позиции | NEC | SAGT | sFA | F ( χ 2 ) | P | |
|---|---|---|---|---|---|---|
| Мужской (%) | 52.5 (31/59) | 68,6 (24/35) | 46,7 (14/30) | (3,579) | 0,167 | |
| Eutocia (%) | 38,9 (23/59) | 34,3 (12/35) | 26,7 (8/30) | (1,335) | 0,513 | |
| Тяжелость (%) | 1 | 38,9 (23/59) | 28,6 (10/35) | 50,0 (15/30) | (4,818) | 0,567 |
| 2 | 25,4 (15/59) | 34. 3 (12/35) 3 (12/35) | 16,7 (5/30) | |||
| 3 | 16,9 (10/59) | 17,1 (6/35) | 10,0 (3/30) | |||
| ≧ 4 | 18,7 (11/59) | 20,0 (7/35) | 23,3 (7/30) | |||
| Четность (%) | 1 | 71,2 (42/59) | 48,6 (17/35) | 56,7 (17/30) | (5,029) | 0,078 |
| ≧ 2 | 28,8 (17/59) | 51,4 (18/35) | 43.3 (13/30) | |||
| GA (M ± SD, d) | 258 ± 20 | 272 ± 13 | 270 ± 12 | 8,399 | <0,001 | |
| BW (M ± SD, кг) | 2,70 ± 0,64 | 3,17 ± 0,54 | 3,19 ± 0,42 | 11,233 | <0,001 | |
| Масса при поступлении (M ± SD, кг) | 2,60 ± 0,64 | 3,00 ± 0,53 3,13 ± 0,45 | 10,513 | <0,001 | ||
| Время начала [медиана (P25 ~ P75)] d | 7 (3, 13) | 10 (4, 17) | 13 (8. 75, 20,25) 75, 20,25) | (9,318) | 0,009 | |
Факторы риска и сопутствующие симптомы новорожденных с NEC, SAGT и sFA
Различия в отсроченной экскреции мекония, режимах питания и использовании антибиотиков среди три группы были статистически значимыми с точки зрения факторов риска ( P <0,01). Доля новорожденных с задержкой экскреции мекония в группе SAGT составила 37,1%, что было значительно выше, чем в двух других группах ( P <0.Доля кормления смесью и введения антибиотиков до положительного результата FOBT в группе NEC составляла 61,0% и 52,5% соответственно, что было значительно выше, чем в двух других группах ( P <0,01). Частота сопутствующих симптомов, рвоты, вздутия живота, диареи, кровавого стула, ослабленных кишечных шумов и плохого ответа была статистически значимой среди трех групп ( P <0,05). Кроме того, пропорции новорожденных с кровавым стулом (90. 0%) и диарея (63,3%) в группе sFA были заметно выше, чем в других группах. Частота рвоты (94,3%) и вздутия живота (80,0%) была явно выше в группе SAGT, чем в других группах, и эти симптомы сопровождались относительно слабым ответом (60,0%) и ослаблением кишечных шумов (48,6%). . Кроме того, в группе НЭК наблюдались высокие показатели частоты ослабленных кишечных шумов (62,7%), плохой реакции (72,1%), вздутия живота (71,2%) и кровянистого стула (64,4%) (таблица).
0%) и диарея (63,3%) в группе sFA были заметно выше, чем в других группах. Частота рвоты (94,3%) и вздутия живота (80,0%) была явно выше в группе SAGT, чем в других группах, и эти симптомы сопровождались относительно слабым ответом (60,0%) и ослаблением кишечных шумов (48,6%). . Кроме того, в группе НЭК наблюдались высокие показатели частоты ослабленных кишечных шумов (62,7%), плохой реакции (72,1%), вздутия живота (71,2%) и кровянистого стула (64,4%) (таблица).
Таблица 2
Клинические характеристики FOBT-положительных новорожденных с NEC, SAGT и sFA. НЭК: некротический энтероколит; САГТ: структурные аномалии желудочно-кишечного тракта; sFA: подозрение на пищевую аллергию; CBC: общий анализ крови; АР: рентгенография брюшной полости.
| Клинические характеристики | NEC (%) | SAGT (%) | sFA (%) | F ( χ 2 ) | P | ||
|---|---|---|---|---|---|---|---|
| Риск Факторы | Сахарный диабет беременных | 11. 9 (7/59) 9 (7/59) | 5,7 (2/35) | 3,3 (1/30) | (2,316) | 0,314 | |
| Мекониевый запор | 3,4 (2/59) | 37,1 (13 / 35) | 6,7 (2/30) | (20,770) | <0,001 | ||
| Преждевременный разрыв мембраны | 23,7 (14/59) | 11,4 (4/35) | 16,7 (5/30) ) | (2,293) | 0,318 | ||
| Окрашенные меконием околоплодные воды | 18.6 (11/59) | 14,3 (5/35) | 6,7 (2/30) | (2,301) | 0,316 | ||
| Патентный артериальный проток | 27,1 (16/59) | 20,0 (7 / 35) | 10,0 (3/30) | (3,545) | 0,17 | ||
| Способ кормления | Formula | 61,0 (36/59) | 51,4 (18/35) | 36,7 (11 / 30) | (21,450) | 0,002 | |
| Грудь | 8,5 (5/59) | 14. 3 (5/35) 3 (5/35) | 30,0 (9/30) | ||||
| Смешанный | 11,9 (7/59) | 20,0 (7/35) | 33,3 (10/30) | ||||
| Другое | 18,6 (11/59) | 14,3 (5/35) | 0,0 (0/30) | ||||
| Применение антибиотиков | 52,5 (31/59) | 34,3 (12/35) | 13,3 (4 / 30) | (13,261) | 0,001 | ||
| Сопутствующие симптомы | Рвота | 49.2 (29/59) | 94,3 (33/35) | 33,3 (10/30) | (28,318) | <0,001 | |
| Вздутие живота | 71,2 (42/59) | 80,0 (28 / 35) | 30,0 (9/30) | (20,188) | <0,001 | ||
| Диарея | 27,1 (16/59) | 11,4 (4/35) | 63,3 (19/30) | (21,166) | <0,001 | ||
| Стул с кровью | 64,4 (38/59) | 22.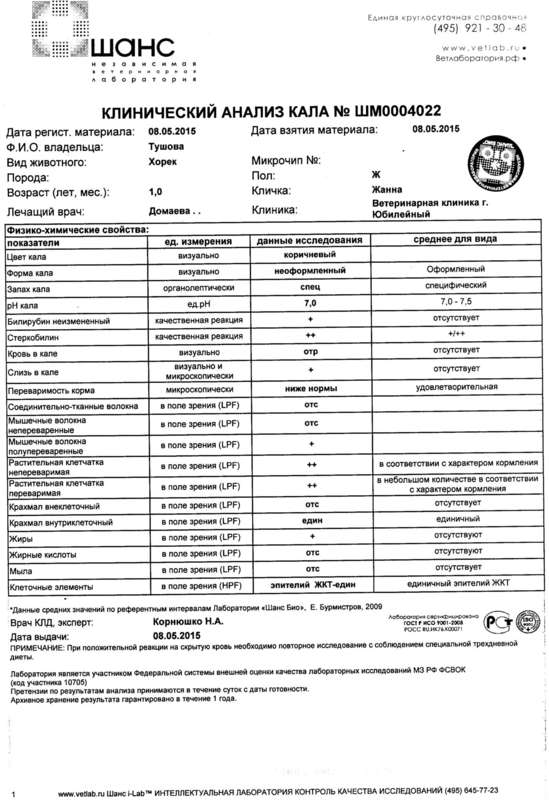 9 (8/35) 9 (8/35) | 90,0 (27/30) | (31,501) | <0,001 | ||
| Ослабленные звуки кишечника | 62,7 (37/59) | 48,6 (17/35) | 23,3 ( 7/30) | (12,346) | 0,002 | ||
| Лихорадка | 16,9 (10/59) | 17,1 (6/35) | 20,0 (6/30) | (0,139) | 0,933 | ||
| Плохой ответ | 72,9 (43/59) | 60,0 (21/35) | 23.3 (7/30) | (20.100) | <0,001 | ||
| Вспомогательные исследования | CBC | Нейтрофилы (%) | 55,4 ± 16,9 | 57,1 ± 15,8 | 43,610 ± 12,0 | 43,610 ± 12,0 | 0,001|
| Нейтрофилы (* 10 12 ) | 8,50 ± 7,70 | 8,42 ± 4,68 | 4,90 ± 2,25 | 3,789 | 0,025 | ||
| Нейтрофил / лимфоцит / лимфоцит 2 | 28 ± 1,77 | 2,23 ± 1,64 | 1,12 ± 0,66 | 5,862 | 0,04 | ||
| Эозинофилы (%) | 7,6 ± 6,4 | 4,1 ± 4,0 | 7,8 ± 5,4 | 900 | |||
| Эозинофилы (* 10 12 ) | 0,76 ± 0,34 | 0,47 ± 0,18 | 0,79 ± 0,37 | 8,547 | <0,001 | ||
| Тромбоциты (* 10 9 ) | 135311 ± 100 | 393 ± 159 | 3. 788 788 | 0,025 | |||
| AR | Нормальный | 1,8 (1/57) | 2,9 (1/34) | 7,4 (2/27) | (33,983) | <0,001 | |
| Мягкий | 8,8 (5/57) | 44,1 (15/34) | 14,8 (4/27) | ||||
| Умеренный | 31,6 (18/57) | 32,4 (11/34) | 48,1 (13 / 27) | ||||
| Тяжелая | 47,4 (27/57) | 2,9 (1/34) | 18.5 (5/27) | ||||
| Снижение кишечного газа | 10,5 (6/57) | 17,6 (6/34) | 11,1 (3/27) | ||||
| Клинические результаты | Улучшение | Медицинское лечение | 57,6 (34/59) | 14,3 (5/35) | 86,7 (26/30) | (6,861) | 0,032 |
| Хирургическое лечение | 6,8 (4/59) | 68,6 (24/35) | 0,0 (0/30) | ||||
| Прекращение терапии | 35. 6 (21/59) 6 (21/59) | 17,1 (6/35) | 13,3 (4/30) | ||||
Дополнительные обследования новорожденных с положительными FOBT в результате NEC, SAGT и sFA
Полная кровь подсчет (CBC) показал, что процент нейтрофилов был значительно увеличен в группах NEC (55,4%) и SAGT (57,1%) ( P <0,001). Кроме того, процент эозинофилов в группах NEC (7,6%) и sFA (7,8%) был явно выше, чем в группе SAGT (4.1%) ( P <0,05). Количество тромбоцитов в группе sFA было значительно повышено, достигнув в среднем 393 × 10 9 / л ( P <0,05), тогда как количество тромбоцитов в двух других группах было 316 × 10 9 / л и 311 × 10 9 / л соответственно. FOBT у новорожденных с sFA часто выявляли повышенные уровни эозинофилов и / или тромбоцитов в CBC, что обычно указывает на васкулит, связанный с аллергической реакцией, в то время как у новорожденных в группах NEC и SAGT часто наблюдались повышенные уровни нейтрофилов. Рентгенография брюшной полости показала, что у новорожденных в группе NEC в основном наблюдалась тяжелая степень кровотечения (47,4%), тогда как у новорожденных в группе sFA (48,1%, умеренная степень), по-видимому, была несколько более тяжелая степень, чем у новорожденных в группе SAGT ( 44,1%, легкая степень) (Таблицы и).
Рентгенография брюшной полости показала, что у новорожденных в группе NEC в основном наблюдалась тяжелая степень кровотечения (47,4%), тогда как у новорожденных в группе sFA (48,1%, умеренная степень), по-видимому, была несколько более тяжелая степень, чем у новорожденных в группе SAGT ( 44,1%, легкая степень) (Таблицы и).
Таблица 3
DAAS 25 и степень отклонения от нормы на рентгенограммах 26 .
| Оценка | Результат | Степень серьезности | |
|---|---|---|---|
| 0 | Нормальный газовый образец | Нормальный | |
| 1 | Легкое диффузное растяжение | ||
| 2 | 2 | 2 | 2 |
| 2 | 2 | с пузырчатой прозрачностью, которая, вероятно, является стулом | Легкая |
| 3 | Фокусное умеренное растяжение петли кишечника | ||
| 4 | Разделение или очаговое утолщение петель кишечника | ||
| Без признаков 5 | петли кишечника | Умеренная | |
| 6 | Возможный пневматоз с другими отклонениями от нормы | ||
| 7 | Фиксированная или стойкая дилатация петель кишечника | Тяжелая | |
| 8 | Пневматоз с высокой вероятностью|||
| 9 | Газ в воротной вене | ||
| 10 | Пневмоперитонеум |
Прогноз для новорожденных с положительным FOBT из-за NEC, SAGT и sFA
Прогноз включал улучшение и отказ от терапии. Улучшение было определено как заметное облегчение. Новорожденных, у которых отмечалось улучшение, в дальнейшем классифицировали в группу лечения или группу хирургического и медикаментозного лечения. Напротив, отказ от терапии был определен как слишком ранняя выписка из больницы из-за серьезных осложнений или экономических ограничений.
Улучшение было определено как заметное облегчение. Новорожденных, у которых отмечалось улучшение, в дальнейшем классифицировали в группу лечения или группу хирургического и медикаментозного лечения. Напротив, отказ от терапии был определен как слишком ранняя выписка из больницы из-за серьезных осложнений или экономических ограничений.
Очевидно, что улучшение было основным результатом во всех трех группах, составив более 60,0% от общего числа. Всего 86,7% новорожденных с sFA, 57.6% новорожденных с NEC и 14,3% новорожденных с SAGT получали медикаментозное лечение, тогда как 68,6% новорожденных с SAGT и 6,8% новорожденных с NEC подвергались хирургическому лечению. Более того, 35,5% новорожденных с NEC, 17,1% новорожденных с SAGT и 13,3% новорожденных с sFA были исключены из терапии. Различия между этими группами были статистически значимыми ( X 2 = 6,861, P = 0,032; таблица). В группе НЭК 21 новорожденный был исключен из терапии из-за серьезных осложнений, включая нарушения гомеостаза, стриктуру кишечника после НЭК и синдром короткой кишки.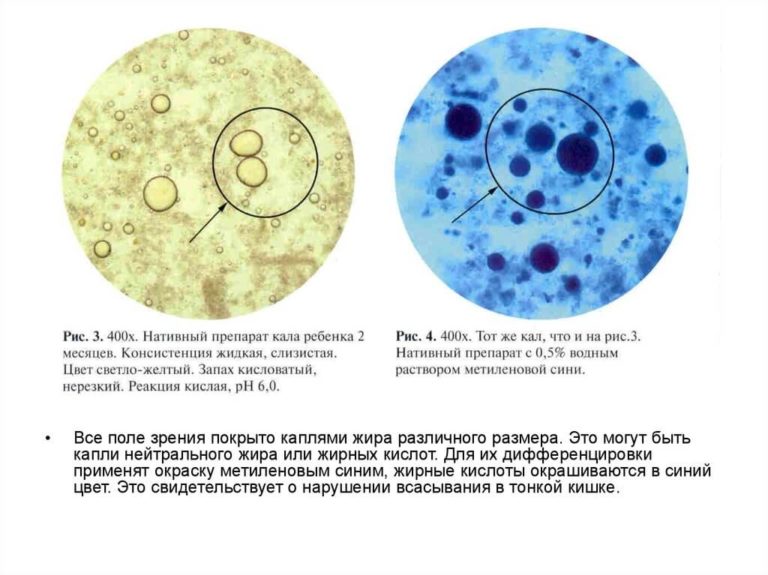 Однако 4 пациента в группе sFA были выписаны до полного энтерального питания из-за экономических факторов или эмоциональных факторов, таких как невыносимое разлучение со своими детьми.
Однако 4 пациента в группе sFA были выписаны до полного энтерального питания из-за экономических факторов или эмоциональных факторов, таких как невыносимое разлучение со своими детьми.
Значения клинических характеристик в диагностической дифференциации NEC, SAGT и sFA
Чтобы определить, были ли статистически значимые индексы в таблице ценными для дифференциальной диагностики, индексы были подвергнуты многомерному анализу, включая дискриминантный анализ и множественный анализ. логистический регрессионный анализ (Таблицы и).Дискриминантный анализ показал корреляцию BW (X 1 ), задержку выведения мекония (X 2 ), рвоту (X 3 ), диарею (X 4 ), кровянистый стул (X 5 ). ) и плохой отклик (X 6 ) с NEC (Y NE C = 0,010X 1 + 1,515X 2 + 3,641X 3 — 1,201X 4 + 4,029X 5 + 6,761 X 6 — 19,433), SAGT (Y SAGT = 0,012X 1 + 4,291X 2 + 6. 002X 3 — 1,619X 4 + 2,644X 5 + 6,595X 6 — 25,853), и sFA (Y sFA = 0,011X 1 + 2,410X 2 + 3,472X 3 + 0,491X 4 + 5,182X 5 + 4,686X 6 — 22,395). Было выбрано максимальное значение Y, и прогнозируемая вероятность составила 71,0%, тогда как многомерный логистический регрессионный анализ выявил корреляцию времени начала (X 1 ), применения антибиотиков, рвоты (X 2 ) и диареи (X ). 3 ) с NEC (Y NEC = −2.634 — 0,105X 1 — 1,862X 2 + 2,091X 3 ) и SAGT (Y SAGT = −10,654 — 0,125X 1 — 2,59X 2 + 2,651X 3 ), когда рассматривая группу sFA в качестве ориентира. Была выбрана максимальная вероятность, и прогнозируемая вероятность составила 77,4%. Разница в общей прогнозируемой вероятности между двумя моделями не была статистически значимой ( X 2 = 1,348, P = 0,246; таблица).
002X 3 — 1,619X 4 + 2,644X 5 + 6,595X 6 — 25,853), и sFA (Y sFA = 0,011X 1 + 2,410X 2 + 3,472X 3 + 0,491X 4 + 5,182X 5 + 4,686X 6 — 22,395). Было выбрано максимальное значение Y, и прогнозируемая вероятность составила 71,0%, тогда как многомерный логистический регрессионный анализ выявил корреляцию времени начала (X 1 ), применения антибиотиков, рвоты (X 2 ) и диареи (X ). 3 ) с NEC (Y NEC = −2.634 — 0,105X 1 — 1,862X 2 + 2,091X 3 ) и SAGT (Y SAGT = −10,654 — 0,125X 1 — 2,59X 2 + 2,651X 3 ), когда рассматривая группу sFA в качестве ориентира. Была выбрана максимальная вероятность, и прогнозируемая вероятность составила 77,4%. Разница в общей прогнозируемой вероятности между двумя моделями не была статистически значимой ( X 2 = 1,348, P = 0,246; таблица).
Таблица 4
Дискриминантный анализ и множественный логистический регрессионный анализ.
| Группа | Прогнозируемая этиология | всего | Прогнозируемая вероятность (%) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| NEC | SAGT | sFA | |||||||||
| Фактическая этиология | 106107 | Дискриминантный анализ | 11 | 14 | 59 | 57,6 | |||||
| SAGT | 6 | 27 | 2 | 35 | 77,1 | ||||||
| sFA | 90. 0 0 | ||||||||||
| Всего | 41 | 40 | 43 | 124 | 71,0 | ||||||
| Анализ MLR | NEC | 48 | 3 | 8 | 900 | 7 | 26 | 2 | 35 | 74,3 | |
| sFA | 6 | 2 | 22 | 30 | 73,3 | 124 | 77. 4 4 | ||||
Обсуждение
Гематохезия часто встречается в неонатальном периоде, проявляясь в виде видимого кровянистого стула или положительного теста на FOBT. Этиология сложная, включая заболевания пищеварительного тракта и / или осложнения многих критических расстройств. Раннее выявление причины — залог ее успешного лечения. Из-за небольшого количества крови у некоторых пациентов не видно видимой крови в стуле, и FOBT необходим, чтобы уменьшить количество ошибочных диагнозов. Таким образом, это исследование ретроспективно проанализировало клинические характеристики FOBT-положительных новорожденных, предоставив клинический опыт для этиологических диагнозов и соответствующих эффективных методов лечения.Наше отделение было крупнейшим отделением интенсивной терапии в западном Китае. Всего с 1 января по 31 июля 2016 г. было госпитализировано 5330 новорожденных, в том числе 1183 недоношенных и 4147 доношенных. Большинство из них страдали перинатальной асфиксией, тяжелой пневмонией, сепсисом, тяжелым гемолизом и желтухой на уровне или выше порогового уровня для обменного переливания крови, недоношенности и других критических заболеваний.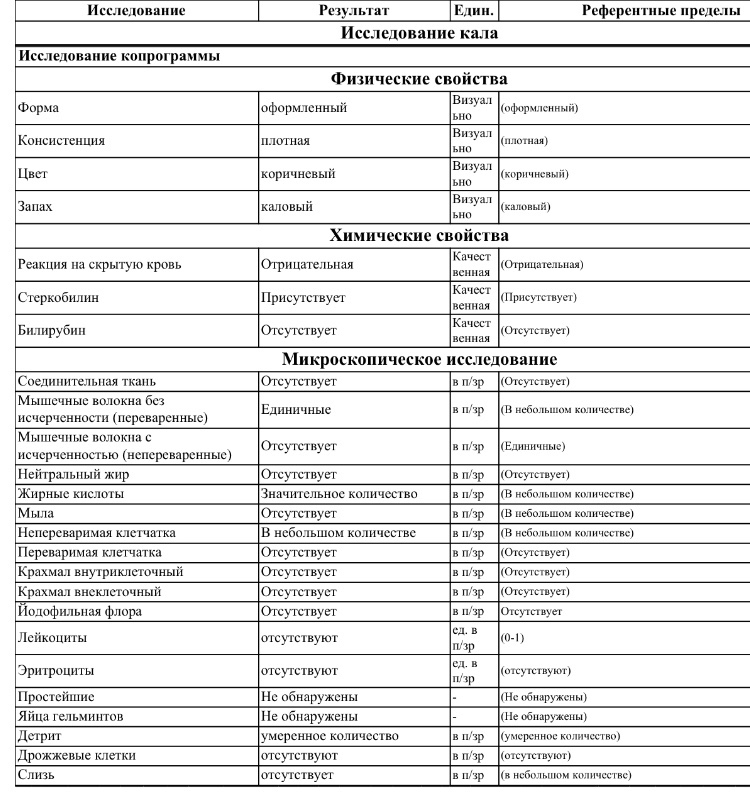 Поскольку это больница третичного уровня, входящая в медицинский университет, и центр неонатальной транспортной системы неотложной помощи в западном Китае, многие новорожденные, поступающие в наше отделение, переводятся из загородных районов и разлучены со своими семьями, что приводит к относительно низким показателям. грудного вскармливания составляет примерно 30%, что также является фактором риска поражения кишечника, что отражается как положительный результат FOBT.Поэтому FOBT используется в качестве стандартного скринингового теста в нашем отделении интенсивной терапии. Ряд состояний связан с положительными FOBT среди новорожденных. Системные проблемы, связанные с геморрагическими заболеваниями или коагулопатией, вызывают положительные FOBT. Однако ни одно из этих расстройств не было обнаружено в этом исследовании, что указывает на то, что частота скрытой гематохезии, вызванной системными расстройствами, у новорожденных не так высока, как сообщалось ранее (1-2%). 6 .
Поскольку это больница третичного уровня, входящая в медицинский университет, и центр неонатальной транспортной системы неотложной помощи в западном Китае, многие новорожденные, поступающие в наше отделение, переводятся из загородных районов и разлучены со своими семьями, что приводит к относительно низким показателям. грудного вскармливания составляет примерно 30%, что также является фактором риска поражения кишечника, что отражается как положительный результат FOBT.Поэтому FOBT используется в качестве стандартного скринингового теста в нашем отделении интенсивной терапии. Ряд состояний связан с положительными FOBT среди новорожденных. Системные проблемы, связанные с геморрагическими заболеваниями или коагулопатией, вызывают положительные FOBT. Однако ни одно из этих расстройств не было обнаружено в этом исследовании, что указывает на то, что частота скрытой гематохезии, вызванной системными расстройствами, у новорожденных не так высока, как сообщалось ранее (1-2%). 6 . Настоящие данные показали, что общая частота положительных результатов FOBT составила 6.2%, и что интересно, 25,2% (71/282) положительных FOBT у новорожденных были ложноположительными, которые были вызваны зараженными фекалиями или проглатыванием крови матери или новорожденного. Кроме того, 74,8% (211/282) кровотечений были вызваны кишечными источниками гематохезии. Среди них наиболее частыми причинами были NEC, SAGT и sFA, составляющие 20,9%, 12,4% и 10,6% от общего числа положительных FOBT, соответственно.
Настоящие данные показали, что общая частота положительных результатов FOBT составила 6.2%, и что интересно, 25,2% (71/282) положительных FOBT у новорожденных были ложноположительными, которые были вызваны зараженными фекалиями или проглатыванием крови матери или новорожденного. Кроме того, 74,8% (211/282) кровотечений были вызваны кишечными источниками гематохезии. Среди них наиболее частыми причинами были NEC, SAGT и sFA, составляющие 20,9%, 12,4% и 10,6% от общего числа положительных FOBT, соответственно.
Время начала НЭК обратно коррелировало с ГА. НЭК может проявляться в течение первой недели жизни у доношенных детей, тогда как у недоношенных новорожденных она обычно появляется после начала кормления и возникает после 2 -й и 3 -й недель жизни 7 .В этом исследовании среднее время начала НЭК у FOBT-положительных младенцев приходилось на 7 900–13 9–15 дней после рождения, что, вероятно, было связано с преждевременными родами через 35 недель у 59 новорожденных с НЭК.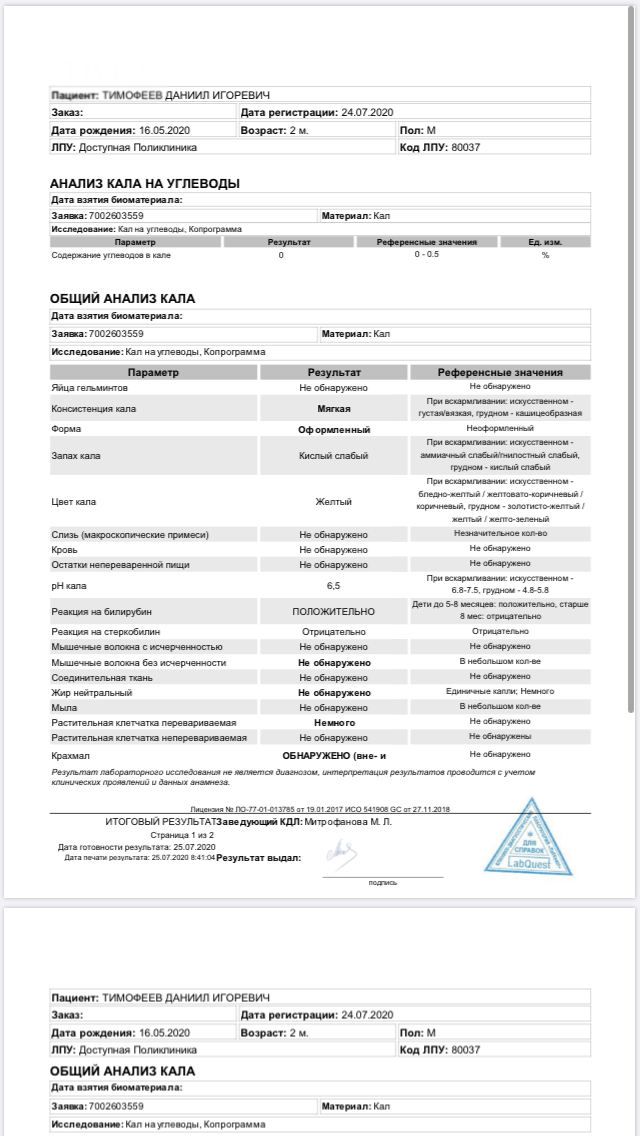 Кроме того, было указано, что новорожденного с молодой GA, низкой частотой грудного вскармливания, воздействием антибиотиков и такими симптомами, как вздутие живота, ослабленные звуки кишечника или плохая реакция, следует рассматривать при возникновении NEC. В этой ситуации необходимо немедленно провести общий анализ крови и рентгенографию брюшной полости.Действительно, гематологические отклонения обычно несут определенную важную и ценную прогностическую информацию. Махешвари и др. . 8 отметили, что повышенное количество нейтрофилов является соответствующей воспалительной реакцией у пациентов с заболеванием легкой или средней степени тяжести. Напротив, нейтропения может наблюдаться при тяжелой форме НЭК. Настоящие данные показали, что у новорожденных в группе НЭК было повышенное количество нейтрофилов, что может быть связано с 64,4% [38/59] новорожденных в группе НЭК с диагнозом НЭК I стадии.Кроме того, Ян Y и др. . 9 сообщил, что соотношение нейтрофилов / лимфоцитов (N / L) может быть хорошим маркером для ранней диагностики НЭК, определяя степень тяжести.
Кроме того, было указано, что новорожденного с молодой GA, низкой частотой грудного вскармливания, воздействием антибиотиков и такими симптомами, как вздутие живота, ослабленные звуки кишечника или плохая реакция, следует рассматривать при возникновении NEC. В этой ситуации необходимо немедленно провести общий анализ крови и рентгенографию брюшной полости.Действительно, гематологические отклонения обычно несут определенную важную и ценную прогностическую информацию. Махешвари и др. . 8 отметили, что повышенное количество нейтрофилов является соответствующей воспалительной реакцией у пациентов с заболеванием легкой или средней степени тяжести. Напротив, нейтропения может наблюдаться при тяжелой форме НЭК. Настоящие данные показали, что у новорожденных в группе НЭК было повышенное количество нейтрофилов, что может быть связано с 64,4% [38/59] новорожденных в группе НЭК с диагнозом НЭК I стадии.Кроме того, Ян Y и др. . 9 сообщил, что соотношение нейтрофилов / лимфоцитов (N / L) может быть хорошим маркером для ранней диагностики НЭК, определяя степень тяжести. Данные показали, что у новорожденных в группе NEC было повышенное соотношение (N / L). Из-за небольшой выборки новорожденных с НЭК анализ подгрупп не проводился, а данные были слишком ограничены, чтобы определить степень тяжести. Требуются большие выборки, многоцентровые исследования.
Данные показали, что у новорожденных в группе NEC было повышенное соотношение (N / L). Из-за небольшой выборки новорожденных с НЭК анализ подгрупп не проводился, а данные были слишком ограничены, чтобы определить степень тяжести. Требуются большие выборки, многоцентровые исследования.
Традиционно рентгенография брюшной полости также играла решающую роль в диагностике НЭК.Новорожденные с НЭК часто имеют тяжелые поражения кишечника, которые в основном выявляют очаговое вздутие, фиксированные петли кишечника, пневматоз и газ в воротной вене при рентгенографии брюшной полости. Кроме того, у некоторых новорожденных с НЭК в этом исследовании на рентгенограмме брюшной полости наблюдались типичные признаки, классифицированные как средние и тяжелые поражения кишечника (таблицы и). Ван и др. . 10 показали, что скорость восстановления NEC составляла 70–80%, тогда как степень улучшения NEC составляла 64.4% (38/59) в этом исследовании. Среди изученных новорожденных 34 получили консервативное лечение, четверо перенесли операцию из-за перфорации или полной непроходимости, а 21 был исключен из терапии из-за серьезных осложнений, включая нарушения гомеостаза, стриктуры кишечника после НЭК и синдром короткой кишки. Годен и др. . 11 исследовали факторы риска, связанные со стриктурой кишечника после НЭК, и указали, что наличие признаков перитонита и тромбопении являются факторами риска.Чжан и др. . 12 указали, что время позднего начала было предиктором стриктуры кишечника после НЭК и что у новорожденных с пост-НЭК наблюдалось повышение уровня лейкоцитов (лейкоцитов) и прокальцитонина (ПКТ).
Годен и др. . 11 исследовали факторы риска, связанные со стриктурой кишечника после НЭК, и указали, что наличие признаков перитонита и тромбопении являются факторами риска.Чжан и др. . 12 указали, что время позднего начала было предиктором стриктуры кишечника после НЭК и что у новорожденных с пост-НЭК наблюдалось повышение уровня лейкоцитов (лейкоцитов) и прокальцитонина (ПКТ).
Предыдущие исследования показали, что частота sFA явно увеличивается после НЭК или хирургии желудочно-кишечного тракта. 13 , 14 . Симптомы sFA разнообразны и в основном проявляются с 2 до 4 недель после контакта с пищевым белком или другими подозреваемыми веществами.Было обнаружено, что время начала положительного FOBT, вызванного sFA, в основном приходилось на 2 недель жизни и у 93,3% (28/30) младенцев с ГА более 35 недель. Кроме того, частота появления грубого кровянистого стула и диареи составила 90,0% и 63,3% соответственно. Повышенное количество эозинофилов и тромбоцитов в CBC, по-видимому, указывает на аллергическое расстройство, что согласуется с выводами Feuille 15 . На рентгенограмме брюшной полости в основном видны диффузное вздутие живота и разделение или очаговое утолщение петель кишечника.Однако Kawai M et al . 16 сообщили, что признаки рентгенографии брюшной полости у младенцев с sFA представляют собой повторяющиеся эпизоды пневматозоподобного NEC, которые трудно отличить от NEC. Подобные рентгенологические признаки были обнаружены у шести новорожденных в этом исследовании. Что касается лечения, у 86,7% (26/30) новорожденных улучшилось состояние после отказа от еды, как и наблюдалось в настоящем исследовании. Суда и др. . 17 сообщил, что некоторые случаи sFA впоследствии переросли в NEC.Они предположили, что стойкое снижение количества тромбоцитов может указывать на эту тенденцию. Поэтому следует проводить динамическое наблюдение за клиническим анализом крови, чтобы своевременно отслеживать прогресс.
Повышенное количество эозинофилов и тромбоцитов в CBC, по-видимому, указывает на аллергическое расстройство, что согласуется с выводами Feuille 15 . На рентгенограмме брюшной полости в основном видны диффузное вздутие живота и разделение или очаговое утолщение петель кишечника.Однако Kawai M et al . 16 сообщили, что признаки рентгенографии брюшной полости у младенцев с sFA представляют собой повторяющиеся эпизоды пневматозоподобного NEC, которые трудно отличить от NEC. Подобные рентгенологические признаки были обнаружены у шести новорожденных в этом исследовании. Что касается лечения, у 86,7% (26/30) новорожденных улучшилось состояние после отказа от еды, как и наблюдалось в настоящем исследовании. Суда и др. . 17 сообщил, что некоторые случаи sFA впоследствии переросли в NEC.Они предположили, что стойкое снижение количества тромбоцитов может указывать на эту тенденцию. Поэтому следует проводить динамическое наблюдение за клиническим анализом крови, чтобы своевременно отслеживать прогресс.
На основании представленных статистических данных было обнаружено, что болезнь Гиршпрунга, стриктура кишечника и атрезия кишечника были частыми пороками развития у FOBT-положительных новорожденных в группе SAGT, и их доли составляли 37,1% (13/35), 14,3% (5). / 35) и 14,3% (5/35) соответственно. Госаин и др. . 18 сообщили, что новорожденные с болезнью Гиршпрунга имеют высокий риск развития энтероколита, связанного с Гиршпрунгом.Настоящие данные согласуются с этим, поскольку было окончательно подтверждено, что 13 новорожденных с положительным FOBT, у которых были NEC-подобные клинические характеристики, страдали SAGT. Среди этих новорожденных восемь страдали болезнью Гиршпрунга, у четырех была стриктура кишечника и у одного была атрезия кишечника. Из новорожденных с SAGT с положительным результатом FOBT у 37,1% (13/35) отмечалось отсроченное выведение мекония, тогда как у 94,3% (33/35) наблюдалась рвота. Общий анализ крови показал повышенное количество нейтрофилов, что указывает на возможность вторичной инфекции. Поскольку энтеральные структурные аномалии различаются, различные характеристики визуализации брюшной полости способствуют дифференциации диагноза.Хирургия может поставить окончательный диагноз, но может не подходить для исправления структурных аномалий кишечника. Учитывая этот инвазивный подход, который может привести к послеоперационным осложнениям, таким как спаечная кишечная непроходимость, НЭК и аллергический энтерит, точное понимание хирургической возможности имеет жизненно важное значение. В настоящем исследовании 68,6% (24/35) новорожденных с энтеральными структурными аномалиями и положительными FOBT были прооперированы. Среди этих новорожденных 5 новорожденных были повторно госпитализированы с осложнениями, у 3 новорожденных была спаечная кишечная непроходимость и у двоих в течение одного года после операции был выявлен НЭК.Повторно госпитализированным больным были проведены контрольные обследования. Однако данные по-прежнему были ограничены, чтобы отразить фактический долгосрочный прогноз.
САГТ возникает в неонатальном периоде, в том числе врожденным и приобретенным. Врожденный САГТ можно рассматривать как порок развития желудочно-кишечного тракта. NEC, sFA и SAGT имеют схожие клинические проявления, которые иногда переходят друг в друга (рис.). Врожденный и приобретенный САГТ может вызвать кишечную непроходимость и, как следствие, местную инфекцию или воспаление из-за повреждения кишечного барьера, что приводит к гиперчувствительности к определенным специфическим диетическим антигенам, проявляющейся как пищевая аллергия.Если врачи сталкиваются с младенцами с хирургическим заболеванием желудочно-кишечного тракта, включая мальротацию кишечника, им необходимо учитывать пищевую аллергию при дифференциальной диагностике или как осложняющий фактор 13 . Стриктура после НЭК — широко известное осложнение. После острого эпизода НЭК стриктура, связанная с тяжелой и продолжительной болезнью (сепсис, перфорация, кишечная непроходимость) и заболеваемость, вторичная по отношению к стриктуре кишечника, может развиться в течение различного периода независимо от способа лечения.Пищевая аллергия — это гиперчувствительная реакция на определенные пищевые антигены. Суда и др. . 17 сообщили, что 2 новорожденным с sFA потребовалась лапаротомия из-за вторичной NEC. Отек кишечника и травма могут возникнуть, если не практикуется надлежащее избегание предполагаемой пищи, а тяжелое воспаление кишечника может прогрессировать до местного некроза и перфорации или эндогенной инфекции, имитируя NEC и вызывая энтеральные осложнения, такие как стриктура кишечника и другие приобретенные SAGT.Однако лечение и прогнозы NEC, sFA и SAGT обычно различны. Поэтому исследователи попытались создать прогностические модели с помощью дискриминантного анализа и множественного логистического регрессионного анализа. Рвота и диарея используются в качестве индексов в двух моделях, что позволяет предположить, что они могут иметь некоторое клиническое значение при постановке диагноза. К сожалению, не было обнаружено статистически значимой разницы в общей прогностической скорости этих двух моделей. Таким образом, в настоящее время невозможно обеспечить эффективный подход к дифференциальной диагностике.Следовательно, рекомендуется проспективное исследование для создания ценной модели клинического прогноза.
Общая этиология неонатальной гематохезии.
Таким образом, для новорожденных с положительным FOBT сначала следует исключить ложноположительные результаты. Затем следует идентифицировать системные заболевания и расстройства пищеварительного тракта, такие как инфекция, деформация, аллергия, стресс и травмы 1 , 19 в соответствии с процессом, описанным на рис. NEC, SAGT и sFA были наиболее частыми причинами неонатальной гематохезии.У новорожденных эти заболевания имеют схожие клинические проявления и иногда могут переходить друг в друга при определенных условиях. Пикеринг А и др. . 20 сообщили, что рутинный анализ кала на скрытую кровь не позволяет прогнозировать некротический энтероколит. Следовательно, хотя мы не смогли обеспечить раннее предупреждение о тяжелом заболевании с помощью FOBT, а раннее вмешательство для FOBT может не уменьшить NEC, sFA, структурные повреждения кишечника или любые другие осложнения, значение положительности FOBT у новорожденных заключается в том, что медицинский персонал будет внимательно следить за соответствующими заболеваниями, включая НЭК, пороки развития желудочно-кишечного тракта и подозрения на пищевую аллергию, при более тщательном наблюдении и последующем наблюдении.Основываясь на сочетании общего состояния, толерантности к кормлению, температуры, абдоминальных признаков, общего анализа крови, рутинных анализов стула плюс FOBT и визуальных исследований брюшной полости, клиницисты смогут определить возможную этиологию, что полезно для своевременного изменения терапевтической стратегии. .
Диагностическая схема положительного FOBT у новорожденных.
Методы
Условия исследования и отбор пациентов
Это исследование проводилось в отделении неонатологии детской больницы Чунцинского медицинского университета.Данные были собраны из медицинских карт отделения неонатологии с 1 января по 31 июля 2016 года. Исследование было одобрено институциональным наблюдательным советом детской больницы Чунцинского медицинского университета. Все методы были выполнены в соответствии с соответствующими инструкциями и правилами. Данные были собраны, просмотрены, деидентифицированы и проанализированы авторами анонимно; комитет по этике отказался от требования информированного согласия из-за анонимности данных и научной цели исследования.
Субъекты
Всего было обследовано 5 330 новорожденных. Из них 1183 новорожденных были недоношенными, в том числе 140 новорожденных с очень низкой массой тела. В данном исследовании предварительно было зарегистрировано 330 новорожденных с положительными FOBT. Частота положительных результатов FOBT составила 6,2%. Два новорожденных с неполными медицинскими картами и 46 новорожденных с гематохезией через 28 дней или с GA ≥ 42 недель были исключены. Таким образом, в исследование были включены 282 новорожденных. Стул людей проверялся как минимум один раз, 60 новорожденных — один раз, а остальные — дважды или более.Среди этих субъектов у 90 в анамнезе был отчетливо видимый кровавый стул, и FOBT проводился после исчезновения грубого кровянистого стула.
Сбор данных
Демографические данные, история родов и кормления, физикальное обследование (сопутствующие симптомы), запись о лечении, общий анализ крови и другие специфические обследования, включая обследование брюшной полости с помощью пленочного снимка (наиболее тяжелым результатом считался, если было несколько повторных обследований), все данные были собраны из электронной медицинской карты (ЭМИ).NEC был определен на основе критериев Белла с модификациями 21 .
Побочные реакции, связанные с ФА, часты в первый год жизни 22 . Пробный тест с причинной пищей незаменим при диагностике пищевой аллергии, но нереален для всех случаев у новорожденных 23 , потому что эти тесты могут быть опасными, а результаты трудно анализировать у новорожденных. Поэтому концепция подозрения на пищевую аллергию может быть более подходящей для этих случаев.В нашем исследовании диагноз sFA был основан на сочетании следующих факторов, семейном анамнезе анафилактических заболеваний, анамнезе прямого или косвенного воздействия антибиотиков и / или других предполагаемых веществ, а также исключении других возможных причин кровавый стул. Кроме того, симптомы уменьшились при кормлении молоком с аминокислотами или подозрении на отказ от пищи, рецидив после приема предполагаемой пищи.
Острая стрессовая язва диагностируется в зависимости от того, у недоношенных и доношенных детей в отделении интенсивной терапии для новорожденных развиваются поражения слизистой оболочки желудка и проявляются кровотечения из верхних отделов желудочно-кишечного тракта, предполагаемые промыванием желудочного сока, а также факторы воздействия стресса, включая перинатальную асфиксию, внутричерепное кровоизлияние, усиление внутричерепного кровообращения. давление, сепсис, гипогликемия, сильная рвота и т. д. 24 900 15.
Острая диарея диагностировалась в соответствии с повышенной частотой и / или измененными характеристиками стула по сравнению с нормальным стулом, тогда как диарея новорожденных проявляется жидким или водянистым стулом не менее шести раз в течение 24 часов.
Структурные аномалии желудочно-кишечного тракта (САГТ) были диагностированы на основании биопсии или соответствующих послеоперационных результатов, что означает «врожденный или приобретенный САГТ».
Анализ кала на скрытую кровь
FOBT были выполнены в нашей клинической лаборатории с использованием метода коллоидного золота (реагент для обнаружения скрытой крови Aibo; Aibo Biomedical, Ханчжоу, Китай).Вкратце, образец стула был взят из подгузника. Затем небольшое количество собранной пробы фекалий размазали в пробирке и сразу же доставили в клиническую лабораторию. Анализ выполняли в соответствии с инструкциями к продукту. Результат считался положительным, когда появлялась и линия обнаружения, и линия контроля качества.
Оценка рентгенографии брюшной полости
Рентгенография брюшной полости была оценена на основе Шкалы оценки живота Duke (DAAS) 25 .Поскольку уменьшение воспаления кишечника не входит в DAAS, это было проанализировано отдельно. Степень тяжести, указанная в исследовании Boyin Deng et al . 26 (Таблица).
Статистический анализ
Все данные были проанализированы с использованием программного обеспечения SPSS 17.0 (Чикаго, Иллинойс, США). Нормально распределенные непрерывные данные были описаны как среднее ± стандартное отклонение (M ± SD) и исследованы с помощью дисперсионного анализа. Искаженные данные были описаны как медиана (межквартильный диапазон [IQR]) и проанализированы с помощью теста Kruskal-Wallis .Категориальные данные анализировали с помощью теста хи-квадрат или точного теста Фишера . Для анализа дифференциального диагноза применялся многомерный анализ, включая дискриминантный анализ и анализ множественной логистической регрессии. Значение P <0,05 считалось статистически значимым.
Утверждение этических норм и согласие на участие
Протокол исследования был одобрен Наблюдательным советом детской больницы Чунцинского медицинского университета.
Заявление об информированном согласии
Это ретроспективное исследование. Комитет по этике отказался от требования информированного согласия из-за анонимности данных и научной цели исследования.
Клиническое значение положительного результата анализа кала на скрытую кровь у новорожденных
Реферат
Анализ кала на скрытую кровь (FOBT) — это инструмент скрининга на гематохезию. Это исследование направлено на обобщение клинических характеристик, связанных с положительным FOBT у новорожденных, и на изучение некоторых ключей к основным причинам.Комбинация с другой клинической информацией для определения возможной этиологии более вероятна и может быть полезна для выбора эффективной терапевтической стратегии. Были собраны и ретроспективно проанализированы медицинские карты 282 новорожденных с положительным диагнозом FOBT с 1 января по 31 июля 2016 г. Общая частота случаев положительной реакции на FOBT у новорожденных составила 6,2%. Среди этих пациентов у 71 (25,2%) новорожденного были ложноположительные FOBT, тогда как у 211 (74,8%) новорожденных были внутрикишечные источники гематохезии.Некротический энтероколит (NEC, 20,9%), структурные аномалии желудочно-кишечного тракта (SAGT, 12,4%) и подозрение на пищевую аллергию (sFA, 10,6%) были наиболее частыми причинами неонатальной гематохезии. Он показал, что FOBT-положительные новорожденные с НЭК чаще страдали из-за более молодого гестационного возраста, более низкого веса при рождении и меньшего веса при поступлении, чем новорожденные с другими заболеваниями. Доля новорожденных с кровавым стулом (90,0%) и диареей (63,3%) в группе sFA была заметно выше, чем в других группах.Однако в группе SAGT рвота (94,3%) и вздутие живота (80,0%) были явно выше, как правило, сопровождались относительно слабым ответом (60,0%) и ослаблением кишечных шумов (48,6%). Кроме того, в группе НЭК наблюдалась более высокая частота плохого ответа (72,1%), вздутия живота (71,2%), кровянистого стула (64,4%) и ослабления кишечных шумов (62,7%). Из-за сложной этиологии, связанной с положительным FOBT, проанализированные показатели были объединены с другими клиническими признаками для выявления вероятных причин неонатальной гематохезии.Поскольку NEC, sFA и SAGT демонстрируют схожие клинические проявления и иногда могут трансформироваться друг в друга, тщательное и частое наблюдение имеет решающее значение для своевременного вмешательства и достижения лучшего прогноза. Несмотря на то, что он не смог обеспечить раннее предупреждение о тяжелом заболевании с помощью FOBT, а раннее вмешательство для FOBT может не уменьшить NEC, sFA, структурные повреждения кишечника или любые другие осложнения, положительный результат FOBT у новорожденных напоминает медицинскому персоналу о необходимости осознавать связанные заболевания, включая NEC, SAGT и sFA, при более тщательном наблюдении и последующем наблюдении.
Термины темы: Желудочно-кишечное кровотечение, кишечные заболевания
Введение
Гематохезия, обычное явление среди новорожденных, определяется как желудочно-кишечное кровотечение, вызванное различными причинами, включая расстройства пищеварительного тракта и сопутствующие заболевания некоторых критических заболеваний, таких как некротические заболевания. энтероколит (НЭК), мальротация кишечника и заворот кишечника, болезнь Гиршпрунга, инфекционный колит и системная коагулопатия 1 , 2 900 15.
Анализ кала на скрытую кровь (FOBT), скрининговый тест на гематохезию, используется для обнаружения невидимой или скрытой (скрытой) крови в кале. Это просто и неинвазивно. У взрослых FOBT используется в качестве инструмента скрининга колоректального рака, связанного с повреждением слизистой оболочки кишечника 3 . Однако этиологические данные, связанные с положительными FOBT у новорожденных, немногочисленны из-за особенностей популяции новорожденных. Сообщалось, что частота положительных результатов FOBT у новорожденных составляет примерно 8.5% 4 , но он может быть выше у новорожденных с крайне низкой массой тела при рождении. Абрамо и др. . сообщили, что уровень заболеваемости скрытой кровью составлял 10% среди новорожденных с массой тела <1800 г при рождении 5 .
Это исследование было направлено на ретроспективный анализ характеристик, связанных с положительными FOBT у новорожденных, поступивших в наше отделение интенсивной терапии новорожденных (NICU), путем сравнения клинических характеристик и окончательных диагнозов, а также попытки изучить некоторые подсказки для повышения эффективности диагностики и лечения.
Результаты
Основные причины положительных FOBT у новорожденных
Среди 282 новорожденных с положительными FOBT у 71 новорожденного (25,2%) были ложноположительные результаты, в то время как у оставшихся 211 новорожденных (74,8%) были внутрикишечные источники кровотечения. НЭК, структурные аномалии желудочно-кишечного тракта (SAGT) и подозрение на пищевую аллергию (sFA) были наиболее частыми причинами неонатальной гематохезии и встречались у 59 новорожденных (20,9%), 35 новорожденных (12,4%) и 30 новорожденных (10.6%) соответственно. Другая этиология включала острые стрессовые язвы у 29 новорожденных (10,3%), острую диарею у 27 новорожденных (9,6%), послеоперационное кишечное кровотечение у 12 новорожденных (4,3%), функциональное вздутие живота у 10 новорожденных (3,5%), непереносимость пищи у восьми. новорожденные (2,8%) и мекониевый запор у одного новорожденного (0,4%). Ложноположительные результаты FOBT были вызваны фекальным загрязнением (часто вызываемым псевдоменструацией и гематозом) или другими внекишечными источниками, включая проглоченную материнскую кровь (проглоченную во время родов или из разделенных сосков) и кровь новорожденных (катетер-индуцированная травма верхних дыхательных путей или желудка слизистая оболочка).
Клинические характеристики новорожденных с НЭК, SAGT и sFA
Была проанализирована клиническая информация по первым трем этиологиям у FOBT-положительных новорожденных. Во-первых, внимание было направлено на время начала положительного FOBT, и было обнаружено, что медиана (IQR) времени начала NEC (7 [3, 13] дней, данные представлены как Median [P25, P75]), SAGT (10 [4, 17] дней) и sFA (13 [8,75, 20,25] дней) значительно различались ( X 2 = 9,318, P = 0.009). Гестационный возраст (GA) (258 ± 20) дней и масса тела при рождении (BW) (2,70 ± 0,64) кг в группе SAGT были значительно ниже, чем в группе NEC (272 ± 13) дней и (3,17 ± 0,54) кг. соответственно, тогда как в группе sFA (270 ± 12) дней и (3,19 ± 0,42) кг соответственно ( P <0,001). Кроме того, вес при поступлении в группу NEC (2,60 ± 0,64) кг был явно ниже, чем в группах SAGT и sFA (3,00 ± 0,53) кг и (3,13 ± 0,45) кг соответственно ( P <0.001, таблица). Другие наблюдаемые элементы включали пол, эвтоцию, гравитацию и паритет, которые не имели статистических различий ( P > 0,05). Эти данные показали, что новорожденные с НЭК и положительными FOBT с большей вероятностью будут страдать от более молодого возраста, более низкого BW и более низкого веса при поступлении, чем дети с другими состояниями.
Таблица 1
Демографические данные FOBT-положительных новорожденных с NEC, SAGT и sFA.
| Позиции | NEC | SAGT | sFA | F ( χ 2 ) | P | |
|---|---|---|---|---|---|---|
| Мужской (%) | 52.5 (31/59) | 68,6 (24/35) | 46,7 (14/30) | (3,579) | 0,167 | |
| Eutocia (%) | 38,9 (23/59) | 34,3 (12/35) | 26,7 (8/30) | (1,335) | 0,513 | |
| Тяжелость (%) | 1 | 38,9 (23/59) | 28,6 (10/35) | 50,0 (15/30) | (4,818) | 0,567 |
| 2 | 25,4 (15/59) | 34.3 (12/35) | 16,7 (5/30) | |||
| 3 | 16,9 (10/59) | 17,1 (6/35) | 10,0 (3/30) | |||
| ≧ 4 | 18,7 (11/59) | 20,0 (7/35) | 23,3 (7/30) | |||
| Четность (%) | 1 | 71,2 (42/59) | 48,6 (17/35) | 56,7 (17/30) | (5,029) | 0,078 |
| ≧ 2 | 28,8 (17/59) | 51,4 (18/35) | 43.3 (13/30) | |||
| GA (M ± SD, d) | 258 ± 20 | 272 ± 13 | 270 ± 12 | 8,399 | <0,001 | |
| BW (M ± SD, кг) | 2,70 ± 0,64 | 3,17 ± 0,54 | 3,19 ± 0,42 | 11,233 | <0,001 | |
| Масса при поступлении (M ± SD, кг) | 2,60 ± 0,64 | 3,00 ± 0,53 3,13 ± 0,45 | 10,513 | <0,001 | ||
| Время начала [медиана (P25 ~ P75)] d | 7 (3, 13) | 10 (4, 17) | 13 (8.75, 20,25) | (9,318) | 0,009 | |
Факторы риска и сопутствующие симптомы новорожденных с NEC, SAGT и sFA
Различия в отсроченной экскреции мекония, режимах питания и использовании антибиотиков среди три группы были статистически значимыми с точки зрения факторов риска ( P <0,01). Доля новорожденных с задержкой экскреции мекония в группе SAGT составила 37,1%, что было значительно выше, чем в двух других группах ( P <0.Доля кормления смесью и введения антибиотиков до положительного результата FOBT в группе NEC составляла 61,0% и 52,5% соответственно, что было значительно выше, чем в двух других группах ( P <0,01). Частота сопутствующих симптомов, рвоты, вздутия живота, диареи, кровавого стула, ослабленных кишечных шумов и плохого ответа была статистически значимой среди трех групп ( P <0,05). Кроме того, пропорции новорожденных с кровавым стулом (90.0%) и диарея (63,3%) в группе sFA были заметно выше, чем в других группах. Частота рвоты (94,3%) и вздутия живота (80,0%) была явно выше в группе SAGT, чем в других группах, и эти симптомы сопровождались относительно слабым ответом (60,0%) и ослаблением кишечных шумов (48,6%). . Кроме того, в группе НЭК наблюдались высокие показатели частоты ослабленных кишечных шумов (62,7%), плохой реакции (72,1%), вздутия живота (71,2%) и кровянистого стула (64,4%) (таблица).
Таблица 2
Клинические характеристики FOBT-положительных новорожденных с NEC, SAGT и sFA. НЭК: некротический энтероколит; САГТ: структурные аномалии желудочно-кишечного тракта; sFA: подозрение на пищевую аллергию; CBC: общий анализ крови; АР: рентгенография брюшной полости.
| Клинические характеристики | NEC (%) | SAGT (%) | sFA (%) | F ( χ 2 ) | P | ||
|---|---|---|---|---|---|---|---|
| Риск Факторы | Сахарный диабет беременных | 11.9 (7/59) | 5,7 (2/35) | 3,3 (1/30) | (2,316) | 0,314 | |
| Мекониевый запор | 3,4 (2/59) | 37,1 (13 / 35) | 6,7 (2/30) | (20,770) | <0,001 | ||
| Преждевременный разрыв мембраны | 23,7 (14/59) | 11,4 (4/35) | 16,7 (5/30) ) | (2,293) | 0,318 | ||
| Окрашенные меконием околоплодные воды | 18.6 (11/59) | 14,3 (5/35) | 6,7 (2/30) | (2,301) | 0,316 | ||
| Патентный артериальный проток | 27,1 (16/59) | 20,0 (7 / 35) | 10,0 (3/30) | (3,545) | 0,17 | ||
| Способ кормления | Formula | 61,0 (36/59) | 51,4 (18/35) | 36,7 (11 / 30) | (21,450) | 0,002 | |
| Грудь | 8,5 (5/59) | 14.3 (5/35) | 30,0 (9/30) | ||||
| Смешанный | 11,9 (7/59) | 20,0 (7/35) | 33,3 (10/30) | ||||
| Другое | 18,6 (11/59) | 14,3 (5/35) | 0,0 (0/30) | ||||
| Применение антибиотиков | 52,5 (31/59) | 34,3 (12/35) | 13,3 (4 / 30) | (13,261) | 0,001 | ||
| Сопутствующие симптомы | Рвота | 49.2 (29/59) | 94,3 (33/35) | 33,3 (10/30) | (28,318) | <0,001 | |
| Вздутие живота | 71,2 (42/59) | 80,0 (28 / 35) | 30,0 (9/30) | (20,188) | <0,001 | ||
| Диарея | 27,1 (16/59) | 11,4 (4/35) | 63,3 (19/30) | (21,166) | <0,001 | ||
| Стул с кровью | 64,4 (38/59) | 22.9 (8/35) | 90,0 (27/30) | (31,501) | <0,001 | ||
| Ослабленные звуки кишечника | 62,7 (37/59) | 48,6 (17/35) | 23,3 ( 7/30) | (12,346) | 0,002 | ||
| Лихорадка | 16,9 (10/59) | 17,1 (6/35) | 20,0 (6/30) | (0,139) | 0,933 | ||
| Плохой ответ | 72,9 (43/59) | 60,0 (21/35) | 23.3 (7/30) | (20.100) | <0,001 | ||
| Вспомогательные исследования | CBC | Нейтрофилы (%) | 55,4 ± 16,9 | 57,1 ± 15,8 | 43,610 ± 12,0 | 43,610 ± 12,0 | 0,001|
| Нейтрофилы (* 10 12 ) | 8,50 ± 7,70 | 8,42 ± 4,68 | 4,90 ± 2,25 | 3,789 | 0,025 | ||
| Нейтрофил / лимфоцит / лимфоцит 2 | 28 ± 1,77 | 2,23 ± 1,64 | 1,12 ± 0,66 | 5,862 | 0,04 | ||
| Эозинофилы (%) | 7,6 ± 6,4 | 4,1 ± 4,0 | 7,8 ± 5,4 | 900 | |||
| Эозинофилы (* 10 12 ) | 0,76 ± 0,34 | 0,47 ± 0,18 | 0,79 ± 0,37 | 8,547 | <0,001 | ||
| Тромбоциты (* 10 9 ) | 135311 ± 100 | 393 ± 159 | 3.788 | 0,025 | |||
| AR | Нормальный | 1,8 (1/57) | 2,9 (1/34) | 7,4 (2/27) | (33,983) | <0,001 | |
| Мягкий | 8,8 (5/57) | 44,1 (15/34) | 14,8 (4/27) | ||||
| Умеренный | 31,6 (18/57) | 32,4 (11/34) | 48,1 (13 / 27) | ||||
| Тяжелая | 47,4 (27/57) | 2,9 (1/34) | 18.5 (5/27) | ||||
| Снижение кишечного газа | 10,5 (6/57) | 17,6 (6/34) | 11,1 (3/27) | ||||
| Клинические результаты | Улучшение | Медицинское лечение | 57,6 (34/59) | 14,3 (5/35) | 86,7 (26/30) | (6,861) | 0,032 |
| Хирургическое лечение | 6,8 (4/59) | 68,6 (24/35) | 0,0 (0/30) | ||||
| Прекращение терапии | 35.6 (21/59) | 17,1 (6/35) | 13,3 (4/30) | ||||
Дополнительные обследования новорожденных с положительными FOBT в результате NEC, SAGT и sFA
Полная кровь подсчет (CBC) показал, что процент нейтрофилов был значительно увеличен в группах NEC (55,4%) и SAGT (57,1%) ( P <0,001). Кроме того, процент эозинофилов в группах NEC (7,6%) и sFA (7,8%) был явно выше, чем в группе SAGT (4.1%) ( P <0,05). Количество тромбоцитов в группе sFA было значительно повышено, достигнув в среднем 393 × 10 9 / л ( P <0,05), тогда как количество тромбоцитов в двух других группах было 316 × 10 9 / л и 311 × 10 9 / л соответственно. FOBT у новорожденных с sFA часто выявляли повышенные уровни эозинофилов и / или тромбоцитов в CBC, что обычно указывает на васкулит, связанный с аллергической реакцией, в то время как у новорожденных в группах NEC и SAGT часто наблюдались повышенные уровни нейтрофилов.Рентгенография брюшной полости показала, что у новорожденных в группе NEC в основном наблюдалась тяжелая степень кровотечения (47,4%), тогда как у новорожденных в группе sFA (48,1%, умеренная степень), по-видимому, была несколько более тяжелая степень, чем у новорожденных в группе SAGT ( 44,1%, легкая степень) (Таблицы и).
Таблица 3
DAAS 25 и степень отклонения от нормы на рентгенограммах 26 .
| Оценка | Результат | Степень серьезности | |
|---|---|---|---|
| 0 | Нормальный газовый образец | Нормальный | |
| 1 | Легкое диффузное растяжение | ||
| 2 | 2 | 2 | 2 |
| 2 | 2 | с пузырчатой прозрачностью, которая, вероятно, является стулом | Легкая |
| 3 | Фокусное умеренное растяжение петли кишечника | ||
| 4 | Разделение или очаговое утолщение петель кишечника | ||
| Без признаков 5 | петли кишечника | Умеренная | |
| 6 | Возможный пневматоз с другими отклонениями от нормы | ||
| 7 | Фиксированная или стойкая дилатация петель кишечника | Тяжелая | |
| 8 | Пневматоз с высокой вероятностью|||
| 9 | Газ в воротной вене | ||
| 10 | Пневмоперитонеум |
Прогноз для новорожденных с положительным FOBT из-за NEC, SAGT и sFA
Прогноз включал улучшение и отказ от терапии.Улучшение было определено как заметное облегчение. Новорожденных, у которых отмечалось улучшение, в дальнейшем классифицировали в группу лечения или группу хирургического и медикаментозного лечения. Напротив, отказ от терапии был определен как слишком ранняя выписка из больницы из-за серьезных осложнений или экономических ограничений.
Очевидно, что улучшение было основным результатом во всех трех группах, составив более 60,0% от общего числа. Всего 86,7% новорожденных с sFA, 57.6% новорожденных с NEC и 14,3% новорожденных с SAGT получали медикаментозное лечение, тогда как 68,6% новорожденных с SAGT и 6,8% новорожденных с NEC подвергались хирургическому лечению. Более того, 35,5% новорожденных с NEC, 17,1% новорожденных с SAGT и 13,3% новорожденных с sFA были исключены из терапии. Различия между этими группами были статистически значимыми ( X 2 = 6,861, P = 0,032; таблица). В группе НЭК 21 новорожденный был исключен из терапии из-за серьезных осложнений, включая нарушения гомеостаза, стриктуру кишечника после НЭК и синдром короткой кишки.Однако 4 пациента в группе sFA были выписаны до полного энтерального питания из-за экономических факторов или эмоциональных факторов, таких как невыносимое разлучение со своими детьми.
Значения клинических характеристик в диагностической дифференциации NEC, SAGT и sFA
Чтобы определить, были ли статистически значимые индексы в таблице ценными для дифференциальной диагностики, индексы были подвергнуты многомерному анализу, включая дискриминантный анализ и множественный анализ. логистический регрессионный анализ (Таблицы и).Дискриминантный анализ показал корреляцию BW (X 1 ), задержку выведения мекония (X 2 ), рвоту (X 3 ), диарею (X 4 ), кровянистый стул (X 5 ). ) и плохой отклик (X 6 ) с NEC (Y NE C = 0,010X 1 + 1,515X 2 + 3,641X 3 — 1,201X 4 + 4,029X 5 + 6,761 X 6 — 19,433), SAGT (Y SAGT = 0,012X 1 + 4,291X 2 + 6.002X 3 — 1,619X 4 + 2,644X 5 + 6,595X 6 — 25,853), и sFA (Y sFA = 0,011X 1 + 2,410X 2 + 3,472X 3 + 0,491X 4 + 5,182X 5 + 4,686X 6 — 22,395). Было выбрано максимальное значение Y, и прогнозируемая вероятность составила 71,0%, тогда как многомерный логистический регрессионный анализ выявил корреляцию времени начала (X 1 ), применения антибиотиков, рвоты (X 2 ) и диареи (X ). 3 ) с NEC (Y NEC = −2.634 — 0,105X 1 — 1,862X 2 + 2,091X 3 ) и SAGT (Y SAGT = −10,654 — 0,125X 1 — 2,59X 2 + 2,651X 3 ), когда рассматривая группу sFA в качестве ориентира. Была выбрана максимальная вероятность, и прогнозируемая вероятность составила 77,4%. Разница в общей прогнозируемой вероятности между двумя моделями не была статистически значимой ( X 2 = 1,348, P = 0,246; таблица).
Таблица 4
Дискриминантный анализ и множественный логистический регрессионный анализ.
| Группа | Прогнозируемая этиология | всего | Прогнозируемая вероятность (%) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| NEC | SAGT | sFA | |||||||||
| Фактическая этиология | 106107 | Дискриминантный анализ | 11 | 14 | 59 | 57,6 | |||||
| SAGT | 6 | 27 | 2 | 35 | 77,1 | ||||||
| sFA | 90.0 | ||||||||||
| Всего | 41 | 40 | 43 | 124 | 71,0 | ||||||
| Анализ MLR | NEC | 48 | 3 | 8 | 900 | 7 | 26 | 2 | 35 | 74,3 | |
| sFA | 6 | 2 | 22 | 30 | 73,3 | 124 | 77.4 | ||||
Обсуждение
Гематохезия часто встречается в неонатальном периоде, проявляясь в виде видимого кровянистого стула или положительного теста на FOBT. Этиология сложная, включая заболевания пищеварительного тракта и / или осложнения многих критических расстройств. Раннее выявление причины — залог ее успешного лечения. Из-за небольшого количества крови у некоторых пациентов не видно видимой крови в стуле, и FOBT необходим, чтобы уменьшить количество ошибочных диагнозов. Таким образом, это исследование ретроспективно проанализировало клинические характеристики FOBT-положительных новорожденных, предоставив клинический опыт для этиологических диагнозов и соответствующих эффективных методов лечения.Наше отделение было крупнейшим отделением интенсивной терапии в западном Китае. Всего с 1 января по 31 июля 2016 г. было госпитализировано 5330 новорожденных, в том числе 1183 недоношенных и 4147 доношенных. Большинство из них страдали перинатальной асфиксией, тяжелой пневмонией, сепсисом, тяжелым гемолизом и желтухой на уровне или выше порогового уровня для обменного переливания крови, недоношенности и других критических заболеваний. Поскольку это больница третичного уровня, входящая в медицинский университет, и центр неонатальной транспортной системы неотложной помощи в западном Китае, многие новорожденные, поступающие в наше отделение, переводятся из загородных районов и разлучены со своими семьями, что приводит к относительно низким показателям. грудного вскармливания составляет примерно 30%, что также является фактором риска поражения кишечника, что отражается как положительный результат FOBT.Поэтому FOBT используется в качестве стандартного скринингового теста в нашем отделении интенсивной терапии. Ряд состояний связан с положительными FOBT среди новорожденных. Системные проблемы, связанные с геморрагическими заболеваниями или коагулопатией, вызывают положительные FOBT. Однако ни одно из этих расстройств не было обнаружено в этом исследовании, что указывает на то, что частота скрытой гематохезии, вызванной системными расстройствами, у новорожденных не так высока, как сообщалось ранее (1-2%). 6 . Настоящие данные показали, что общая частота положительных результатов FOBT составила 6.2%, и что интересно, 25,2% (71/282) положительных FOBT у новорожденных были ложноположительными, которые были вызваны зараженными фекалиями или проглатыванием крови матери или новорожденного. Кроме того, 74,8% (211/282) кровотечений были вызваны кишечными источниками гематохезии. Среди них наиболее частыми причинами были NEC, SAGT и sFA, составляющие 20,9%, 12,4% и 10,6% от общего числа положительных FOBT, соответственно.
Время начала НЭК обратно коррелировало с ГА. НЭК может проявляться в течение первой недели жизни у доношенных детей, тогда как у недоношенных новорожденных она обычно появляется после начала кормления и возникает после 2 -й и 3 -й недель жизни 7 .В этом исследовании среднее время начала НЭК у FOBT-положительных младенцев приходилось на 7 900–13 9–15 дней после рождения, что, вероятно, было связано с преждевременными родами через 35 недель у 59 новорожденных с НЭК. Кроме того, было указано, что новорожденного с молодой GA, низкой частотой грудного вскармливания, воздействием антибиотиков и такими симптомами, как вздутие живота, ослабленные звуки кишечника или плохая реакция, следует рассматривать при возникновении NEC. В этой ситуации необходимо немедленно провести общий анализ крови и рентгенографию брюшной полости.Действительно, гематологические отклонения обычно несут определенную важную и ценную прогностическую информацию. Махешвари и др. . 8 отметили, что повышенное количество нейтрофилов является соответствующей воспалительной реакцией у пациентов с заболеванием легкой или средней степени тяжести. Напротив, нейтропения может наблюдаться при тяжелой форме НЭК. Настоящие данные показали, что у новорожденных в группе НЭК было повышенное количество нейтрофилов, что может быть связано с 64,4% [38/59] новорожденных в группе НЭК с диагнозом НЭК I стадии.Кроме того, Ян Y и др. . 9 сообщил, что соотношение нейтрофилов / лимфоцитов (N / L) может быть хорошим маркером для ранней диагностики НЭК, определяя степень тяжести. Данные показали, что у новорожденных в группе NEC было повышенное соотношение (N / L). Из-за небольшой выборки новорожденных с НЭК анализ подгрупп не проводился, а данные были слишком ограничены, чтобы определить степень тяжести. Требуются большие выборки, многоцентровые исследования.
Традиционно рентгенография брюшной полости также играла решающую роль в диагностике НЭК.Новорожденные с НЭК часто имеют тяжелые поражения кишечника, которые в основном выявляют очаговое вздутие, фиксированные петли кишечника, пневматоз и газ в воротной вене при рентгенографии брюшной полости. Кроме того, у некоторых новорожденных с НЭК в этом исследовании на рентгенограмме брюшной полости наблюдались типичные признаки, классифицированные как средние и тяжелые поражения кишечника (таблицы и). Ван и др. . 10 показали, что скорость восстановления NEC составляла 70–80%, тогда как степень улучшения NEC составляла 64.4% (38/59) в этом исследовании. Среди изученных новорожденных 34 получили консервативное лечение, четверо перенесли операцию из-за перфорации или полной непроходимости, а 21 был исключен из терапии из-за серьезных осложнений, включая нарушения гомеостаза, стриктуры кишечника после НЭК и синдром короткой кишки. Годен и др. . 11 исследовали факторы риска, связанные со стриктурой кишечника после НЭК, и указали, что наличие признаков перитонита и тромбопении являются факторами риска.Чжан и др. . 12 указали, что время позднего начала было предиктором стриктуры кишечника после НЭК и что у новорожденных с пост-НЭК наблюдалось повышение уровня лейкоцитов (лейкоцитов) и прокальцитонина (ПКТ).
Предыдущие исследования показали, что частота sFA явно увеличивается после НЭК или хирургии желудочно-кишечного тракта. 13 , 14 . Симптомы sFA разнообразны и в основном проявляются с 2 до 4 недель после контакта с пищевым белком или другими подозреваемыми веществами.Было обнаружено, что время начала положительного FOBT, вызванного sFA, в основном приходилось на 2 недель жизни и у 93,3% (28/30) младенцев с ГА более 35 недель. Кроме того, частота появления грубого кровянистого стула и диареи составила 90,0% и 63,3% соответственно. Повышенное количество эозинофилов и тромбоцитов в CBC, по-видимому, указывает на аллергическое расстройство, что согласуется с выводами Feuille 15 . На рентгенограмме брюшной полости в основном видны диффузное вздутие живота и разделение или очаговое утолщение петель кишечника.Однако Kawai M et al . 16 сообщили, что признаки рентгенографии брюшной полости у младенцев с sFA представляют собой повторяющиеся эпизоды пневматозоподобного NEC, которые трудно отличить от NEC. Подобные рентгенологические признаки были обнаружены у шести новорожденных в этом исследовании. Что касается лечения, у 86,7% (26/30) новорожденных улучшилось состояние после отказа от еды, как и наблюдалось в настоящем исследовании. Суда и др. . 17 сообщил, что некоторые случаи sFA впоследствии переросли в NEC.Они предположили, что стойкое снижение количества тромбоцитов может указывать на эту тенденцию. Поэтому следует проводить динамическое наблюдение за клиническим анализом крови, чтобы своевременно отслеживать прогресс.
На основании представленных статистических данных было обнаружено, что болезнь Гиршпрунга, стриктура кишечника и атрезия кишечника были частыми пороками развития у FOBT-положительных новорожденных в группе SAGT, и их доли составляли 37,1% (13/35), 14,3% (5). / 35) и 14,3% (5/35) соответственно. Госаин и др. . 18 сообщили, что новорожденные с болезнью Гиршпрунга имеют высокий риск развития энтероколита, связанного с Гиршпрунгом.Настоящие данные согласуются с этим, поскольку было окончательно подтверждено, что 13 новорожденных с положительным FOBT, у которых были NEC-подобные клинические характеристики, страдали SAGT. Среди этих новорожденных восемь страдали болезнью Гиршпрунга, у четырех была стриктура кишечника и у одного была атрезия кишечника. Из новорожденных с SAGT с положительным результатом FOBT у 37,1% (13/35) отмечалось отсроченное выведение мекония, тогда как у 94,3% (33/35) наблюдалась рвота. Общий анализ крови показал повышенное количество нейтрофилов, что указывает на возможность вторичной инфекции. Поскольку энтеральные структурные аномалии различаются, различные характеристики визуализации брюшной полости способствуют дифференциации диагноза.Хирургия может поставить окончательный диагноз, но может не подходить для исправления структурных аномалий кишечника. Учитывая этот инвазивный подход, который может привести к послеоперационным осложнениям, таким как спаечная кишечная непроходимость, НЭК и аллергический энтерит, точное понимание хирургической возможности имеет жизненно важное значение. В настоящем исследовании 68,6% (24/35) новорожденных с энтеральными структурными аномалиями и положительными FOBT были прооперированы. Среди этих новорожденных 5 новорожденных были повторно госпитализированы с осложнениями, у 3 новорожденных была спаечная кишечная непроходимость и у двоих в течение одного года после операции был выявлен НЭК.Повторно госпитализированным больным были проведены контрольные обследования. Однако данные по-прежнему были ограничены, чтобы отразить фактический долгосрочный прогноз.
САГТ возникает в неонатальном периоде, в том числе врожденным и приобретенным. Врожденный САГТ можно рассматривать как порок развития желудочно-кишечного тракта. NEC, sFA и SAGT имеют схожие клинические проявления, которые иногда переходят друг в друга (рис.). Врожденный и приобретенный САГТ может вызвать кишечную непроходимость и, как следствие, местную инфекцию или воспаление из-за повреждения кишечного барьера, что приводит к гиперчувствительности к определенным специфическим диетическим антигенам, проявляющейся как пищевая аллергия.Если врачи сталкиваются с младенцами с хирургическим заболеванием желудочно-кишечного тракта, включая мальротацию кишечника, им необходимо учитывать пищевую аллергию при дифференциальной диагностике или как осложняющий фактор 13 . Стриктура после НЭК — широко известное осложнение. После острого эпизода НЭК стриктура, связанная с тяжелой и продолжительной болезнью (сепсис, перфорация, кишечная непроходимость) и заболеваемость, вторичная по отношению к стриктуре кишечника, может развиться в течение различного периода независимо от способа лечения.Пищевая аллергия — это гиперчувствительная реакция на определенные пищевые антигены. Суда и др. . 17 сообщили, что 2 новорожденным с sFA потребовалась лапаротомия из-за вторичной NEC. Отек кишечника и травма могут возникнуть, если не практикуется надлежащее избегание предполагаемой пищи, а тяжелое воспаление кишечника может прогрессировать до местного некроза и перфорации или эндогенной инфекции, имитируя NEC и вызывая энтеральные осложнения, такие как стриктура кишечника и другие приобретенные SAGT.Однако лечение и прогнозы NEC, sFA и SAGT обычно различны. Поэтому исследователи попытались создать прогностические модели с помощью дискриминантного анализа и множественного логистического регрессионного анализа. Рвота и диарея используются в качестве индексов в двух моделях, что позволяет предположить, что они могут иметь некоторое клиническое значение при постановке диагноза. К сожалению, не было обнаружено статистически значимой разницы в общей прогностической скорости этих двух моделей. Таким образом, в настоящее время невозможно обеспечить эффективный подход к дифференциальной диагностике.Следовательно, рекомендуется проспективное исследование для создания ценной модели клинического прогноза.
Общая этиология неонатальной гематохезии.
Таким образом, для новорожденных с положительным FOBT сначала следует исключить ложноположительные результаты. Затем следует идентифицировать системные заболевания и расстройства пищеварительного тракта, такие как инфекция, деформация, аллергия, стресс и травмы 1 , 19 в соответствии с процессом, описанным на рис. NEC, SAGT и sFA были наиболее частыми причинами неонатальной гематохезии.У новорожденных эти заболевания имеют схожие клинические проявления и иногда могут переходить друг в друга при определенных условиях. Пикеринг А и др. . 20 сообщили, что рутинный анализ кала на скрытую кровь не позволяет прогнозировать некротический энтероколит. Следовательно, хотя мы не смогли обеспечить раннее предупреждение о тяжелом заболевании с помощью FOBT, а раннее вмешательство для FOBT может не уменьшить NEC, sFA, структурные повреждения кишечника или любые другие осложнения, значение положительности FOBT у новорожденных заключается в том, что медицинский персонал будет внимательно следить за соответствующими заболеваниями, включая НЭК, пороки развития желудочно-кишечного тракта и подозрения на пищевую аллергию, при более тщательном наблюдении и последующем наблюдении.Основываясь на сочетании общего состояния, толерантности к кормлению, температуры, абдоминальных признаков, общего анализа крови, рутинных анализов стула плюс FOBT и визуальных исследований брюшной полости, клиницисты смогут определить возможную этиологию, что полезно для своевременного изменения терапевтической стратегии. .
Диагностическая схема положительного FOBT у новорожденных.
Методы
Условия исследования и отбор пациентов
Это исследование проводилось в отделении неонатологии детской больницы Чунцинского медицинского университета.Данные были собраны из медицинских карт отделения неонатологии с 1 января по 31 июля 2016 года. Исследование было одобрено институциональным наблюдательным советом детской больницы Чунцинского медицинского университета. Все методы были выполнены в соответствии с соответствующими инструкциями и правилами. Данные были собраны, просмотрены, деидентифицированы и проанализированы авторами анонимно; комитет по этике отказался от требования информированного согласия из-за анонимности данных и научной цели исследования.
Субъекты
Всего было обследовано 5 330 новорожденных. Из них 1183 новорожденных были недоношенными, в том числе 140 новорожденных с очень низкой массой тела. В данном исследовании предварительно было зарегистрировано 330 новорожденных с положительными FOBT. Частота положительных результатов FOBT составила 6,2%. Два новорожденных с неполными медицинскими картами и 46 новорожденных с гематохезией через 28 дней или с GA ≥ 42 недель были исключены. Таким образом, в исследование были включены 282 новорожденных. Стул людей проверялся как минимум один раз, 60 новорожденных — один раз, а остальные — дважды или более.Среди этих субъектов у 90 в анамнезе был отчетливо видимый кровавый стул, и FOBT проводился после исчезновения грубого кровянистого стула.
Сбор данных
Демографические данные, история родов и кормления, физикальное обследование (сопутствующие симптомы), запись о лечении, общий анализ крови и другие специфические обследования, включая обследование брюшной полости с помощью пленочного снимка (наиболее тяжелым результатом считался, если было несколько повторных обследований), все данные были собраны из электронной медицинской карты (ЭМИ).NEC был определен на основе критериев Белла с модификациями 21 .
Побочные реакции, связанные с ФА, часты в первый год жизни 22 . Пробный тест с причинной пищей незаменим при диагностике пищевой аллергии, но нереален для всех случаев у новорожденных 23 , потому что эти тесты могут быть опасными, а результаты трудно анализировать у новорожденных. Поэтому концепция подозрения на пищевую аллергию может быть более подходящей для этих случаев.В нашем исследовании диагноз sFA был основан на сочетании следующих факторов, семейном анамнезе анафилактических заболеваний, анамнезе прямого или косвенного воздействия антибиотиков и / или других предполагаемых веществ, а также исключении других возможных причин кровавый стул. Кроме того, симптомы уменьшились при кормлении молоком с аминокислотами или подозрении на отказ от пищи, рецидив после приема предполагаемой пищи.
Острая стрессовая язва диагностируется в зависимости от того, у недоношенных и доношенных детей в отделении интенсивной терапии для новорожденных развиваются поражения слизистой оболочки желудка и проявляются кровотечения из верхних отделов желудочно-кишечного тракта, предполагаемые промыванием желудочного сока, а также факторы воздействия стресса, включая перинатальную асфиксию, внутричерепное кровоизлияние, усиление внутричерепного кровообращения. давление, сепсис, гипогликемия, сильная рвота и т. д. 24 900 15.
Острая диарея диагностировалась в соответствии с повышенной частотой и / или измененными характеристиками стула по сравнению с нормальным стулом, тогда как диарея новорожденных проявляется жидким или водянистым стулом не менее шести раз в течение 24 часов.
Структурные аномалии желудочно-кишечного тракта (САГТ) были диагностированы на основании биопсии или соответствующих послеоперационных результатов, что означает «врожденный или приобретенный САГТ».
Анализ кала на скрытую кровь
FOBT были выполнены в нашей клинической лаборатории с использованием метода коллоидного золота (реагент для обнаружения скрытой крови Aibo; Aibo Biomedical, Ханчжоу, Китай).Вкратце, образец стула был взят из подгузника. Затем небольшое количество собранной пробы фекалий размазали в пробирке и сразу же доставили в клиническую лабораторию. Анализ выполняли в соответствии с инструкциями к продукту. Результат считался положительным, когда появлялась и линия обнаружения, и линия контроля качества.
Оценка рентгенографии брюшной полости
Рентгенография брюшной полости была оценена на основе Шкалы оценки живота Duke (DAAS) 25 .Поскольку уменьшение воспаления кишечника не входит в DAAS, это было проанализировано отдельно. Степень тяжести, указанная в исследовании Boyin Deng et al . 26 (Таблица).
Статистический анализ
Все данные были проанализированы с использованием программного обеспечения SPSS 17.0 (Чикаго, Иллинойс, США). Нормально распределенные непрерывные данные были описаны как среднее ± стандартное отклонение (M ± SD) и исследованы с помощью дисперсионного анализа. Искаженные данные были описаны как медиана (межквартильный диапазон [IQR]) и проанализированы с помощью теста Kruskal-Wallis .Категориальные данные анализировали с помощью теста хи-квадрат или точного теста Фишера . Для анализа дифференциального диагноза применялся многомерный анализ, включая дискриминантный анализ и анализ множественной логистической регрессии. Значение P <0,05 считалось статистически значимым.
Утверждение этических норм и согласие на участие
Протокол исследования был одобрен Наблюдательным советом детской больницы Чунцинского медицинского университета.
Заявление об информированном согласии
Это ретроспективное исследование. Комитет по этике отказался от требования информированного согласия из-за анонимности данных и научной цели исследования.
Журнал детской гастроэнтерологии и питания
Тезисы: Ежегодное собрание Североамериканского общества детской гастроэнтерологии и питания; Денвер, 21-24 октября 1999 г.
MetroHealth Medical Center & CWRU, Кливленд, Огайо
Аннотация 43
Общие сведения : Когда видимая / скрытая кровь обнаруживается в стуле детей, находящихся на исключительно грудном вскармливании (EBF), это часто происходит из-за аллергического колита, вызванного коровьим молоком / соевым белком.Устранение антигенов из рациона матери обычно приводит к быстрому разрешению. Если кровь остается, несмотря на дальнейшие ограничения в питании матери, врачи могут посоветовать матерям прекратить грудное вскармливание и заменить его на гипо- / моноаллергенную смесь. Некоторые использовали ферменты поджелудочной железы для лечения экземы, вызванной аллергией на пищевые белки. Постулируется, что протеазный компонент расщепляет белки-вредители, делая их менее антигенными. Цель : Определить, разрешается ли стойкий стул крови в стуле у младенца EBF, несмотря на тщательное ограничение питания матери, путем предоставления матери ферментами поджелудочной железы. Методы : Четверо доношенных новорожденных с EBF (возрастом от 1,5 до 3 месяцев) были обследованы на наличие видимой / скрытой крови в стуле, несмотря на ограничение матери в рационе коровьего молока / соевого белка. Ни у одной матери не было трещин / болей на сосках. У всех младенцев был положительный атопический семейный анамнез, но не было обнаружено возбудителей анальной трещины или стула. Дальнейшее ограничение употребления яиц, пшеницы, рыбы, орехов и арахиса (≥ двух недель) не привело к выведению крови из стула. Соблюдение диеты контролировалось диетологом. Из-за раздражительности, ГЭ-рефлюкса, диареи и гематохезии у двух детей была проведена эндоскопия, показавшая аллергический колит.Затем матерям прописывали ферменты поджелудочной железы (Pancrease MT 4®, единицы USP: 4000 липазы / 12000 амилазы, 12000 протеаз) по две капсулы во время еды / одна во время перекуса. Кровь стула контролировали два-три раза в неделю с помощью анализа гваяковой кислоты (Hemoccult®). Результаты : У младенцев кровь в стуле исчезла в течение нескольких дней после терапии. Одной матери потребовалось три капсулы во время еды / две во время еды до того, как кровь в стуле рассосется. Побочных эффектов в результате терапии не наблюдалось. Заключение : Ферментная терапия материнской поджелудочной железы может быть альтернативным лечением для младенцев EBF с кровью стула, когда диетические ограничения не помогают.Это позволяет матери продолжать грудное вскармливание и снизить риск анемии.
Описание раздела
ПОСТЕРНЫЙ СИМПОЗИЙ
Клинические заболевания
© 1999 Европейское общество детской гастроэнтерологии, гепатологии и питания и Североамериканское общество детской гастроэнтерологии,(PDF) Клиническое значение положительного результата анализа кала на скрытую кровь у новорожденных
5
НАУЧНЫЕ ОТЧЕТЫ | (2019) 9: 17898 | https: // doi.org / 10.1038 / s41598-019-54511-5
www.nature.com/scientificreports
www.nature.com/scientificreports/
FOBT используется в качестве стандартного скринингового теста в нашем отделении интенсивной терапии. Ряд состояний связан с положительными FOBT среди новорожденных. Системные проблемы, связанные с геморрагическими заболеваниями или коагулопатией, вызывают
FOBT. Однако ни одно из этих расстройств не было обнаружено в этом исследовании, что указывает на то, что частота случаев скрытой
гематохезии, вызванной системными заболеваниями у новорожденных, не так высока, как сообщалось ранее (1-2%) 6.Согласно имеющимся данным, общая частота положительных результатов FOBT составила 6,2%, и что интересно, 25,2% (71/282) из
положительных результатов FOBT у новорожденных были ложноположительными, что было вызвано загрязненными фекалиями или заглатывание
материнской или неонатальной крови. Кроме того, 74,8% (211/282) кровотечений были вызваны кишечными источниками гемато-
хезии. Среди них наиболее частыми причинами были NEC, SAGT и sFA, составляющие 20,9%, 12,4% и 10,6%
от общего числа положительных FOBT, соответственно.
Время начала НЭК обратно коррелировало с ГА. NEC может появиться в течение первой недели жизни у доношенных
новорожденных, тогда как у недоношенных новорожденных он обычно появляется после начала кормления и возникает после 2-й и 3-й
недель жизни7. В этом исследовании среднее время начала НЭК у FOBT-положительных младенцев было на 7-й день после рождения,
, что, вероятно, было связано с преждевременными родами через 35 недель из 59 новорожденных с НЭК. Кроме того,
указывало на то, что новорожденного с молодой GA, низким уровнем грудного вскармливания, воздействием антибиотиков и такими симптомами, как
вздутие живота, ослабленные звуки кишечника или плохая реакция, следует рассматривать при возникновении NEC.В
этой ситуации необходимо немедленно провести общий анализ крови и рентгенографию брюшной полости. Действительно, гематологические аномалии
обычно несут определенную важную и ценную прогностическую информацию. Maheshwari et al. (8) отметили, что
повышенного количества нейтрофилов представляют собой соответствующий воспалительный ответ у пациентов с
тяжелым заболеванием легкой-средней степени тяжести. Напротив, нейтропения может наблюдаться при тяжелой форме НЭК. Настоящие данные показали, что у новорожденных в группе
NEC было повышенное количество нейтрофилов, что может быть связано с 64.4% [38 из 59] новорожденных в группе
НЭК были диагностированы как НЭК I стадии. Кроме того, Yang Y et al.9 сообщили, что соотношение нейтрофилы / лимфоциты (N / L) может составлять
хорошим маркером для ранней диагностики НЭК, определяя степень тяжести. Эти данные показали, что у новорожденных в группе NEC
было повышенное соотношение (N / L). Из-за небольшой выборки новорожденных с НЭК анализ подгрупп не проводился,
, и данные были слишком ограничены, чтобы различить степень тяжести. Требуются большие выборки, многоцентровые исследования.
Традиционно рентгенография брюшной полости также играла решающую роль в диагностике НЭК. Новорожденные с
NEC часто имеют тяжелые поражения кишечника, которые в основном выявляют очаговое вздутие, фиксированные петли кишечника, пневматоз
и газ в воротной вене при рентгенографии брюшной полости. Кроме того, некоторые из новорожденных с НЭК в этом исследовании
имели типичные признаки, классифицированные как средние и тяжелые поражения кишечника, на рентгенограмме брюшной полости
(Таблицы 2 и 3).Wang et al.10 показали, что скорость выздоровления NEC составляла 70–80%, тогда как скорость улучшения
NEC составила 64,4% (38/59) в этом исследовании. Среди обследованных новорожденных 34 получили консервативное лечение,
, четверо перенесли операцию из-за перфорации или полной непроходимости, а 21 был исключен из терапии из-за
серьезных осложнений, включая нарушения гомеостаза, стриктуры кишечника после НЭК и короткую кишку
синдром. Gaudin и др. [11] исследовали факторы риска, связанные со стриктурами кишечника после НЭК, и указали, что
наличие признаков перитонита и тромбопении были факторами риска.Zhang et al. 12 указали, что время позднего начала
было предиктором стриктуры кишечника после НЭК и что у новорожденных с пост-НЭК наблюдалось повышение лейкоцитов (лейкоцитов) и прокальци-
тонина (ПКТ). Стриктура НЭК кишечника.
Предыдущие исследования показали, что частота sFA явно увеличивается после операции на НЭК или желудочно-кишечного тракта
13,14. Симптомы нЖК разнообразны и в основном проявляются со 2-й по 4-ю неделю после контакта с
пищевым белком или другими подозреваемыми веществами.Было обнаружено, что время начала положительного FOBT, вызванного
sFA, в основном появлялось на 2-й неделе жизни и у 93,3% (28/30) младенцев с GA более 35 недель. В добавлении
ичастота случаев грубого кровянистого стула и диареи составляла 90,0% и 63,3%, соответственно. Повышенное количество эозинофилов и тромбоцитов на
в общем анализе крови, по-видимому, указывает на аллергическое расстройство, что согласуется с данными
Фейля15. Признаки на рентгенографии брюшной полости в основном показывают диффузное вздутие и разделение или
очагового утолщения петель кишечника.Тем не менее, Kawai M. и др. 16 сообщили, что признаки абдоминальной рентгенографии у
младенцев с sFA представляют собой повторяющиеся эпизоды пневматозоподобного NEC, которые трудно отличить от
NEC. Подобные рентгенологические признаки были обнаружены у шести новорожденных в этом исследовании. Что касается лечения, 86,7% (26/30)
новорожденных улучшили отказ от пищи, как это наблюдалось в настоящем исследовании. Суда и др. 17 сообщили, что около
случаев sFA впоследствии переросли в NEC.Кей предположил, что стойкое снижение количества тромбоцитов может указывать на эту тенденцию. Таким образом, следует проводить динамическое наблюдение за клиническим анализом крови для своевременного отслеживания прогресса.
На основании представленных статистических данных было обнаружено, что болезнь Гиршпрунга, стриктура кишечника и атрезия кишечника
были частыми пороками развития у FOBT-положительных новорожденных в группе SAGT, и доля
составляла 37,1% (13/35 ), 14,3% (5/35) и 14,3% (5/35) соответственно.Gosain et al.18 сообщили, что новорожденные с болезнью Гиршпрунга
имеют высокий риск развития энтероколита, связанного с Гиршпрунгом. Настоящие данные согласуются с этим,
, поскольку 13 новорожденных с положительными FOBT, у которых были клинические характеристики, подобные NEC, были окончательно подтверждены как пострадавшие от
SAGT. Среди этих новорожденных восемь страдали болезнью Гиршпрунга, у четырех была стриктура кишечника и у одного была атрезия кишечника
. Из новорожденных с SAGT с положительными FOBT у 37,1% (13/35) отмечена задержка экскреции мекония, тогда как у
94.У 3% (33/35) была рвота. Общий анализ крови показал повышенное количество нейтрофилов, что указывает на возможность вторичной
инфекции. Поскольку энтеральные структурные аномалии различаются, разные характеристики визуализации брюшной полости способствуют дифференциации диагноза
. Хирургия может предоставить точный диагноз, но может не подходить для восстановления структурных аномалий кишечника. Учитывая этот инвазивный подход, который может привести к послеоперационным осложнениям, таким как
спаечная кишечная непроходимость, НЭК и аллергический энтерит, точное понимание хирургической возможности имеет жизненно важное значение.В настоящем исследовании
68,6% (24/35) новорожденных с энтеральными структурными аномалиями и положительными FOBT перенесли операции
. Среди этих новорожденных 5 новорожденных были повторно госпитализированы с осложнениями, у 3 новорожденных было
спаечной непроходимости кишечника, а у двоих в течение одного года после операции был выявлен НЭК. Повторные обследования были проведены
повторно госпитализированных больных. Однако данные все еще были ограничены, чтобы отражать фактический долгосрочный прогноз.
САГТ возникает в неонатальном периоде, в том числе врожденным и приобретенным. Врожденный САГТ
можно рассматривать как порок развития желудочно-кишечного тракта. NEC, sFA и SAGT имеют схожие клинические проявления, которые
иногда переходят друг в друга (рис. №1). Врожденный и приобретенный САГТ может вызвать кишечную непроходимость и, как следствие, местную инфекцию или воспаление из-за повреждения кишечного барьера, что приводит к содержанию
любезно предоставлено Springer Nature, применяются условия использования.Права защищены
Желудочно-кишечное кровотечение у младенцев и детей
Цели
После прочтения этой статьи читатели должны иметь возможность:
Разработать дифференциальный диагноз на основе клинических проявлений желудочно-кишечной кровопотери.
Обсудите возрастные причины кровотечений из верхних и нижних отделов ЖКТ.
Обозначьте последовательность процесса оценки и принятия решения у ребенка с желудочно-кишечным кровотечением.
Опишите новые методы лечения и эндоскопические приемы для остановки кровотечения из ЖКТ.
Пример из практики
3-недельная девочка, ранее здоровая, поступила с двухдневным анамнезом ректального кровотечения. Ее родители описали от трех до пяти жидких стульев в день, смешанных с ярко-темно-красной кровью и слизью. Сопутствующие симптомы включали эпизодическую некровавую рвоту и эритематозную сыпь на руках и ногах. Младенец получал стандартную смесь коровьего молока.Прибавка в весе и линейный рост были отличными. Абдоминальное обследование не выявило болезненности, органегалии, трещин заднего прохода. Стул был положительным по гваяковой кислоте. Общий анализ крови (CBC) показал нормальный гематокрит, средний корпускулярный объем (MCV), количество тромбоцитов и количество лейкоцитов. Общее количество эозинофилов слегка увеличилось и составило 0,55 × 10 3 / мм 3 . Посев кала был отрицательным . Присутствовал токсин Clostridium difficile . Через три дня после того, как ребенок был переведен на смесь с гидролизатом протеина, частота дефекации уменьшилась до двух раз в день.Несмотря на то, что ребенок продолжал выглядеть хорошо, с хорошим набором веса и ростом, в ее стуле периодически в течение следующих 3 недель периодически находились нити крови и слизи. Гибкая ректороманоскопия в это время выявила умеренную узловую лимфоидную гиперплазию в ректосигмоидной области (рис. 1). В остальном слизистая оболочка толстой кишки выглядела нормальной. Биопсия сигмовидной и прямой кишки показала шесть эозинофилов на поле высокого увеличения, нормальную архитектуру крипт и лимфоидные узелки. Младенец продолжал получать смесь с протеиновым гидролизатом, и сильное кровотечение постепенно прекратилось в течение следующих 2 недель .
Рисунок 1.Узловая лимфоидная гиперплазия: множественные подслизистые узелки в…
Новый взгляд на скрытое и неясное желудочно-кишечное кровотечение
САРА Х. МИТЧЕЛЛ, доктор медицины, ДЭВИД К. ШЕФЕР, доктор медицины, доктор философии и ШРИНИВАСАН ДУБАГУНТА, доктор медицины, Медицинский центр Гейзингер, Данвилл, Пенсильвания
Am Fam Physician. , 15 февраля 2004 г .; 69 (4): 875-881.
Скрытое желудочно-кишечное кровотечение обычно обнаруживается при положительных результатах анализа кала на скрытую кровь или обнаружении железодефицитной анемии.Методы анализа кала на скрытую кровь различаются, но все они имеют ограниченную чувствительность и специфичность. Первоначальное обследование скрытого кровотечения обычно включает колоноскопию или эзофагогастродуоденоскопию, либо и то, и другое. У пациентов без симптомов, указывающих на источник в верхних отделах желудочно-кишечного тракта, или у пациентов старше 50 лет, колоноскопия обычно выполняется в первую очередь. Около половины пациентов с желудочно-кишечным кровотечением не имеют очевидного источника кровотечения. Этим пациентам могут быть выполнены визуализация тонкой кишки или повторная панендоскопия.Исследования тонкой кишки с барием широко доступны, но имеют ограниченную диагностическую ценность. Поражения слизистой оболочки, такие как сосудистые эктазии, частая причина неясных кровотечений, могут быть пропущены при исследованиях тонкой кишки. Эндоскопию тонкой кишки сложно выполнить, но она дает более высокую диагностическую ценность. Капсульная эндоскопия — это новый метод, который позволяет неинвазивную визуализацию тонкой кишки. Радионуклидное сканирование эритроцитов или ангиография могут быть полезны у пациентов с активным кровотечением. Лечение кровотечения чаще всего включает эндоскопическую абляцию места кровотечения с помощью тепловой энергии, если это место доступно.Ангиографическая эмболизация может использоваться для лечения поражений, недоступных эндоскопически. Распространенные диффузные сосудистые поражения трудно поддаются лечению. Медицинское лечение, обычно с комбинированной гормональной терапией, имеет ограниченную пользу. Хирургическое лечение неясного кровотечения часто оказывается безуспешным или нецелесообразным из-за множественных участков кровотечения.
Скрытое кровотечение (то есть желудочно-кишечное кровотечение, которое не видно пациенту или врачу) обычно обнаруживается при обнаружении железодефицитной анемии или при положительном результате анализа кала на скрытую кровь (FOBT).1 Неизвестное кровотечение — это желудочно-кишечное кровотечение из неизвестного источника, которое сохраняется или повторяется после отрицательной первоначальной оценки (например, колоноскопии, эзофагогастродуоденоскопии [EGD]). видимая кровь).
Желудочно-кишечное кровотечение имеет множество возможных причин (Таблица 1) .2–4 История болезни пациента, возраст, симптомы, физикальное обследование и результаты лабораторных анализов могут использоваться в качестве клинических ключей для проведения первоначального исследования.
Анализ кала на скрытую кровь
Потеря 0,5–1,5 мл крови в день в желудочно-кишечном тракте — это нормально, 3 и мелена обычно выявляется, когда в верхних отделах желудочно-кишечного тракта теряется более 150 мл крови3. чувствительность для обнаружения кровотечения, которое не видно в стуле. Существует три класса FOBT: тесты на основе гваяковой кислоты, тесты на гемепорфирин и иммунохимические тесты.
В тестах на основе гваяковой кислоты псевдопероксидазная активность гемоглобина превращает гваяковое соединение в синий цвет в присутствии перекиси водорода.3,4 Если в кале присутствуют определенные вещества (таблица 2), 3 результаты могут быть ложноположительными. Пациентов обычно предупреждают не есть красное мясо или некоторые фрукты и овощи в течение 72 часов перед тестированием. Следует избегать приема аспирина или других нестероидных противовоспалительных препаратов (НПВП) в течение одной недели перед тестированием. У пациентов, принимающих витамин С, могут быть ложноотрицательные результаты; Пациентам следует рекомендовать не принимать витамин С за неделю до тестирования. Пациентам рекомендуется есть продукты с высоким содержанием клетчатки в течение одной недели перед тестированием, чтобы ускорить прохождение стула.Hemoccult II и Hemoccult II SENSA — это наиболее часто используемые тесты на основе гваяковой кислоты3. Широко доступные и недорогие, они могут быть быстро выполнены в кабинете врача или пациентом дома. Hemoccult II SENSA имеет более высокую чувствительность3; регидратация карт стула перед тестированием увеличивает чувствительность, но снижает специфичность.
Просмотр / печать таблицы
ТАБЛИЦА 1Причины оккультной желудочно-кишечной кровопотери
Источник верхних трактов | |||||
Пищевод / желудок | |||||
| 909 | Эрозивный гастрит / изъязвление * | ||||
Варикоз | |||||
Эрозии Камерона внутри грыжи пищеводного отверстия диафрагмы | |||||
| y(например, расширенный аберрантный сосуд, лежащий в основе небольшого дефекта слизистой оболочки) | |||||
Сосудистая эктазия антрального отдела желудка (т. е. «арбузный желудок») | |||||
64 | |||||
Дуоденит | |||||
Целиакия | |||||
Дивертикул Меккеля | 6|||||
Источник нижнего тракта | |||||
Толстая кишка | |||||
Дивертикулы (обычно вызывают явное кровотечение) | |||||
| 28 Иш Ulc активный колит | |||||
Другой колит | |||||
Инфекция (напр.g., анкилостомы, власоглавы, стронгилоиды, аскаридоз, туберкулезный энтероколит, амебиаз, цитомегаловирус) | |||||
Прямая кишка | |||||
Fissure | Fissure 928446 92849 желудочно-кишечный источник | ||||
Сосудистая эктазия / ангиодисплазия | |||||
Карцинома (особенно толстой кишки) * | |||||
Васкулит | |||||
| 06 A Fistulag., саркома Капоши, лимфома, лейомиома, лейомиосаркоа, карциноидные опухоли, меланома) | |||||
Большие полипы | |||||
телеангиэктазии (т.е. синдром пузырчатого невуса | |||||
Амилоидоз | |||||
Гемангиома | |||||
Радиационно-индуцированное повреждение слизистой оболочки | |||||
Кровохарканье | |||||
Носоглотка (e.g., носовое кровотечение, кровоточивость десен) | |||||
Мнимый | |||||
Бег на длинные дистанции | |||||
Источник не найден | |||||
9280 Причины оккультной крови 9280
Источник верхних отделов тракта
Пищевод / желудок
Рефлюкс-эзофагит *
Эрозивный гастрит 6 9106
6 9106
9105
Эрозии Камерона при грыже пищеводного отверстия диафрагмы
Поражение Дьелафуа (i.(например, расширенный аберрантный сосуд, лежащий в основе небольшого дефекта слизистой оболочки)
Сосудистая эктазия антрального отдела желудка (т. е. «арбузный желудок»)
64
Портальная гастропатия
Тонкая кишка
Дуоденит
Целиакия
Дивертикул Меккеля
6
)
Источник нижнего тракта
Толстая кишка
Дивертикулы (обычно вызывают явное кровотечение)
Иш Ulc активный колит
Другой колит
Инфекция (напр.g., анкилостомы, власоглавы, стронгилоиды, аскаридоз, туберкулезный энтероколит, амебиаз, цитомегаловирус)
Прямая кишка
Fissure
Fissure
92844
6 9284r
92849 желудочно-кишечный источник
9 желудочно-кишечный источник
Сосудистая эктазия / ангиодисплазия
Карцинома (особенно толстой кишки) *
Васкулит
Большие полипы
телеангиэктазии (т.е. синдром пузырчатого невуса
Амилоидоз
Гемангиома
Радиационно-индуцированное повреждение слизистой оболочки
Кровохарканье
Носоглотка (e.g., носовое кровотечение, кровоточивость десен)
Поддельный
Бег на длинные дистанции
Источник не обнаружен
Гемопорфирин, тест на гемоглобин производные порфиринов, позволяющие количественно измерить гемоглобин в стуле3. Его использование ограничено, поскольку оно дает более высокий уровень ложноположительных результатов, является дорогостоящим и требует лабораторного времени. В отличие от тестов на основе гваяка, пищевые пероксидазы не вызывают ложноположительных результатов теста на гемепорфирин.
Иммунохимические тесты FOBT, такие как HemeSelect и FECA-EIA, выявляют интактный гемоглобин человека. Эти тесты более специфичны для кровотечения из нижних отделов желудочно-кишечного тракта, а потребление красного мяса или пищевых пероксидаз не дает ложноположительных результатов. К недостаткам можно отнести ограниченную доступность и время, необходимое для обработки теста. Иммунохимические FOBT не обнаруживают переваренный гемоглобин, поэтому они не могут обнаружить кровотечение из верхних отделов желудочно-кишечного тракта.3
Из-за возможности кровотечения из-за травмы неизвестно, был ли положительный результат теста, проведенного на образце из пальцевое ректальное исследование отличается от положительного теста на самопроизвольный стул.В идеале, для рутинного скрининга карты стула должны составляться из самопроизвольно откачавшегося стула, и пациент должен соблюдать рекомендуемые ограничения диеты перед тестированием. Ежедневное употребление варфарина (кумадина) или аспирина в низких дозах (например, 81 мг в день) не повышает уровень фекалий в достаточной степени для получения положительных результатов FOBT на основе гваяковой кислоты.5
Обследование скрытого кровотечения
ЭНДОСКОПИЯ
Первоначальная оценка скрытого кровотечения обычно состоит из колоноскопии или EGD. У пациентов старше 50 лет колоноскопия обычно выявляет источник кровотечения; это должен быть первый проведенный тест.3 Опухоль, полип размером более 1 см, колит или эктазия сосудов при колоноскопии могут быть причиной гем-положительного стула в нижних отделах желудочно-кишечного тракта. Первоначальная оценка с помощью ФГДС может быть необходима пациентам с такими факторами риска, как прием НПВП или аспирина (в более высоких дозах) или симптомами со стороны верхних отделов желудочно-кишечного тракта. Некоторые дополнительные данные, которые могут указывать на источник кровотечения, приведены в таблице 3.6,7
Просмотр / печать таблицы
ТАБЛИЦА 2Причины ложноположительных результатов анализа кала на скрытую кровь
Внекишечная кровопотеря |
Носовое кровотечение |
Десневое кровотечение |
Тонзиллит / фарингит |
Кровохарканье |
| 66 |
| 666 Лекарства, вызывающие раздражение Нестероидные противовоспалительные препараты |
Витамин С |
Экзогенная пероксидазная активность |
Потребление красного мяса (нечеловеческий гемоглобин) |
потребление фруктов (инжир) 900 05 |
Потребление сырых овощей (редис, цветная капуста, брокколи, репа, хрен; реже: огурец, морковь, капуста, картофель, тыква, петрушка, кабачки) |
Причины ложноположительных результатов анализа кала на скрытую кровь
Внекишечная кровопотеря | |
| Epistaxis | |
Десневое кровотечение | |
Тонзиллит / фарингит | |
Кровохарканье | |
Лекарства, вызывающие раздражение желудка | 6 | противовоспалительное лекарственные препараты |
Витамин C | |
Экзогенная пероксидазная активность | |
Потребление красного мяса (нечеловеческий гемоглобин) | |
0004 Грейпфрут, инжир6 | Потребление сырых овощей (редис, цветная капуста, брокколи, репа, хрен; менее вероятно: огурец, морковь, капуста, картофель, тыква, петрушка, кабачки) |
Использование одностоечных бариевых клизм прекращено из-за неприемлемо высокой частоты пропущенных случаев рака толстой кишки.Бариевые клизмы с двойным контрастированием используются в первую очередь, когда результаты колоноскопии неоптимальны.8
Если эндоскопическая оценка верхних и нижних трактов отрицательна или сомнительна, может потребоваться исследование источника кровотечения из тонкой кишки, особенно у пациентов с постоянным или рецидивирующим заболеванием. кровотечение. Из-за значительного количества ложноотрицательных результатов при первичной эндоскопии некоторые органы рекомендуют повторную эндоскопию верхних и нижних отделов перед визуализацией тонкой кишки1 [Уровень доказательности C, консенсус / рекомендации экспертов] Эрозии Камерона (внутри грыжи пищеводного отверстия диафрагмы), пептическая язвенная болезнь и сосудистые эктазии являются наиболее частыми поражениями верхних отделов желудочно-кишечного тракта, обнаруживаемыми при повторной эндоскопии, а рак и ангиодисплазия являются наиболее часто упускаемыми из виду аномалиями нижних отделов.1
Расстояние от тонкой кишки до рта и ануса затрудняет эндоскопию тонкой кишки. Процедура ограничивается перистальтикой кишечника и петляющим, свободно свисающим ходом тонкой кишки. Обычно энтероскопия охватывает только проксимальный отдел тонкой кишки, без подвздошной кишки. Хотя энтероскопия доступна не везде, она позволяет вмешаться, если обнаружено место кровотечения.
Исследования бария в тонкой кишке более доступны, чем энтероскопия. Однако последующие обследования тонкой кишки (SBFT) и энтероклиз могут не выявить поражения слизистой оболочки, такие как сосудистые эктазии, которые являются частой причиной кровотечений из тонкой кишки.SBFT — это простой тест, включающий прием контрастного красителя с последующей рентгенографической визуализацией. Энтероклич аналогичен, за исключением того, что барий вводится через трубку, которая проходит через нос в тонкий кишечник. Надувают баллон, чтобы предотвратить перемещение трубки, и быстро закапывают смесь метилцеллюлозы бария. Этот метод позволяет получить более непрерывное изображение тонкого кишечника. Хотя он менее приятен для пациента, он имеет более высокую диагностическую ценность и чувствительность, чем SBFT.8 «Бескамерный энтероклич» — это недавно появившаяся разновидность, позволяющая перорально принимать контрастный краситель, но она еще не получила широкого распространения.
Интраоперационная эндоскопия использовалась для исследования тонкой кишки, когда другие методы не позволяют обнаружить источник кровотечения, но сама операция сопряжена с повышенным риском и не всегда способствует диагностике. Хирургическое вмешательство может привести к появлению артефактов, которые могут быть ошибочно приняты за кровоточащие поражения. Интраоперационные методы определили источник скрытого кровотечения в 40 процентах недиагностированных случаев 9, но они исследуют только 50–80 процентов тонкой кишки.10
Просмотр / печать таблицы
ТАБЛИЦА 3Клинические признаки конкретных причин желудочно-кишечного кровотечения
| Клинические признаки | Вероятная причина кровотечения |
|---|---|
| 66 Возраст старше 50 | |
Хроническая почечная недостаточность | Сосудистая эктазия / ангиодисплазия |
Кожные гемангиомы | Синдром синего резинового пузыря невуса |
Синдром приобретенного иммунодефицита | Саркома Капоши, цитомегаловирусный колит |
Клинические признаки специфических причин желудочно-кишечного кровотечения
2Возраст старше 50 лет
Карцинома
Хроническая почечная недостаточность
Сосудистая эктазия / ангиодисплазия
4
Хроническая диарея / боль в животе
Целиакия
Синдром приобретенного иммунодефицита
Саркома Каптехноси , цитомегалов,
добавлены новые методы исследования микробовРИСУНОК 1.
Вид эктазии сосудов при капсульной эндоскопии.
РИСУНОК 2.
Вид язвы при капсульной эндоскопии.
Одно рандомизированное исследование показало, что при капсульной эндоскопии было обнаружено больше поражений, чем при стандартной энтероскопии.10 Капсульная эндоскопия может использоваться у пациентов, которые слишком слабы для проведения стандартной эндоскопии. Сообщалось об осложнениях после капсульной эндоскопии, таких как закупорка и стриктура тонкой кишки. 12 Капсульная эндоскопия — это диагностический инструмент, который не позволяет проводить вмешательство.Его клиническая ценность при визуализации толстой кишки еще не оценена.
Таблица 4 представляет собой сводку методов исследования, а алгоритм оценки желудочно-кишечного кровотечения представлен на рисунке 3.1.
ЯДЕРНАЯ МЕДИЦИНА СКАНИРОВАНИЕ И АНГИОГРАФИЯ
Радионуклеотидная визуализация с мечеными эритроцитами наиболее полезна при оценке активного желудочно-кишечного тракта. кровотечение. Это сканирование с большей вероятностью локализует источник кровотечения, когда скорость кровопотери превышает 0.От 1 до 0,4 мл в минуту (то есть, когда пациенту необходимо переливание более двух единиц крови в день) .2,3 Объединение крови в кишечнике может привести к ложной локализации, а сканирование эритроцитов высокий уровень ложноотрицательных результатов, поскольку во время тестирования часто пропускается периодическое кровотечение.
Прямая ангиография с большей вероятностью продемонстрирует точное место кровотечения, если скорость кровотечения превышает 0,5 мл в минуту, но этот метод более инвазивен, чем сканирование эритроцитов.2 Прямая ангиография может быть полезна для выявления некровоточащих поражений с типичным сосудистым паттерном, например ангиодисплазией или неоплазией. Интервенционные радиологи также могут назначить специфическую эмболизирующую терапию, если имеется поддающееся поражению поражение. Ни сканирование меченых эритроцитов, ни ангиография не подходят пациентам с неясным кровотечением, потому что кровопотеря часто слишком мала, чтобы ее можно было обнаружить.
Некоторые врачи назначают провокационные тесты с использованием антикоагулянтов, вазодилататоров или тромбоцитов, чтобы спровоцировать кровотечение и повысить вероятность обнаружения источника кровотечения.8 Поскольку эти тесты могут вызвать неконтролируемое кровотечение, они используются редко и обычно не рекомендуются. Хотя сканирование эритроцитов или ангиография могут быть полезны для определения места кровотечения, эти методы часто не позволяют определить конкретную причину кровотечения. Сканирование Меккеля может быть полезно для исключения дивертикула Меккеля у молодых пациентов с продолжающимся кровотечением из тонкой кишки неясной этиологии.
Просмотр / печать таблицы
ТАБЛИЦА 4Сравнение: желудочно-кишечные методы исследования оккультных и скрытых кровотечений
| Метод | Плюсы | Против |
|---|---|---|
| 9104 9104 Тонкий кишечник Минимальные побочные эффекты или риск | Пропуск поражений слизистой оболочки Неудобная трубка для энтероклиза | |
Сканирование эритроцитов с метками | Хорошо для быстрого кровотечения | Неспецифическое кровотечение, ложная локализация 95 и отсутствие неправильной локализации |
Сканирование Меккеля | Подходит для обнаружения дивертикула у молодых пациентов | Специально только для дивертикула Меккеля |
Ангиография | Быстрое кровотечение Хорошо при быстром кровотечении источник расположен | Инвазивный; риск инфаркта кишечника с эмболизацией Менее вероятно установить причину, чем эндоскопия Риск реакции на внутривенное контрастирование |
Толкающая энтероскопия | Прямая визуализация и вмешательство | Инвазивный, эндоскопический риск, дискомфорт пациента, тошноту пациента не входит и подвздошная кишка |
Капсульная эндоскопия | Позволяет обследовать большую часть тонкой кишки Неинвазивно | Нет возможности вмешательства Интерпретация врача требует времени |
Сравнение методов исследования желудочно-кишечного тракта: и неясное кровотечение
| Метод | Плюсы | Против | |
|---|---|---|---|
Последующее кровотечение в тонкой кишке / энтероклиз | Минимальные побочные эффекты или риск | Мистические поражения слизистой оболочки Клиническая трубка неудобна | |
Сканирование эритроцитов с метками | Хорошо для быстрого кровотечения | Неспецифическая, ложная локализация и пропущенное кровотечение Невозможно определить причину | |
68585 Меккель у молодых пациентов для обнаружения дивертикула | Специфично только для дивертикула Меккеля | ||
Ангиография | Подходит для быстрого кровотечения Может вмешиваться в быстрое кровотечение, если источник находится | Инвазивный; риск инфаркта кишечника с эмболизацией Менее вероятно установить причину, чем эндоскопия Риск реакции на внутривенное контрастирование | |
Толкающая энтероскопия | Прямая визуализация и вмешательство | Инвазивный, эндоскопический риск, дискомфорт пациента, тошноту пациента не входит и подвздошная кишка | |
Капсульная эндоскопия | Позволяет обследовать большую часть тонкой кишки Неинвазивно | Нет возможности вмешательства Интерпретация врача требует времени | |
Лечение и результат лечения этиология и тяжесть кровотечения и сопутствующие заболевания.Варианты лечения включают эндоскопическую, ангиографическую, медикаментозную и хирургическую терапию. Эндоскопическая терапия включает термоконтактные зонды, лазерную коагуляцию, инъекционную склеротерапию и бандаж. 8
Просмотр / печать Рисунок
Оценка скрытого кровотечения
РИСУНОК 3.
Оценка пациентов с желудочно-кишечным кровотечением источник кровотечения остается неясным после первичной эндоскопии.
Адаптировано с разрешения Медицинской позиции Американской гастроэнтерологической ассоциации: оценка и лечение скрытых и неясных желудочно-кишечных кровотечений.Гастроэнтерология 2000; 118: 201.
Оценка скрытого кровотечения
РИСУНОК 3.
Оценка пациентов с желудочно-кишечным кровотечением, когда источник кровотечения остается неясным после первоначальной эндоскопии.
Адаптировано с разрешения Медицинской позиции Американской гастроэнтерологической ассоциации: оценка и лечение скрытых и неясных желудочно-кишечных кровотечений. Гастроэнтерология 2000; 118: 201.
Термическая абляция кровотечения — это лечение, наиболее часто используемое при доступных поражениях.Однако этот метод сопряжен с некоторыми рисками. Во время ангиографии интервенционные радиологи вводят вазопрессин или эмболизирующий материал в кровоточащие сосуды. Осложнения от инъекции вазопрессина включают инфаркт миокарда, аритмию, гипертензию и непреднамеренный тромбоз артерий, отличных от целевого поражения.2 Медикаментозные методы лечения являются одним из немногих вариантов, доступных для диффузных сосудистых поражений, но они имеют ограниченные показатели успеха.13
Желудочно-кишечный тракт кровотечение из пороков развития артериальных вен традиционно лечится комбинированной терапией эстрогенами и прогестероном.Однако непрерывное употребление гормонов в течение нескольких месяцев имеет серьезные побочные эффекты, такие как гинекомастия, потеря либидо и феминизация у мужчин, а также вагинальное кровотечение и болезненность груди у женщин. Гормональная терапия теоретически увеличивает риск тромбоэмболических осложнений, хотя обсервационные исследования не подтвердили повышение риска.14 Считается, что гормональная терапия приносит пользу некоторым пациентам с наследственными телеангиэктазиями, болезнью фон Виллебранда или ангиодисплазиями при терминальной стадии почечной недостаточности.Октреотид (сандостатин), вводимый в дозировке от 0,05 до 0,1 мг подкожно два-три раза в день, оказался успешным в тематических исследованиях.
Если не выявлено единственное причинное поражение, хирургическое лечение должно быть крайней мерой. У пациентов с неясным кровотечением часто бывает несколько участков кровотечения, и кровотечение может сохраняться после операции. Могут быть показаны поддерживающие меры, включая замену железа, переливание крови и коррекцию нарушений свертывания крови или тромбоцитов.
Тесты стула — Здоровье детей Orange County
Что такое анализ стула?
Анализ кала также может называться «образец стула», «посев кала» или «образец кала».«Этот тип теста исследует фекалии на предмет наличия какого-либо заболевания. Тест может искать признаки инфекции, аллергии, проблем с кровью или пищеварением.
Некоторые анализы кала не являются культурами. Другие анализы стула проводятся для выявления признаков воспаления, кровотечения или плохого усвоения пищи в кишечнике. Существует множество различных тестов, которые ищут множество различных состояний, которые могут помочь объяснить болезнь вашего ребенка. Чтобы узнать, что означают результаты, важно поговорить с врачом вашего ребенка.
Что такое посев стула?
Посев кала может искать бактерии, вирусы и другие организмы в стуле пациента. Этот тест может помочь выяснить, что вызывает инфекцию пищеварительного тракта. В CHOC проводится много видов анализов стула на наличие инфекции. Врач вашего ребенка определит, какой тип обследования нужен вашему ребенку, исходя из его или ее симптомов.
Для этого теста образец стула помещается в специальный контейнер с питательными веществами, необходимыми для роста бактерий или других организмов.Лаборатория ждет, пока не появится достаточное количество организмов, чтобы их можно было увидеть под микроскопом. Как только врач узнает тип организма, вызывающего инфекцию, он может диагностировать и лечить болезнь.
Какова цель посева кала?
Врач вашего ребенка может попросить вашего ребенка сдать образец стула в лабораторию, если он или она считает, что у вашего ребенка инфекция пищеварительного тракта. Симптомы могут включать:
- Высокая температура
- Стул, содержащий кровь или слизь
- Сильная боль в животе или спазмы
- Сильная диарея
- Тошнота
- Диарея, продолжающаяся более нескольких дней.
Эти симптомы часто вызваны пищевым отравлением, которое вызвано употреблением пищи или питьевой воды, зараженной бактериями, паразитами, вирусами или другими организмами.
Также можно запросить анализ стула, если у вашего ребенка:
- Проблемы с иммунитетом или высокое количество лейкоцитов. Высокое количество лейкоцитов — признак того, что организм вашего ребенка пытается бороться с инфекцией.
- Путешествовал в регион, где нет чистой воды и есть симптомы паразитарной инфекции.Также может потребоваться анализ стула, если у вашего ребенка диарея, которая не проходит после лечения.
- Принимает антибиотики широкого спектра действия и подвергается риску заражения опасным штаммом бактерий, например Clostridium difficile.
Что означают результаты теста?
Многие вещи могут повлиять на результаты лабораторных тестов вашего ребенка, и даже результаты, которые отличаются от нормального значения, могут не означать, что существует проблема. Чтобы узнать, что означают результаты, важно поговорить с врачом вашего ребенка.
- Нормальные результаты отрицательны, это означает, что в культуре стула не было обнаружено микробов, которые обычно вызывают заболевание, и что у вашего ребенка нет инфекции.
- Положительные результаты означают, что в культуре стула вашего ребенка были обнаружены бактерии, паразиты или другие микробы и что они могут вызывать проблемы с желудком у вашего ребенка.
- Иногда тест показывает ложноотрицательный результат, что означает, что в тесте пропущены определенные инфекционные бактерии. Если у вашего ребенка все еще есть симптомы инфекции, врач может назначить другие анализы, чтобы выяснить причину проблем с желудком.
Как проводится этот тест?
Для этого теста требуется образец стула. Врач вашего ребенка объяснит вам, как собрать образец в одноразовый контейнер для образцов с крышкой. Стул нельзя собирать из унитаза или класть туалетную бумагу в контейнер для образцов. При взятии пробы важно надевать резиновые или латексные перчатки и после этого тщательно мыть руки. Лаборатория может дать вам инструкции о том, как собирать и сдавать образцы.
Представляет ли этот тест какие-либо риски?
Этот тест не представляет известных рисков.
Что может повлиять на результаты тестов моего ребенка?
На некоторые тесты могут влиять лекарства, которые принимает ребенок, или пища, которую он может съесть.
