Хирургическая диагностика диффузных поражений легких и внутригрудных лимфаденопатий. Состояние вопроса | Мотус И.Я., Баженов А.В., Раевская Н.В., Цвиренко А.С., Басыров Р.Т.
В статье приводится состояние вопроса хирургической диагностики диффузных поражений легких и внутригрудных лимфаденопатий
Введение
Диффузные поражения легких (ДПЛ) и внутригрудные лимфаденопатии (ЛАП) – обширная группа самых различных по этиологии болезней, диагностика которых является комплексным процессом, включающим клинические, лучевые, лабораторные исследования. Диагностические технологии в последние годы развиваются чрезвычайно динамично, но в то же время результат биопсии остается если не основой диагноза, то, во всяком, случае важнейшим фактором в его построении.
В настоящей работе мы попытались осмыслить результаты биопсийных исследований в этом направлении, сделать некоторые выводы и наметить перспективы дальнейшей работы.
Материал и методы
В исследование включены 558 пациентов с синдромом ДПЛ/ЛАП, направленных в клиники Уральского НИИ фтизиопульмонологии с целью морфологической верификации патологического процесса и установления диагноза. Схема обследования была следующей. После общеклинического обследования выполнялась компьютерная томография (КТ), задачей которой было уточнить локализацию поражения (легкие/лимфатические узлы/средостение) и наметить путь биопсийной диагностики по принципу «от простого к сложному».
Схема обследования была следующей. После общеклинического обследования выполнялась компьютерная томография (КТ), задачей которой было уточнить локализацию поражения (легкие/лимфатические узлы/средостение) и наметить путь биопсийной диагностики по принципу «от простого к сложному».
Отсутствие в биоптате информативного материала являлось показанием к применению хирургических методов диагностики. Выбор конкретного метода хирургической диагностики осуществляли на основании синдромного принципа.
1. При увеличении лимфатических узлов центрального средостения и отсутствии признаков ДПЛ – медиастиноскопию по Карленсу.
2. При увеличении лимфатических узлов центрального средостения и наличии признаков ДПЛ – парастернальную медиастиноплевроскопию (ПМС), либо видеоторакоскопию (ВТС).
3. При увеличении лимфатических узлов переднего средостения – ПМС.
4. При наличии симптомов ДПЛ без признаков ЛАП – ВТС или открытую биопсию легкого (ОБЛ).
Не будем вдаваться в детали хирургической техники вышеперечисленных вмешательств, поскольку это описано в соответствующих руководствах [1, 2].

Медиастиноскопия по Карленсу – наиболее простой и надежный способ хирургической диагностики поражений лимфатических узлов центрального средостения. При ЛАП центрального средостения, большинство которых представлено саркоидозом, лимфоузлы увеличены до 1,5–2,0 см и отчетливо пальпируются уже при формировании канала в средостение. Биопсия трудностей не представляет.
Что предпочесть при увеличении лимфатических узлов центрального средостения и наличии признаков ДПЛ? При ПМС доступны биопсии передние и верхние бронхопульмональные, а также трахеобронхиальные лимфатические узлы, но зона биопсии легкого ограничена медиальными сегментами. Следовательно, этот метод удобен, когда легкое поражено на всем протяжении. В тех же случаях, где ДПЛ имеет «гнездный» характер, предпочтительна ВТС, при которой зона доступности распространяется практически на всю плевральную полость.
При лимфопролиферативных опухолевых процессах поражение практически всегда начинается с передних медиастинальных лимфатических узлов. Если опухоль прилегает к грудной стенке, методом выбора является пункционная биопсия под УЗ-контролем. В остальных случаях пункции выполняют под контролем КТ. Внедрение данного метода биопсии позволяет в большинстве случаев избежать хирургических методов диагностики. Это особенно важно при таком осложнении данных заболеваний, как синдром медиастинальной компрессии. Пункция здесь практически безопасна, в то время как хирургические методы диагностики неизбежно усугубляют компрессию и могут привести к тяжелым осложнениям. Критерии, по которым мы считаем применение хирургических методов диагностики недопустимым, включают выраженный синдром верхней полой вены и сдавление трахеи и/или главных бронхов более чем на 1/3.
 ).
).Результаты
ТББЛ выполнена у 378 пациентов. Информативность ее при ДПЛ представлена в таблице 1.
В таблице 2 представлены результаты хирургических методов диагностики при синдроме ДПЛ/ЛАП. Всего выполнено 117 операций (медиастиноскопии по Карленсу – 33, ПМС – 39, ВТС – 34, ОБЛ – 11).
В таблице 3 приведены результаты биопсийной диагностики заболеваний, поражающих лимфатические узлы переднего средостения. Информативный материал, обеспечивающий постановку морфологического диагноза, был получен во всех случаях.
Осложнения отмечены в 17 (3,0%) случаях среди всех пациентов, включенных в исследование. Травматический пневмоторакс случился у 11 (2,9%) пациентов после ТББЛ и у 3-х (2,6%) – после хирургических методов диагностики. Во всех случаях пневмоторакс был ликвидирован путем консервативных мероприятий (покой, наблюдение, пункция). В 3-х случаях после ПМС при медиастинальных лимфомах, осложненных синдромом медиастинальной компрессии, имело место нарастание компрессии с угрожающими расстройствами дыхания и невозможностью экстубации.
Обсуждение
Говоря о данной проблеме, следует начать с того, что постановка диагноза при ДПЛ – это комплексный процесс, в котором наряду с результатом морфологического исследования должны учитываться и другие характеристики, а именно: клинические, лучевые, иммунологические, функциональные. Соответственно в диагностическом процессе необходимо участие специалистов по всем перечисленным разделам диагностики. Это положение относится в первую очередь к группе идиопатических интерстициальных пневмоний (ИИП), где отсутствуют четкие морфологические признаки каждого варианта заболевания, а стремление к получению биоптата большего объема либо к повторным биопсиям не всегда оправдано у этой достаточно тяжелой группы больных. Кроме того, показано, что изменения в паренхиме легких при ИИП имеют неоднородный характер, и у одного и того же пациента могут быть разные варианты ИИП [3].
Поскольку в данной статье идет речь об оперативных вмешательствах, носящих сугубо диагностический характер, то обсуждаться должна только одна позиция, а именно: соотношение «польза/риск» для каждого конкретного пациента. В этой связи актуален вопрос об адекватности минимально инвазивных и, следовательно, наименее травматичных методов биопсии, таких как трансбронхиальные и трансторакальные игловые биопсии и ТББЛ. Но данные методы биопсии приносят, как известно, наименьший объем биоптата. Как видно из таблицы 1, самая высокая информативность (90,2%) ТББЛ имела место при карциноматозе легких.

Какой же способ биопсии предпочесть?
ТББЛ, по нашим данным, обеспечивает материал, достаточный для постановки диагноза в 60,9% случаев, другие авторы приводят более высокую результативность за счет сочетания ТББЛ и бронхоальвеолярного лаважа – 82,9% [10].
 Следовательно, около трети пациентов с клинико-рентгенологическим диагнозом «саркоидоз» будут нуждаться в хирургических методах диагностики. В случаях ЛАП без поражения легочной ткани достаточно выполнения медиастиноскопии по Карленсу.
Следовательно, около трети пациентов с клинико-рентгенологическим диагнозом «саркоидоз» будут нуждаться в хирургических методах диагностики. В случаях ЛАП без поражения легочной ткани достаточно выполнения медиастиноскопии по Карленсу. Всегда ли нужна биопсия легкого?
Этот вопрос решается индивидуально. Для уточнения стадии заболевания это целесообразно, особенно, если клинико-рентгенологическая картина отличается от типичной. С другой стороны, современные методы лучевой диагностики, в частности КТ высокого разрешения, выявляют поражения паренхимы легких с высокой точностью и на ранних стадиях. Следовательно, в случаях, когда хирургическая биопсия легкого по каким-либо причинам представляет риск, ее можно избежать.
При синдроме ДПЛ могут применяться два варианта диагностической операции: видеоторакоскопия и открытая биопсия легкого через торакотомный доступ. В работе Miller et al. [11] путем сравнения рандомизированных групп больных не выявлено каких-либо преимуществ того или иного из вышеупомянутых способов.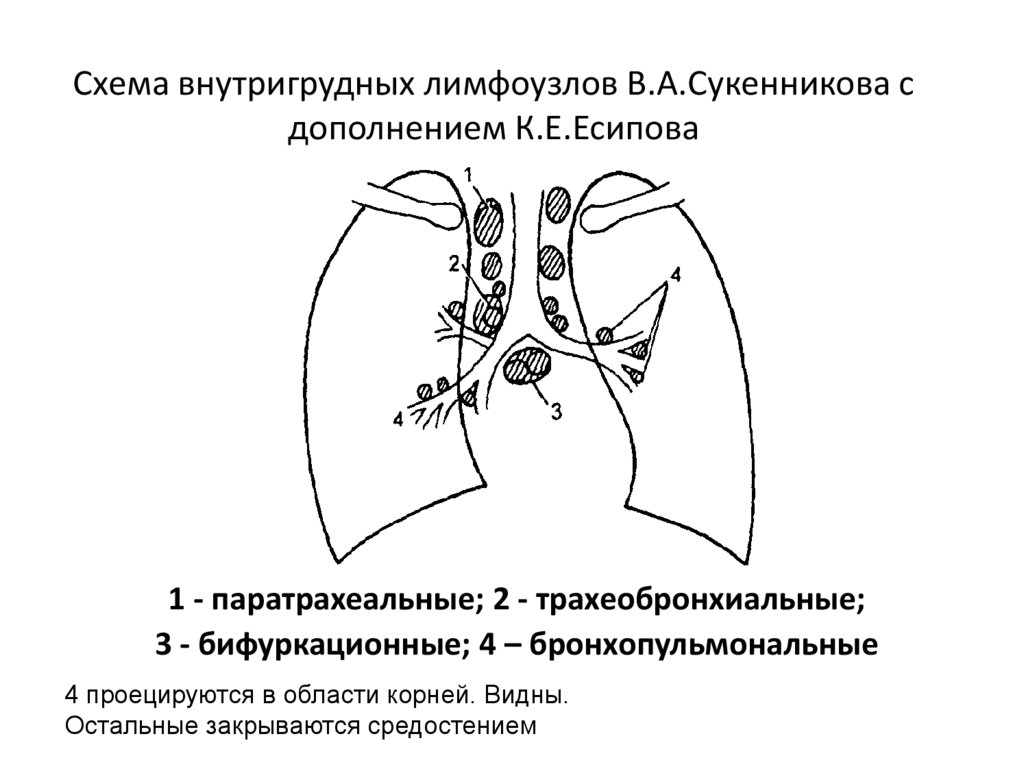 Технический прогресс и накапливающийся опыт хирургов скорее всего решат этот вопрос в пользу ВТС.
Технический прогресс и накапливающийся опыт хирургов скорее всего решат этот вопрос в пользу ВТС.
Хирургическая эндоскопическая диагностика при медиастинальных лимфомах технических сложностей не представляет, за исключением случаев медиастинальной компрессии, когда мы наблюдали осложнения, описанные выше. Внедрение пункционных биопсий под контролем УЗ и КТ с иглами, позволяющими получать «столбик» ткани, практически вытеснило медиастиноскопию и существенно упростило диагностический процесс не в ущерб качеству диагностики. Данный факт также наглядно демонстрирует преимущества минимально инвазивных методик среди диагностических вмешательств.
Диагностические вмешательства, ведущие к излечению опосредованно, через установление правильного диагноза, безусловно, должны сопровождаться минимальным риском для пациента. Между тем сообщают о 4,4% летальности после ВТС-биопсий легкого у больных с ИИП [7]. Единственный способ избежать подобных неприятностей – тщательный выбор метода биопсии и правильная оценка риска предстоящей операции.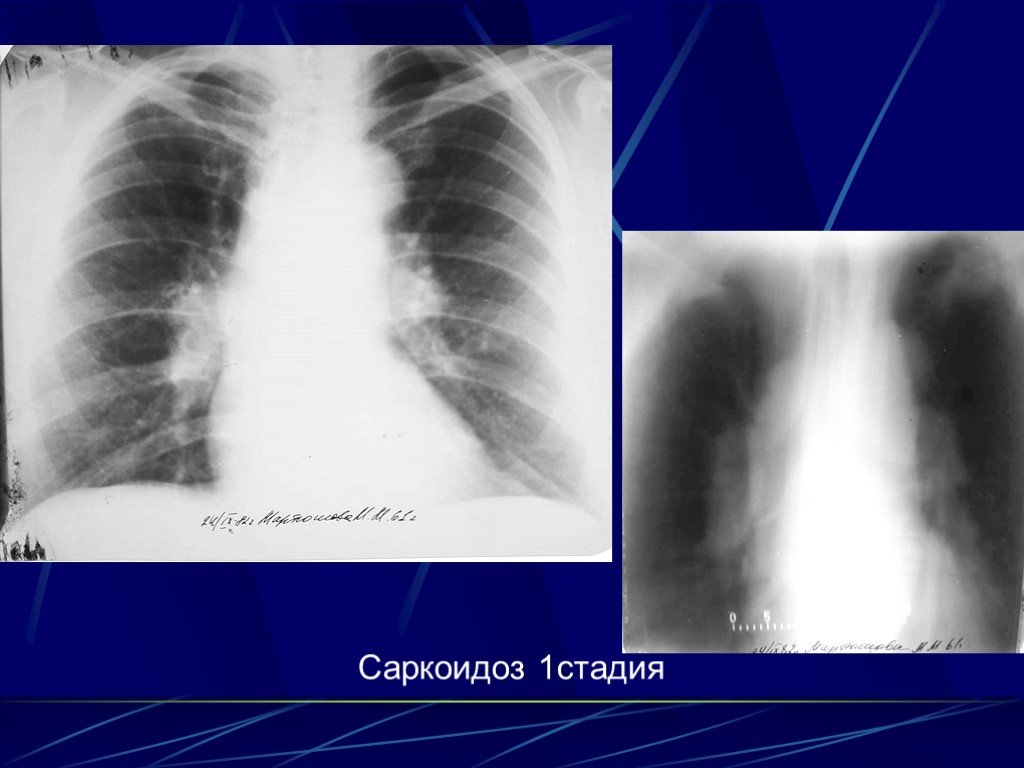
Выводы
1. Стратегия биопсийной диагностики при внутригрудных ЛАП и синдроме ДПЛ заключается в принципе «от простого к сложному», начиная с бронхологических и пункционных методов и заканчивая хирургическими методами диагностики. Показания к хирургическим методам возникают тогда, когда комплексная оценка данных обследования больного с ДПЛ, в т. ч. заключение морфолога по биоптату, не приводит к диагнозу.
2. Диагноз саркоидоза и ИИП должен ставиться с учетом всех характеристик болезни: клинических, лучевых, лабораторных и морфологических.
3. Прогресс в биопсийной диагностике при синдромах ЛАП/ДПЛ должен идти по пути развития и совершенствования минимально инвазивных технологий, что повышает безопасность диагностических вмешательств не в ущерб их информативности.
Атипичные проявления саркоидоза органов дыхания: клинические наблюдения
Головна > Статьи > Атипичные проявления саркоидоза органов дыхания: клинические наблюдения
Авторы: В. К. Гаврисюк, д.м.н., профессор, Г.Л. Гуменюк, к.м.н., Е.А. Меренкова, к.м.н., О.В. Страфун, к.м.н., Н.С. Шкуренко, О.В. Быченко, ГУ «Национальный институт фтизиатрии и пульмонологии им. Ф.Г. Яновского НАМН Украины», г. Киев
К. Гаврисюк, д.м.н., профессор, Г.Л. Гуменюк, к.м.н., Е.А. Меренкова, к.м.н., О.В. Страфун, к.м.н., Н.С. Шкуренко, О.В. Быченко, ГУ «Национальный институт фтизиатрии и пульмонологии им. Ф.Г. Яновского НАМН Украины», г. Киев
15.12.2015
Атипичные изменения внутригрудных лимфатических узлов и паренхимы легких при компьютерной томографии (КТ) больных саркоидозом органов дыхания в большинстве случаев сочетаются с классическими высокоспецифичными симптомами, в связи с чем не создают особых трудностей для диагностики. Однако примерно в 2% случаев атипичные КТ-симптомы являются единственными проявлениями заболевания, что обусловливает необходимость применения дополнительных методов диагностики.
Частота бессимптомного течения саркоидоза органов дыхания составляет в среднем от 30% (II-III стадии) до 80% (I стадия) случаев. При этом клинические проявления саркоидоза (сухой кашель, одышка, общая слабость, повышение температуры тела) являются неспецифичными, в связи с чем их присутствие не позволяет не только диагностировать, но даже заподозрить наличие саркоидоза.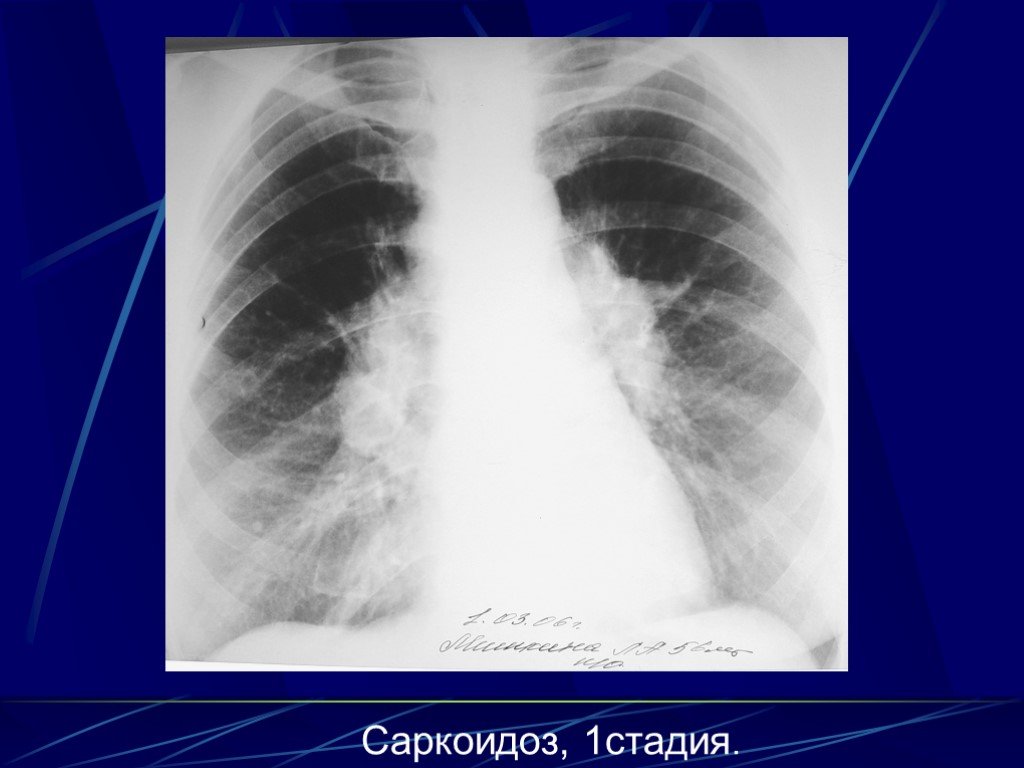
По этой причине международное положение Statement on Sarcoidosis, опубликованное в 1999 году [1], предусматривало обязательную верификацию диагноза с помощью патогистологических методов исследования. Однако за 16 лет, прошедших от момента опубликования Положения, диагностические возможности КТ органов грудной полости возросли настолько, что, по результату морфологической диагностики интерстициальных заболеваний легких, КТ в настоящее время успешно конкурирует с методами патогистологического исследования. В связи с этим в Унифицированном клиническом протоколе «Саркоидоз» (приказ МЗ Украины от 08.09.2014 № 634) [2] показания к проведению биопсии легкого с целью верификации диагноза значительно сужены – биопсия показана только при наличии весомых оснований для исключения лимфаденопатии или легочной диссеминации другого происхождения.
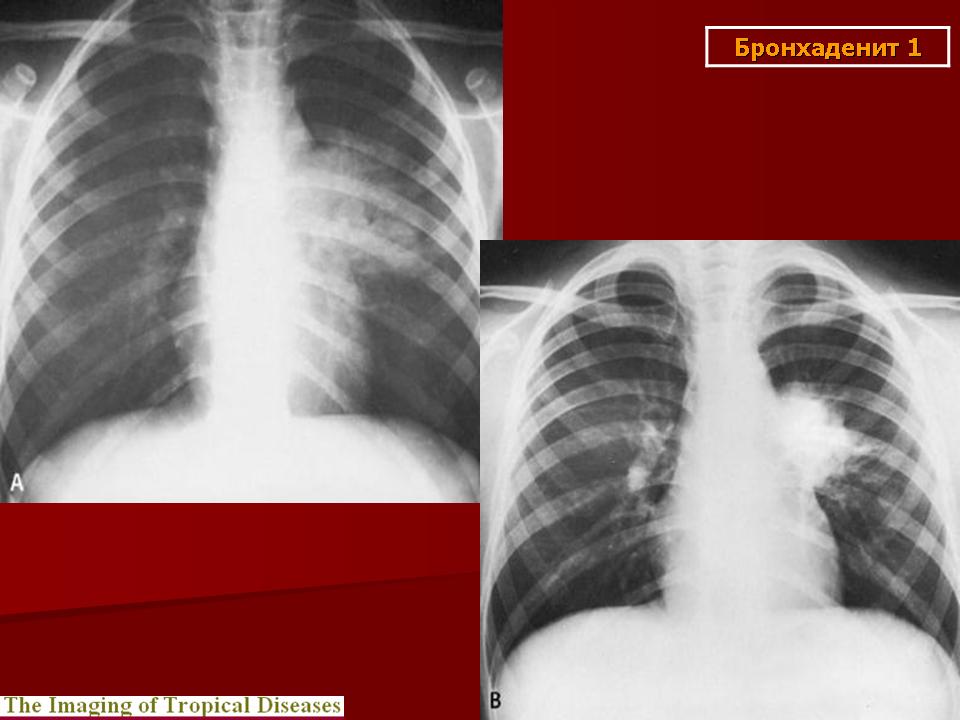
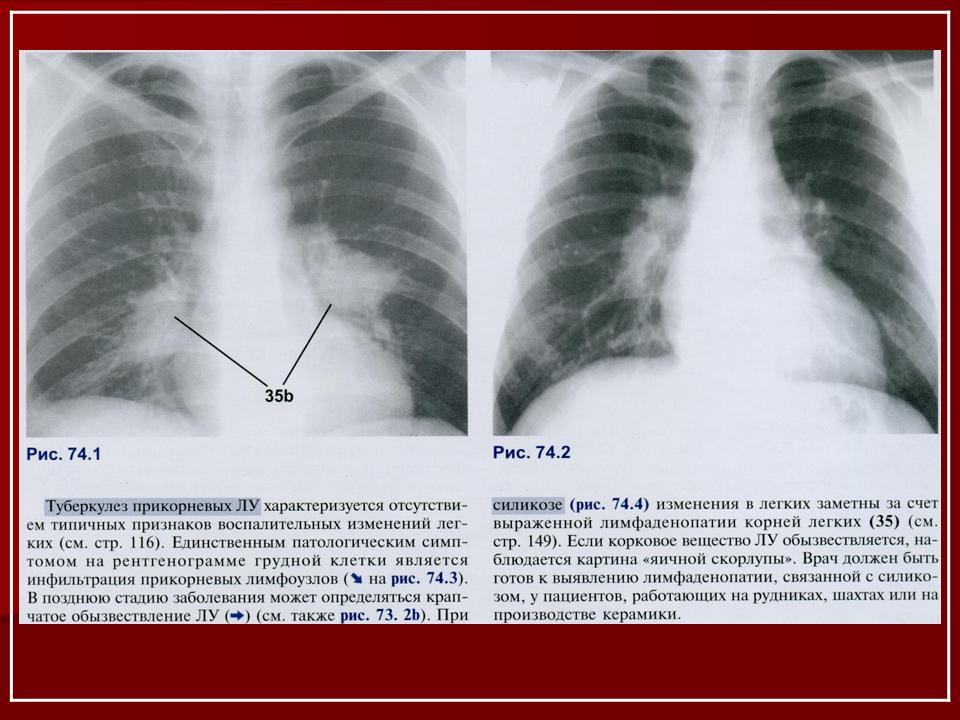
Необходимо отметить, что даже качественно выполненная рентгенография органов грудной полости позволяет уверенно диагностировать саркоидоз примерно в 80% случаев – именно с такой частотой у больных саркоидозом органов дыхания встречается двусторонняя прикорневая лимфаденопатия (ДПЛ) [1, 3]. Если учесть, что симметричная ДПЛ у больных с лимфомами наблюдается только в 3,8% случаев, при бронхогенной карциноме – в 0,8%, при злокачественных опухолях экстраторакальной локализации – в 0,2% [4], а дифференциальная диагностика с бронхоаденитом туберкулезной этиологии не представляет особых трудностей, то можно заключить, что рентгенологический симптомокомплекс ДПЛ является в высшей степени специфичным для саркоидоза.
Если учесть, что симметричная ДПЛ у больных с лимфомами наблюдается только в 3,8% случаев, при бронхогенной карциноме – в 0,8%, при злокачественных опухолях экстраторакальной локализации – в 0,2% [4], а дифференциальная диагностика с бронхоаденитом туберкулезной этиологии не представляет особых трудностей, то можно заключить, что рентгенологический симптомокомплекс ДПЛ является в высшей степени специфичным для саркоидоза.
Вместе с тем возможности рентгенографии в диагностике саркоидозного поражения паренхимы легких весьма ограниченны, в связи с чем все больные с подозрением на саркоидоз органов дыхания должны быть обследованы методом КТ высокого разрешения.
В таблице представлены современные критерии КТ-диагностики саркоидоза органов дыхания [5], которые подразделяются на классические и атипичные.
К классическим относятся симптомы, характерные для саркоидоза и редко наблюдаемые при других заболеваниях. Например, симптомокомплекс ДПЛ наблюдается у 80% больных саркоидозом и только у 4% пациентов с лимфомами.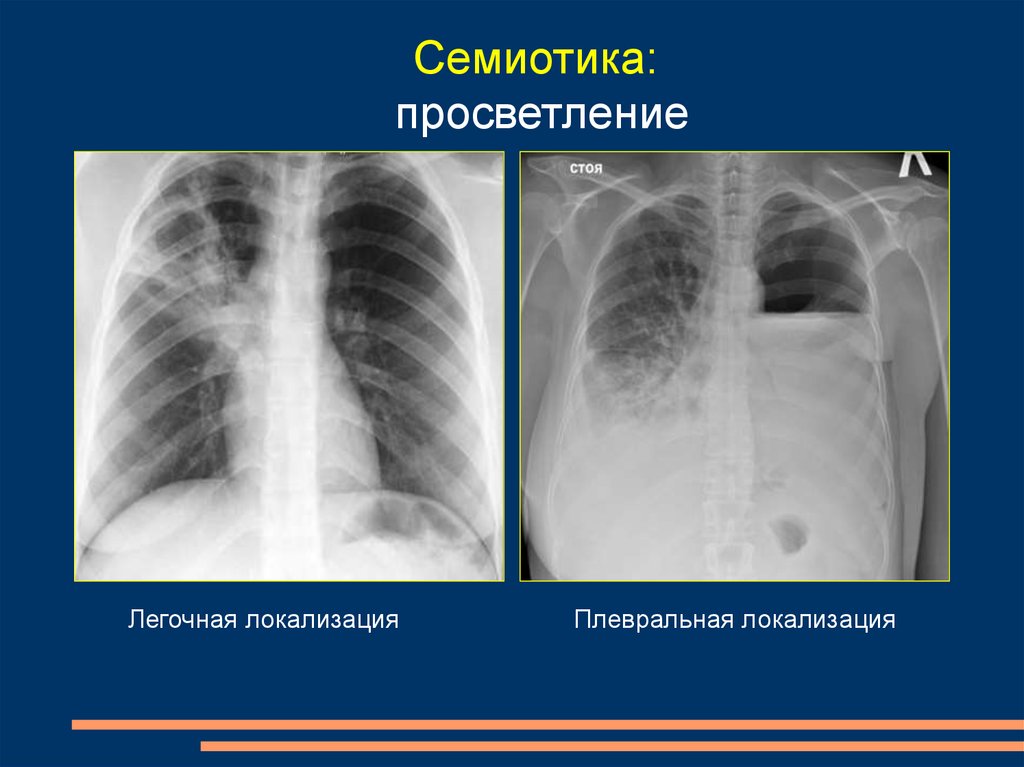 И наоборот, атипичные изменения чаще характерны для других заболеваний органов грудной полости и редко встречаются при саркоидозе.
И наоборот, атипичные изменения чаще характерны для других заболеваний органов грудной полости и редко встречаются при саркоидозе.
Например, лимфаденопатия передних медиастинальных узлов характерна для лимфогранулематоза и редко встречается при саркоидозе.
Атипичные КТ-признаки в большинстве случаев сочетаются с классическими высокоспецифичными симптомами. Однако в редких случаях атипичные КТ-симптомы являются единственными проявлениями заболевания, что обусловливает значительные трудности в диагностике саркоидоза.
Клинический случай 1
Пациентка М., 1963 года рождения, направлена в Национальный институт фтизиатрии и пульмонологии (НИФП) им. Ф.Г. Яновского для уточнения диагноза.
Жалобы на умеренно выраженный сухой кашель, субфебрильную температуру тела, умеренную общую слабость и повышенную утомляемость.
Считает себя больной на протяжении трех месяцев. Начало заболевания малозаметное – появился незначительный сухой кашель, затем стала беспокоить общая слабость, повышенная утомляемость, через некоторое время появилась субфебрильная температура. Безуспешно самостоятельно лечилась антибиотиками и муколитическими средствами.
Безуспешно самостоятельно лечилась антибиотиками и муколитическими средствами.
При рентгенографии была выявлена правосторонняя прикорневая лимфаденопатия, для уточнения диагноза больная была направлена в НИФП.
Хронических заболеваний органов дыхания в анамнезе нет. Не курит, работа с неблагоприятными производственными факторами не связана.
Кожа и периферические лимфатические узлы без изменений. Аускультативно: дыхание везикулярное, хрипов нет. Тоны сердца ритмичные, звучные. ЧСС – 84 уд/мин. АД – 130/80 мм рт. ст. Тоны сердца ритмичные, звучные. Живот мягкий, при пальпации безболезненный. Периферические отеки не определяются. Другие органы и системы – без видимой патологии.
Клинический анализ крови: Hb – 122 г/л, эритроциты – 4,1×1012/л, лейкоциты – 11,4×109/л, СОЭ – 61 мм/ч.
Уровень ионизированного кальция в крови: 1,37 ммоль/л – гиперкальциемия (норма до 1,32 ммоль/л).
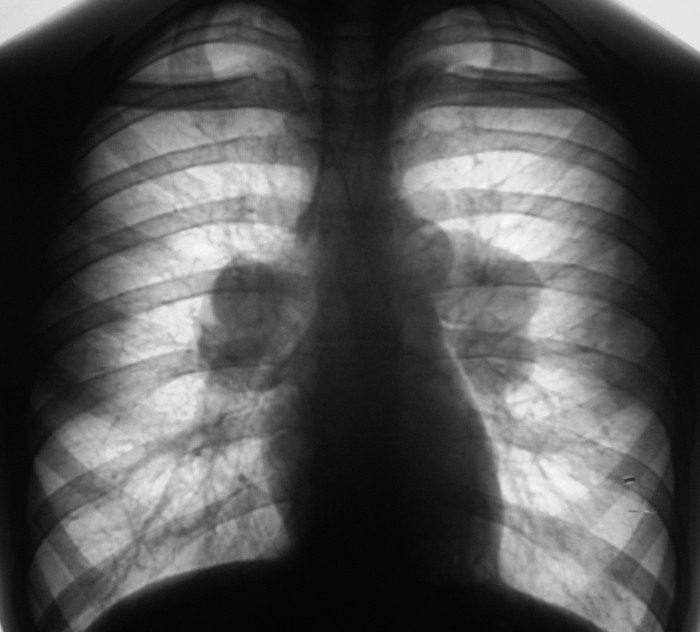
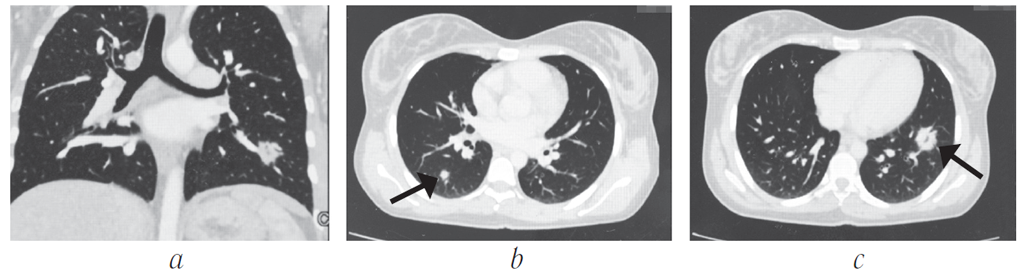
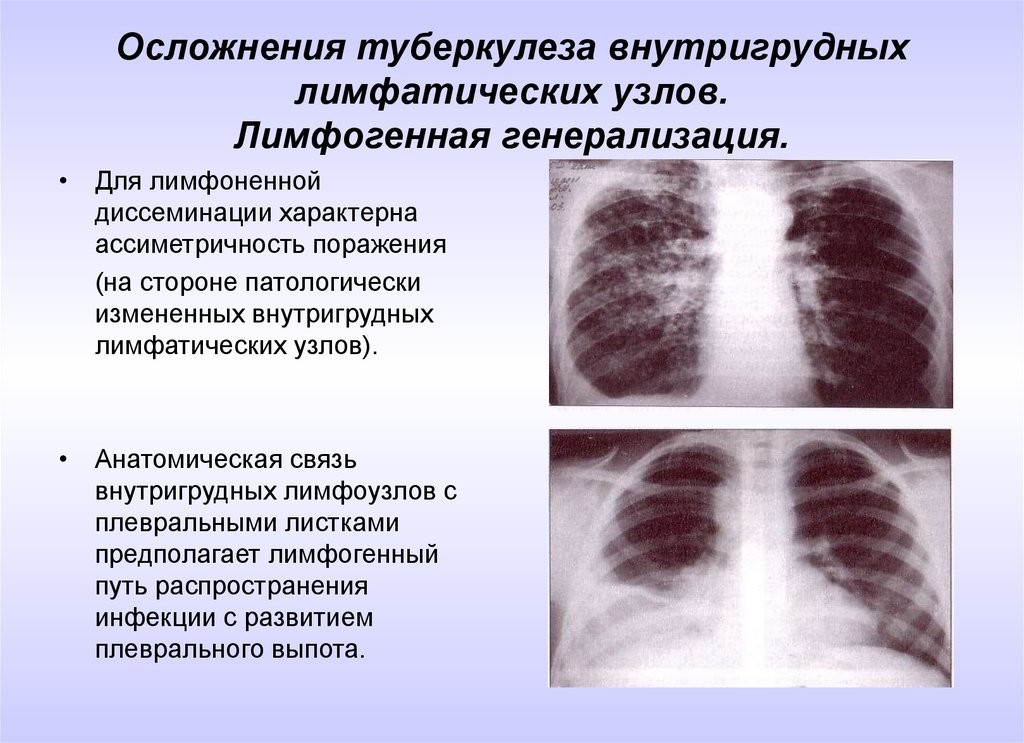
Многосрезовая КТ (МСКТ) органов грудной полости: правосторонняя прикорневая лимфаденопатия (рис. 1 слева) в сочетании с увеличением бифуркационных и нижних паратрахеальных узлов справа; мелкоузелковая диссеминация преимущественно в средних и верхних легочных полях.
1 слева) в сочетании с увеличением бифуркационных и нижних паратрахеальных узлов справа; мелкоузелковая диссеминация преимущественно в средних и верхних легочных полях.
Рис. 1. МСКТ больной М., слева – до лечения: правосторонняя прикорневая лимфаденопатия, мелкоузелковая диссеминация легких; справа – после трехмесячной терапии метилпреднизолоном: регрессия лимфаденопатии, сохраняется необильная мелкоузелковая диссеминация.
Показатели легочной вентиляции в норме, снижение диффузионной способности легких (DLCO) – 66,6% от должного.
Учитывая то, что атипичное проявление саркоидоза (односторонняя прикорневая лимфаденопатия) сочеталось с гиперкальциемией и классическими КТ-изменениями (увеличение бифуркационных и нижних паратрахеальных узлов справа, микроузелковый паттерн легочной диссеминации), больной без применения дополнительных методов исследования был установлен диагноз: саркоидоз органов дыхания, впервые выявленный, II стадия. Назначена терапия метилпреднизолоном в дозе 0,4 мг/кг массы тела в течение 8 недель с последующим снижением дозы до 0,2 мг/кг к концу третьего месяца.
На втором визите через 3 мес лечения: субъективные проявления заболевания исчезли; СОЭ – 18 мм/ч; уровень кальция в крови – 1,28 ммоль/л; DLCO – 74,5% от должного.
МСКТ: отмечается регрессия прикорневой лимфаденопатии (рис. 1 справа), уменьшение бифуркационных и нижних паратрахеальных узлов справа, сохраняется необильная мелкоузелковая диссеминация.
Диагноз: саркоидоз органов дыхания, II стадия, фаза регрессии.
Пациентке рекомендовано продолжение лечения метилпреднизолоном в режиме постепенного снижения дозы до 0,1 мг/кг к третьему визиту (конец 6-го месяца).
Клинический случай 2
Пациент П., 1993 года рождения, направлен в НИФП для уточнения диагноза после проведения профилактического рентгенологического исследования, на котором были выявлены патологические изменения легких и внутригрудных лимфатических узлов.
Жалоб нет. В анамнезе острые респираторные вирусные инфекции, хронических заболеваний внутренних органов не отмечает. Не курит, в контакте с неблагоприятными производственными факторами не работал.
При объективном обследовании: кожа обычной окраски, без высыпаний, периферические лимфатические узлы не увеличены. Аускультативно: дыхание везикулярное, хрипов нет. ЧСС – 64 уд/мин, АД – 110/70 мм рт. ст. Тоны сердца ритмичные, звучные. Другие органы и системы без видимой патологии.
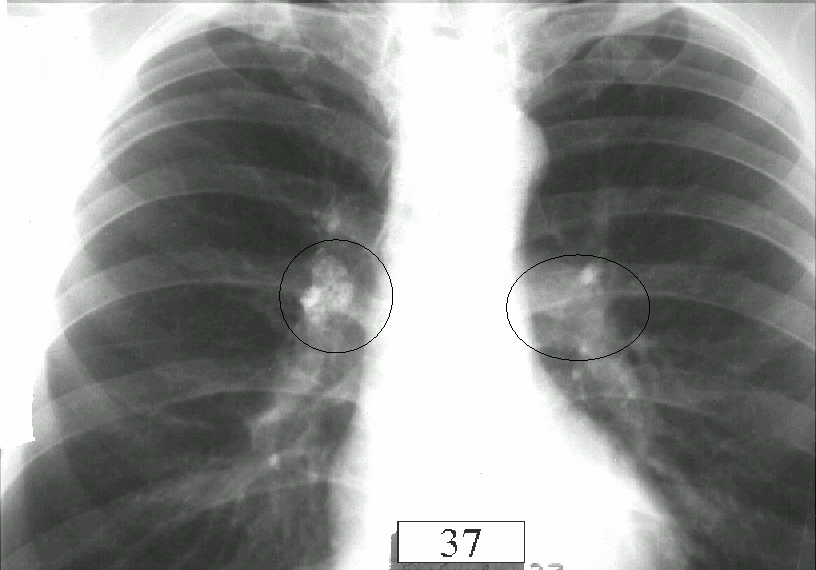
Рис. 2. МСКТ больного П. (мягкотканный режим), слева – первичное обследование: значительное увеличение передних медиастинальных лимфатических узлов, расположенных преимущественно вокруг восходящего отдела аорты; справа – после трехмесячного периода наблюдения: регрессия лимфаденопатии.
МСКТ: значительное увеличение передних медиастинальных (рис. 2, слева) и бронхопульмональных (рис. 3, слева) лимфатических узлов. Билатерально в легких определяется мелкоузелковая диссеминация преимущественно в верхних и средних отделах с распределением узелков вдоль бронхо-сосудистых пучков.
Рис. 3. МСКТ больного П., слева – первичное обследование: мелкоузелковая диссеминация паренхимы легких, увеличение прикорневых лимфатических узлов; справа – после трехмесячного периода наблюдения: регрессия лимфаденопатии, сохраняется мелкоузелковая диссеминация.
Рис. 4. МСКТ больного К., слева – первичное обследование: диффузное снижение прозрачности паренхимы легких по типу «матового стекла», плотность паренхимы: –609 HU; увеличение прикорневых лимфатических узлов; справа – через 12 мес лечения: повышение прозрачности паренхимы, плотность паренхимы: –683 HU; регрессия лимфаденопатии.
Рис. 5. МСКТ больного К. (фрагмент среза правого легкого в режиме увеличения), слева – первичное обследование: интенсивное диффузное снижение прозрачности паренхимы легких по типу «матового стекла»; справа – через 12 мес лечения: повышение прозрачности паренхимы, на срезе более отчетливо дифференцируется легочный рисунок.
При бодиплетизмографии отмечено незначительное уменьшение общей емкости и остаточного объема легких, показатели кривой форсированного выдоха в пределах нормы. DLCO – 72,7%.
Содержание кальция в крови – 1,31 ммоль/л.
В данном случае атипичное проявление (увеличение передних медиастинальных лимфатических узлов) также сочеталось с высокоспецифичными КТ-признаками саркоидоза (ДПЛ, микроузелковый паттерн диссеминации с распределением узелков вдоль бронхо-сосудистых пучков). Кроме того, отсутствовали клинические проявления лимфопролиферативного заболевания. В связи с этим больному без проведения дополнительных методов исследования был установлен диагноз: саркоидоз органов дыхания, впервые выявленный, II стадия.
Кроме того, отсутствовали клинические проявления лимфопролиферативного заболевания. В связи с этим больному без проведения дополнительных методов исследования был установлен диагноз: саркоидоз органов дыхания, впервые выявленный, II стадия.
Учитывая отсутствие клинических проявлений, изменений функции дыхания, нормальный уровень кальция в крови, лечение не назначалось, больному было рекомендовано контрольное обследование через 3 месяца.
При повторном обследовании на МСКТ органов грудной полости констатирована регрессия медиастинальной (рис. 2 справа) и прикорневой (рис. 3 справа) лимфаденопатии, при этом сохранялась мелкоузелковая диссеминация паренхимы. В соответствии с клиническим протоколом противовоспалительная терапия не назначалась, больному было рекомендовано очередное обследование через 3 месяца.
Клинический случай 3
Пациент К., 1977 года рождения, поступил в отделение интерстициальных заболеваний легких НИФП с жалобами на одышку при незначительной физической нагрузке (ходьбе по ровной местности), сухой кашель, выраженную общую слабость, повышенную утомляемость.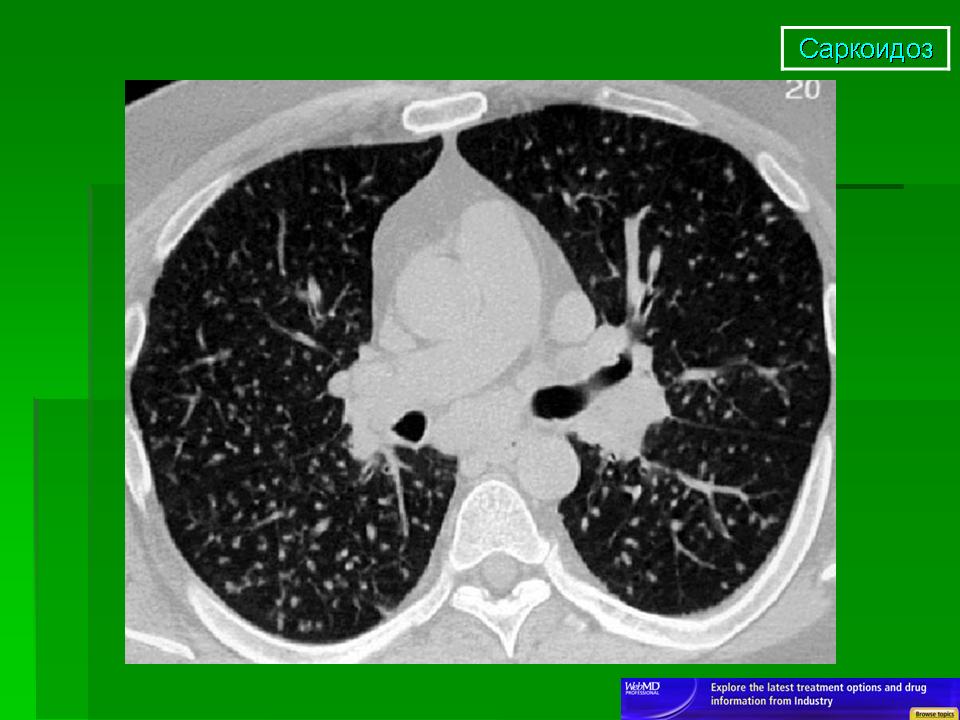
Заболевание началось три года назад без очевидных причин с малозаметной одышки, которая медленно прогрессировала. Периодически отмечался сухой кашель. На протяжении последних двух месяцев одышка значительно усилилась, появилась выраженная общая слабость, в связи с чем впервые обратился к врачу.
В анамнезе частые ОРВИ, трижды болел пневмонией. Не курит. Работал водителем дальних рейсов, строителем.
Объективно: одышки в покое и при разговоре нет. Частота дыхания – 22 в 1 мин. При аускультации дыхание с жестким оттенком, над базальными отделами билатерально – крепитирующие хрипы. ЧСС – 104 уд/мин, АД – 130/90 мм рт. ст. Тоны сердца ритмичны, приглушены. Другие органы и системы при физикальном обследовании без изменений.
СОЭ – 15 мм/ч, содержание кальция в крови в пределах нормы (1,29 ммоль/л).
МСКТ (рис. 4 слева): диффузное снижение прозрачности паренхимы легких по типу «матового стекла», небольшое увеличение бронхопульмональных лимфатических узлов с обеих сторон.
Функция внешнего дыхания: значительное уменьшение общей (44,7%) и жизненной (31,6%) емкости легких, резкое снижение диффузионной способности легких (DLCO – 22,6%).
Газовый состав крови: выраженная гипоксемия (РаО2 – 44 мм рт. ст., SaO2 – 82%).
Анализ результатов обследования не позволил уверенно предположить характер заболевания, при этом диагноз саркоидоза представлялся маловероятным по следующим причинам.
Симптом «матового стекла» без наличия мелкоузелковой диссеминации относится к перечню атипичных КТ-признаков саркоидоза и является не следствием альвеолита, а результатом атипичного диффузного распределения гранулем в интерстиции. Однако при саркоидозе феномен «матового стекла» обычно представлен отдельными изолированными участками, а в нашем случае наблюдалось диффузное снижение прозрачности паренхимы, что при саркоидозе встречается крайне редко.
Двустороннее небольшое увеличение бронхопульмональных лимфатических узлов также имело сомнительную диагностическую ценность, поскольку при саркоидозе прикорневая лимфаденопатия обычно выражена в значительно большей степени.
Кроме того, клинические и функциональные симптомы тяжелой респираторной недостаточности несовместимы с диагнозом саркоидоза II стадии, они характерны для IV стадии заболевания – распространенного пневмосклероза.
Наиболее вероятным был диагноз: гиперсенситивный пневмонит неустановленной природы, хроническая форма. При этом заболевании КТ-признаки диффузного снижения прозрачности паренхимы в виде «матового стекла» в сочетании с умеренной и тяжелой респираторной недостаточностью наблюдаются достаточно часто.
Вместе с тем диагноз требовал верификации. С этой целью пациенту была проведена видеоторакоскопия с биопсией паренхимы легких и внутригрудного лимфатического узла. При патогистологическом исследовании выявлены эпителиоидноклеточные гранулемы, характерные для саркоидоза.
Таким образом, больному был установлен диагноз: саркоидоз органов дыхания, впервые выявленный, II стадия, легочная недостаточность II степени.
Больному был назначен метилпреднизолон по 24 мг/сут на протяжении 4 нед с последующим снижением дозы по схеме до 12 мг к концу 3-го месяца. Однако пациент самостоятельно снизил дозу до 2 мг/сут. При обследовании на визите 2 через 3 мес клиническая картина заболевания и КТ-семиотика сохранялись на прежнем уровне, в связи с чем доза метилпреднизолона была увеличена до 16 мг/сут на протяжении 4 нед с постепенным ее снижением до 8 мг/сут к концу 6-го месяца. Однако и на третьем визите (6 мес) улучшения клинического состояния больного и признаков регрессии изменений в легких при КТ-исследовании не наблюдалось. Дополнительно к лечению метилпреднизолоном (8 мг/сут) назначен гидроксихинолин по 200 мг 2 раза в сутки.
Однако и на третьем визите (6 мес) улучшения клинического состояния больного и признаков регрессии изменений в легких при КТ-исследовании не наблюдалось. Дополнительно к лечению метилпреднизолоном (8 мг/сут) назначен гидроксихинолин по 200 мг 2 раза в сутки.
На визите 4 (12 мес) выявлены признаки регрессии саркоидоза – уменьшение бронхопульмональных лимфатических узлов и повышение прозрачности паренхимы (рис. 4 справа), при этом на фоне «матового стекла» стали отчетливо дифференцироваться бронхо-сосудистые структуры (рис. 5 справа). При исследовании функции внешнего дыхания отмечено увеличение жизненной емкости легких (35,6%), вместе с тем диффузионная способность сохранялась на крайне низком уровне (21,8%).
Результаты газового состава крови свидетельствовали о существенном уменьшении степени артериальной гипоксемии (РаО2 – 57 мм рт. ст., SaO2 – 89%).
Вместе с тем темпы регрессии патологического процесса были явно недостаточны – сохранялось значительное снижение прозрачности паренхимы легких, были крайне низкими показатели легочной вентиляции и диффузии. В связи с этим больному была назначена иммуносупрессивная терапия метотрексатом по 10 мг/нед в комбинации с фолиевой кислотой на фоне лечения метилпреднизолоном, рекомендовано наблюдение пульмонологом по месту жительства с целью мониторинга возможных побочных эффектов терапии и контрольное обследование в НИФП через 3 месяца.
В связи с этим больному была назначена иммуносупрессивная терапия метотрексатом по 10 мг/нед в комбинации с фолиевой кислотой на фоне лечения метилпреднизолоном, рекомендовано наблюдение пульмонологом по месту жительства с целью мониторинга возможных побочных эффектов терапии и контрольное обследование в НИФП через 3 месяца.
Заключение
По нашим данным, атипичные проявления саркоидоза при КТ органов грудной полости в группе больных с поражением паренхимы наблюдаются с частотой от 0,7% (односторонняя прикорневая лимфаденопатия) до 36,5% (сluster-симптом – скопление микроузелков в виде куста или грозди). При этом классические высокоспецифичные симптомы регистрируются значительно чаще – от 67,1% (перилимфатическое распределение узелков) до 91,1% (ДПЛ). В связи с этим атипичные признаки, как правило, сочетаются с классическими (случаи 1 и 2) и не создают особых трудностей для диагностики. Однако примерно в 2% случаев атипичные КТ-симптомы являются единственными проявлениями заболевания, что иллюстрирует случай 3. Это обусловливает необходимость применения методов трансбронхиальной или хирургической биопсии.
Это обусловливает необходимость применения методов трансбронхиальной или хирургической биопсии.
Литература
1. American Thoracic Society (ATS), European Respiratory Society (ERS), World Association of Sarcoidosis and Other Granulomatous Disoders (WASOG). Statement on Sarcoidosis // Am. J. Respir. Crit. Care Med. – 1999. – Vol. 160. – P. 736-755.
2. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Саркоїдоз» // Наказ МОЗ України № 634 від 08.09.2014.
3. Nunes H. Imaging of sarcoidosis of the airways and lung parenchyma and correlation with lung function / H. Nunes, Yu. Uzunhan, T. Gille et al. // Eur. Respir. J. – 2012. – Vol. 40. – P. 750-765.
4. Winterbauer R.H. Clinical interpretation of bilateral hilar adenopathy / R.H. Winterbauer, N. Belik, K.D. Moores // Ann. Intern. Med. – 1973. – Vol. 78. – P. 65-71.
5. Veltkamp M. The pulmonary manifestations of sarcoidosis / M.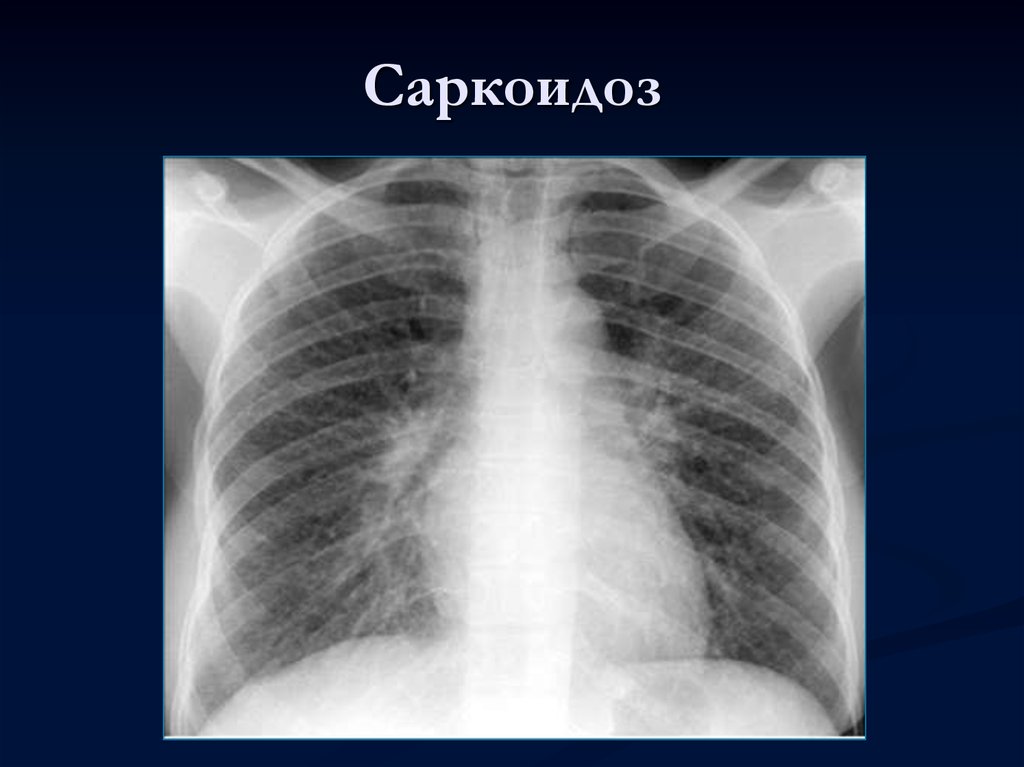 Veltkamp, J.C. Grutters // Pulmonary sarcoidosis. M.A. Judson Editor. – Humana Press – brand of Springer, 2014. – P. 19-40.
Veltkamp, J.C. Grutters // Pulmonary sarcoidosis. M.A. Judson Editor. – Humana Press – brand of Springer, 2014. – P. 19-40.
- Номер:
- Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (31) вересень 2015 р.
20.03.2023 Пульмонологія та оториноларингологіяЕфективність назального спрея мометазону фуроату в лікуванні гострого риносинуситу
Основою лікування гострого бактеріального риносинуситу є протимікробні препарати. Втім, додавання до антибіотиків інтраназальних кортикостероїдів може прискорити одужання і зменшити частоту та тяжкість рецидивів.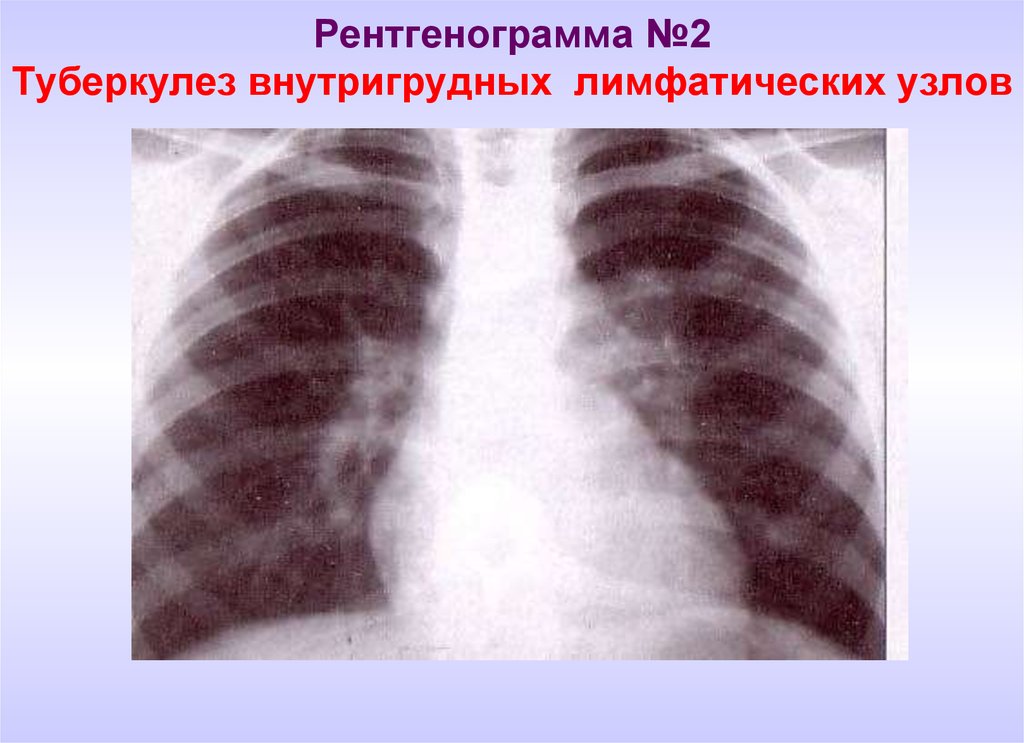 Саме тому метою цього дослідження було порівняти ефективність комбінації назального спрея мометазону фуроату з пероральним амоксициліном і амоксициліну окремо в лікуванні гострого риносинуситу….
Саме тому метою цього дослідження було порівняти ефективність комбінації назального спрея мометазону фуроату з пероральним амоксициліном і амоксициліну окремо в лікуванні гострого риносинуситу….
16.03.2023 Пульмонологія та оториноларингологіяРесперо Миртол у разі гострого вірусного риносинуситу: рандомізоване плацебо-контрольоване клінічне дослідження
Гострий вірусний риносинусит (ГВРС) клінічно проявляється запаленням слизової оболонки носа та приносових пазух. Ключовими симптомами ГВРС є ринорея (виділення з носа), постназальне затікання, закладеність носа, біль у ділянці обличчя, ускладнене носове дихання та розлади нюху [1]. ГВРС є одним із найпоширеніших розладів, які трапляються в закладах первинної медичної допомоги. Річна поширеність цього стану становить 6-15% [1], а щорічна захворюваність – від 2 до 5 епізодів на людину [2]. Незважаючи на свій самообмежувальний характер, ГВРС має високу соціально-економічну значущість із погляду втрати продуктивності, негативного впливу на якість життя та витрат для систем охорони здоров’я. Отже, сучасні варіанти лікування спрямовані на зменшення тяжкості захворювання. Зокрема, рекомендується симптоматичне лікування деконгестантами, аналгетиками, промиванням носа фізіологічним розчином і лікарськими засобами рослинного походження, які є переважною початковою стратегією лікування для дорослих із ГВРС….
Незважаючи на свій самообмежувальний характер, ГВРС має високу соціально-економічну значущість із погляду втрати продуктивності, негативного впливу на якість життя та витрат для систем охорони здоров’я. Отже, сучасні варіанти лікування спрямовані на зменшення тяжкості захворювання. Зокрема, рекомендується симптоматичне лікування деконгестантами, аналгетиками, промиванням носа фізіологічним розчином і лікарськими засобами рослинного походження, які є переважною початковою стратегією лікування для дорослих із ГВРС….
10.03.2023 Пульмонологія та оториноларингологіяСольові розчини для носа при гострому риносинуситі
Риносинусит – поширене захворюванням у більшості країн світу, котре спричиняє значний суспільний тягар, зумовлений споживанням медичних послуг і зниженням продуктивності праці. Річна поширеність гострого риносинуситу (ГРС) становить 6-15%. Етіологічними агентами ГРС здебільшого є різноманітні вірусні інфекції. Гострий бактеріальний риносинусит (ГБРС) розвивається тільки у 0,5-2% пацієнтів з ознаками риносинуситу, тому рутинне призначення антибактеріальної терапії при ГРС є недоцільним….
Річна поширеність гострого риносинуситу (ГРС) становить 6-15%. Етіологічними агентами ГРС здебільшого є різноманітні вірусні інфекції. Гострий бактеріальний риносинусит (ГБРС) розвивається тільки у 0,5-2% пацієнтів з ознаками риносинуситу, тому рутинне призначення антибактеріальної терапії при ГРС є недоцільним….
02.03.2023 Пульмонологія та оториноларингологіяСтратегія відкладеної антибіотикотерапії: міф чи можливість?
Наразі світовою медичною спільнотою активно обговорюється стратегія відкладеної антибіотикотерапії (АБТ). У чому суть і переваги цієї тактики? Кому вона підходить? Чи доцільно розглядати відкладену АБТ, якщо в пацієнта підтверджено коронавірусну хворобу (COVID-19)?…
Грудная лимфаденопатия при доброкачественных заболеваниях: современный обзор
Обзор
. 2016 март; 112:10-7.
2016 март; 112:10-7.
doi: 10.1016/j.rmed.2016.01.021. Epub 2016 1 февраля.
Карлос Шулер Нин 1 , Винисиус Валериу Сильвейра де Соуза 2 , Рикардо Холдербаум ду Амарал 3 , Роберто Шумахер Нето 4 , Джордано Рафаэль Тронко Алвес 5 , Эдсон Марчиори 6 , Клаус Лоурейро Ирион 7 , Фернанда Бальбинот 8 , Густаво де Соуза Портес Мейреллес 9 , Пабло Сантана 10 , Антонио Карлос Португалия Гомес 10 , Бруно Хоххеггер 11
Принадлежности
- 1 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 3 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 4 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 5 Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, Бразилия. Электронный адрес: [email protected].
- 6 Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, Бразилия.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 7 Ливерпульская больница сердца и грудной клетки, Ливерпуль, Великобритания. Электронный адрес: [email protected].
- 8 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 9 Fleury Medicina Diagnostica, Сан-Паулу, Бразилия.
- 10 Больница São Joaquim Beneficência Portuguesa, Сан-Паулу, Бразилия.
- 11 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- PMID: 26860219
- DOI:
10.
 1016/ж.рмед.2016.01.021
1016/ж.рмед.2016.01.021
Бесплатная статья
Обзор
Карлос Шулер Нин и др. Респир Мед. 2016 март
Бесплатная статья
. 2016 март; 112:10-7.
doi: 10.1016/j.rmed.2016.01.021. Epub 2016 1 февраля.
Авторы
Карлос Шулер Нин 1 , Винисиус Валериу Сильвейра де Соуза 2 , Рикардо Холдербаум ду Амарал 3 , Роберто Шумахер Нето 4 , Джордано Рафаэль Тронко Алвес 5 , Эдсон Марчиори 6 , Клаус Лоурейро Ирион 7 , Фернанда Бальбинот 8 , Густаво де Соуза Портес Мейреллес 9 , Пабло Сантана 10 , Антонио Карлос Португалия Гомес 10 , Бруно Хоххеггер 11
Принадлежности
- 1 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 3 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 4 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 5 Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, Бразилия. Электронный адрес: [email protected].
- 6 Федеральный университет Рио-де-Жанейро, Рио-де-Жанейро, Бразилия.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 7 Ливерпульская больница сердца и грудной клетки, Ливерпуль, Великобритания. Электронный адрес: [email protected].
- 8 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- 9 Fleury Medicina Diagnostica, Сан-Паулу, Бразилия.
- 10 Больница São Joaquim Beneficência Portuguesa, Сан-Паулу, Бразилия.
- 11 Федеральный университет медицинских наук Порту-Алегри, Порту-Алегри, Бразилия. Электронный адрес: [email protected].
- PMID: 26860219
- DOI:
10.
 1016/ж.рмед.2016.01.021
1016/ж.рмед.2016.01.021
Абстрактный
Лимфаденопатия является обычным рентгенологическим признаком многих торакальных заболеваний и может быть вызвана различными инфекционными, воспалительными и неопластическими состояниями. Этот обзор направлен на описание моделей медиастинальной и внутригрудной лимфаденопатии, обнаруживаемой при доброкачественных заболеваниях у иммунокомпетентных пациентов. Компьютерная томография является методом выбора для оценки лимфаденопатии, так как она способна продемонстрировать увеличение размеров отдельных узлов, аномалии границы между средостением и легкими, инвазию окружающего жира, слияние соседних узлов, облитерацию медиастинального жира. гипо- и гиперденсивность лимфатических узлов. Может потребоваться внутривенное контрастирование, чтобы отличить узлы от сосудов. Наиболее частыми инфекциями, приводящими к этой находке, являются туберкулез и грибковые заболевания (особенно гистоплазмоз и кокцидиоидомикоз).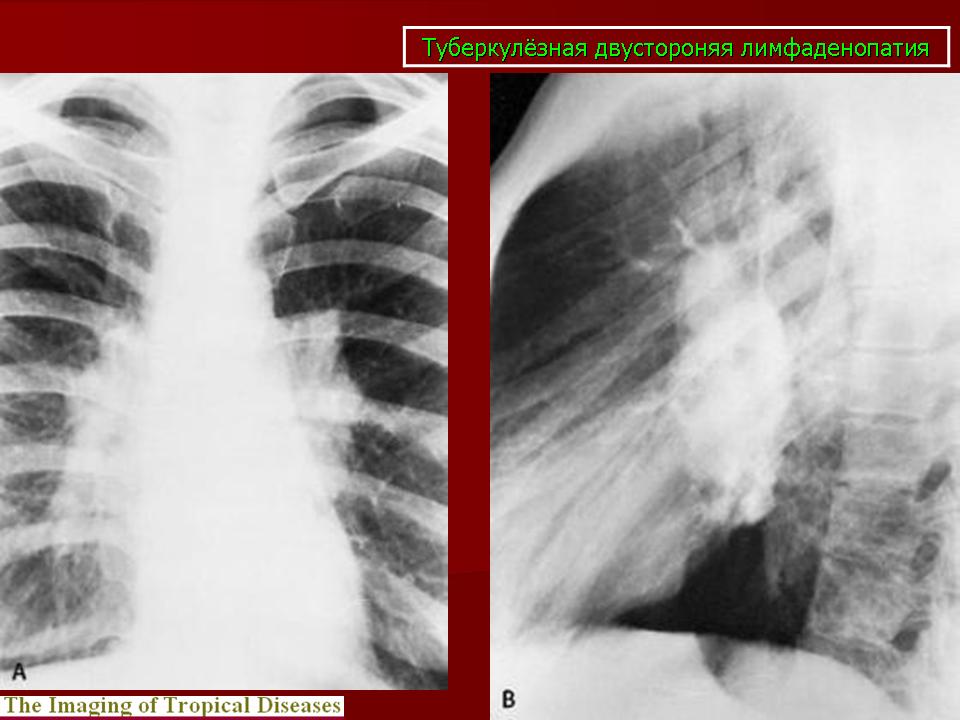 Саркоидоз является относительно частой причиной лимфаденопатии у молодых людей, и его можно отличить от других заболеваний, особенно когда обнаруживаются множественные и симметричные увеличенные лимфатические узлы. Другими состояниями, обсуждаемыми в этом обзоре, являются силикоз, реакции на лекарства, амилоидоз, сердечная недостаточность, болезнь Кастлемана, вирусные инфекции и хроническая обструктивная болезнь легких.
Саркоидоз является относительно частой причиной лимфаденопатии у молодых людей, и его можно отличить от других заболеваний, особенно когда обнаруживаются множественные и симметричные увеличенные лимфатические узлы. Другими состояниями, обсуждаемыми в этом обзоре, являются силикоз, реакции на лекарства, амилоидоз, сердечная недостаточность, болезнь Кастлемана, вирусные инфекции и хроническая обструктивная болезнь легких.
Ключевые слова: Доброкачественное заболевание; Компьютерная томография; лимфаденопатия; Торакальная болезнь.
Copyright © 2016 Elsevier Ltd. Все права защищены.
Похожие статьи
[Болезнь Кастлемана — необычная причина лихорадочного состояния с лимфаденопатией].
Краманн Б., Рембергер К. Краманн Б. и соавт.
 Dtsch Med Wochenschr. 1998 17 апреля; 123(16):513.
Dtsch Med Wochenschr. 1998.
PMID: 9589028
Немецкий.
Аннотация недоступна.
Dtsch Med Wochenschr. 1998 17 апреля; 123(16):513.
Dtsch Med Wochenschr. 1998.
PMID: 9589028
Немецкий.
Аннотация недоступна.Эндоскопическая тонкоигольная аспирация лимфатических узлов средостения под ультразвуковым контролем у пациентов с подозрением на рак легкого после позитронно-эмиссионной томографии и компьютерной томографии.
Элоубейди М.А., Серфолио Р.Дж., Чен В.К., Десмонд Р., Сайед С., Оджа Б. Элоубейди М.А. и соавт. Энн Торак Серг. 2005 янв; 79(1): 263-8. doi: 10.1016/j.athoracsur.2004.06.089. Энн Торак Серг. 2005. PMID: 15620955 Клиническое испытание.
Гранулематозная медиастинальная лимфаденопатия: может ли тонкоигольная аспирация под эндоскопическим ультразвуковым контролем отличить туберкулез от саркоидоза?
Фричер-Рэйвенс А.
 , Ганбари А., Топалидис Т., Пеллинг М., Кон О.М., Патель К., Арлт А., Бховмик А.
Fritscher-Ravens A, et al.
Эндоскопия. 2011 ноябрь;43(11):955-61. doi: 10.1055/s-0031-1271110. Epub 2011 10 августа.
Эндоскопия. 2011.
PMID: 21833904
Клиническое испытание.
, Ганбари А., Топалидис Т., Пеллинг М., Кон О.М., Патель К., Арлт А., Бховмик А.
Fritscher-Ravens A, et al.
Эндоскопия. 2011 ноябрь;43(11):955-61. doi: 10.1055/s-0031-1271110. Epub 2011 10 августа.
Эндоскопия. 2011.
PMID: 21833904
Клиническое испытание.Лимфаденопатия верхнего средостения при силикозе, имитирующем метастазы папиллярной карциномы щитовидной железы — отчет о клиническом случае и обзор литературы.
Цукатани Т., Нива Х., Комори Т., Ёнеяма Т., Цудзи Х., Мичигиши Т., Йокояма К., Йошизаки Т. Цукатани Т. и др. Гортань Аурис Насус. 2020 дек;47(6):1054-1057. doi: 10.1016/j.anl.2019.12.003. Epub 2019 31 декабря. Гортань Аурис Насус. 2020. PMID: 31899060 Обзор.
Болезнь Кастлемана — редкая причина лихорадочного состояния с лимфаденопатией.
Хартмайер С.Х., Штойрер Дж., Кристен Р., Фер Дж., Шлейффенбаум Б. Хартмайер С.Х. и соавт. Dtsch Med Wochenschr. 1997 г., 19 сентября; 122 (38): 1141-6. doi: 10.1055/s-2008-1047740. Dtsch Med Wochenschr. 1997. PMID: 9378025 Обзор. Немецкий.
Посмотреть все похожие статьи
Цитируется
Эндобронхиальная трансбронхиальная игольчатая аспирация под ультразвуковым контролем при внутригрудной лимфаденопатии с экстраторакальной злокачественностью.
Ли С.Дж., Ву Ц. Ли С.Дж. и соавт. Мировые дела J Clin. 2022 26 декабря; 10 (36): 13227-13238. дои: 10.12998/wjcc.v10.i36.13227. Мировые дела J Clin. 2022. PMID: 36683624 Бесплатная статья ЧВК.
Диагностическая ценность рентгенологических характеристик медиастинальных и прикорневых лимфатических узлов при саркоидозе.
Айчичек О., Бюльбюль Ю., Озтуна Ф., Озлу Т., Аккая С. Айчичек О. и др. Терк Торак Дж. 2022 июль; 23 (4): 284-289. doi: 10.5152/TurkThoracJ.2022.21254. Терк Торак Дж. 2022. PMID: 35848436 Бесплатная статья ЧВК.
Случайные находки грудной клетки при коронарной КТ-ангиографии: иллюстрированное эссе и предложение по лечению.
Пинто Э., Пенья Д., Хоххеггер Б., Монаган С., Марчиори Э., Таборда-Барата Л., Ирион К. Пинто Э. и др. J Брас Пневмол. 2022 13 мая;48(4):e20220015. doi: 10.36416/1806-3756/e20220015. Электронная коллекция 2022. J Брас Пневмол. 2022. PMID: 35584528 Бесплатная статья ЧВК. Обзор.
Сравнение силикоза и туберкулеза с поражением медиастинальных лимфатических узлов по данным мультидетекторно-рядной компьютерной томографии с контрастным усилением.
Вэнь С.Л., Ши Р., Го Ю.К., Ли И., Шу Ю., Ю. К.С., Ю. К.К., Тан С.С., Ян З.Г. Вэнь XL и др. Легкое. 2022 Апрель; 200 (2): 261-268. doi: 10.1007/s00408-022-00522-5. Epub 2022 15 марта. Легкое. 2022. PMID: 35290523
Результаты компьютерной томографии при прогрессирующем массивном фиброзе: анализ 90 случаев.
Сары Г., Гёкчек А., Коюнджу А., Шимшек С. Сары Г. и др. мед лав. 2022 22 февраля; 113 (1): e2022002. doi: 10.23749/mdl.v113i1.12303. мед лав. 2022. PMID: 35226653 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
Медиастинальная лимфаденопатия и интерстициальное заболевание легких у онкологического больного
Главная страница ▶ Профессионалы ▶ Клинические ресурсы ▶ Клинические случаи ▶ Медиастинальная лимфаденопатия и интерстициальное заболевание легких у онкологического больного
средостенная лимфаденопатия и интерстициальная болезнь легких у пациента с раком
, рассмотренные с помощью Аллергии, иммунологии и воспаления.
Университет Индианы
Индианаполис, Индиана
Джон Мастронард, доктор медицины
Университет штата Огайо
Колумбус, Огайо
Отправьте свои комментарии автору (авторам).
Анамнез
59-летняя белая женщина поступила в клинику для оценки одышки и аномалий при компьютерной томографии (КТ) органов грудной клетки. Три года назад у нее диагностировали рак молочной железы. Один из двадцати девяти подмышечных лимфатических узлов был положительным на опухоль, которая была положительной по рецептору эстрогена. Ее лечили хирургическим вмешательством, лучевой терапией и химиотерапией, которые включали доксирубицин, циклофосфамид, паклитаксел и гемцитабин. Затем ей дали анастрозол. За ней внимательно следили в течение следующих двух лет, и у нее не было никаких признаков рецидива.
До развития рака молочной железы пациентка была физически активной, проходила пешком от 3 до 4 миль в день. Однако за последние два года у нее усилилась одышка при физической нагрузке, и она смогла пройти только 1 милю.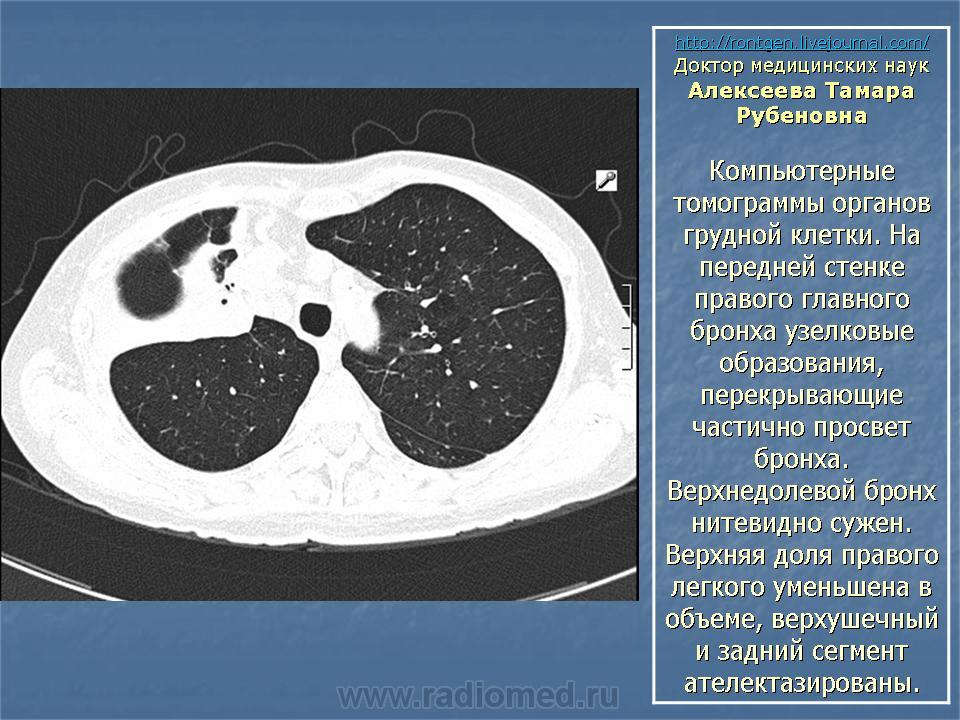 Непосредственно перед посещением рентгенограмма грудной клетки выявила внутригрудную и медиастинальную лимфаденопатию. КТ грудной клетки подтвердила двустороннюю внутригрудную и медиастинальную лимфаденопатию, а также перилимфатические узелки диаметром менее сантиметра в легких. Кроме того, позитронно-эмиссионная томография (ПЭТ) выявила поглощение в нескольких средостенных лимфатических узлах со стандартным значением поглощения 8. Пациент отрицал наличие кашля, потери веса, ночной потливости, лихорадки, а также воздействия на работе или в путешествии. Повторная маммография и УЗИ молочных желез были отрицательными.
Непосредственно перед посещением рентгенограмма грудной клетки выявила внутригрудную и медиастинальную лимфаденопатию. КТ грудной клетки подтвердила двустороннюю внутригрудную и медиастинальную лимфаденопатию, а также перилимфатические узелки диаметром менее сантиметра в легких. Кроме того, позитронно-эмиссионная томография (ПЭТ) выявила поглощение в нескольких средостенных лимфатических узлах со стандартным значением поглощения 8. Пациент отрицал наличие кашля, потери веса, ночной потливости, лихорадки, а также воздействия на работе или в путешествии. Повторная маммография и УЗИ молочных желез были отрицательными.
Физикальный осмотр
При физикальном осмотре у пациента отсутствовала лихорадка, артериальное давление и пульс были нормальными. Частота дыхания составляла 12, а пульсоксиметрия показала насыщение кислородом 96% на комнатном воздухе. Физикальное обследование было нормальным, за исключением небольшого покалывания.
Лаборатория
На основании данных КТ и ПЭТ больному выполнена бронхоскопия с бронхоальвеолярным лаважем и трансбронхиальной биопсией, а также медиастиноскопия. Результаты образцов показаны на рисунке 3.
Результаты образцов показаны на рисунке 3.
FEV1 2,77 (81%)
FVC 2,29 (86%)
FEV1/FVC 80,1%
TLC 4,18 (81%)
DLCO 20,3 (91%)
SEAD в диаметре присутствовали в обоих легких с перилимфатическим распространением. Размер правого паратрахеального лимфатического узла 1,9 см. Был 1,3 см правый прекаринальный лимфатический узел, 1,4 см левый переднесредостенный лимфатический узел и 1,4 см субкаринальный лимфатический узел. Плеврального выпота или пневмоторакса не было (рис. 1 и 2).
ПЭТ-сканирование: поглощение в нескольких медиастинальных лимфатических узлах со стандартным значением поглощения 8 (Изображения недоступны).
Рисунки
Рисунок 1. Аксиальная проекция КТ грудной клетки с высоким разрешением с использованием окон легких, показывающая множественные узелки диаметром менее одного сантиметра в перилимфатическом распределении.
Рис. 2. Аксиальная проекция КТ грудной клетки с высоким разрешением с использованием окон средостения, показывающая двустороннюю внутригрудную и субкаринальную лимфаденопатию.
Рисунок 3. Препарат трансбронхиальной биопсии, на котором видны многоядерные гигантские клетки и эпителиоидные гистиоциты в гранулематозном образовании (20-кратное увеличение)
Вопрос 1
Какой наиболее вероятный диагноз?
| A. | Лимфангиозный карциноматоз Неверно! | |
| Б. | Саркоидоз Верно! | |
| C. | Гистоплазмоз Неверно! | |
| D. | Гиперчувствительный пневмонит Неверно! | |
| E. | Туберкулез Неверно! |
Каталожные номера
- Bergin C, Roggli V, Coblentz C et al.
 Вторичная легочная долька: нормальный и патологический вид на КТ. Am J Roentgenol 1988;151:21-25.
Вторичная легочная долька: нормальный и патологический вид на КТ. Am J Roentgenol 1988;151:21-25. - Рауф С., Амченцев А., Влахос И. и др. Иллюстрированное эссе: Многоузловая болезнь. Диагностический алгоритм компьютерной томографии высокого разрешения. Грудь 2006;129:805-815.
- Груден Дж. Ф., Уэбб В. Р., Уорнок М. Центрилобулярные затемнения на КТВР: диагностика и дифференциальная диагностика с патологической корреляцией. Am J Roentgenol 1994;162:569-574.
- Коллинз Дж., Бланкенбейкер Д., Стерн Э.Дж. КТ-паттерны бронхиолярной болезни: что такое «дерево в зародыше»? Ам Дж. Рентгенол 1998;171:365-370.
- Brincker H, Wilbek E. Частота злокачественных опухолей у пациентов с респираторным саркоидозом. Бр Дж. Рак 1974; 29:247-251.
- Brincker H. Солидные опухоли, предшествующие или следующие за саркоидозом. Med Pediatr Oncol 1987;15:82-88.
- Израиль HL. Саркоидоз, злокачественные новообразования и иммуносупрессивная терапия. Arch Int Med 1978; 138:907-908.
- Askling J, Grunewald J, Eklund A et al. Повышенный риск развития рака после саркоидоза. Am J Respir Crit Care Med 1999;160:1668-1672.
- Курата А., Терадо Ю., Шульц А. и др. Воспалительные клетки в формировании опухолевых саркоидных реакций. Хум Патол 2005; 36: 546-554.
- Cohen PR, Kurzrock R. Саркоидоз и злокачественные новообразования. Клиника Дерм 2007;25:326-333.
- Ромер Ф.К. Саркоидоз и рак — критический взгляд. Материалы VIII Международной конференции по саркоидозу. Кардифф: Альфа Омега Пресс; 1980: 567-571.
- Yu JQ, Zhuang H, Mavi A, Alavi A. Оценка роли ПЭТ с флюродезоксиглюкозой в лечении пациентов с саркоидозом. ПЭТ Клин 2006; 1:141-152.
- Hamper UM, Fishman EK, Khouri NF et al. Типичные и атипичные КТ проявления легочного саркоидоза. J Comput Assist Tomogr 1986; 10:928-936.
- Алави А., Гупта Н., Альберини Дж.Л. и др. Позитронно-эмиссионная томография при незлокачественных заболеваниях грудной клетки. Semin Nucl Med 2002;32:293-321.
- Ямада Ю., Учида Ю., Тацуми К. и др. Фтор-18-фтордезоксиглюкоза и углерод-11-метионин оценивают лимфаденопатию при саркоидозе. J Nuc Med 1998; 39:1160-1166.
- Льюис П.Дж., Салама А. Поглощение фтор-18-фтордезоксиглюкозы при саркоидозе. J Nuc Med 1994; 35:1647-1649.
- Кук Г.Дж., Фогельман И., Мэйси М.Н. Нормальные физиологические и доброкачественные патологические варианты позитронно-эмиссионной томографии с 18-фтор-2-дезоксиглюкозой: возможность ошибки в интерпретации. Semin Nucl Med 1996;26:308-314.
- Кайра К., Ориучи Н., Отани Ю. и др. Диагностическая ценность позитронно-эмиссионной томографии с фтор-18-α-метилтирозином в сочетании с 18F-фтордезоксиглюкозой у пациентов с саркоидозом. Грудь 2007;131:1019-1027.
- Рейх Дж.М. Неоплазия в этиологии саркоидоза. Европейский J Int Med 2006;17:81-87.
- Oâ€⠄¢Connell MJ, Schimpff SC, Krischner RH et al. Эпителиоидные гранулемы при болезни Ходжкина. ЯМА 1975; 233:886-889.
- Yeager H Jr, Williams MC, Beekman JF et al.
 Саркоидоз: анализ клеток, полученных при лаваже бронхов. Am Rev Respir Dis 1977; 116:951-954.
Саркоидоз: анализ клеток, полученных при лаваже бронхов. Am Rev Respir Dis 1977; 116:951-954. - Winterbauer RH, Lammert J, Selland M et al. Популяции клеток бронхоальвеолярного лаважа в диагностике саркоидоза. Сундук 1993;104:352-361.
- Американское торакальное общество. Заявление о саркоидозе. Am J Respir Crit Care Med 1999; 160:736-755.
- Роте Р.А., Фуллер П.Б., Берд Р.Б. и др. Трансбронхоскопическая биопсия легкого при саркоидозе. Оптимальное количество и сайты для диагностики. Грудь 1980;77:400-402.
- Trisolini R, Agli LL, Cancellieri A et al. Значение гибкой трансбронхиальной аспирации в диагностике саркоидоза I стадии. Грудь 2003;124:2126-2130.
- Гарвуд С., Джадсон М.А., Сильвестри Г. и др. Эндобронхиальное УЗИ для диагностики легочного саркоидоза. Грудь 2007; 132:1298-1304.
Американское торакальное общество улучшает глобальное здравоохранение, продвигая исследования, уход за пациентами и общественное здравоохранение при заболеваниях легких, критических состояниях и нарушениях сна.