Антибиотики при ЛОР заболеваниях: описание болезни, причины, симптомы, стоимость лечения в Москве
Антибиотики при ЛОР заболеваниях назначаются достаточно часто. Препараты из этой категории требуются при наличии бактериального поражения, которое вызывает воспалительный процесс. Данные лекарственные средства обладают значительными побочными действиями, но при некоторых поражениях обойтись без них все равно не получится, так как организм своими силами не сможет противостоять патологии. Не все антибиотики одинаково эффективны против тех или иных нарушений, из-за чего важно правильно подобрать препарат. В отоларингологии применяют средства нескольких групп. Самостоятельно назначать себе антибиотики категорически запрещается. Ошибка с выбором лекарства станет причиной значительного ухудшения состояния больного и будет способствовать проявлению особенно стойких бактерий.
В большинстве случаев при ЛОР заболеваниях появляется необходимость в приеме антибиотиков.
Назначаться для терапии антибиотические средства могут при заболеваниях ЛОР органов в любом возрасте. Для детей дозировка при необходимости существенно корректируется, в этом случае она рассчитывается по весу больного. Не все группы препаратов возможно использовать в раннем возрасте, из-за чего при лечении ребенка дошкольного возраста могут возникать некоторые сложности. Сами же антибиотики при ЛОР заболеваниях у взрослых и детей одинаковы.
Когда нельзя обойтись без антибиотиков
В отоларингологии антибиотики применяются широко. Они показаны к использованию при бактериальных поражениях тканей, когда есть риск развития осложнений, так как организм не справляется своими силами с возбудителем. Основные заболевания, которые лечатся антибиотическими средствами, – это ангины, синуситы и отиты.
Они показаны к использованию при бактериальных поражениях тканей, когда есть риск развития осложнений, так как организм не справляется своими силами с возбудителем. Основные заболевания, которые лечатся антибиотическими средствами, – это ангины, синуситы и отиты.
Для того чтобы определить, что требуется использование именно антибиотиков, проводится мазок из глотки, носа или уха. Полученный материал позволяет не только выявить конкретного возбудителя, а еще и определить к какому лекарству он наиболее чувствительный.
Основные показания для проведения лечения антибиотическими составами – это бактериальные инфекции, при которых нет положительного результата от проведения иной терапии, а также высока вероятность развития тяжелых осложнений. Также в обязательном порядке средство будет прописано при наличии вторичного инфицирования и после проведения хирургических вмешательств.
В зависимости от того, какие особенности организма имеются у больного, препараты могут использоваться для местного или общего действия. Они выпускаются в форме спреев, таблеток, капсул или раствора для инъекций. Последняя форма считается более безопасной, так как в меньшей степени нарушает микрофлору кишечника.
Они выпускаются в форме спреев, таблеток, капсул или раствора для инъекций. Последняя форма считается более безопасной, так как в меньшей степени нарушает микрофлору кишечника.
Особенности использования
Есть несколько принципов использования лекарств из группы антибиотиков, которые требуют обязательного соблюдения. Нарушения их могут приводить к тяжелым последствиям. Препарат всегда должен назначаться врачом отоларингологом, а если его нет, то терапевтом.
1. При первичном обращении, если нет возможности дождаться результатов мазка, для лечения назначается препарат широкого спектра действия, эффективный против основных возбудителей выявленной патологии. После того как результаты исследования будут получены, схема лечения при необходимости будет отредактирована.
2. При отсутствии результата требуется замена лекарственного средства. В такой ситуации может понадобиться повторное взятие мазка, так как неуспех лечения, скорее всего, означает, что при выборе лекарства совершена ошибка. Если же больной не соблюдал схему приема, то отсутствие эффекта от антибиотика связано с развитием стойкой к препарату формы возбудителя.
Если же больной не соблюдал схему приема, то отсутствие эффекта от антибиотика связано с развитием стойкой к препарату формы возбудителя.
3. Минимальная продолжительность курса 7 дней. Обязательно пройти лечение полностью. Даже если кажется, что в лекарстве уже нет необходимости, обязательно нужно продолжить его прием. В противном случае не оконченный больным курс станет причиной появления особенно стойкого возбудителя, против которого в дальнейшем антибиотики из данной категории будут бесполезны.
4. При выборе лекарственного препарата требуется изучение карты больного с целью определения того, какие антибиотические лекарства уже были пропиты в недавнем времени. Выбирать при этом надо иное средство, так как предыдущее может оказаться уже недостаточно действенным. В один год использовать несколько раз одинаковый препарат крайне не желательно. Это допускается только в том случае, если нет иного выхода;
Также пациент в обязательном порядке должен сообщить лечащему врачу о том, какие препараты он принимает, так как далеко не со всеми средствами можно сочетать прием антибиотиков. В этом случае терапия строится по особому плану, если нет возможности отменить лекарство.
В этом случае терапия строится по особому плану, если нет возможности отменить лекарство.
Меры предосторожности при терапии
При использовании антибиотиков с целью лечения заболеваний ЛОР органов требуется соблюдать ряд правил. Они позволят максимально оградить свой организм от негативного воздействия лекарства. Если их проигнорировать, то в дальнейшем потребуется лечение побочных эффектов, которое является достаточно длительным и сложным.
Основная опасность при использовании антибиотиков – это развитие дисбактериоза, который может оказаться очень сильным. Для предотвращения такого явления параллельно с лекарственным препаратом назначается употребление пробиотиков. Они позволят восстановить правильный баланс полезных бактерий и сохранить здоровье кишечника.
Основные лекарственные препараты
При лечении воспалительных заболеваний в отоларингологии применяют средства из пяти основных групп. По возможности лечение стараются начинать с самого легкого из них.
Препараты могут убивать возбудителя заболевания или же подавлять его развитие, вследствие чего он, теряя возможность размножаться и утратив способность защищаться от иммунитета человека, погибает. То, какое лекарство выбрать, определяет только врач.
Чаще всего при патологии назначают для лечения какой-либо из нескольких наиболее распространенных и эффективных препаратов, которые обладают минимум побочных действий и уничтожают при правильном использовании большинство возбудителей патологических процессов. Обычно выбирают одно из таких антибиотических средств:
-
Амоксициллин – препарат полусинтетической природы, имеющий широкий спектр действий;
-
Амоксиклав;
-
Амоксицилин с клавулановой кислотой – комбинированное лекарство, которое обладает особенно сильным действием за счет сочетания двух компонентов;
-
Азитромицин – лекарство широкого спектра действия, эффективное при большинстве поражений придаточных пазух носа;
-
-
Имипенем – средство широкого спектра действия;
-
Цефалотоксим – полусинтетическое средство третьего поколения.
Также, кроме лекарственных средств широкого спектра действия, при точном выявлении возбудителя могут быть прописаны составы направленного воздействия на конкретного болезнетворного агента. Это лечение оказывается максимально эффективным и быстрым. Иногда назначается комбинированное воздействие при помощи местного антибиотика и общего. Такой метод, как правило, применяется только при тяжелом течении болезни с бурным гнойным процессом. В остальных случаях подбирают только один вид медикаментозного препарата.
ЛОР-заболевания: без точной диагностики лечение бесполезно
ЛОР-заболевания: без точной диагностики лечение бесполезноВоспалительные заболевания ЛОР-органов являются наиболее
распространенными и значимыми патологическими процессами в клинической
практике. Формы ЛОР-заболеваний достаточно разнообразны: заболевания
верхних дыхательных путей – риносинуситы, тонзиллофарингиты, ларингиты;
наружный и средний отит, различные виды снижения слуха.
Самолечение, бесконтрольное использование лекарственных средств,
антибиотиков, сосудосуживающих капель в нос и других препаратов
увеличивает риск развития затяжного, рецидивирующего и хронического
течения болезни, а так же возможного развития тяжелых, угрожающих жизни
осложнений.
При этом, ЛОР заболевания могут проявлять себя самым неожиданным
образом. Для иллюстрации этого приведем несколько примеров из практики
клиники «Медсервис».
Пациент два года мучился от головной боли
Пациент 42-х лет, обратился к кардиологу в клинику «Медсервис»
жалобами на повышение артериального давления и головные боли. Головные
боли беспокоили около двух лет. В последнее время появилось ухудшение на
фоне затруднения носового дыхания.
Кардиологом пациент был направлен к ЛОР врачу. При прохождении
обследования, в том числе компьютерной томографии околоносовых пазух,
было выявлено гнойное воспаление в пазухах и киста гайморовой пазухи. На
На
фоне назначенного кардиологом и ЛОР врачом лечения состояние значительно
улучшилось.
С ситуацией разобрались после компьютерной томографии
Пациент, 12-ти лет, обратился к лор-врачу с жалобами на сильную
заложенность носа, практически дыхание через рот, храп. Болен около трех
недель. В течение этого времени по месту медицинского обслуживания была
сделана рентгенография пазух носа. Мальчик получал лечение — антибиотики,
физиолечение. Но состояние на фоне назначенной терапии только ухудшалось.
При обращении в клинику ООО «Медсервис» была сделана компьютернаятомография (КТ) околоносовых пазух, где выявился воспалительный процесс во
всех пазухах носа с наличием экссудата (гнойного содержимого). Лор — врачом
назначено лечение. При повторном обращении отмечалось значительное
улучшение. Носовое дыхание восстановилось, пациент пошел на поправку.
Рациональный выбор антибиотика для лечения инфекций верхних дыхательных путей и ЛОР-органов
Статья в формате PDF.
Бактериальное воспаление верхних дыхательных путей (ВДП) и ЛОР-органов занимает одно из лидирующих мест среди проблем, с которыми приходится сталкиваться практикующим семейным врачам, педиатрам, отоларингологам. В то же время широкий выбор антибактериальных препаратов (АПБ), имеющийся в распоряжении современного врача, может стать камнем преткновения при выборе антибиотика для эффективной терапии. Безусловно, самым оптимальным вариантом является выбор препарата по результатам проведенного бактериологического исследования с оценкой чувствительности микроорганизма к химиопрепаратам. Однако для реальных условий врачебной практики такой подход слишком затруднителен, прежде всего – из-за сроков осуществления исследований. Соответственно, перед врачом стоит задача эмпирического назначения антибиотика, и оценить в данном случае, насколько удачен этот выбор, возможно далеко не всегда.
Существующий уровень развития медицины позволяет практикующим врачам получить огромное количество информации о патогенезе того или иного заболевания, вероятных возбудителях в зависимости от локализации воспаления и региона проживания пациента, об уровнях резистентности тех или иных антибиотиков, о возможных осложнениях антибиотикотерапии (АБТ) и т. д. Стремление современной медицины к тотальному использованию принципа доказательности отчасти облегчает задачу врача, в какой-то мере снимая с него ответственность за выбор, однако и пациенты, и клинические ситуации и двести лет назад, и сегодня остаются разными, так что практический опыт специалиста по-прежнему поистине бесценен. Понятие рациональной АБТ, широко используемое в настоящее время ведущими специалистами, включает в себя взвешенное отношение к выбору препарата, предполагающее учитывать как рекомендации клинических протоколов, так и особенности течения заболевания у конкретного пациента.
д. Стремление современной медицины к тотальному использованию принципа доказательности отчасти облегчает задачу врача, в какой-то мере снимая с него ответственность за выбор, однако и пациенты, и клинические ситуации и двести лет назад, и сегодня остаются разными, так что практический опыт специалиста по-прежнему поистине бесценен. Понятие рациональной АБТ, широко используемое в настоящее время ведущими специалистами, включает в себя взвешенное отношение к выбору препарата, предполагающее учитывать как рекомендации клинических протоколов, так и особенности течения заболевания у конкретного пациента.
Однако успешное решение клинической задачи – не единственная проблема современного врача. К сожалению, все чаще мировому медицинскому сообществу приходится сталкиваться с таким глобальным понятием, как антибиотикорезистентность. «Антибиотики увеличили продолжительность жизни на планете и облегчили терапию львиной доли заболеваний, но сейчас нависла реальная угроза утраты всех этих преимуществ. И если мы не начнем действовать сейчас, не активизируем усилия по предотвращению дальнейшего развития антибиотикорезистентности, то последствия будут крайне разрушительными», – сказал в своем докладе Keiji Fukuda, представитель Всемирной организации здравоохранения (ВОЗ) (2014). Разумеется, наиболее остро вопрос антибиотикорезистентности стоит пока в лечении тяжелых госпитальных и жизнеугрожающих инфекций (сепсис, реанимационные инфекции, пневмонии и т. д.), тем не менее негативная тенденция отмечается и на уровне привычных амбулаторных инфекций.
И если мы не начнем действовать сейчас, не активизируем усилия по предотвращению дальнейшего развития антибиотикорезистентности, то последствия будут крайне разрушительными», – сказал в своем докладе Keiji Fukuda, представитель Всемирной организации здравоохранения (ВОЗ) (2014). Разумеется, наиболее остро вопрос антибиотикорезистентности стоит пока в лечении тяжелых госпитальных и жизнеугрожающих инфекций (сепсис, реанимационные инфекции, пневмонии и т. д.), тем не менее негативная тенденция отмечается и на уровне привычных амбулаторных инфекций.
В упомянутом выше докладе ВОЗ говорилось также следующее: «Медицинским работникам и фармацевтам настоятельно рекомендуется расширить инфекционный контроль, назначать антибиотики по строгим показаниям, только когда это назначение продиктовано реальной необходимостью, желательно – с верификацией возбудителя до начала антибиотикотерапии». Инфекции ВДП и ЛОР-органов, особенно острые, практически в 100% случаев требуют эмпирического подбора антибиотика. Остается вопрос – что же такое «реальная необходимость АБТ»? Общеизвестно, что высокий процент бактериальных инфекций ВДП возникает вследствие или на фоне острой респираторной вирусной инфекции (ОРВИ) за счет суперинфекции эндо- или экзогенного происхождения. Ежегодно в Украине регистрируется 4-4,8 млн случаев ОРВИ и гриппа (Крамарев С. А., 2014). При этом не существует четкой статистики того, какой же процент случаев ОРВИ оканчивается тем или иным осложнением бактериального генеза. Тем не менее цифры говорят о том, что 70-90% случаев острых респираторных заболеваний (ОРЗ) имеют вирусную природу (Зайцев А. А., 2009; Кочетков П. А., Мейтель И. Ю., 2016; Абатуров А. Е., 2014). В каких именно случаях из этих 90% пациенты получали антибиотики – можно только предполагать.
Остается вопрос – что же такое «реальная необходимость АБТ»? Общеизвестно, что высокий процент бактериальных инфекций ВДП возникает вследствие или на фоне острой респираторной вирусной инфекции (ОРВИ) за счет суперинфекции эндо- или экзогенного происхождения. Ежегодно в Украине регистрируется 4-4,8 млн случаев ОРВИ и гриппа (Крамарев С. А., 2014). При этом не существует четкой статистики того, какой же процент случаев ОРВИ оканчивается тем или иным осложнением бактериального генеза. Тем не менее цифры говорят о том, что 70-90% случаев острых респираторных заболеваний (ОРЗ) имеют вирусную природу (Зайцев А. А., 2009; Кочетков П. А., Мейтель И. Ю., 2016; Абатуров А. Е., 2014). В каких именно случаях из этих 90% пациенты получали антибиотики – можно только предполагать.
Cледует отметить, что ошибки в АБТ инфекций ВДП имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок, совершаемых в терапевтической практике, и оказывают существенное влияние на исход заболевания (Дворецкий Л. И., Яковлев С. В., 2003). Известный патологоанатом И. В. Давыдовский писал: «Врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Увы, несмотря на «добросовестность», врачебная ошибка, к сожалению, остается ошибкой. Поэтому, назначая АБТ, врачу необходимо решать как тактические, так и стратегические задачи. К первым относится рациональный выбор АБП, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием. Стратегическая задача АБТ в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции (Дворецкий Л. И., Яковлев С. В., 2003). В соответствии с этим можно выделить основные ошибки при назначении АБТ (табл.).
И., Яковлев С. В., 2003). Известный патологоанатом И. В. Давыдовский писал: «Врачебные ошибки – род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Увы, несмотря на «добросовестность», врачебная ошибка, к сожалению, остается ошибкой. Поэтому, назначая АБТ, врачу необходимо решать как тактические, так и стратегические задачи. К первым относится рациональный выбор АБП, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием. Стратегическая задача АБТ в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции (Дворецкий Л. И., Яковлев С. В., 2003). В соответствии с этим можно выделить основные ошибки при назначении АБТ (табл.).
Хотелось бы отметить, что положительное влияние антибиотиков на течение вирусной респираторной инфекции – не более чем миф, а эффективность профилактики развития бактериальных осложнений ОРВИ не доказана ни в одном из клинических исследований. Исходя из этого особенно важно отдельно выделить современные принципы применения антибиотиков (Баранов А. А., Богомильский М. Р. и др., 2015):
Исходя из этого особенно важно отдельно выделить современные принципы применения антибиотиков (Баранов А. А., Богомильский М. Р. и др., 2015):
- Назначать антибиотики следует только при высоковероятной или доказанной бактериальной природе заболевания, требующей обязательного проведения этиотропной терапии, так как в противном случае велика вероятность развития осложнений и неблагоприятных исходов.
- Выбирать антибиотики по возможности с учетом региональных данных о наиболее распространенных (вероятных) возбудителях и их резистентности.
- При выборе антибиотика учитывать АБТ, которую пациент получал в предшествующие 2-3 мес, так как повышен риск носительства резистентной микрофлоры (S. pneumoniae, H. influenzae и др.).
- В амбулаторных условиях использовать пероральный путь приема антибиотиков.
- Не применять в амбулаторной практике потенциально токсичные препараты (аминогликозиды, хлорамфеникол, сульфаниламиды).
- При выборе антибиотиков учитывать возрастные ограничения (например, тетрациклины можно назначать только с 8 лет).

- При необходимости своевременно проводить коррекцию стартовой терапии (при отсутствии клинических признаков улучшения в течение 48-72 ч от начала терапии; в более ранние сроки при нарастании тяжести заболевания; при развитии тяжелых нежелательных реакций; при уточнении возбудителя инфекции и его чувствительности к антибиотикам по результатам микробиологического исследования).
- Отменять антибиотики при появлении данных о том, что инфекция не является бактериальной, не ожидая завершения первоначально намеченного курса терапии.
- При проведении коротких курсов АБТ не назначать антибиотики вместе с антигистаминными или противогрибковыми препаратами, иммуномодуляторами из-за отсутствия доказательств преимуществ их совместного назначения.
- По возможности не использовать жаропонижающие средства вместе с антибиотиками, так как это может скрыть отсутствие эффекта и задержать смену препарата.
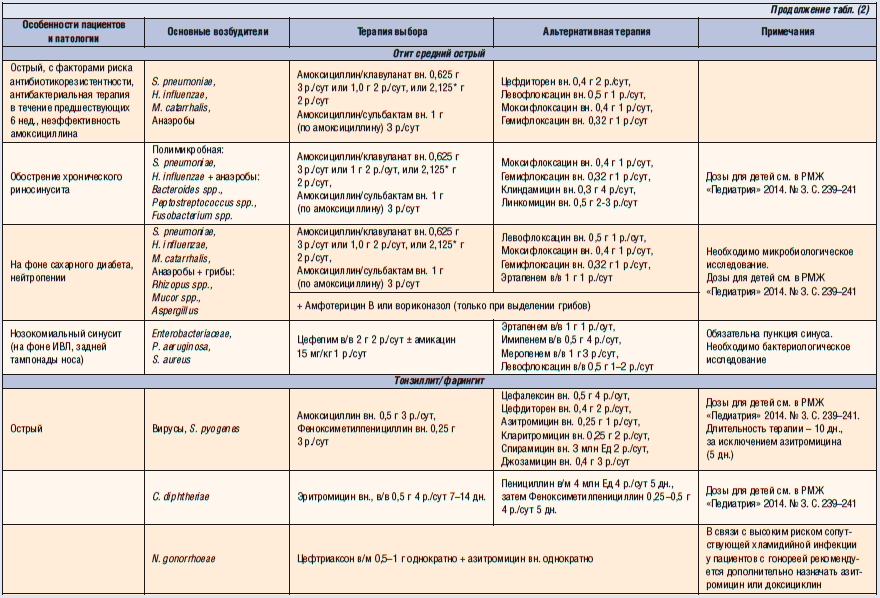
При этом абсолютными показаниями к назначению антибиотиков при инфекциях ВДП и ЛОР-органов являются: острый бактериальный риносинусит, обострение хронического синусита, острый стрептококковый тонзиллит, острый средний отит (ОСО) у детей до 6 мес, а также гнойный ОСО, паратонзиллит, эпиглотит.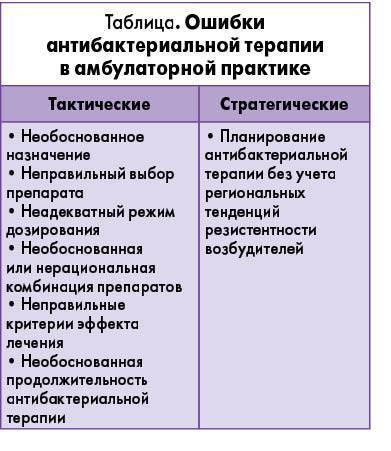
Кроме того, назначая АБТ при ОРЗ, важно не забывать, что бактериальные осложнения ОРВИ развиваются, как правило, после 5-7 дней заболевания и изменяют его классическое течение. В действующем отечественном унифицированном клиническом протоколе по ведению пациентов с риносинуситами четко обозначено, что слизисто-гнойное отделяемое из носа является наиболее частым симптомом, сопровождающим ОРВИ, и не может быть показанием для назначения антибиотика. АБТ при риносинусите может быть оправданным выбором только при высокой вероятности наличия бактериальной суперинфекции, о чем говорит сохранение симптомов в течение 10-14 дней в сочетании с лихорадкой, отеком лица или болью в проекции придаточных пазух носа.
Определив показания к назначению антибиотика, врач должен затем решить не менее важную задачу – выбрать оптимальный препарат. Рассмотрим наиболее распространенные локализации инфекций ВДП и ЛОР-органов и возможности использования тех или иных антибиотиков.
Острый тонзиллофарингит (ОТФ) – инфекционное воспаление слизистой оболочки ротоглотки и нёбных миндалин, осложняющееся в ряде случаев развитием гнойных процессов в окружающих тканях (паратонзиллит, паратонзиллярный абсцесс), а при стрептококковой этиологии – острой ревматической лихорадкой, кардитом или гломерулонефритом. Среди бактериальных возбудителей ОТФ наибольшее значение имеет S. pyogenes – бета-гемолитический стрептококк группы А (БГСА) – 15-30% случаев. Реже острый тонзиллит вызывают стрептококки групп С и G, микоплазмы, хламидии, A. haemolyticum, N. gonorrhoeae, C. Diphtheriae, анаэробы (Страчунский Л. С., Белоусов Е.Б, 2007). При выборе антибиотика важно помнить, что БГСА отличаются полной чувствительностью к пенициллинам и цефалоспоринам. Тетрациклины, сульфаниламиды, ко-тримоксазол не обеспечивают эрадикацию БГСА, резистентность к этим препаратам превышает 40% (Баранов А. А., Богомильский М. Р. и др., 2015).
Среди бактериальных возбудителей ОТФ наибольшее значение имеет S. pyogenes – бета-гемолитический стрептококк группы А (БГСА) – 15-30% случаев. Реже острый тонзиллит вызывают стрептококки групп С и G, микоплазмы, хламидии, A. haemolyticum, N. gonorrhoeae, C. Diphtheriae, анаэробы (Страчунский Л. С., Белоусов Е.Б, 2007). При выборе антибиотика важно помнить, что БГСА отличаются полной чувствительностью к пенициллинам и цефалоспоринам. Тетрациклины, сульфаниламиды, ко-тримоксазол не обеспечивают эрадикацию БГСА, резистентность к этим препаратам превышает 40% (Баранов А. А., Богомильский М. Р. и др., 2015).
Итак, препаратами выбора при ОТФ сегодня признаны пероральные аминопенициллины, в т. ч. защищенные, применяемые курсами не менее 10 дней. Однако в последние годы появился целый ряд сообщений о случаях неэффективности производных пенициллина для эрадикации БГСА со слизистой миндалин и задней стенки глотки, частота которых может достигать 30-40% (Kaplan E. L., Johnson D. R., 2001; Ovetchkine P. , Levy C. et al., 2002). Среди наиболее часто упоминаемых причин неудачной эрадикации БГСА пенициллинами отмечают: низкий комплайенс к 10-дневным курсам лечения, реинфекцию стрептококками от инфицированных членов семьи, разрушение пенициллина ко-патогенами ротовой полости, недостаточное проникновение антибиотика в ткань миндалин, использование контаминированных зубных щеток, протезов, явления толерантности стрептококков к пенициллину (Pichichero M. E., Casey J. R., 2007). Кроме того, как указывалось выше, БГСА при ОТФ – далеко не единственный возбудитель. Все большую роль, особенно в случаях рецидивирующих инфекций, приобретают атипичные возбудители. Общеизвестно, что золотым стандартом терапии инфекций, вызванных такими микроорганизмами, является применение макролидов. Макролиды, в том числе азитромицин, отнесены к группе альтернативных антибиотиков для лечения ОТФ. Азитромицин (первый представитель группы полусинтетических 15-членных макролидов – азалидов) применяется в клинической практике с 1991 г.
, Levy C. et al., 2002). Среди наиболее часто упоминаемых причин неудачной эрадикации БГСА пенициллинами отмечают: низкий комплайенс к 10-дневным курсам лечения, реинфекцию стрептококками от инфицированных членов семьи, разрушение пенициллина ко-патогенами ротовой полости, недостаточное проникновение антибиотика в ткань миндалин, использование контаминированных зубных щеток, протезов, явления толерантности стрептококков к пенициллину (Pichichero M. E., Casey J. R., 2007). Кроме того, как указывалось выше, БГСА при ОТФ – далеко не единственный возбудитель. Все большую роль, особенно в случаях рецидивирующих инфекций, приобретают атипичные возбудители. Общеизвестно, что золотым стандартом терапии инфекций, вызванных такими микроорганизмами, является применение макролидов. Макролиды, в том числе азитромицин, отнесены к группе альтернативных антибиотиков для лечения ОТФ. Азитромицин (первый представитель группы полусинтетических 15-членных макролидов – азалидов) применяется в клинической практике с 1991 г.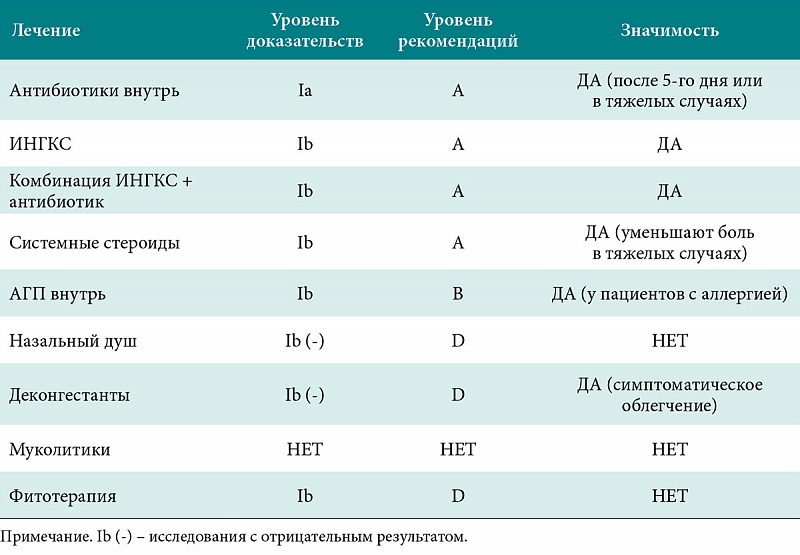 и является одним из наиболее часто назначаемых препаратов во многих странах мира. Резистентность БГСА к макролидам остается достаточно низкой – не более 8% (Козлов Р.С., Сивая О.В. и др., 2005), широкий спектр действия покрывает практически все возможные возбудители ОТФ, в том числе атипичные, а возможность коротких курсов терапии с низкой кратностью суточного приема обеспечивают высокий уровень комплайенса.
и является одним из наиболее часто назначаемых препаратов во многих странах мира. Резистентность БГСА к макролидам остается достаточно низкой – не более 8% (Козлов Р.С., Сивая О.В. и др., 2005), широкий спектр действия покрывает практически все возможные возбудители ОТФ, в том числе атипичные, а возможность коротких курсов терапии с низкой кратностью суточного приема обеспечивают высокий уровень комплайенса.
Многие авторы отмечают хорошие результаты лечения ОТФ препаратами группы фторхинолонов. Т. н. «респираторные» современные фторхинолоны (левофлоксацин) обладают высокой анти-БГСА-активностью, способны создавать высокие концентрации в тканях ротоглотки, характеризуются широчайшим спектром антимикробного действия и беспрецедентно низким уровнем резистентности возбудителей.
Безусловно, роль пенициллинов в лечении ОТФ оспаривать нельзя, но, имея перед собой пациента с аллергией на бета-лактамы, историей недавнего применения препаратов этой группы или цефалоспоринов, с подозрением на наличие атипичной микрофлоры, повторным эпизодом или рецидивом ОТФ, тяжелым течением, заведомо низким комплайенсом к длительной терапии высокой суточной кратности приема лекарственных средств, – следует рассмотреть возможность использования азитромицина или левофлоксацина по 500 мг/сут на протяжении ≥5 дней (Зубков М. Н., 2009).
Н., 2009).
Острый бактериальный риносинусит (ОБРС) – острое бактериальное воспаление слизистой оболочки носа и как минимум одной из околоносовых пазух. Это состояние входит в десятку наиболее часто встречающихся в амбулаторной практике состояний (Schied D. C., Hamm R. M., 2006). Основными возбудителями при ОБРС являются S. pneumoniae (при пневмококковой инфекции, в отличие от других патогенов, редко наблюдается спонтанное разрешение инфекционного процесса) и H. influenzae, существенно реже встречаются M. catarrhalis, S. pyogenes, S. aureus, анаэробы. Этиология рецидивирующего острого риносинусита принципиально не отличается от ОБРС, но при обострении хронического риносинусита возрастает роль стафилококковой и стрептококковой инфекции при снижении удельного веса S. pneumoniae и H. influenzae, чаще встречаются анаэробы (Peptostreptococcus spp., Veillonella spp., Prevotella spp., Fusobacterium spp.) грибы и энтеробактерии (Зубков М. Н., 2009). В Украине в 2015 г. был опубликован новый унифицированный клинический протокол по ведению пациентов с риносинуситами.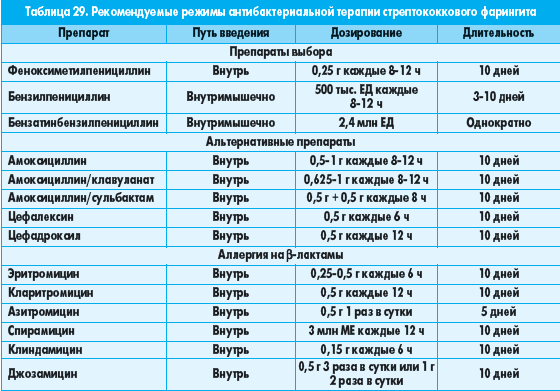 Вот цитата из раздела антибиотикотерапии ОБРС: «Препаратом первой линии является амоксициллин в сочетании с клавулановой кислотой, если это НЕ противоречит текущим рекомендациям регионального уровня по наиболее частым возбудителям в соответствии с топическим поражением органов респираторной системы и антибактериальной чувствительностью возбудителей. Макролиды рассматриваются в случаях, когда есть подтверждение этиологической роли атипичной флоры в возникновении ОБРС или имеются противопоказания для назначения защищенных аминопенициллинов. Препаратами второй линии являются левофлоксацин и цефтриаксон». На практике тяжесть течения и предшествующий анамнез применения антибиотиков далеко не всегда позволяют назначить пенициллины пациентам с ОБРС, особенно при рецидивирующих эпизодах. Высокая распространенность атипичной и анаэробной флоры у пациентов с риносинуситами, значительный уровень хронизации процесса заставляют практикующих врачей использовать азитромицин и левофлоксацин чаще, чем это видится авторам рекомендаций и руководств.
Вот цитата из раздела антибиотикотерапии ОБРС: «Препаратом первой линии является амоксициллин в сочетании с клавулановой кислотой, если это НЕ противоречит текущим рекомендациям регионального уровня по наиболее частым возбудителям в соответствии с топическим поражением органов респираторной системы и антибактериальной чувствительностью возбудителей. Макролиды рассматриваются в случаях, когда есть подтверждение этиологической роли атипичной флоры в возникновении ОБРС или имеются противопоказания для назначения защищенных аминопенициллинов. Препаратами второй линии являются левофлоксацин и цефтриаксон». На практике тяжесть течения и предшествующий анамнез применения антибиотиков далеко не всегда позволяют назначить пенициллины пациентам с ОБРС, особенно при рецидивирующих эпизодах. Высокая распространенность атипичной и анаэробной флоры у пациентов с риносинуситами, значительный уровень хронизации процесса заставляют практикующих врачей использовать азитромицин и левофлоксацин чаще, чем это видится авторам рекомендаций и руководств..gif) Важно отметить, что левофлоксацин незаменим при тяжелом течении ОБРС, в том числе при фронтитах, сфеноидитах, пансинуситах. Высокая эффективность препарата дополняется возможностью реализации ступенчатой терапии – переходом от парентеральных форм левофлоксацина к таблетированным после стабилизации состояния пациента.
Важно отметить, что левофлоксацин незаменим при тяжелом течении ОБРС, в том числе при фронтитах, сфеноидитах, пансинуситах. Высокая эффективность препарата дополняется возможностью реализации ступенчатой терапии – переходом от парентеральных форм левофлоксацина к таблетированным после стабилизации состояния пациента.
Острый средний отит – вирусная или бактериальная инфекция среднего уха, обычно возникающая как осложнение респираторных вирусных инфекций ВДП, особенно у детей. Несмотря на то что ОСО в 70% случаев обусловлен вирусами и излечивается без применения антибиотиков, он может осложняться перфорацией барабанной перепонки, хроническим СО, холестеатомой, лабиринтитом, мастоидитом, бактериальным менингитом, абсцессом мозга и др. Источником инфицирования барабанной полости служат микроорганизмы, колонизирующие глотку, поэтому ведущими бактериальными возбудителями ОСО являются S. pneumoniae и H. influenzae, определенную роль играют M. catarrhalis и S. pyogenes. Вид возбудителя влияет на характер клинических проявлений ОСО: в присутствии H. influenzae чаще отмечается конъюнктивит и редко возникает лихорадка, а пневмококковая инфекция, наоборот, сопровождается высокой температурой тела и отсутствием конъюнктивита (Зубков М. Н., 2009). Тактика применения антибиотиков при ОСО остается предметом дискуссии. Однако абсолютными показаниями к применению АБТ при ОСО остаются возраст пациентов <6 мес и тяжелые формы ОСО, сопровождающиеся выраженным болевым синдромом, температурой тела выше 38 °C и сохранением симптомов >24 ч. В указанных случаях выжидательная тактика недопустима. Рекомендации по ведению пациентов с ОСО предлагают начинать АБТ с амоксициллина. Вместе с тем антибиотиками резерва остаются азитромицин (0,25-0,5 г 1 раз/сут) и фторхинолоны (левофлоксацин). У пациентов с наличием факторов риска (сахарный диабет, патология печени, почек, сердечная недостаточность) АБТ рекомендуется начинать с левофлоксацина (Оковитый С. В., Ивкин Д. Ю., 2012).
Вид возбудителя влияет на характер клинических проявлений ОСО: в присутствии H. influenzae чаще отмечается конъюнктивит и редко возникает лихорадка, а пневмококковая инфекция, наоборот, сопровождается высокой температурой тела и отсутствием конъюнктивита (Зубков М. Н., 2009). Тактика применения антибиотиков при ОСО остается предметом дискуссии. Однако абсолютными показаниями к применению АБТ при ОСО остаются возраст пациентов <6 мес и тяжелые формы ОСО, сопровождающиеся выраженным болевым синдромом, температурой тела выше 38 °C и сохранением симптомов >24 ч. В указанных случаях выжидательная тактика недопустима. Рекомендации по ведению пациентов с ОСО предлагают начинать АБТ с амоксициллина. Вместе с тем антибиотиками резерва остаются азитромицин (0,25-0,5 г 1 раз/сут) и фторхинолоны (левофлоксацин). У пациентов с наличием факторов риска (сахарный диабет, патология печени, почек, сердечная недостаточность) АБТ рекомендуется начинать с левофлоксацина (Оковитый С. В., Ивкин Д. Ю., 2012).
Терапия инфекций ВДП не всегда укладывается в рамки стандартных протоколов. В погоне за профилактикой селекции резистентности к антибиотикам не стоит забывать о том, что наиболее эффективной мерой в этом отношении является не назначение наиболее слабых препаратов, а применение средств, достаточных для эрадикации предполагаемых возбудителей. Важно помнить, что азитромицин остается в числе первых рекомендаций в протоколах ведения пациентов с инфекциями ВДП, являясь не просто препаратом широкого спектра и достойной альтернативой амоксициллину, но средством выбора при подозрении на атипичность флоры. Левофлоксацин, благодаря уникальному спектру активности и беспрецедентно низкому уровню резистентности к нему, несмотря на ярлык «антибиотик резерва», – одно из наиболее мощных средств, обеспечивающих полную эрадикацию возбудителей инфекций ВДП, в т. ч. редких и анаэробных. Важно отметить, что и азитромицин, и левофлоксацин – современные лекарственные средства, а значит, при надлежащем использовании обеспечивают высокий уровень безопасности терапии, при этом удобные схемы лечения делают эти препараты незаменимыми в амбулаторной практике.
На фармацевтическом рынке Украины представлены отечественные препараты азитромицина Азицин и левофлоксацина Лефлок («Дарница»). Азицин выпускается в таблетках по 250 и 500 мг, Лефлок – во флаконах по 100 мл (5 мг/мл) и таблетках по 500 мг. Высокая безопасность, безупречная репутация производителя и приемлемая для украинского пациента цена позволяют рекомендовать Азицин и Лефлок для лечения инфекций ВДП при наличии соответствующих показаний.
Подготовила Александра Меркулова
СТАТТІ ЗА ТЕМОЮ Пульмонологія та оториноларингологія
20.05.2021 Пульмонологія та оториноларингологія Професору Георгію Миколайовичу Дранніку – 80 років!Редакція «Медична газета «Здоров’я України». Тематичний номер «Пульмонологія, алергологія, риноларингологія» та «Медичний журнал «Клінічна імунологія. Алергологія. Інфектологія»» щиро вітає ювіляра з нагоди його дня народження і бажає натхнення, наснаги і нових успіхів і досягнень у плідній повсякденній праці на науковій ниві….
Тематичний номер «Пульмонологія, алергологія, риноларингологія» та «Медичний журнал «Клінічна імунологія. Алергологія. Інфектологія»» щиро вітає ювіляра з нагоди його дня народження і бажає натхнення, наснаги і нових успіхів і досягнень у плідній повсякденній праці на науковій ниві….
Минув рік з оголошення масового локдауну в Україні, і за цей час пандемія COVID‑19 внесла суттєві зміни в життя кожної людини і систему охорони здоров’я. Упродовж року медична спільнота перебувала в пошуках найбільш оптимальних і ефективних шляхів подолання пандемії. 12-13 березня 2021 року відбувся один із наймасштабніших інформаційних медичних онлайн-заходів – ІІ Міжнародний конгрес «Pandemic STOP!», присвячений обговоренню найважливіших питань ведення хворих на COVID‑19 в амбулаторних і стаціонарних умовах, проблем вакцинації, правового захисту лікаря під час пандемії тощо. Провідні закордонні і вітчизняні експерти галузі поділилися з учасниками заходу найактуальнішою інформацією і власним досвідом щодо клінічних аспектів діагностики й лікування коронавірусної інфекції.
…
Упродовж року медична спільнота перебувала в пошуках найбільш оптимальних і ефективних шляхів подолання пандемії. 12-13 березня 2021 року відбувся один із наймасштабніших інформаційних медичних онлайн-заходів – ІІ Міжнародний конгрес «Pandemic STOP!», присвячений обговоренню найважливіших питань ведення хворих на COVID‑19 в амбулаторних і стаціонарних умовах, проблем вакцинації, правового захисту лікаря під час пандемії тощо. Провідні закордонні і вітчизняні експерти галузі поділилися з учасниками заходу найактуальнішою інформацією і власним досвідом щодо клінічних аспектів діагностики й лікування коронавірусної інфекції.
…
Виявлення SARS-CoV‑2 у слині пацієнтів, хворих на коронавірусну хворобу (COVID‑19), зробило цю біологічну рідину значущою з точки зору діагностики і передачі інфекції. Як результат, з огляду на ризик потенційної передачі вірусу через краплі та аерозолі, стоматологічні клініки стали вважатися небезпечним середовищем для медичного персоналу і пацієнтів. Для запобігання перехресному зараженню під час проведення стоматологічних процедур було запропоновано проводити попередню обробку (полоскання) ротової порожнини розчинами, що містять окисники, зокрема 1% перекис водню і 0,2% повідон-йод. Цей протокол, із невеликими змінами, був прийнятий однією з провідних професійних асоціацій світу – Американською стоматологічною асоціацією (ADA, 2020). Згодом перед лікарями постало питання – якщо антисептичний розчин для полоскання ротової порожнини продемонстрував віруліцидну активність, навіщо обмежувати його застосування умовами стоматологічної клініки, чому б не розпочати рутинне використання цього антисептика для запобігання передачі коронавірусу в популяції?
…
Як результат, з огляду на ризик потенційної передачі вірусу через краплі та аерозолі, стоматологічні клініки стали вважатися небезпечним середовищем для медичного персоналу і пацієнтів. Для запобігання перехресному зараженню під час проведення стоматологічних процедур було запропоновано проводити попередню обробку (полоскання) ротової порожнини розчинами, що містять окисники, зокрема 1% перекис водню і 0,2% повідон-йод. Цей протокол, із невеликими змінами, був прийнятий однією з провідних професійних асоціацій світу – Американською стоматологічною асоціацією (ADA, 2020). Згодом перед лікарями постало питання – якщо антисептичний розчин для полоскання ротової порожнини продемонстрував віруліцидну активність, навіщо обмежувати його застосування умовами стоматологічної клініки, чому б не розпочати рутинне використання цього антисептика для запобігання передачі коронавірусу в популяції?
…
 05.2021
Пульмонологія та оториноларингологія COVID‑19: особливості ураження легень і причини пошкодження нирок
05.2021
Пульмонологія та оториноларингологія COVID‑19: особливості ураження легень і причини пошкодження нирокМетою роботи був аналіз особливостей ураження легень у зіставленні з патогістологічними відомостями про пошкодження нирок при COVID‑19 зі спробою знайти об’єктивні причини зазначеної патології. …
Антибиотики ОАО «Киевмедпрепарат» | Еженедельник АПТЕКА
|
|
— Поскольку воспалительные заболевания верхних дыхательных путей по распространенности занимают первое место в структуре ЛОР-патологии, неудивительно, что они являются одним из наиболее частых показаний для назначения антибиотиков. По данным зарубежной литературы (R. Gonzales et at., 1997), заболевания верхних дыхательных путей составляют 31% всех назначений антибиотиков.
По данным зарубежной литературы (R. Gonzales et at., 1997), заболевания верхних дыхательных путей составляют 31% всех назначений антибиотиков.
При выборе антибиотиков большое значение имеют видовой состав микроорганизмов, их восприимчивость к применяемым лекарственным средствам. Чаще всего основными бактериальными возбудителями острых инфекций в оториноларингологии являются пневмококк (Streptococcus pneumoniae) и гемофильная палочка (Haemophilis influenzae). Гораздо реже выделяют моракселл (М. catarrhalis), b-гемолитические стрептококки группы А (S. pyogenes) и др. В последнее время появились сообщения о выделении Chlamydia pneumoniae.
— Каковы тенденции развития современной антибиотикотерапии?
— Предпочтение следует отдавать препаратам с широким спектром антимикробного действия и доказанной клинической эффективностью, так как возросла частота выделения антибиотикорезистентных штаммов микроорганизмов, обусловливающих трудности лечения больных отоларингологического профиля. К примеру, развитие устойчивости к аминогликозидам способствовало внедрению новых, более эффективных, но и более дорогих аминогликозидов. Продуцирование b-лактамаз стафилококками как средство защиты микроорганизма от воздействия антибиотика привело к снижению частоты назначения незащищенных пенициллинов и цефалоспоринов I поколения. В свою очередь, это способствовало внедрению цефалоспоринов II и III поколения — цефуроксима, цефотаксима, цефтриаксона и др., а также защищенных ингибиторами b-лактамаз пенициллинов, (например, ампициллин/сульбактам или амоксициллин/клавуланат натрия).
К примеру, развитие устойчивости к аминогликозидам способствовало внедрению новых, более эффективных, но и более дорогих аминогликозидов. Продуцирование b-лактамаз стафилококками как средство защиты микроорганизма от воздействия антибиотика привело к снижению частоты назначения незащищенных пенициллинов и цефалоспоринов I поколения. В свою очередь, это способствовало внедрению цефалоспоринов II и III поколения — цефуроксима, цефотаксима, цефтриаксона и др., а также защищенных ингибиторами b-лактамаз пенициллинов, (например, ампициллин/сульбактам или амоксициллин/клавуланат натрия).
На современном этапе при разработке новых антибиотиков уделяют внимание повышению их антибактериальной активности, снижению токсичности, а также улучшению комплаентности. Разработаны антибиотики «once daily» — препараты, которые достаточно принимать один раз в день. В настоящее время терапевтический эффект обеспечивается приемом, например, азитромицина в течение 3 суток, а такой антибиотик, как ЦЕФТРИАКСОН-КМП, достаточно вводить всего 1 раз в сутки внутримышечно.
— Какова стратегия антибактериальной терапии в оториноларингологии?
— В основе антибактериальной терапии всегда лежит эмпирический выбор. Однако при этом надо помнить, что эмпирическая терапия должна базироваться на сведениях, полученных в проспективных исследованиях (Страчунский Л.С. и соавт., 1997), и переходить на целенаправленную этиотропную терапию после выделения чувствительного к антибиотику штамма бактерии. Планируя эмпирическую антибиотикотерапию, врачу необходимо учитывать следующее:
Какой наиболее вероятный возбудитель мог вызвать данное заболевание?
Эффективность каких антибиотиков доказана в клинических исследованиях?
Какова наиболее вероятная чувствительность предполагаемого возбудителя к этим антибиотикам?
Какие имеются локальные данные о его чувствительности?
Например, в настоящее время в этиологии острых синуситов ведущую роль играют такие возбудители, как S. pneumoniae, Н. influenzae, Moraxella catarrhalis, стрептококки группы А, анаэробы, вирусы, реже S. aureus. До недавнего времени для лечения гнойных инфекций полости носа и околоносовых пазух (абсцесс носовой перегородки, острые синуситы) у взрослых традиционно использовали противомикробные средства для перорального применения: амоксициллин (в СНГ — ампициллин), доксициклин, ко-тримоксазол. Однако такой выбор в современных условиях не всегда может привести к хорошим результатам. Это связано как с повышением устойчивости микрофлоры к этим препаратам, так и, в случае ко-тримоксазола, с недостаточной безопасностью.
pneumoniae, Н. influenzae, Moraxella catarrhalis, стрептококки группы А, анаэробы, вирусы, реже S. aureus. До недавнего времени для лечения гнойных инфекций полости носа и околоносовых пазух (абсцесс носовой перегородки, острые синуситы) у взрослых традиционно использовали противомикробные средства для перорального применения: амоксициллин (в СНГ — ампициллин), доксициклин, ко-тримоксазол. Однако такой выбор в современных условиях не всегда может привести к хорошим результатам. Это связано как с повышением устойчивости микрофлоры к этим препаратам, так и, в случае ко-тримоксазола, с недостаточной безопасностью.
Если высеваются штаммы, выделяющие b-лактамазы, используют антибиотики, защищенные ингибиторами b-лактамаз: комбинации цефалоспоринов II поколения или аминопенициллинов с ингибиторами b-лактамаз — сульбактамом или клавуланатом (ампициллин/сульбактам или амоксициллин/клавуланат натрия).
Примером такого подхода к лечению инфекционных заболеваний ЛОР-органов может служить проведенное на базе кафедры оториноларингологии Львовского государственного медицинского университета им. Данилы Галицкого клиническое исследование препарата АМПИСУЛЬБИН-КМП. Результаты исследования свидетельствуют о высокой терапевтической эффективности этого препарата в лечении больных с острым синуситом.
Данилы Галицкого клиническое исследование препарата АМПИСУЛЬБИН-КМП. Результаты исследования свидетельствуют о высокой терапевтической эффективности этого препарата в лечении больных с острым синуситом.
— Какие антибиотики КМП вы используете в своей практике в лечении других заболеваний ЛОР-органов?
— Защищенные ингибиторами b-лактамаз аминопенициллины (АМПИСУЛЬБИН-КМП) в определенных ситуациях используют как препараты второго ряда. Так, показаниями к применению ампициллина/сульбактама являются обострение тонзиллофарингита, тонзиллофарингит, возникший на фоне лечения пенициллином, макролидами. При возникновении отогенных или риногенных внутричерепных осложнений, вызывающих менингиты и внутричерепные абсцессы мозга, следует отдавать предпочтение таким препаратам, как ЦЕФТРИАКСОН-КМП и ЦЕФОТАКСИМ-КМП, которые вводят внутривенно.
В случае возникновения инфекции ЛОР-органов, вызванной синегнойной палочкой, наиболее целесообразна терапия антипсевдомонадными цефалоспоринами III поколения (ЦЕФОПЕРАЗОН-КМП и ЦЕФТАЗИДИМ-КМП).
Часто у больных, находящихся в стационаре, вследствие назотрахеальной интубации и установки назогастрального зонда возникает синусит, вызванный энтеробактериями и псевдомонадами. В этом случае, особенно, если инфекция вызвана нозакамиальными штаммами, необходима терапия вышеназванными препаратами в комбинации с аминогликозидами III поколения (АМИКАЦИН-КМП).
— Как бы вы охарактеризовали арсенал антибактериальных препаратов, применяемых в оториноларингологии?
— Прежде всего следует отметить наличие на украинском фармацевтическом рынке современных отечественных антибиотиков. Это фторхинолон ОФЛОКСАЦИН-КМП; полусинтетический аминопенициллин — АМОКСИЛ-КМП, цефалоспорин I поколения — ЦЕФАЗОЛИН-КМП. Несомненным лидером на рынке Украины по выпуску этих и других антибактериальных препаратов является завод «Киевмедпрепарат».
Как было сказано выше, в схему лечения осложнений гнойных заболеваний ЛОР-органов мы обязательно включаем цефалоспорины III поколения (ЦЕФОТАКСИМ-КМП, ЦЕФТАЗИДИМ-КМП, ЦЕФТРИАКСОН-КМП, ЦЕФОПЕРАЗОН-КМП и др. ), которые в зависимости от степени активности в отношении синегнойной палочки (умеренная или высокая) разделяют на две подгруппы.
К первой относятся цефотаксим, цефтриаксон. По активности в отношении грамположительных кокков они уступают цефалоспоринам I поколения, хотя ЦЕФАЗОЛИН-КМП может оставаться базовым антибиотиком в лечении инфекционных заболеваний ЛОР-органов.
К группе препаратов, оказывающих выраженное действие на синегнойную палочку при внутричерепных осложнениях, относятся ЦЕФТАЗИДИМ-КМП и ЦЕФОПЕРАЗОН-КМП, которые оказывают сходное с вышеперечисленными цефалоспоринами III поколения действие на аэробные грамотрицательные палочки, несколько менее активны в отношении грамположительных кокков и высокоэффективны в лечении инфекций, вызванных синегнойной палочкой.
Таким образом, борьба с инфекциями продолжает оставаться одним из приоритетных направлений клинической оториноларингологии. И единственным путем снижения стоимости противомикробной терапии на данном этапе является назначение антибиотиков строго по показаниям, учитывая преимущества препаратов отечественного производства.
Несмотря на кажущееся многообразие и даже избыток антибиотиков в медицинской практике, ЛОР-врачи, как и врачи других специальностей, все же испытывают недостаток в лекарственных средствах, которые были бы эффективны, доступны по цене и при этом соответствовали бы нормам и схемам назначения, которыми пользуются наши коллеги в Европе и мире. Многие назначаемые сегодня в Украине антибиотики, доставшиеся нам со времен СССР, но не применяемые во всем мире, продолжают оставаться популярными.
В арсенале отечественных специалистов мало антибиотиков, выпускаемых одновременно в инъекционной и пероральной форме. А это лишает врача возможности назначать препарат ступенчато — переходя с инъекций на таблетки, экономя тем самым деньги пациентов.
Хочется, чтобы завод «Киевмедпрепарат» не утрачивал своей популярности у практикующих врачей и выпускал как уже известные препараты, так и новые. Перефразируя старый лозунг, хотелось бы пожелать: больше антибиотиков хороших и разных!
|
— В большинстве случаев хирургическая патология органов брюшной полости вызвана преимущественно грамотрицательной микрофлорой, что обусловлено микробным спектром кишечного содержимого и попаданием его в брюшную полость. Наиболее тяжелыми проявлениями абдоминальной инфекции являются гнойный панкреонекроз, перитонит, одиночные и множественные абсцессы брюшной полости, которые объединяют общим термином «абдоминальный сепсис». Значительная роль в лечении этой патологии отводится антибактериальной химиотерапии.
Поскольку в ургентной хирургии до сих пор не внедрены экспресс-методы определения чувствительности микрофлоры, выделенной при вскрытии очагов абдоминальной инфекции, на первый план выступают препараты, воздействующие на основной спектр патологических микроорганизмов, вызвавших данное патологическое состояние.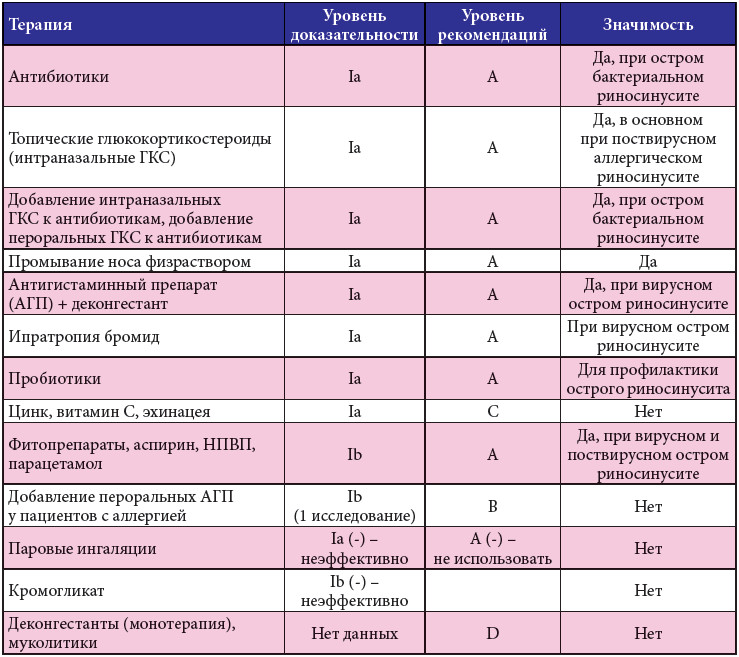 Среди препаратов, назначаемых эмпирически, преимущественное положение занимают цефалоспорины, фторхинолоны и аминогликозиды.
Среди препаратов, назначаемых эмпирически, преимущественное положение занимают цефалоспорины, фторхинолоны и аминогликозиды.
Обычной схемой, по данным литературы, является комбинация цефазолина с гентамицином, широкое применение которой привело к появлению резистентных штаммов и снижению эффективности этой комбинации. В то же время достаточно высокая стоимость современных аминогликозидов и цефалоспоринов III поколения зарубежного производства ограничивала их применение в клинической практике. Поэтому появление на фармацевтическом рынке Украины ЦЕФТАЗИДИМА-КМП (цефалоспорин III поколения) и АМИКАЦИНА-КМП (аминогликозидный антибиотик) было с радостью воспринято хирургами.
Назначаемый как в комбинации, так и в качестве монотерапии, ЦЕФТАЗИДИМ-КМП зарекомендовал себя как эффективное средство для антибактериальной терапии абдоминального сепсиса. Назначение ЦЕФТАЗИДИМА-КМП и АМИКАЦИНА-КМП в послеоперационный период позволяет улучшить результаты лечения гнойных осложнений и сократить количество повторных оперативных вмешательств.
— Проводились ли в хирургическом отделении Киевской областной клинической больницы клинические исследования других антибиотиков, выпускаемых ОАО «Киевмедпрепарат»?
— Было проведено исследование по изучению эффективности ЦЕФОПЕРАЗОНА-КМП в лечении пациентов, оперированных по поводу желчнокаменной болезни, осложненной холедохолитиазом и холангитом, в котором принимали участие 30 больных. В одной группе (18 пациентов) проводили монотерапию цефоперазоном-КМП, в другой (12 пациентов) — в комбинации с метронидазолом. Использовали общеклинические методы обследования больных в предоперационный и послеоперационный период, бактериологическое исследование желчи, полученной во время операции. Выделенные микроорганизмы идентифицировали по общепринятым микробиологическим схемам.
ЦЕФОПЕРАЗОН-КМП продемонстрировал высокую клиническую эффективность — выздоровление отмечено у 97% больных, отсутствие клинического эффекта — у 3%. Высокую антибактериальную активность ЦЕФОПЕРАЗОН-КМП проявлял как в комплексе с метронидазолом, так и при монотерапии — эрадикация возбудителя отмечена у 29 больных. Что касается периода выздоровления и разницы в сроках проведения антибактериальной терапии между пациентами первой и второй групп, то достоверных различий не выявлено.
Высокую антибактериальную активность ЦЕФОПЕРАЗОН-КМП проявлял как в комплексе с метронидазолом, так и при монотерапии — эрадикация возбудителя отмечена у 29 больных. Что касается периода выздоровления и разницы в сроках проведения антибактериальной терапии между пациентами первой и второй групп, то достоверных различий не выявлено.
Это позволяет сделать следующий вывод: ЦЕФОПЕРАЗОН-КМП проявляет высокую антибактериальную активность в отношении большинства возбудителей хирургической инфекции желчных протоков и может быть использован в качестве базисной монотерапии у оперированных больных с осложненной желчнокаменной болезнью.
Пресс-служба «Еженедельника АПТЕКА»
Фото Евгения Кривши
*Продолжение. Начало см. «Еженедельник АПТЕКА», № 49 (370) от 16.12.02, № 2 (373) от 20.01.03.
Пять причин назначить макролиды при заболеваниях лор-органов | ШИЛЕНКОВА
1. Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. Смоленск: МАКМАХ, 2002. 350 с. / Practical guidance on anti-infective chemotherapy. Ed. by Strachunskiy L.S., Belousov Y.B., Kozlov S.N. Smolensk: IACMAC, 2002. 350 p.
Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. Смоленск: МАКМАХ, 2002. 350 с. / Practical guidance on anti-infective chemotherapy. Ed. by Strachunskiy L.S., Belousov Y.B., Kozlov S.N. Smolensk: IACMAC, 2002. 350 p.
2. Marriott HM, Mitchell TJ, Dockrell DH. Pneumolysin: A double-edged sword during the host-pathogen interaction. Current Molecular Medicine, 2008, 8: 497-509.
3. Torumkuney D, Gur D, Soyletir G, Gurler N, Aktas Z, Sener B, Tunger A, Bayramoglu G, Koksal I, Yalcin AN, Tanriver Y, Morrissey I, Barker K. Results from the Survey of Antibiotic Resistance (SOAR) 2002-09 in Turkey. J. Antimicrob. Chemother., 2016, 71(1): 185-191. doi: 10.1093/jac/dkw067.
4. Uncu H, Colakoğlu S, Turunç T, Demiroğlu YZ, Arslan H. In vitro resistance rates of Streptococcus pneumoniae and Haemophilus influenzae clinical isolates to the antibiotics used in therapy. Mikrobiyol Bul., 2007, 41(3): 441-446.
In vitro resistance rates of Streptococcus pneumoniae and Haemophilus influenzae clinical isolates to the antibiotics used in therapy. Mikrobiyol Bul., 2007, 41(3): 441-446.
5. Zientara M, Rudy M, Nowakowska M, Martirosian G. Nosopharyngeal microflora in ambulatory treated children and adults with upper respiratory tract infections. Med. Dosw. Mikrobiol., 2006, 58(3): 239-245.
6. Kaneko Y, Yanagihara K, Seki M, Kuroki M, Miyazaki Y, Hirakata Y, Mukae H, Tomono K, Kadota J, Kohno S. Clarithromycin inhibits overproduction of muc5ac core protein in murine model of diffuse panbronchiolitis. Am. J. Physiol. Lung Cell Mol. Physiol., 2003, 285(4): 847-853.
7. Morikawa K, Zhang J, Nonaka M, Morikawa S. Modulatory effect of macrolide antibiotics on the Th2- and Th3-type cytokine production. Int. J. of Antimicrobial Agents, 2002, 19(1): 53-59.
Int. J. of Antimicrobial Agents, 2002, 19(1): 53-59.
8. Morikawa K, Watabe H, Araaka A, Morikawa S. Modulatory effect of antibiotics on c cytokine production by human monocytes in vitro. Antimicrob. Agents and Chemother., 1996, 40(6): 1366-1370.
9. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. Смоленск, «Русич». 1998: 304. / Strachunskiy L.S., Kozlov S.N. Macrolides in modern clinical practice. Smolensk, «Rusich». 1998: 304.
10. Gotfried MH. Clarithromycin (Biaxin) extendedrelease tablet: a therapeutic review. Expert Rev. Anti-Infect. Ther., 2003, 1(1): 9-20.
11. Гаращенко Т.И. Макролиды в терапии острого тонзиллита и его осложнений у детей. РМЖ, 2001, 19: 812-816. / Garaschenko T.I. Macrolides in the treatment of acute tonsillitis and its complications in children. RMZ, 2001, 19: 812-816.
/ Garaschenko T.I. Macrolides in the treatment of acute tonsillitis and its complications in children. RMZ, 2001, 19: 812-816.
12. Cillóniz C, Ardanuy C, Vila J, Torres A. What is the clinical relevance of drug-resistant pneumococcus? Curr. Opin. Pulm. Med., 2016, 22(3): 227-234. doi: 10.1097/MCP.0000000000000262.
13. Лопатин А.С., Свистушкин В.М. Острый риносинусит: этиология, патогенез, диагностика и принципы лечения. Клинические рекомендации. М., 2009: 25. / Lopatin A.S., Svistushkin A.M. Acute rhinosinusitis: etiology, pathogenesis, diagnosis and treatment approach. Clinical guidelines. M., 2009: 25.
14. Почуева Т.В., Ямпольская Е.Е. Особенности микробиологического статуса небных миндалин у детей с сопутствующим кариесом. Folia otorhinolaryngologiae et Pathologiae Respiratoriaea, 2014, 20(3): 104-110. / Pochueva T.V., Yampol’skaya E.E. The specific microbiological status of the tonsils in children with concomitant caries. Folia otorhinolaryngologiae et Pathologiae Respiratoriaea, 2014, 20 (3): 104-110.
/ Pochueva T.V., Yampol’skaya E.E. The specific microbiological status of the tonsils in children with concomitant caries. Folia otorhinolaryngologiae et Pathologiae Respiratoriaea, 2014, 20 (3): 104-110.
15. Bennet JE, Dolin R, Blaser MJ. Principles and practice of infectious diseases. Book chapter Pharyngitis. 2014: 753-759.
16. Линьков В.И., Цурикова Г.П., Чурилина И.Е. и др. Значение хламидийной инфекции в развитии хронических воспалительных заболеваний глотки. Новости отоларингологии и логопатологии, 1995, 3(4): 146. / Lin’kov V.I., Tsurikova G.P., Churilina I.E. et al. The role of chlamydial infection in the development of chronic inflammatory diseases of the pharynx. Novosti Otolaringologii i Logopatologii, 1995, 3(4): 146.
17. Piacentini GL, Peroni DG, Blasi F, Pescollderungg L, Goller P, Gallmetzer L, Drago L, Bodini A, Boner AL. Atypical bacteria in adenoids and tonsils of children requiring adenotonsillectomy. Acta Otolaryngol, 2010, 130(5): 620-625.
Atypical bacteria in adenoids and tonsils of children requiring adenotonsillectomy. Acta Otolaryngol, 2010, 130(5): 620-625.
18. Hoa M, Tomovic S, Nistico L, Hall-Stoodley L, Stoodley P, Sachdeva L, Berk R, Coticchia JM. Identification of adenoid biofilms with middle ear pathogens in otitis-prone children utilizing SEM and FIS. Int. J. of Pediatric Otorhinolaryngology, 2009, 73: 1242-1248. doi: 10.1016/j.ijporl.2009.05.016.
19. Calò L, Passàli GC, Galli J, Fadda G, Paludetti G. Role of biofilms in chronic inflammatory diseases of the upper airways. Adv. Otorhino laryngol., 2011, 72: 93-96. doi: 10.1159/000324622.
20. Винникова Н.В., Трофименко С.Л., Дударев И.В. К патогенезу хронического полипозного риносинусита. Российская оториноларинго логия. Приложение, 2016: 42- 44.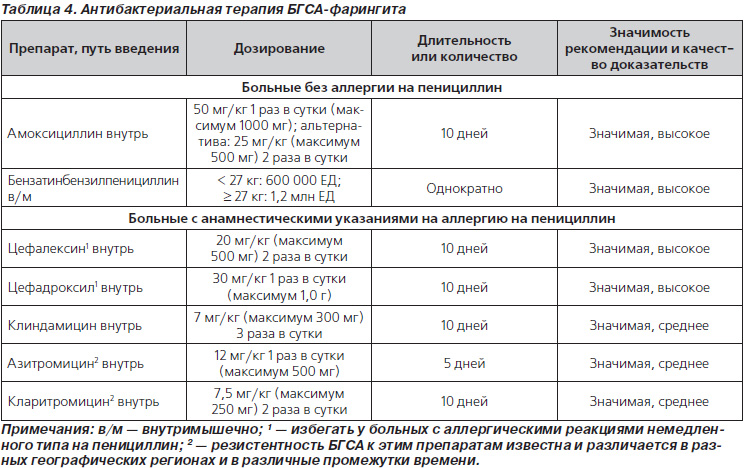 / Vinnikova N.V., Trofimenko S.L., Dudarev I.V. The pathogenesis of chronic polypoid rhinosinusitis. Rossiyskaya Otorinolaringologiya. Supplement, 2016: 42-44.
/ Vinnikova N.V., Trofimenko S.L., Dudarev I.V. The pathogenesis of chronic polypoid rhinosinusitis. Rossiyskaya Otorinolaringologiya. Supplement, 2016: 42-44.
21. Kaplan EL, Chhatwal GS, Rohde M. Reduced ability of penicillin to eradicate ingested group A streptococci from epithelial cells: clinical and pathogenetic implications. Clin. Infect. Dis., 2006, 43(11): 1398-1406.
22. Овчинников Ю.М. Отчет об эффективности и безопасности использования препарата Азитрал (Азитромицин) в лечении больных с острым и обострением хронического гнойного риносинусита и острого среднего отита. 2005:
23. / Ovchinnikov Y.M. Report on the effectiveness and safety of Azitral (Azithromycin) in the treatment of patients with acute and exacerbated chronic suppurative rhinosinusitis and acute otitis media. 2005: 23.
2005: 23.
24. Морозова С.В., Мельник С.М. Применение препарата Азитрал для лечения хронического риносинусита в практике оториноларинголога. РМЖ, 2011, 31: 1976- 979. / Morozova S.V., Mel’nik S.M. Use of Azitral for the treatment of chronic rhinosinusitis in ENT practice. RMZ, 2011, 31: 1976-1979.
25. Miyamoto D, Hasegawa S, Sriwilaijaroen N, Yingsakmongkon S, Hiramatsu H, Takahashi T, Hidari K, Guo CT, Sakano Y, Suzuki T, Suzuki Y. Clarithromycin inhibits progeny virus production from human influenza virus-infected host cells. Biol. Pharm. Bull., 2008, 31(2): 217-222.
БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ ЛОР-ОРГАНОВ: ДЕЛИКАТНАЯ ТЕРАПИЯ | Свистушкин
1. Fokkens WJ et al. European Position Paper on Rhinosinusitis and Nasal Polyps. Rhinology, 2012, 50(Suppl. 23): 1-298.
Rhinology, 2012, 50(Suppl. 23): 1-298.
2. Rosenfeld RM, Piccirillo JF, Chandrasekhar SS, Brook I, MSc Clinical Practice Guideline (Update): Adult Sinusitis. Otolaryngology – Head and Neck Surgery, 152(2S).
3. Barbara J. Turner MD, MSED, Sankey Williams, MD Acute sinusitis. Annals of internal medicine, 2010.
4. Пальчун В.Т., Крюков А.И. Оториноларингология: Руководство для врачей. М., 2014. 616с.
5. Свистушкин В.М., Гринев И.А., Стецюк О.У., Андреева И.В. Рекомендации по ведению взрослых пациентов с острым риносинуситом: достижим ли консенсус? Лечащий врач, 2012, 11: 90-96.
6. Нестерова И.В. Проблемы лечения вирусно-бактериальных респираторных инфекций у «часто и длительно болеющих» иммунокомпрометированных детей..gif) Лечащий врач, 2009, 6: 26-29.
Лечащий врач, 2009, 6: 26-29.
7. Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск, МАКМАХ, 2007. 464 с.
8. McFarland LV. Risk factor for antibiotic-associated diarrhea. Ann. Med. Intern. (Paris), 1998, 149(9): 5: 261-266.
9. Стецюк О.У., Козлов Р.С. Безопасность и переносимость антибиотиков в амбулаторной практике. Клиническая микробиология и антимикробная химиотерапия, 2011, 1: 67-84.
10. Meehan CJ, Beiko RG. A phylogenomic view of ecological specialization in the Lachnospiraceae, a family of digestive tract-associated bacteria. Genome BiolEvol, 2014 Mar, 6(3): 703-13.
11. Louis P, Hold GL, Flint HJ. The gut microbiota, bacterial metabolites and colorectal cancer. Nat RevMicrobiol, 2014 Oct, 12(10): 661-72.
Louis P, Hold GL, Flint HJ. The gut microbiota, bacterial metabolites and colorectal cancer. Nat RevMicrobiol, 2014 Oct, 12(10): 661-72.
12. Gut microbiome is linked to immune cell phenotype in multiple sclerosis. 2014 Joint ACTRIMS-ECTRIMS Meeting, Poster 616.
13. Reeves AE, Koenigsknecht MJ, Bergin IL, Young VB. Suppression of Clostridium difficile in the Gastrointestinal Tracts of Germfree Mice Inoculated with a Murine Isolate From the Family Lachnospiraceae. InfectionandImmunity, 2012, 80(11): 3786-3794.
14. Gratadoux JJ, Blugeon S, Bridonneau C, Furet JP, Corthier G et al. Faecalibacteriumprausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. ProcNatlAcadSci U S A, 2008 Oct 28, 105(43): 16731-6.
15. Furet JP, Kong LC, Tap J et al. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss: links with metabolic and low-grade inflammation markers. Diabetes, 2010, 59: 3049-57.
16. Zhang X, Shen D, Fang Z et al. Human gut microbiota changes reveal the progression of glucose intolerance. PLoS One, 2013, 8: e71108.
17. Tilg H, Moschen AR. Microbiota and diabetes: an evolving relationship. Gut, 2014 Sep, 63(9): 1513-21.
18. Wong VW, Tse CH, Lam TT, Wong GL, Chim AM, Chu WC, Yeung DK, Law PT, Kwan HS, Yu J, Sung JJ, Chan HL. Molecular characterization of the fecal microbiota in patients with nonalcoholic steatohepatitis–a longitudinal study. PLoS One, 2013 Apr 25, 8(4): e62885.
PLoS One, 2013 Apr 25, 8(4): e62885.
19. Salminen S, Deighton M. Lactic acid bacteria in the gut in normal and disordered states. Dig Dis, 1992, 10(4): 227-38.
20. McFarland LV. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am. J. Gastroenterol., 2006, 101(4): 812-822.
21. Wistrom J, Norrby SR, Myhre EB et al. Frequency of antibioticassociateddiarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J. Antimicrob. Chemother., 2001, 47(1): 43-50.
22. Makins R, Ballinger A. Gastrointestinal side effects of drugs. Expert Opin. Drug Saf., 2003, 2(4): 421-429.
23. Мухина Ю.Г. Диагностика и коррекция дисбактериоза у детей. РМЖ, 1999, 7(11): 487-494.
Мухина Ю.Г. Диагностика и коррекция дисбактериоза у детей. РМЖ, 1999, 7(11): 487-494.
24. Парфенов А.И., Ручкина И.Н., Осипов Г.А. Антибиотико-ассоциированная диарея и псевдомембранозный колит. Consilium Medicum, 2004, 6: 12-17.
25. Бельмер С.В. Антибиотик-ассоциированный дисбактериоз кишечника. РМЖ, 2004, 12(3): 148-151.
26. Шевяков М.А., Колб З.К., Савельева О.Г., Борзова Ю.В. Интестинальный дисбиоз у пациентов с синдромом раздраженного кишечника. Успехи медицинской микологии. Под общ. ред. Ю.В. Сергеева. Материалы II Всероссийского конгресса по медицинской микологии, 2014
27. Зрячкин Н.И. Новый подход к классификации пребиотиков, пробиотиков и синбиотиков. Фарматека, 2007, 2(137): 58-61.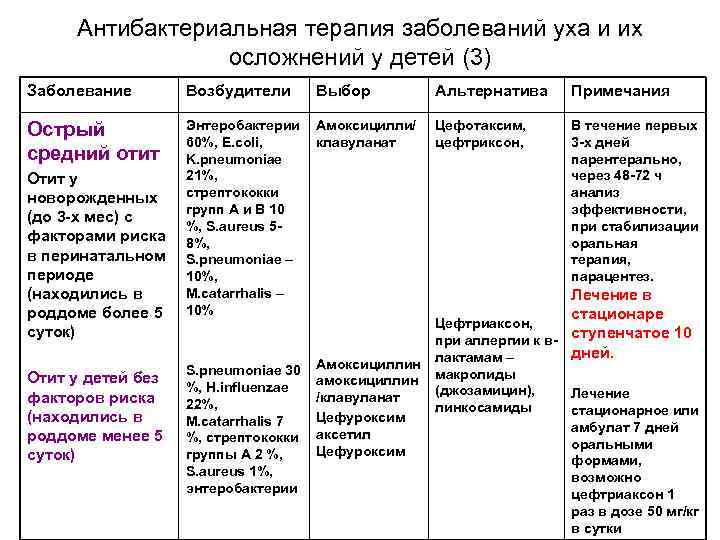
28. Salminen S, von Wright A, Morelli L et al. Demonstration of safety of probiotics – a review. Int J FoodMicrobiol, 1998, 44: 93.
29. Федоров И.Г. и др. Клинические аспекты применения лактулозы в практике гастроэнтеролога. Трудный пациент, 2012, 4.
30. Буторова Л.И., Калинин А.В. Значение лактулозы в регуляции кишечной микрофлоры. Клинические перспективы гастроэнтерологии и гепатологии, 2002, 6: 21-26.
31. http://ecoantibiotic.ru/eco.php.
32. Benno Y, Sawada K, Mitsuoka T. The intestinal microflora of infants: composition of fecal flora in breast-fed and bottle-fed infants. Microbiol. Immunol. , 1984, 28(9): 975-986.
, 1984, 28(9): 975-986.
33. Янов Ю.К., Коноплев О.И., Науменко Н.Н., Антушева И.А. Антибиотики с повышенным профилем безопасности для кишечной микрофлоры: новые перспективы антибиотикотерапии острых бактериальных риносинуситов. Рос. оторинолар., 2010, 3(46): 181-194.
34. Гаращенко Т.И., Левитский М.В., Бойкова Н.Э. и др. Возможности безопасной антибиотикотерапии при острых средних отитах у детей. Детская оториноларингология, 2013, 2: 54-56.
35. Свистушкин В.М., Никифорова Г.Н., Шевчик Е.А., Дедова М.Г. Использование инновационных форм антибиотиков в лечении воспалительных заболеваний околоносовых пазух. Лечащий врач, 2014, 4.
деликатная терапия – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
10. 21518/2079-701X-2017-8-58-63
21518/2079-701X-2017-8-58-63
В.М. СВИСТУШКИН, д.м.н., профессор, Г.Н. НИКИФОРОВА, д.м.н., профессор, Е.И. ПЕТРОВА
Первый Московский государственный медицинский университет им. И.М. Сеченова
БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ ЛОР-ОРГАНОВ:
ДЕЛИКАТНАЯ ТЕРАПИЯ
Несмотря на то что в подавляющем большинстве случаев острые воспалительные заболевания ЛОР-органов имеют вирусную природу, присоединение бактериальных агентов значительно отягощает течение инфекционного процесса, ведет к развитию рецидивирующих и хронических форм. Подобные клинические случаи требуют проведения адекватной, зачастую продолжительной, системной этиотропной терапии. В практике оториноларинголога широко используются антибактериальные препараты следующих групп — р-лактамы (пенициллины и цефалоспорины), макролиды, респираторные фторхинолоны.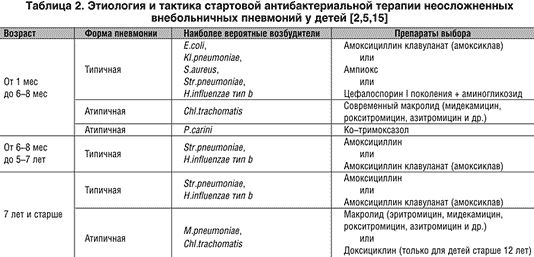 Частота нежелательных явлений, в т. ч. и со стороны желудочно-кишечного тракта при использовании препаратов всех вышеперечисленных групп достаточно велика, чтобы ей пренебрегать. В статье подробно рассматриваются вопросы нарушения нормального биоценоза кишечной микрофлоры при этиотропном лечении бактериальных инфекций ЛОР-органов и существующие пути решения данной проблемы. Широкие перспективы в этом плане имеют так называемые экоантибиотики — новая группа антибактериальных препаратов, содержащих традиционный антибиотик и пребиотик как вспомогательное вещество. Ключевые слова: бактериальный риносинусит, клинические рекомендации, рекомендательные документы, этиотропная терапия, экоантибиотики, антибиотикорезистентность, пребиотики, антибиотик-ассоциированная диарея, лактулоза.
Частота нежелательных явлений, в т. ч. и со стороны желудочно-кишечного тракта при использовании препаратов всех вышеперечисленных групп достаточно велика, чтобы ей пренебрегать. В статье подробно рассматриваются вопросы нарушения нормального биоценоза кишечной микрофлоры при этиотропном лечении бактериальных инфекций ЛОР-органов и существующие пути решения данной проблемы. Широкие перспективы в этом плане имеют так называемые экоантибиотики — новая группа антибактериальных препаратов, содержащих традиционный антибиотик и пребиотик как вспомогательное вещество. Ключевые слова: бактериальный риносинусит, клинические рекомендации, рекомендательные документы, этиотропная терапия, экоантибиотики, антибиотикорезистентность, пребиотики, антибиотик-ассоциированная диарея, лактулоза.
V.M. SVISTUSHKIN, MD, Prof., G.N. NIKIFOROVA, MD, Prof., E.I. PETROVA
First Moscow State Medical University named after I. M. Sechenov
M. Sechenov
BACTERIAL INFECTIONS OF THE EAR, NOSE AND THROAT: A DELICATE TREATMENT
Although the majority of acute inflammatory ENT pathologies are known to be caused by viruses alone, their association with bacteria tend to make the infection severe, persistent, and recurrent. In these caseslong-term systemic antibiotics are required. ENT-specialists use beta-lactameantibiotics (penicilline/cephalosporine), macrolides, respiratoryfluoroquinolones. Adverse drug reactions for these medications are very common, and gastrointestinal tract is particularly vulnerable.
The article gives a detailed account ofnormal gut mictobiota changesafter systemic use of antibiotics forbacterial ENT-infections and consideration to problem solving. Ecoantibiotics are the new a new group of antibacterial drugs containing traditional antibiotic and prebiotic as adjuvant, that give us future prospect for delicate and safe antibiotic therapy.
Keywords: bacterial rhinosinusitis, treatment guidelines, reference documents, etiotropic treatment, antibiotic resistance, ecoantibiotics, prebiotics, antibiotic-assotiated diarrhea, lactulose.
Существенную долю в структуре патологии ЛОР-органов составляют острые и хронические инфекционные заболевания — риносинуситы, тонзилло-фарингиты, ларингиты и отиты. Не являясь, как правило, состояниями, непосредственно приводящими к летальному исходу, они существенно влияют на качество жизни больных, ведут к временной утрате трудоспособности и обуславливают значительный экономический ущерб государственному здравоохранению и самим пациентам.
Проблема адекватной антибактериальной терапии больных с патологией ЛОР-органов не теряет актуальности. Известно, что подавляющее большинство случаев острых инфекционных заболеваний верхних отделов дыхательных путей и уха (до 95%) обусловлены вирусной инвазией, в основном протекают в нетяжелой форме и не требуют назначения системной этиотропной терапии [1, 2]. Однако в ряде случаев вирусная природа патологического процесса сменяется бактериальной — активируется сапрофитная или присоединяется патогенная микрофлора, усугубляются клинические проявления и заболевание принимает более тяжелое и затяжное течение [2, 3]. Существует также немалая группа пациентов с сопутствующими хроническими заболеваниями и анатомическими нарушениями ЛОР-
Однако в ряде случаев вирусная природа патологического процесса сменяется бактериальной — активируется сапрофитная или присоединяется патогенная микрофлора, усугубляются клинические проявления и заболевание принимает более тяжелое и затяжное течение [2, 3]. Существует также немалая группа пациентов с сопутствующими хроническими заболеваниями и анатомическими нарушениями ЛОР-
органов, у которых каждый эпизод обычной простуды с высокой вероятностью и в краткие сроки приводит к обострению имеющейся патологии, что в конечном счете требует назначения системных антибактериальных препаратов. Значительно отягощает течение острых воспалительных заболеваний респираторного тракта также наличие хронической патологии и других органов и систем [4, 5].
Учитывая вышеизложенное, вопрос о целесообразности назначения системных антибактериальных препаратов является нередким в практике оториноларинголога. Неадекватно подобранная терапия острого инфекционно-воспалительного процесса респираторного тракта приводит к затяжному течению заболевания, рецидивам, развитию осложнений и переходу в хроническую форму. Клинический, экономический и моральный ущерб неадекватной этиотропной терапии трудно переоценить [4, 5].
Неадекватно подобранная терапия острого инфекционно-воспалительного процесса респираторного тракта приводит к затяжному течению заболевания, рецидивам, развитию осложнений и переходу в хроническую форму. Клинический, экономический и моральный ущерб неадекватной этиотропной терапии трудно переоценить [4, 5].
Структуру возбудителей внебольничных острых бактериальных инфекций верхних отделов дыхательных путей и уха (за исключением тонзиллофарингитов) составляют преимущественно Streptococcus pneumoniaeu Haemophilus influenzae (40-60 и 25-40% случаев заболеваний соответственно), реже встречаются Moraxella catarrhalis (2-10%), Staphylococcus aureus (4-5%), Streptococcus pyogenes
(0-5%), атипичная флора — Chlamydia pneumoniae, Mycoplasma pneumoniae (у 7-12% пациентов), Bacteroides, Fusobacterium, анаэробы и другие микроорганизмы. В глотке основным возбудителем бактериальных инфекционных процессов является Streptococcuspyogenes. По разным оценкам, около 20% клинических случаев характеризуются бактериальными микст-инфекциями, а также бактериально-вирусными ассоциациями. У детей этиологическая значимость вирусно-бактериальных ассоциаций отмечается при 25-30% острых заболеваний респираторного тракта [6, 7].
По разным оценкам, около 20% клинических случаев характеризуются бактериальными микст-инфекциями, а также бактериально-вирусными ассоциациями. У детей этиологическая значимость вирусно-бактериальных ассоциаций отмечается при 25-30% острых заболеваний респираторного тракта [6, 7].
Из всего спектра доступных сегодня антибактериальных препаратов в ЛОР-практике для эмпирического лечения острых инфекционных заболеваний препаратом выбора является полусинтетический пенициллин — амок-сициллин, в т. ч. и в сочетании с ингибитором ß-лактамаз -клавулановой кислотой. Данные препараты обладают достаточным бактерицидным эффектом в отношении широкого спектра как грамотрицательных, так и грампо-ложительных микроорганизмов — Streptococcus pneumoniae, Haemophilus influenzae, Streptococcus pyogenes, Moraxella catarrhalis, Staphylococcus spp, Proteusmirabilis, Escheri-chiacoli, а также ряда других инфекционных агентов и хорошо переносятся. Однако, наряду с положительными свойствами, комбинация амоксициллина и клавулановой кислоты имеет высокую активность против энтерококков и анаэробов, входящих в состав нормофлоры кишечника человека [7, 8].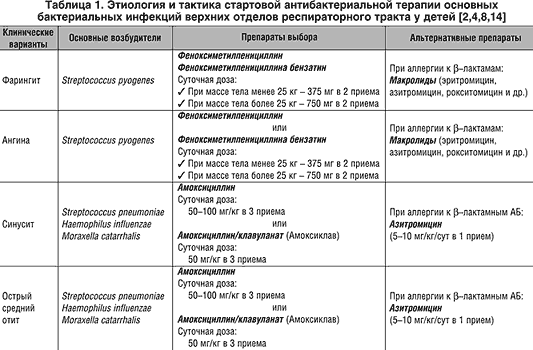 Кроме амоксициллина и других препаратов пенициллинового ряда, в практике оториноларинголога широко используются цефалоспорины II-III поколений, макролиды и респираторные фторхинолоны. К сожалению, при удовлетворительной клинической эффективности частота нежелательных побочных явлений со стороны желудочно-кишечного тракта при использовании препаратов всех вышеперечисленных групп слишком велика, чтобы ей можно было пренебрегать. Если дополнительно учитывать случаи бесконтрольного применения антибиотиков пациентами и самостоятельное изменение ими дозировок и сроков лечения, частота побочных эффектов возрастает в разы. По статистическим данным, каждый 5-й случай обращения пациентов за амбулаторной медицинской помощью связан с нежелательными лекарственными реакциями после приема антибиотиков, обусловленными как прямым токсическим действием препарата, так и угнетением нормальной микрофлоры человека [7, 9].
Кроме амоксициллина и других препаратов пенициллинового ряда, в практике оториноларинголога широко используются цефалоспорины II-III поколений, макролиды и респираторные фторхинолоны. К сожалению, при удовлетворительной клинической эффективности частота нежелательных побочных явлений со стороны желудочно-кишечного тракта при использовании препаратов всех вышеперечисленных групп слишком велика, чтобы ей можно было пренебрегать. Если дополнительно учитывать случаи бесконтрольного применения антибиотиков пациентами и самостоятельное изменение ими дозировок и сроков лечения, частота побочных эффектов возрастает в разы. По статистическим данным, каждый 5-й случай обращения пациентов за амбулаторной медицинской помощью связан с нежелательными лекарственными реакциями после приема антибиотиков, обусловленными как прямым токсическим действием препарата, так и угнетением нормальной микрофлоры человека [7, 9].
Термин «микробиота» появился в научной литературе в последние несколько лет. Микробиота определяется как совокупность генома всех бактерий, населяющих человеческий организм. Благодаря широкому внедрению современных лабораторных методов во многих клинических центрах стал доступен анализ внутриклеточных структур, таких как дезоксирибонуклеиновая кислота (ДНК), началась «новая эра» в изучении и понимании значения микрофлоры для нормальной жизнедеятельности макроорганизма. Некоторые ученые даже называют микробио-ту «отдельным органом макроорганизма», отводя ей значительную роль в регуляции физиологических процессов человека. Микробиота одного индивидуума насчитывает примерно 1014 клеток и представлена отдельными био-
Микробиота определяется как совокупность генома всех бактерий, населяющих человеческий организм. Благодаря широкому внедрению современных лабораторных методов во многих клинических центрах стал доступен анализ внутриклеточных структур, таких как дезоксирибонуклеиновая кислота (ДНК), началась «новая эра» в изучении и понимании значения микрофлоры для нормальной жизнедеятельности макроорганизма. Некоторые ученые даже называют микробио-ту «отдельным органом макроорганизма», отводя ей значительную роль в регуляции физиологических процессов человека. Микробиота одного индивидуума насчитывает примерно 1014 клеток и представлена отдельными био-
топами, преимущественно в дыхательных путях, коже и кишечнике. Для каждого биотопа характерен свой состав бактерий. Именно ЖКТ представляет собой самый обширный ареал обитания микрофлоры в организме, здесь сосредоточено 60% всех бактерий (1013-1015 КОЕ/мл). При этом до 70% микробиоты находится в толстой кишке.
Нормальная кишечная микрофлора выполняет множество жизненно важных функций и абсолютно необходима для жизнедеятельности организма, что подтверждено в ряде клинических исследований. Каждый микроорганизм, относящийся к тому или иному семейству, выполняет определенную роль в микробиоте.
Семейство Lachnospiraceae является активным производителем масляной кислоты (бутирата) [10]. Бутират играет важнейшую роль в поддержании гомеостаза и целостности кишечника человека, является источником энергии для колоноцитов, способствует защите от развития воспалительных заболеваний, аденомы и рака кишечника [11]. У страдающих рассеянных склерозом количество единиц Lachnospiraceae, обеспечивающих противовоспалительный эффект, оказалось рекордно низким [12]. Представители Lachnospiraceae способны препятствовать колонизационной резистентности C. difficile за счет поддержания пула вторичных желчных кислот. Представители данного рода рассматриваются как прямой антагонист C. Difficile. Снижение представленности Lachnospiraceae ассоциировано с риском развития рассеянного склероза, повышения колонизационной резистентности C. difficile, воспалительных заболеваний и рака кишечника [11, 13].
Представители данного рода рассматриваются как прямой антагонист C. Difficile. Снижение представленности Lachnospiraceae ассоциировано с риском развития рассеянного склероза, повышения колонизационной резистентности C. difficile, воспалительных заболеваний и рака кишечника [11, 13].
Представители семейства Clostridiaceae Faecalibacterium prausnitzii также активные производители бутирата как из пищевых волокон, так и из N-ацетилглюкозамина, входящего в состав слизистой оболочки стенки кишечника. Faecalibacterium prausnitzii также считается противовоспалительным компонентом микрофлоры, уменьшение ее представленности ассоциировано с риском развития метаболических нарушений и воспалительных заболеваний кишечника [14]. У пациентов с метаболическим синдромом, сахарным диабетом 2-го типа, ожирением доля Faecalibacterium prausnitzii достоверно снижается [15-18].
Микроорганизмы семейства Lactobacillaceae обладают способностью образовывать молочную кислоту в качестве основного продукта брожения. Молочная кислота положительно влияет на перистальтику кишечника человека, уменьшает метеоризм, также способна оказывать стимулирующее действие на секреторную деятельность слюнных желез; в ее присутствии улучшается усвоение кальция, фосфора и железа. В целом присутствие представителей данного семейства ассоциировано со здоровым состоянием ЖКТ [19].Снижение представленности семейства Lactobacillaceae ассоциировано с риском нарушения гомеостаза слизистой оболочки кишечника, повышением ее колонизации условно-патогенными микроорганизмами, нарушением ряда ферментативных процессов — синтеза и всасывания аминокислот и витаминов, нарушением нормального пищеварения — сбраживания лактозы до молочной кислоты, оказывающей антисептическое действие и трансформирующей кальций, поступающий с пищей, в усвояемый лактат.
Молочная кислота положительно влияет на перистальтику кишечника человека, уменьшает метеоризм, также способна оказывать стимулирующее действие на секреторную деятельность слюнных желез; в ее присутствии улучшается усвоение кальция, фосфора и железа. В целом присутствие представителей данного семейства ассоциировано со здоровым состоянием ЖКТ [19].Снижение представленности семейства Lactobacillaceae ассоциировано с риском нарушения гомеостаза слизистой оболочки кишечника, повышением ее колонизации условно-патогенными микроорганизмами, нарушением ряда ферментативных процессов — синтеза и всасывания аминокислот и витаминов, нарушением нормального пищеварения — сбраживания лактозы до молочной кислоты, оказывающей антисептическое действие и трансформирующей кальций, поступающий с пищей, в усвояемый лактат.
Вышеперечисленные и ряд других семейств микро-биоты кишечника человека (Christensenellaceae, Coriobac-teriaceae, Ruminococcaceae, Ruminococcus, Roseburia, Leuco-nostocaceae, Methanobacteriaceae) являются биомаркерами для диагностики предрасположенности к широкому спектру метаболических нарушений.
Говоря о последствиях дисбаланса микрофлоры, важно отметить, что разнообразие видов микробиоты важнее численности. Исчезающие виды и роды практически не восстанавливаются, происходит замещение их другими родами и видами бактерий, в т. ч. и условно-патогенными. Исчезновение метаболически важных представителей микромира человека может повлечь развитие отдаленных разнообразных негативных последствий.
Хорошо известно, что состав нормальной кишечной микрофлоры достаточно подвержен изменениям под воздействием эндогенных или экзогенных факторов, что в свою очередь, приводит к нарушению течения целого ряда физиологических процессов в организме [20, 21]. Важной проблемой при выборе системного этиотропного лечения инфекций респираторного тракта и уха является отсутствие в арсенале врачей препаратов, способных подавлять патогенные агенты, не оказывая при этом негативного влияния на эндогенную микрофлору человеческого организма. Согласно заявлению Администрации по контролю качества продуктов и лекарственных препаратов США (FDA), практически любой из ныне существующих антибактериальных препаратов обеспечивает пагубное воздействие на состав нормальной кишечной микрофлоры. Антимикробные средства, успешно применяемые для лечения воспалительных заболеваний верхних отделов дыхательных путей и уха, одновременно угнетают жизнедеятельность таких бактерий толстой кишки, как Lactobacillus acidophilus и Bifidobacterium bifidum, необходимых для регуляции процесса расщепления и всасывания пищи, синтеза отдельных групп витаминов и других биологически активных веществ, нейтрализации образующихся в кишечной трубке токсичных белковых соединений.
Согласно заявлению Администрации по контролю качества продуктов и лекарственных препаратов США (FDA), практически любой из ныне существующих антибактериальных препаратов обеспечивает пагубное воздействие на состав нормальной кишечной микрофлоры. Антимикробные средства, успешно применяемые для лечения воспалительных заболеваний верхних отделов дыхательных путей и уха, одновременно угнетают жизнедеятельность таких бактерий толстой кишки, как Lactobacillus acidophilus и Bifidobacterium bifidum, необходимых для регуляции процесса расщепления и всасывания пищи, синтеза отдельных групп витаминов и других биологически активных веществ, нейтрализации образующихся в кишечной трубке токсичных белковых соединений.
Наиболее серьезным, а в некоторых случаях и летальным, осложнением системной антибактериальной терапии является псевдомембранозный колит, связанный с активацией Clostridium difficile в толстой кишке. Метаанализ нескольких крупных исследований, проведенный в 2006 году Makins R. и соавт., выявил высокую степень вероятности развития псевдомембранозного колита при применении антибиотиков из групп пеницил-линов, фторхинолонов, линкозамидов [22]. Помимо псев-домембранозного колита, возможны и другие неспецифические нарушения деятельности желудочно-кишечного тракта. При приеме только аминопенициллина у 29% детей развиваются такие негативные реакции как рвота, сыпь, диспепсия [6]. В англоязычной литературе для обозначения комплекса изменений в кишечнике в совокупности с клиническими проявлениями, связанными с нарушениями нормальной функции кишечникана на фоне приема антибиотиков, используется термин «antibiotic-associateddiarrhea» (AAD) — антибиотик-ассо-циированная диарея (ААД) [8, 20]. По результатам выше-
и соавт., выявил высокую степень вероятности развития псевдомембранозного колита при применении антибиотиков из групп пеницил-линов, фторхинолонов, линкозамидов [22]. Помимо псев-домембранозного колита, возможны и другие неспецифические нарушения деятельности желудочно-кишечного тракта. При приеме только аминопенициллина у 29% детей развиваются такие негативные реакции как рвота, сыпь, диспепсия [6]. В англоязычной литературе для обозначения комплекса изменений в кишечнике в совокупности с клиническими проявлениями, связанными с нарушениями нормальной функции кишечникана на фоне приема антибиотиков, используется термин «antibiotic-associateddiarrhea» (AAD) — антибиотик-ассо-циированная диарея (ААД) [8, 20]. По результатам выше-
перечисленных исследований частота ААД в разных группах пациентов колеблется от 5 до 39% [8, 20-22], а среди детей, получавших перорально антибактериальные средства широкого спектра действия, частота встречаемости этого состояния составляет от 5 до 62% [23].
Одним из самых частых нежелательных эффектов антибактериальной терапии является так называемый антибиотик-ассоциированный дисбиоз — качественное и (или) количественное изменение состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений с формированием желудочно-кишечных расстройств. Частота встречаемости антибиотик-ассоциированной диареи колеблется от 2-3 до 25-30% и зависит также от вида принимаемого антибиотика [24, 25].
Среди разнообразных по структуре преобладающей микрофлоры вариантов дисбиоза кишечника в большинстве случаев развивается кандидозный (дисбиоз кишечника с избыточным ростом грибов рода Candida, неинва-зивный кандидоз кишечника). По данным некоторых авторов, доля кандидозного дисбиоза может достигать 31% [26]. Это связано с тем, что современные антибиотики отличаются высокой бактерицидной активностью и широким спектром антибактериального действия, однако не действуют на дрожжеподобные грибы и, более того, угнетают естественных антагонистов грибов — нормальную кишечную микрофлору [24-26].
Очевидно, что в реальной клинической практике врачи курируют пациентов не только с инфекционной, но и сопутствующей патологией, из которой огромный процент составляют нарушения функций пищеварительной системы. У пациентов с хроническими заболеваниями желудочно-кишечного тракта (ЖКТ) изначально почти в 100% случаев наблюдается дисбаланс состава нормальной микрофлоры кишечника в разной степени выраженности. У таких больных антибиотики угнетают микрофлору кишечника, усугубляя тем самым состояние дисбиоза как толстой, так и тонкой кишки. Действие бактериальных токсинов, в свою очередь, увеличивает нагрузку на печень и ухудшает течение многих гастроэнтерологических заболеваний.
Нежелательные явления антибиотикотерапии у пациентов с проблемами со стороны ЖКТ включают не только ААД, но и снижение эффективности этиотропного лечения инфекционного заболевания в результате несоблюдения больными схемы приема лекарственного средства (низкий комплаенс в связи с плохой переносимостью терапии), повышение риска ухудшения течения заболеваний ЖКТ, развития синдрома раздраженного кишечника, особенно у женщин, воспалительных заболеваний и рака ЖКТ, метаболических нарушений.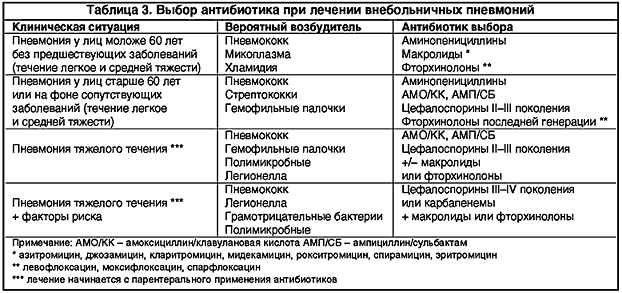
Одним из наиболее распространенных направлений в коррекции антибиотик-ассоциированных кишечных дис-биозов является использование так называемых фармабио-тиков. Среди фармабиотиков различают пробиотики — препараты, содержащие представителей кишечной микрофлоры в живом виде, пребиотики — бактериальные компоненты, такие как дезоксирибонуклеиновые кислоты, биологически
активные метаболиты бактериального происхождения, пищевые компоненты, и синбиотики — комбинации пребио-тиков и пробиотиков. Пребиотики представляют собой пищевые субстанции, преимущественно содержащие поли-и олигосахариды некрахмального происхождения, — лакту-лозу, инулин, олигофруктозу, олигосахариды грудного молока. Данные вещества практически не перевариваются в желудочно-кишечном тракте человека, но являются пищевым субстратом для бактерий — представителей нормальной микрофлоры толстой кишки. Классическим пребиоти-ком, широко используемым в клинической практике, является лактулоза, которая представляет собой дисахарид, синтезированный из лактозы (молочного сахара) [27].
Для восстановления кишечной микробиоты наиболее часто врачи назначают заместительную терапию — пробио-тики, поскольку они способствуют достаточно быстрому восстановлению количественного состава лакто- и бифидо-бактерий. Однако для восстановления нормального состава микробиоты недостаточно принимать 1-2 штамма лакто-или бифидобактерий, так как они не могут обеспечить поддержание многообразия видов микрофлоры кишечника, перечисленных выше. Гораздо более существенным представляется достижение возможности изначально избежать угнетения как можно большего количества представителей кишечной микробиоты. Важно, что пробиотики назначаются уже после курса антибактериальной терапии, чтобы обеспечить восстановление лактобактерий и бифидобактерий. В отличие от них пребиотики следует назначать во время основного курса лечения вместе с антибиотиками для сохранения многообразия нормальной микрофлоры.
Пробиотики достаточно широко и активно применяются в клинической практике, в литературе имеются достаточно многочисленные свидетельства их нежелательного воздействия, например, повышение риска системных инфекций, чрезмерная стимуляция иммунной системы у чувствительных лиц, перенос генов резистентности бактерий, то есть содействие росту антибиотикорезистентности [28].
В этом аспекте определенный интерес представляют Экоантибиотики — новая группа фармпрепаратов. Это инновационные лекарственные формы, представляющие собой традиционные антибактериальные препараты, в состав которых входит пребиотик лактулоза в качестве действующего вещества. Механизм действия Экоанти-биотиков заключается в следующем — после приема внутрь антибиотик оказывает бактерицидное действие на патогенную микрофлору, повреждая при этом и нормальную микрофлору кишечника, одновременно с этим, пребиотик лактулоза в составе препарата компенсирует негативное влияние антибиотика, стимулируя восстановление микробиоты кишечника.
Лактулоза — синтетический дисахарид, стереоизомер молочного сахара лактозы, состоящий из остатков молекул галактозы и фруктозы. Лактулоза попадает в толстую кишку в неизмененном виде и выполняет роль субстрата для сахаролитических бактерий, так как в отличие от лактозы она не всасывается в кишечнике, и в организме человека нет ферментов, способных гидролизировать ее. Повышается осмотическое давление, что приводит к задержке
Повышается осмотическое давление, что приводит к задержке
жидкости в просвете кишки и усилению ее перистальтики. На сегодняшний день лактулоза является наиболее изученным пребиотиком: создавая кислую среду в просвете толстой кишки она угнетает процессы гниения, снижает образование токсичных продуктов, создавая более благоприятную среду для размножения «полезных» сапрофитных бактерий в кишечнике. Лактулоза уменьшает побочное действие антибиотиков на кишечную нормофлору, при этом не взаимодействует с молекулой антибиотика в составе лекарственной формы, не изменяет фармакокине-тику и клиническую эффективность антибиотика, не влияет на моторику кишечника, т. к. используется в составе экоан-тибиотиков в пребиотических дозах и в качестве вспомогательного вещества [29]. Кроме того, лактулоза обладает умеренным противогрибковым эффектом за счет бифидо-генного действия — в присутствии лактулозы бифидобакте-рии более склонны ингибировать рост грибов [30]. Клинически доказано, что применение лактулозы безопасно и оправдано даже у недоношенных детей [31].
Клинически доказано, что применение лактулозы безопасно и оправдано даже у недоношенных детей [31].
Экоантибиотики имеют ряд преимуществ по сравнению с обычными антимикробными препаратами — обладают лучшей терапевтической переносимостью, поддерживают баланс кишечной микрофлоры, препятствуют развитию Clostridium difficile — ассоциированной диареи, не вызывают кандидозов, оптимизируют иммунный статус. По противомикробной активности экоантибиотики эквивалентны оригинальным представителям класса антибиотиков (что подтверждено заключениями о биоэквивалентности), а по профилю безопасности значительно превосходят их. Негативное влияние антибактериального компонента экоантибиотика на кишечную микрофлору нивелируется протективным действием на нее лактулозы [28-30].
Экоантибиотики представлены во всех наиболее востребованных группах антибактериальных препаратов -Экобол (амоксициллин), Экоклав (амоксициллин с клаву-лановой кислотой), Экомед (азитромицин), Экозитрин (кларитромицин), Эколевид (левофлоксацин) и Экоцифол (ципрофлоксацин).
Воздействие антибиотиков на состояние микробиоты кишечника человека стало возможным оценить благодаря секвенированию ДНК-бактерий. Секвенирование (sequencing) — это общее название методов, которые позволяют установить последовательность нуклеотидов в молекуле ДНК и, таким образом, произвести точную идентификацию бактерий. Изучение состояния микробиоты кишечника при помощи секвенирования ДНК-бактерий до и после этио-тропного лечения больных с инфекционными процессами показало, что на фоне системной антибиотикотерапии могут практически полностью исчезнуть до 30-40% семейств полезных бактерий, в т. ч. и метаболически значимых, от которых зависит пищеварение и всасывание веществ в кишечнике человека. С помощью метода секвенирования ДНК было наглядно продемонстрировано, что пребиотик лактулоза в составе экоантибиотиков способствует сохранению большинства родов полезных бактерий. Добавление даже небольших доз лактулозы приводит к значительному уменьшению негативного воздействия антибиотика на микробиоту.
Результаты многоцентрового открытого рандомизированного сравнительного исследования микробиоты кишечника человека методом секвенирования до и после лечения Экоклавом демонстрируют его существенное преимущество перед обычным препаратом амокси-циллина/клавуланата. Исследование проводилось на базе Научно-исследовательского института физико-химической медицины Федерального медико-биологического агентства (ФГБУН НИИ ФХМ ФМБА России, г. Москва) в 2014 г. Проводилось изучение состава и количественных характеристик более 100 родов и от 80 до 170 видов представителей микробиоты. Оба препарата в виде порошка для суспензии (250 мг + 62,5 мг/ 5 мл) использовались в лечении детей с острым гнойным средним отитом. Методом секвенирования был проведен анализ микробного состава кишечника на основе оценки вариабельности генов 16S рибосомальной РНК в обеих группах до и после терапии антибиотиками. В результате исследования было обнаружено, что после лечения амок-сициллином/клавуланатом исчезло 39 родов бактерий, а после использования Экоклава — всего 3. Результаты исследования микробиоты кишечника методом секвенирования, проведенного компанией АВВА РУС совместно с Центром биотехнологий Университета Иллинойса (США) в 2015 г., также показали, что применение амоксицилли-на приводило к снижению разнообразия микробиоты кишечника на 38% сразу после терапии и еще на 18% через 10 дней после окончания терапии [32].
Доказательная база по экоантибиотикам накапливается. В Санкт-Петербургском НИИ болезней уха, горла, носа и речи было проведено сравнительное исследование эффективности, безопасности и переносимости препаратов Экозитрин (экоантибиотик кларитромицин) и Клацид в лечении больных с острым бактериальным риносинуси-том в течение 10-14 дней. Результаты исследования показали, что клиническая эффективность используемых препаратов была сопоставима, однако изучение микробного состава кишечной микрофлоры пациентов показало, что в основной группе, получавшей Экозитрин, нарастало количество бифидо- и лактобактерий (р < 0,01), произошла практически полная санация инфекции Candida albicans (р < 0,001), содержание E. Сой осталось неизменным, а в группе сравнения наблюдалось достоверное (р < 0,01) снижение количества E. Coli (в среднем на 19%), бифидобактерий (в среднем на 19%) и лактобацилл (в среднем на 21%). При этом значительно возросло содержание Candida albicans (в среднем в 2,8 раза). Диспепсические явления на фоне приема Клацида были выраженными и потребовали в некоторых случаях медикаментозной коррекции, чего не отмечалось в основной группе пациентов. Таким образом, результаты исследования продемонстрировали не только сопоставимую клиническую эффективность изучаемых препаратов, но и высокий профиль безопасности и переносимости экоантибиотика [33].
Оценка эффективности и переносимости, а также влияния на кишечную микрофлору препарата Экоклав в сравнении с амоксициллином/клавуланатом в терапии детей с острым средним отитом проводилась на базе кафедры
оториноларингологии ФУВ РНИМУ им. Н.И. Пирогова. Результаты исследования продемонстрировали высокую эффективность препаратов Экоклав и амоксициллина/кла-вуланата в отношении всех возбудителей отита, выявленных в процессе обследования детей. Однако после использования амоксициллина/клавуланата возросло число пациентов с нарушением содержания бифидобактерий до 67%, лактобактерий — до 37%, с выявленным ростом дрожжепо-добных грибов — до 43%, с наличием клебсиелл — до 13%. В группе детей, принимавших Экоклав, напротив, произошло увеличение доли пациентов с нормальным биоценозом кишечника — нормальное содержание бифидобактерий выявлено у 73% детей, лактобактерий — у 97% [34].
Сотрудниками нашей кафедры в 2013 г. проводилось исследование эффективности применения препаратов Экомед и азитромицин у пациентов с острым гнойным риносинуситом. Антибиотики использовались в течение 5 дней по 500 мг 1 р/сут. Во время исследования пациенты не получали никакие другие антимикробные средства, помимо исследуемых препаратов, а также сорбенты и фар-мабиотики. Оценка динамики симптомов со стороны желудочно-кишечного тракта проводилась в соответствии с индивидуальными дневниками и результатами анализа кала на дисбактериоз через 14 дней по окончании курса лечения. Результаты показали, что на фоне приема антибактериальной терапии клиническое выздоровление было
зафиксировано у всех больных. Однако со стороны ЖКТ отмечались различия — у 23% пациентов, принимавших Экомед, через 2 недели после лечения был отмечен достоверный рост количества бифидобактерий, у 30% — нормализация уровня лактобактерий, у 10% — снижение роста грибов Candida albicans, а у больных, которые использовали азитромицин, было выявлено угнетение нормофлоры и у 50% был отмечен рост Candida albicans [35].
Таким образом, использование новых антибактериальных лекарственных препаратов, дополнительно содержащих в своем составе пребиотики, способные оптимизировать собственную кишечную микрофлору и физиологические функции кишечника, является весьма перспективным в клинической практике. Данные экспериментальных и сравнительных клинических исследований подтверждают, что пребиотик способен нивелировать негативное воздействие антибактериального компонента на нормальную микрофлору кишечника, не снижая при этом его противомикробного действия. Особенно перспективным представляется использование таких препаратов для лечения пациентов с рецидивирующими и хроническими воспалительными заболеваниями ЛОР-органов и с сопутствующей патологией ЖКТ. Снижение частоты нежелательных явлений на фоне приема антибиотика повышает приверженность пациента к лечению и существенно влияет на качество жизни. ф
ЛИТЕРАТУРА
1. Fokkens WJ et al. European Position Paper on Rhinosinusitis and Nasal Polyps. Rhinology, 2012, 50(Suppl. 23): 1-298.
2. Rosenfeld RM, Piccirillo JF, Chandrasekhar SS, Brook I, MSc Clinical Practice Guideline (Update): Adult Sinusitis. Otolaryngology — Head and Neck Surgery, 152(2S).
3. Barbara J. Turner MD, MSED, Sankey Williams, MD Acute sinusitis. Annals of internal medicine, 2010.
4. Пальчун В.Т., Крюков А.И. Оториноларингология: Руководство для врачей. М., 2014. 616с.
5. Свистушкин В.М., Гринев И.А., Стецюк О.У., Андреева И.В. Рекомендации по ведению взрослых пациентов с острым риносинуситом: достижим ли консенсус? Лечащий врач. 2012, 11: 90-96.
6. Нестерова И.В. Проблемы лечения вирусно-бак-териальных респираторных инфекций у «часто
и длительно болеющих» иммунокомпрометиро-ванных детей. Лечащий врач, 2009, 6: 26-29.
7. Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск, МАКМАХ, 2007. 464 с.
8. McFarland LV. Risk factor for antibiotic-associated diarrhea. Ann. Med. Intern. (Paris), 1998, 149(9): 5: 261-266.
9. Стецюк О.У., Козлов Р.С. Безопасность и переносимость антибиотиков в амбулаторной практике. Клиническая микробиология и антимикробная химиотерапия, 2011, 1: 67-84.
10. Meehan CJ, Beiko RG. A phylogenomic view of ecological specialization in the Lachnospiraceae, a family of digestive tract-associated bacteria. Genome BiolEvol, 2014 Mar, 6(3): 703-13.
11. Louis P, Hold GL, Flint HJ. The gut microbiota, bacterial metabolites and colorectal cancer. Nat RevMicrobiol, 2014 Oct, 12(10): 661-72.
12. Gut microbiome is linked to immune cell phe-notype in multiple sclerosis. 2014 Joint ACTRIMS-ECTRIMS Meeting, Poster 616.
13. Reeves AE, Koenigsknecht MJ, Bergin IL, Young VB. Suppression of Clostridium difficile in the Gastrointestinal Tracts of Germfree Mice Inoculated with a Murine Isolate From the Family Lachnospiraceae. Infectionandlmmunity. 2012, 80(11): 3786-3794.
14. Gratadoux JJ, Blugeon S, Bridonneau C, Furet JP, Corthier G et al. Faecalibacteriumprausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. ProcNatlAcadSci U S A, 2008 Oct 28, 105(43): 16731-6.
15. Furet JP, Kong LC, Tap J et al. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss: links with metabolic and low-grade inflammation markers. Diabetes, 2010, 59: 3049-57.
16. Zhang X, Shen D, Fang Z et al. Human gut microbiota changes reveal the progression of glucose intolerance. PLoS One, 2013, 8: e71108.
17. Tilg H, Müschen AR. Microbiota and diabetes: an evolving relationship. Gut, 2014 Sep, 63(9): 1513-21.
18. Wong VW, Tse CH, Lam TT, Wong GL, Chim AM, Chu WC, Yeung DK, Law PT, Kwan HS, Yu J, Sung JJ, Chan HL. Molecular characterization of the fecal microbiota in patients with nonalcoholic steatohepatitis-a longitudinal study. PLoS One. 2013 Apr 25, 8(4): e62885.
19. Salminen S, Deighton M. Lactic acid bacteria in the gut in normal and disordered states. Dig Dis, 1992, 10(4): 227-38.
20. McFarland LV. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am. J. Gastroenterol,, 2006, 101(4): 812-822.
21. Wistrom J, Norrby SR, Myhre EB et al. Frequency of antibioticassociateddiarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J. Antimicrob. Chemother., 2001, 47(1): 43-50.
22. Makins R, Ballinger A. Gastrointestinal side effects of drugs. Expert Opin. Drug Saf, 2003, 2(4): 421-429.
23. Мухина Ю.П Диагностика и коррекция дисбак-териоза у детей. РМЖ, 1999, 7(11): 487-494.
24. Парфенов А.И., Ручкина И.Н., Осипов Г.А. Анти-биотико-ассоциированная диарея и псевдомем-бранозный колит. Consilium Medicum, 2004, 6: 12-17.
25. Бельмер С.В. Антибиотик-ассоциированный дисбактериоз кишечника. РМЖ, 2004, 12(3): 148-151.
26. Шевяков М.А., Колб З.К., Савельева О.Г., Борзова Ю.В. Интестинальный дисбиоз у пациентов с синдромом раздраженного кишечника. Успехи медицинской микологии. Под общ. ред. Ю.В. Сергеева. Материалы II Всероссийского конгресса по медицинской микологии, 2014
27. Зрячкин Н.И. Новый подход к классификации пребиотиков, пробиотиков и синбиотиков. Фарматека, 2007, 2(137): 58-61.
28. Salmlnen S, von Wright A, MoreHI L et al. Demonstration of safety of probiotics — a review. Int J FoodMicrobiol, 1998, 44: 93.
29. Федоров И.Г. и др. Клинические аспекты применения лактулозы в практике гастроэнтеролога. Трудный пациент, 2012, 4.
30. Буторова Л.И., Калинин А.В. Значение лактулозы в регуляции кишечной микрофлоры. Клинические перспективы гастроэнтерологии и гепатологии, 2002, 6: 21-26.
31. http://ecoantibiotic.ru/eco.php.
32. Benno Y, Sawada K, Mitsuoka T. The intestinal microflora of infants: composition of fecal flora in breast-fed and bottle-fed infants. Microbiol. Immunol., 1984, 28(9): 975-986.
33. Янов Ю.К., Коноплев О.И., Науменко Н.Н., Антушева И.А. Антибиотики с повышенным профилем безопасности для кишечной микрофлоры: новые перспективы антибиоти-котерапии острых бактериальных риносину-ситов. Рос. оторинолар., 2010, 3(46): 181-194.
34. Гаращенко Т.И., Левитский М.В., Бойкова Н.Э. и др. Возможности безопасной антибиотикоте-рапии при острых средних отитах у детей. Детская оториноларингология, 2013, 2: 54-56.
35. Свистушкин В.М., Никифорова ГН., Шевчик Е.А., Дедова М.Г Использование инновационных форм антибиотиков в лечении воспалительных заболеваний околоносовых пазух. Лечащий врач, 2014, 4.
Антибиотиков: выбирайте с умом при ЛОР-инфекциях
Часто кажется, что бактериальные инфекции и детство идут рука об руку, как арахисовое масло и желе (или вино и сыр, если вы более культурный тип).
В большинстве случаев инфекции уха, носа и горла вашего ребенка будут лечить антибиотиками , но перед тем, как совершить это, важно понять, что ваше решение может повлиять на выздоровление вашего ребенка в долгосрочной перспективе.
Узкий спектр против широкого спектра
Есть два типа антибиотиков, которые может порекомендовать вам ЛОР-специалист West Chester .
Антибиотики узкого спектра действия предназначены только для борьбы с бактериями, вызывающими инфекцию; амоксициллин — один из таких примеров.
С другой стороны, антибиотики широкого спектра действия борются с широким спектром видов бактерий.
Азитромицин или Z-Pak ® являются часто назначаемыми примерами.
В исследовании, опубликованном в апреле Исследовательским институтом результатов, ориентированных на пациента (PCORI), приняли участие более 30 000 детей в возрасте от шести месяцев до 12 лет, чтобы сравнить результаты между двумя разными типами антибиотиков.
Все дети посещали педиатрические отделения первичной медико-санитарной помощи в Пенсильвании или Нью-Джерси по поводу инфекций уха, носа или горла в период с января 2015 года по апрель 2016 года, и им были прописаны пероральные антибиотики.
Исследователи обнаружили, что антибиотики узкого спектра действия столь же эффективны, как и антибиотики широкого спектра действия, при уничтожении бактерий в течение трех дней. Лучше всего?
Было меньше побочных эффектов, таких как диарея, рвота и расстройство желудка.
Антибиотики узкого спектра действия подойдут вашему ребенку:
- Стрептококковая ангина, подтвержденная экспресс-тестом на стрептококк или посевом из горла
- Инфекция уха или носа, вызванная бактериями
- В возрасте от шести месяцев до 12 лет
Антибиотики узкого спектра действия не рекомендуются для детей младше шести месяцев или старше 12 лет.Важно помнить, что антибиотики не являются эффективным средством против вирусов .
В исследовании не рассматривалось лечение младенцев и подростков.
Есть и другие проблемы с антибиотиками широкого спектра действия.
Поскольку они нацелены на такой широкий спектр бактерий, они способствуют устойчивости бактерий к антибиотикам — растущей глобальной проблеме, которая ограничивает возможности лечения, когда лекарства, которые когда-то эффективно убивали бактерии, больше не работают.
Это может привести к длительной болезни и даже смерти, если не найти альтернативных методов лечения.
В конечном итоге ЛОР-врач Вест-Честера определит наилучший курс лечения в зависимости от типа и тяжести инфекции, а также количества доступных решений.
Соответствующие стойки для ушей, носа и горла
Отделение ушей, горла и носа в Западной Филадельфии
West Chester
795 East Marshall Street # 303
West Chester, PA 19380
(610) 384-8300
Kennett Square
689 Unionville Road
Kennett Square, PA 19348
(610) 925-5551
West Grove
455 W Woodview Rd # 210
West Grove, PA 19390
(610) 345-0977
Использование антибиотиков первого ряда при респираторных и ЛОР-инфекциях у детей различается
19 октября 2018
Читать 3 мин.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Хилио
САН-ФРАНЦИСКО — Исследование, представленное на IDWeek, выявило ненадлежащее использование противомикробных препаратов для лечения респираторных инфекций и инфекций уха, носа и горла у детей. Исследователи заявили, что во многих случаях антибиотики первого ряда для лечения этих инфекций часто игнорируются в пользу агентов широкого спектра действия.
«Мы обнаружили, что в нашей практической сети наиболее распространенной областью чрезмерного использования антибиотиков был выбор соответствующего агента, особенно при синусите, где чрезмерное использование антибиотиков широкого спектра действия было обычным явлением», Адам Л. Херш, доктор медицины, Доктор философии, , адъюнкт-профессор педиатрии в отделении детских инфекционных заболеваний в Университете штата Юта, рассказал Инфекционные болезни у детей . «Эта проблема была более серьезной в условиях неотложной медицинской помощи по сравнению с традиционными офисными условиями.Это отражает результаты других исследований, и эти условия все чаще признаются в качестве важной цели для вмешательства стратегического руководства ».
Чтобы поддержать создание и применение усилий по управлению антимикробными препаратами в сети педиатрических клиник, Херш и его коллеги провели ретроспективное когортное исследование в период с 1 января 2016 года по 31 декабря 2017 года. Пациенты были включены, если они были представлены в какой-либо из сетей. 31 первичная медико-санитарная помощь или шесть клиник неотложной помощи.
Из 117 279 посещений исследователи отметили, что 14% были связаны с диагнозами, не требующими применения антибиотиков, такими как бронхит, бронхиолит и инфекции верхних дыхательных путей.Меньшее количество посещений было связано с острым средним отитом (AOM; 5%), синуситом (1%) и фарингитом (4%).
Лишь небольшому числу пациентов с диагнозом, не подходящим для приема антибиотиков, были выписаны рецепты (3%). Тем не менее, использование антибиотиков первого ряда при АОМ, синусите и фарингите варьировалось: 27% случаев синусита и 91% случаев фарингита в учреждениях неотложной помощи получали соответствующие антибиотики.
Отдельное исследование, представленное на встрече, показало, что в четырех из пяти случаев АОМ назначаются антибиотики, хотя AAP рекомендует подход «осторожного ожидания» к большинству случаев инфекции, который ранее был признан подходящим для более чем половины педиатрических больных. случаи.Более того, во многих случаях лечение антибиотиками было чрезмерно широким или неоптимальным.
«Я думаю, что людям комфортно использовать некоторые агенты, которые использовались в прошлом, но шире, чем это необходимо и не рекомендуется в настоящее время», — Шамим Ислам, доктор медицины, DTM & H, , доцент кафедры педиатрии Университета Школа медицины и биомедицинских наук Buffalo’s Jacobs рассказала о инфекционных заболеваниях у детей . «Кроме того, азитромицин — это удобная дозировка один раз в день, к которой, я думаю, прибегают некоторые врачи, даже если это не один из рекомендуемых препаратов.”
ПЕРЕРЫВ
Ислам добавил, что азитромицин может быть не столь эффективным против отита, поскольку он не покрывает основной патоген — Streptococcus pneumoniae — так же эффективно, как амоксициллин и амоксициллин / клавуланат калия, которые являются рекомендованными препаратами первой линии.
Ислам и его коллеги провели крупное исследование распространенности точечного сепсиса на уровне сообществ, в которое вошли все пациенты, проходившие лечение в нескольких медицинских учреждениях в Буффало, штат Нью-Йорк, по состоянию на сентябрь.5 декабря 2016 г., 5 декабря 2016 г., 6 марта 2017 г. и 5 июня 2017 г. Все пациенты были в возрасте от 0 до 18 лет.
Исследователи идентифицировали 2062 визита к больному в четыре дня, и 6% из этих пациентов получили диагноз АОМ. Антибиотики назначались в 82% этих случаев (91% в отделении неотложной помощи, 70% в неотложной медицинской помощи, 83% в учреждениях первичной медико-санитарной помощи).
В большинстве случаев врачи использовали препараты первого ряда (69%), но в отделениях неотложной помощи и первичных педиатрических больницах наиболее часто применялись цефалоспорины третьего поколения.Азитромицин был вторым наиболее часто используемым препаратом: его выписывали 20% всех неотложных медицинских услуг и 8% всех детских первичных клиник. Срок действия большинства рецептов составлял не менее 7 дней (90%). Исследователи не заметили различий между амбулаторными учреждениями в отношении практики назначения лекарств.
«Многие поставщики медицинских услуг могут быть осведомлены о доступных руководствах, но что было обнаружено для других состояний, таких как пневмония, так это то, что прямое обучение или переподготовка к поставщикам услуг первой линии может быть полезным», — сказал Ислам.«Кроме того, работа по изучению инфекций верхних дыхательных путей и пневмонии показала, что регулярное наблюдение и пересмотр количества рецептов с поставщиками медицинских услуг могут быть полезны для улучшения соблюдения рекомендаций». — Кэтрин Борц
Каталожный номер с :
Hersh A, et al. Abstract 170. Представлено: IDWeek 2018; 3-7 октября 2018 г .; Сан-Франциско.
Islam I, et al. Тезисы 282. Представлено: IDWeek 2018; 3-7 октября 2018 г .; Сан-Франциско.
Раскрытие информации: Hersh and Islam не сообщают о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей. Подписаться Нам не удалось обработать ваш запрос.Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Хилио
Что вызывает инфекции уха, носа и горла?
Инфекции ушей, носа и горла очень распространены. Симптомы обычно относительно легкие, но инфекции могут иногда вызывать проблемы, которые необходимо лечить у ЛОР-специалиста. Что может вызвать инфекцию в ушах, носу или горле, и когда вам следует обратиться в ЛОР-клинику за советом?
Распространенные инфекции уха, носа и горла
Когда мы говорим об инфекциях уха, носа и горла, мы часто делаем это с точки зрения локализации проблемы, а не конкретной вирусной или бактериальной инфекции, которая вызывает проблему.Это связано с тем, что инфекции в разных областях, как правило, вызывают разные симптомы. По этим симптомам мы можем определить, где возникла инфекция.
- Инфекции уха могут быть инфекциями наружного, среднего или внутреннего уха. Инфекции внутреннего уха встречаются реже, поскольку вирусам и бактериям труднее добраться до этой части уха.
- Инфекции носа часто поражают носовые ходы (ринит), но они также могут поражать связанные области, такие как носовые пазухи (синусит).
- Инфекции горла могут быть названы в соответствии с их расположением, например, тонзиллит в миндалинах или ларингит в гортани (голосовой ящик).
Иногда нам нужно знать местонахождение инфекции, чтобы справиться с симптомами. Однако в некоторых случаях можно определить конкретную инфекцию, которая является причиной. Это особенно важно делать, когда симптомы серьезны, есть вероятность, что инфекция может быть бактериальной или затронуты другие части вашего тела.
Множество различных инфекций могут поражать ваши уши, нос или горло:
- Вирусы простуды и гриппа могут поражать все три эти области, хотя чаще всего они поражают нос или горло
- Инфекции других частей тела (например, грудной клетки или дыхательных путей) могут иногда распространяться на уши, включая серьезные инфекции, такие как корь
- Мононуклеоз и свинка могут поражать горло и в некоторых случаях распространяться на уши
- Стрептококковая ангина — это инфекция, вызываемая определенным типом бактерий, известных как Streptococcus
Любая часть ушей, носа и горла может быть поражена множеством одних и тех же вирусов и бактерий.Однако определенные типы инфекции с большей вероятностью возникнут в разных областях, и симптомы также могут немного отличаться в зависимости от того, где именно находится инфекция.
Вирусные и бактериальные инфекции
Микробы, вызывающие ЛОР-инфекции, могут быть вирусами или бактериями. Может быть важно знать, является ли ваша инфекция вирусной или бактериальной, поскольку она может повлиять на симптомы и варианты лечения:
- Вирусные инфекции более распространены, так как они включают простуду и грипп, которые могут вызывать инфекции ушей, носа и горла.
- Бактериальные инфекции случаются не так часто, но могут быть более серьезными. Однако, если инфекция уха, носа или горла вызвана бактериями, ее можно вылечить антибиотиками. Антибиотики действуют только против бактерий, поэтому они не могут помочь при вирусных инфекциях.
Вероятно, вы не сможете определить, какой у вас тип инфекции, поскольку симптомы могут быть очень похожими, но если вы посетите ЛОР-специалиста, он сможет диагностировать конкретную инфекцию.Может быть полезно выяснить, является ли инфекция бактериальной, поскольку это означает, что ее можно вылечить антибиотиками.
Симптомы инфекций уха, носа и горла
Инфекции ушей, носа и горла часто вызываются одними и теми же бактериями и вирусами. Однако симптомы могут быть разными в зависимости от того, где находится инфекция:
- Ушные инфекции могут вызвать боль в ухе, воск или выделения, потерю слуха и проблемы с равновесием.
- Инфекции носа могут вызвать насморк или заложенность носа и чихание.Инфекции, которые достигают таких областей, как носовые пазухи, также могут вызывать другие симптомы, такие как головные боли.
- Инфекции горла могут вызвать першение или першение в горле, боль или затруднение глотания. Вы также можете почувствовать опухшие железы на шее.
Все три типа инфекций также могут вызывать более общие симптомы инфекции, такие как лихорадка, и инфекции распространены между этими областями. Например, инфекция, которая начинается с боли в горле, может начать вызывать другие симптомы, такие как боль в ухе, когда она распространяется от горла к уху.
Управление симптомами
Симптомы инфекций уха, носа и горла обычно легкие, и они должны начать улучшаться в течение нескольких дней. Чтобы инфекция полностью исчезла, может потребоваться пара недель, но постепенно вы должны почувствовать себя лучше.
Обычно вы можете справиться с симптомами дома. Принятие безрецептурных обезболивающих, таких как парацетамол или ибупрофен, может облегчить любую боль. Он также может уменьшить воспаление, вызывающее многие из ваших симптомов, и может помочь снизить температуру, если она у вас есть.Есть и другие простые средства, которые помогут вам справиться с симптомами инфекций уха, носа и горла:
- Приложите к уху теплый компресс, чтобы облегчить боль в ухе
- Назальные спреи и противоотечные средства могут помочь при заложенности носа или насморке
- Теплый напиток с медом успокаивает боль в горле
- Ношение шляпы и шарфа также может помочь, если вам нужно выйти на улицу в холодную погоду, когда у вас есть инфекция: закройте уши или нос, если они поражены, или перемотайте горло, чтобы согреться.
Когда обратиться к врачу?
Хотя обычно не стоит беспокоиться об инфекциях уха, носа и горла, вам следует проконсультироваться с врачом, если у вас серьезные симптомы, они длятся дольше ожидаемого или если вы продолжаете заражаться той же инфекцией. ЛОР-специалист может выяснить, что вызывает инфекцию, и выявить основные проблемы. Вам могут назначить лечение, например антибиотики, для устранения бактериальной инфекции или посоветовать, как предотвратить возвращение симптомов.
Есть ли у вас другие советы для людей с инфекциями уха, носа или горла?
Боль в горле, инфекция уха или носовых пазух? Проверьте свой антибиотик
Люди с болью в горле, ушными инфекциями и инфекциями носовых пазух как минимум в половине случаев получают неправильный антибиотик, сообщили исследователи в понедельник.
Когда люди принимают неправильный антибиотик, они не только часто не излечиваются, но и могут способствовать развитию устойчивых к лекарствам «супербактерий», по мнению исследователей.
Они думают, что отчасти проблема заключается в том, что пациенты спрашивают легко запоминающиеся названия, такие как «Z-Pack», и исследование показало, что азитромицин, препарат Zithromax, который дает название Z-Packs, является одним из наиболее часто неправильно используемых. наркотики.
«В целом, только 52 процента пациентов, получавших антибиотики от инфекций носовых пазух, инфекций среднего уха и фарингита (боли в горле), получали лечение первой линии, рекомендованное инструкциями по назначению», — д-р Дэвид Хен, специалист по инфекционным заболеваниям в Pew Благотворительный фонд сообщил NBC News.
Это помимо результатов, опубликованных ранее в этом году, которые показывают, что по крайней мере треть людей, получающих антибиотики, даже не нуждаются в них. Взятые вместе, два исследования показывают, что антибиотики назначаются неправильно, — написали исследователи в полном отчете, опубликованном в журнале JAMA Internal Medicine Американской медицинской ассоциации.
Нужен ли мне антибиотик?
Команды Pew, Центров по контролю и профилактике заболеваний, Университета Юты и других стран выбрали ушные инфекции, ангины и инфекции носовых пазух, потому что они выписывают 44 миллиона рецептов на антибиотики в год.
Только иногда уместно прописывать антибиотики при этих состояниях. Стрептококковая ангина легко лечится антибиотиками, и если у ребенка с инфекцией среднего уха выделяется гной, педиатр обычно назначает антибиотик.При хронических инфекциях носовых пазух можно помочь с помощью антибиотиков.
Но еще больше болей в горле и ушных инфекций вызывают вирусы, и антибиотик не поможет пациенту. Инфекции носовых пазух иногда могут быть вызваны бактериями, но часто вызываются вирусами или грибками.
Когда требуется антибиотик, это должен быть базовый антибиотик — обычно амоксициллин, — сказали в команде Pew. Однако это не то, что обычно получают люди.
«Наиболее часто назначаемыми антибиотиками не первого ряда при инфекциях носовых пазух, инфекциях среднего уха и фарингите были макролиды (такие как азитромицин), класс антибиотиков широкого спектра действия (которые нацелены на широкий спектр бактериальных патогенов), часто назначаемых в в амбулаторных условиях », — написала команда Pew в своем отчете.
«Однако макролиды не рекомендуются при инфекциях носовых пазух или среднего уха и рекомендуются при фарингите только пациентам с аллергией на антибиотики класса пенициллина».
Когда необходимы антибиотики. Спросите своего врача, правильно ли я принимаю? СЕГОДНЯПочему врачи прописывают неправильный препарат?
Спрос на пациентов — одна из причин, сказал Хён. «Мы видели исследования, которые показывают, что на назначение врачом влияет давление со стороны пациента и ожидания от приема антибиотиков», — сказал он.
Они могут сказать что-то вроде «Я получил Z-pack в прошлый раз, и мне сразу стало лучше», — сказал Хён. Врачи хотят помочь, и они могут просто сложить и дать удобную Z-упаковку, которая содержит определенное количество таблеток в гладкой упаковке.
Азитромицин иногда может работать, если принимать его всего от трех до пяти дней, что короче, чем у амоксициллина, добавил он, что также может быть привлекательным как для пациентов, так и для врачей, обеспокоенных тем, что пациенты перестанут принимать их лекарство слишком рано.
СВЯЗАННЫЙ: Чего НЕ делать, если у вас грипп.
Хен сказал, что врачи также могут ошибочно полагать, что их пациентам нужны определенные антибиотики. По его словам, важно, чтобы врачи объяснили, почему они назначают или не прописывают тот или иной антибиотик.
В некоторых случаях у людей может быть аллергия на пенициллин (амоксициллин — это разновидность пенициллина), но исследователи приняли это во внимание.
Это правильный антибиотик?
Хорошая новость заключается в том, что большинство детей с ушными инфекциями получают правильные рецепты.В отдельном отчете в JAMA Internal Medicine д-р Адам Херш из Университета Юты и его коллеги обнаружили, что 67 процентов — две трети — детей с ушными инфекциями получали правильный рецепт. Но только 37 процентов взрослых, страдающих ангиной и инфекциями носовых пазух, сделали это.
«Это исследование свидетельствует о значительном чрезмерном использовании антибиотиков не первого ряда».
Команды использовали два крупных национальных исследования 2010 и 2011 годов, которые, по их словам, были самыми последними из доступных. «У нас нет оснований полагать, что практика модели существенно изменились », — написала команда Херша.
Медицинские эксперты жаловались на неправильное использование антибиотиков в течение двух десятилетий, но сообщение до сих пор не доходит, сказал Хен.
Пациентам также необходимо сурово относиться к себе и своим врачам. Спросите: «Действительно ли нужен антибиотик? Это правильный антибиотик?» — сказал он.
По данным CDC, ежегодно более 2 миллионов человек заражаются устойчивыми к лекарствам микробами и 23 000 умирают от своих инфекций
Введение
Существует несколько различных типов ушных инфекций в зависимости от того, какая часть уха инфицирована.Ухо обычно делится на три части: внешнее ухо, среднее ухо и внутреннее ухо. Наружное ухо включает видимую часть уха и слуховой проход. Инфекция слухового прохода называется наружным отитом, обычно называемым «ухом пловца». Среднее ухо — это заполненное воздухом пространство между барабанной перепонкой (барабанной перепонкой) и внутренним ухом. Среднее ухо содержит кости уха и евстахиеву трубу. Инфекции среднего уха называют средним отитом. Внутреннее ухо находится внутри черепа.Он содержит орган слуха, называемый улиткой, и каналы баланса, называемые полукружными каналами. Инфекции внутреннего уха встречаются редко и называются лабиринтитом, вестибулярным невритом или внезапной нейросенсорной тугоухостью, в зависимости от того, какая часть внутреннего уха инфицирована.
Средний отит
Средний отит — это инфекция или воспаление среднего уха. Инфекции уха могут быть кратковременными (острыми) или стойкими (хроническими). Когда большинство людей говорят об ушной инфекции, они имеют в виду острый средний отит.
Острый средний отит
Острый средний отит — это инфекция среднего уха. Чаще всего это происходит, когда вирус или бактерии попадают в ухо и слизь или гной накапливаются за барабанной перепонкой. Инфекции уха обычно начинаются с простуды или инфекции носовых пазух, но могут возникать сами по себе. Работа евстахиевой трубы — регулировать давление и дренировать среднее ухо. Инфекция верхних дыхательных путей вызывает отек евстахиевой трубы и тканей вокруг нее. Это предотвращает стекание скопившейся жидкости и вызывает боль и снижение слуха.
Хотя взрослые могут заразиться ушными инфекциями, они чаще всего встречаются у маленьких детей. Евстахиевы трубы у ребенка уже, короче и расположены более горизонтально, чем у взрослых. Это облегчает попадание жидкости в среднее ухо. Согласно исследованиям, 75% детей заболевают хотя бы одной ушной инфекцией. Чаще всего они случаются на первом году жизни. К 1 году у 60% детей будет хотя бы одна ушная инфекция, а у 17% — 3 или более.
Существует два основных типа: острый средний отит (AOM) и средний отит с выпотом (OME).Острый средний отит вызывает боль, жар и нарушение слуха. Если ребенок слишком мал, чтобы говорить, признаки инфекции уха могут включать плач, раздражительность, проблемы со сном и тянущие за уши.
В OME жидкость остается в ухе. В результате за барабанной перепонкой остается прозрачная жидкость или жидкость соломенного цвета. Это может привести к ощущению заложенности уха и нарушению слуха, но редко к боли.
Факторы риска среднего отита
- Дети до 7 лет
- Посещение детского сада
- Простуда, грипп или инфекция носовых пазух.
- Аллергия
- Воздействие сигаретного дыма
- Члены семьи с историей частых инфекций уха.
- Использование соски.
- Гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
Лечение
- Если присутствует бактериальная инфекция, ваш врач может назначить антибиотики. Если ваш врач прописывает антибиотики, обязательно давайте ребенку все предписанные дозы. У пациентов, принимающих антибиотики, может развиться рвота, диарея или сыпь.В случае появления этих симптомов вам следует обратиться к лечащему врачу.
- Если барабанная перепонка разорвана (в ней есть отверстие), ваш врач может назначить ушные капли с антибиотиками вместо пероральных антибиотиков. Текущие рекомендации для пациентов с ушными трубками или перфорацией — использовать капли с антибиотиками перед пероральным приемом антибиотиков.
- Можно использовать безрецептурные обезболивающие, такие как Ибупрофен или ацетаминофен . Перед тем, как давать ребенку какие-либо лекарства, вам следует поговорить со своим педиатром.
Большинство острых инфекций уха проходят самостоятельно. Антибиотики, как правило, чрезмерно используются для лечения ушных инфекций. По этой причине у детей могут развиться бактерии, устойчивые к антибиотикам. Рекомендации AAP и Американской академии семейных врачей рекомендуют подождать 72 часа, если:
- Ребенок старше 6 месяцев
- Пациент в остальном здоров
- У человека легкие симптомы или неясный диагноз.
Профилактика очень важна. Вы можете снизить риск ушных инфекций для себя или вашего ребенка:
- НЕ подвергайте вашего ребенка пассивному курению.
- Всегда держите ребенка в вертикальном сидячем положении во время кормления из бутылочки.
- Грудное вскармливание в течение как минимум 6 месяцев может снизить предрасположенность ребенка к ушным инфекциям.
- Избегайте использования соски-пустышки.
- Пневмококковая вакцина (Prevnar) предотвращает такие инфекции, как пневмония и менингит, и исследования показывают, что она немного снижает риск инфекций уха у детей.
Хирургия (миринготомия и установка трубки)
Пациентам с рецидивирующими ушными инфекциями или пациентам, у которых жидкость остается на месте в течение нескольких месяцев без разрешения, ваш ЛОР-врач может посоветовать установить трубку. Иногда их называют трубками для выравнивания давления (РЕ) или тимпаностомическими трубками. Эта операция требует общей анестезии для детей, но часто ее можно сделать в офисе под местной анестезией для взрослых. Хирург делает небольшой разрез в барабанной перепонке, а затем вставляет небольшую трубку в барабанную перепонку.Жидкость за барабанной перепонкой может стекать, выравнивая давление между серединой и внешней средой. Барабанная перепонка обычно выталкивает трубки самостоятельно в течение следующих 6-18 месяцев.
Хронический средний отит (COM)
Что такое хронический средний отит?
Если ушная инфекция не проходит полностью или часто возвращается, ее называют хронической. Если не лечить, хронические инфекции уха могут привести к различным осложнениям, включая потерю слуха, повреждение барабанной перепонки, повреждение костей в среднем ухе, хронические или повторяющиеся выделения из уха, проблемы с равновесием, кисту среднего уха, называемую холестеатомой. , паралич лицевого нерва и воспаление головного мозга.
Как возникает хронический средний отит?
Если евстахиева труба блокируется из-за отека или заложенности носа, среднее ухо не может правильно выровнять давление. Затем возникает отрицательное давление. Если закупорка евстахиевой трубы продолжается, жидкость или слизь могут попасть в среднее ухо. По мере того как закупорка сохраняется, ткань среднего уха начинает изменяться. Во-первых, слизь становится гуще и с меньшей вероятностью стекать. Затем сама подкладка начинает утолщаться и воспаляться.Защитные механизмы евстахиевой трубы и среднего уха нарушаются, и бактерии, обычно присутствующие в носу, могут проникать в среднее ухо и средний отит.
Отрицательное давление в среднем ухе или чередование периодов отрицательного, нормального и положительного давления может деформировать барабанную перепонку. Со временем барабанная перепонка может сильно деформироваться, истончиться или даже перфорироваться. Эти изменения могут вызвать потерю слуха и ощущение давления. Когда в барабанной перепонке есть отверстие, естественная защита среднего уха от окружающей среды теряется.Вода и бактерии, попадающие в среднее ухо из ушного прохода, могут вызвать повторное воспаление и инфекцию. Дренаж из уха — частый признак перфорации.
Воспаление и инфекция со временем могут вызвать эрозию костей уха, а также стенок среднего и внутреннего уха. Это может привести к потере слуха, дисбалансу или слабости движений лица. В редких случаях инфекция может проникать глубже в голову, вызывая менингит или абсцесс мозга.
Как лечится хронический средний отит?
Первым шагом в лечении хронического среднего отита является тщательное обследование ЛОР-врачом.Это будет включать в себя сбор анамнеза и осмотр уха, носа и горла. В зависимости от конкретной ситуации пациента дальнейшее обследование может включать проверку слуха, тимпанометрию (испытание давлением среднего уха) или компьютерную томографию.
Лечение зависит от тяжести заболевания. Вначале необходимо устранить причины обструкции евстахиевой трубы, чтобы предотвратить прогрессирование хронического среднего отита. Многие дети и взрослые с хроническими или рецидивирующими ушными инфекциями имеют вентиляционные трубки, вставленные в барабанные перепонки, чтобы обеспечить нормальный воздухообмен в среднем ухе до тех пор, пока евстахиева труба не созреет или пока не будут устранены основные причины дисфункции евстахиевой трубы.
Если болезнь прогрессирует настолько, что вызывает повреждение барабанной перепонки или костей уха, обычно требуется более интенсивное лечение. После того, как активная инфекция находится под контролем, обычно рекомендуется хирургическое вмешательство.
Острый наружный отит или ухо пловца
Острый наружный отит уха пловца возникает в результате инфекции, воспаления или раздражения слухового прохода. Это может повлиять на детей и взрослых. Это состояние обычно возникает из-за попадания воды в ухо (из ванны, душа, плавания, пота), но также может быть результатом экземы, избытка ушной серы, использования слуховых аппаратов или наушников, травм от Q-наконечников или других предметов, вставляемых в ухо. слуховые проходы.
Каковы симптомы наружного отита?
- Зуд внутри уха (общий)
- Боль внутри уха, усиливающаяся при дергании за внешнее ухо (часто)
- Ощущение, что ухо заблокировано или переполнено
- Дренаж из уха
- Снижение слуха
- Покраснение или припухлость кожи вокруг уха
Возможны также рецидивирующие ушные инфекции (хронический наружный отит). Без лечения инфекции могут продолжаться или сохраняться.
Повреждение костей и хрящей (злокачественный наружный отит) также возможно из-за невылеченного уха пловца. Если не лечить, ушные инфекции могут распространиться на основание черепа, головной мозг или черепные нервы. Диабетики, пожилые люди и люди с состояниями, ослабляющими иммунную систему, подвергаются более высокому риску таких опасных осложнений.
Как лечится наружный отит?
Лечение ранних стадий уха пловца включает тщательную очистку слухового прохода и использование ушных капель, которые останавливают рост бактерий или грибков и уменьшают воспаление.Прежде чем использовать какие-либо капли в ухе, важно убедиться, что у вас нет перфорированной барабанной перепонки (барабанной перепонки с отверстием).
Если слуховой проход закрыт, ваш врач может поместить в него губку или фитиль, чтобы капли антибиотика попали в опухший канал более эффективно. Местные антибиотики эффективны при инфекциях, ограниченных слуховым проходом. Также могут быть назначены пероральные антибиотики, если инфекция выходит за пределы кожи слухового прохода.
Контрольные визиты очень важны для наблюдения за вашим состоянием, повторной очистки уха и замены ушного фитиля по мере необходимости.У вашего ЛОР-специалиста есть специальное оборудование и опыт для эффективной очистки слухового прохода и лечения уха пловца. При правильном лечении большинство инфекций проходит через 7-10 дней.
Как предотвратить внешний отит?
Сухое ухо вряд ли заразится, поэтому важно не допускать попадания влаги в уши. Советы по профилактике включают:
- Используйте беруши во время плавания.
- Используйте сухое полотенце или фен (на расстоянии), чтобы высушить уши.
- Если у вас зуд, шелушение или шелушение ушей, а также большое количество ушной серы, периодически очищайте уши у ЛОР-специалиста.
- Не используйте ватные палочки для удаления ушной серы. Они могут забивать ушную серу и грязь глубже в ушной канал, удалять слой ушной серы, защищающий ухо, и раздражать тонкую кожу ушного канала. Это создает идеальную среду для заражения.
Инфекции внутреннего уха
Инфекции внутреннего уха встречаются редко. Обычно они возникают из-за вируса.Симптомы включают внезапное начало потери слуха и / или сильное головокружение.
Внезапная сенсоневральная потеря слуха
Внезапная потеря слуха чаще всего вызывается вирусом и затрагивает только одно ухо. Вам следует срочно обратиться к ЛОР-специалисту (уши, нос и горло) для лечения, чтобы попытаться восстановить слух. Симптомы также могут включать головокружение (ощущение вращения, проблемы с равновесием или головокружение), звон в ушах (тиннитус), ощущение, что ваше ухо должно лопнуть.
Как диагностируется внезапная потеря слуха?
Ваш врач проведет полное ЛОР-обследование и изучит вашу историю болезни.Будет проведена проверка слуха (аудиограмма), чтобы определить, действительно ли у вас потеря слуха, какая часть уха поражена и насколько серьезна потеря слуха. Обычные лабораторные анализы и рентгеновские снимки обычно не рекомендуются. Менее чем в 1% случаев внезапная потеря слуха происходит из-за доброкачественной (незлокачественной) опухоли слухового и уравновешивающего нервов. Ваш врач может назначить МРТ для поиска этой опухоли.
Как лечить внезапную потерю слуха?
Есть много способов лечения ССНВЛ. Чем раньше будет проведено лечение, тем успешнее будет лечение.Лечение может включать пероральные стероиды или стероиды, вводимые непосредственно в ухо (интратимпанические инъекции стероидов). Если первые методы лечения не помогли, вашему отоларингологу следует обсудить «спасительную терапию». Преимущества лечения могут включать более быстрое и полное восстановление слуха, но есть также побочные эффекты стероидов, которые необходимо учитывать при выборе из доступных вариантов. Побочные эффекты стероидов могут включать проблемы со сном, беспокойство, депрессию или перепады настроения, повышенный аппетит с возможным увеличением веса, головокружение, нервозность, высокий уровень сахара в крови и / или высокое кровяное давление.При применении интратимпанических стероидов риски включают боль, головокружение, остаточное отверстие в барабанной перепонке и инфекцию. При непосредственном сравнении интратимпаническая инъекция стероидов вызывает гораздо меньше побочных эффектов, чем пероральные стероиды.
Может быть рекомендовано бдительное ожидание. Это связано с тем, что половина пациентов может вернуть слух самостоятельно — обычно это пациенты с легкой и средней степенью потери слуха, но в настоящее время медицинские работники не могут предсказать, кому станет лучше без лечения.
Вернется ли мой слух?
Примерно половина пациентов с ССНХЛ хотя бы частично восстанавливает слух без лечения. Вероятность выздоровления пациентов после ранней стероидной терапии составляет от 75 до 80 процентов. Чем раньше начато лечение, тем выше шансы на выздоровление. Пациенты с глубокой потерей слуха, которая представляет собой полную или почти полную потерю слуха, пациенты, испытывающие головокружение (головокружение) из-за внезапной потери слуха, и люди старше 65 лет имеют гораздо меньшие шансы на восстановление слуха.В таких случаях вам и вашему лечащему врачу следует обсудить агрессивные методы лечения, чтобы попытаться вернуть слух. Восстановление слуха может занять несколько месяцев после окончания лечения.
Если у вас не происходит полного восстановления слуха, вы можете поговорить со своим отоларингологом и аудиологом о слуховых аппаратах или других устройствах, которые вы можете использовать для облегчения слуха.
Лабиринтит
Лабиринтит — заболевание, связанное с воспалением внутреннего уха. Лабиринт — это заполненный жидкостью отсек, который состоит из слуховой части внутреннего уха (улитки) и уравновешивающей части (полукружные каналы).
Лабиринтит имеет несколько различных причин, им могут быть подвержены пациенты любого возраста и пола. Пациенты с лабиринтитом могут испытывать потерю слуха в пораженном ухе, нарушение равновесия, головокружение и тошноту.
Лабиринтит — это заболевание, которое проходит самостоятельно, и обычно проходит через несколько недель. Симптомы могут начаться внезапно, а затем постепенно ухудшаться в течение нескольких часов или дней. Отказ от лечения может подвергнуть пациентов более высокому риску необратимой потери слуха и дисбаланса.Несмотря на то, что это случается редко, несмотря на лечение, возможна необратимая потеря слуха. Хотя большинство пациентов с дисбалансом и легким головокружением при движении головы выздоравливают, иногда для полного выздоровления могут потребоваться месяцы или годы. Пациентам со значительными проблемами равновесия может быть полезен специальный вид физиотерапии, называемый вестибулярной физиотерапией.
Каковы симптомы лабиринтита?
- Потеря слуха, часто в диапазоне высоких частот
- Снижение способности понимать речь
- Звон в ушах или ощущение звона или жужжания в ухе
- Неуравновешенность и неустойчивость, падение или покачивание в сторону при ходьбе
- Головокружение или ощущение, будто вы кружитесь, когда вам все еще
- Непроизвольное подергивание или подергивание глазного яблока, называемое нистагмом
- Тошнота и рвота
Каковы причины лабиринтита?
Вирусные инфекции — Наиболее частой причиной лабиринтита считаются вирусные инфекции внутреннего уха или активация вируса, находящегося в спячке внутри нервных окончаний.В большинстве случаев конкретный вирус, вызывающий это, обычно неизвестен. Уникальный тип лабиринтита может быть вызван реактивацией вируса ветряной оспы (опоясывающего лишая), который называется синдромом Рамзи Ханта или опоясывающим герпесом. Пациенты могут испытывать боль в ушах, слабость лица и волдыри вокруг уха, слухового прохода и / или барабанной перепонки в дополнение к потере слуха и головокружению.
Бактериальная инфекция —Бактериальная инфекция среднего уха (пространство за барабанной перепонкой) может распространяться на внутреннее ухо и вызывать бактериальный лабиринтит.Дети с деформациями внутреннего уха подвержены более высокому риску бактериального лабиринтита либо из-за инфекции среднего уха, либо из-за распространения бактериального менингита на внутреннее ухо. Тяжелый бактериальный лабиринтит может проявляться болью в ушах, ушной инфекцией, выделением гноя из уха, лихорадкой или ознобом. Пациентам может потребоваться госпитализация. Этот тип инфекции имеет более высокий риск необратимой потери слуха и может также привести к оссифицирующему лабиринтиту, когда после инфекции во внутреннем ухе образуется костная ткань.
Аутоиммунный — Аутоиммунный лабиринтит является редкой причиной лабиринтита и может появляться и исчезать. Это часто связано с другими аутоиммунными заболеваниями, такими как системная красная волчанка, воспалительное заболевание кишечника, ревматоидный артрит или другие аутоиммунные заболевания.
Травма и хирургия — Травма внутреннего уха подвергает пациентов риску развития лабиринтита. Переломы внутреннего уха, сотрясение головы и внутреннего уха или кровотечение во внутреннем ухе могут вызвать лабиринтит.
Как лечится лабиринтит?
Лечение большинства случаев лабиринтита включает наблюдение, постельный режим и гидратацию. Стероиды, такие как преднизон, обычно назначают для минимизации воспаления внутреннего уха. В некоторых случаях стероиды могут вводиться через барабанную перепонку в пространство среднего уха. Сильную тошноту и рвоту можно лечить с помощью лекарств от тошноты. Головокружение можно лечить антигистаминными или седативными средствами, такими как бензодиазепины, хотя длительное применение может продлить выздоровление.
Лечение бактериального лабиринтита направлено на борьбу с первичной инфекцией, которой обычно является инфекция среднего уха. Для этого могут потребоваться антибиотики, установка ушной трубки или более сложная операция на ухе. Лечение аутоиммунного лабиринтита направлено на основное аутоиммунное состояние с помощью стероидов или других иммуномодулирующих препаратов, обычно назначаемых ревматологом.
Наиболее частые проблемы уха, носа и горла
Существует множество различных заболеваний уха, носа и горла (ЛОР) и еще большее разнообразие характерных симптомов.В следующем списке представлены четыре наиболее распространенных заболевания ЛОР-органов. Не у всех будет одинаковый набор симптомов или они будут проявляться так сильно. В некоторых случаях потребуется врач или ЛОР, чтобы поставить правильный диагноз и предложить соответствующее лечение.
Jose Luis Pelaez Inc / Blend Images / Getty ImagesИнфекции уха
Инфекции уха — одно из самых распространенных заболеваний ЛОР-органов. Они возникают, когда микробы попадают во внутреннее ухо.
Евстахиева труба, крошечный канал, который берет начало в ухе и впадает в заднюю стенку глотки, обычно защищает от нежелательных микробов.Если эта трубка слишком мала или забита жидкостью и слизью, бактерии или другие микробы могут попасть в ухо и вызвать инфекцию. Взаимодействие с другими людьми
Признаки и симптомы ушной инфекции включают:
- Боль и давление
- лихорадка
- Потеря баланса
- Нарушение слуха
- Тошнота и рвота
- Выделение жидкости (указывает на перфорацию)
Инфекции уха чаще встречаются у детей, чем у взрослых, и являются наиболее распространенным типом инфекции у младенцев и детей ясельного возраста.Если у маленького ребенка инфекция уха, ее часто бывает трудно обнаружить. Отличительные признаки у младенцев и детей ясельного возраста включают:
- Дергать или дергать за уши
- Повышенная суетливость, особенно перед сном
- Неспособность испугаться громкого шума или не ответить на свое имя
- Ненормальное питание или питье
Стрептококковая инфекция
Strep — это аббревиатура от семейства бактерий под названием Streptococci . Стрептококковая ангина возникает, когда горло и окружающие его структуры заражаются этим микробом.Хотя ангина является распространенной инфекцией, многие другие инфекции имеют те же симптомы.
Симптомы обычно появляются внезапно, в том числе:
При ангины особенно отсутствуют насморк и кашель. Вы также можете заподозрить стрептококковое горло, если за последние две недели контактировали с кем-то, кто болел стрептококковой инфекцией. Наибольшему риску подвержены дети в возрасте от 5 до 15 лет. Кроме того, в зимние месяцы у вас больше шансов заразиться стрептококковой инфекцией.
Стрептококковая инфекция в горле должна быть диагностирована путем посева из горла или экспресс-теста на антиген в кабинете врача, чтобы подтвердить стрептококковую инфекцию по сравнению с другой бактериальной или вирусной инфекцией.
Синусит
Синусит возникает, когда микроб размножается в четырех полых углублениях черепа, которые окружают ваши глаза и нос. Инфекция может попасть в ловушку, вызывая воспаление, давление и боль.
Острый синусит часто является вторичным по отношению к простуде, поэтому у вас больше шансов заболеть синуситом в зимние месяцы. Хронический синусит, симптомы которого сохраняются более 12 недель, может возникать в результате нелеченой аллергии или хронического состояния, такого как бронхиальная астма.Взаимодействие с другими людьми
Симптомы синусита включают:
- Головная боль
- Кашель
- Выделения из носа
- Перегрузка
- лихорадка
- Усталость
- Зубная боль (в основном коренных зубов)
Апноэ во сне
Апноэ — это медицинский термин, означающий остановку дыхания. Апноэ во сне — это нарушение, вызывающее остановку дыхания на короткие периоды времени во время сна. Симптомы включают:
- Часто просыпаться среди ночи
- Чувство свежести после пробуждения
- Дневная сонливость
- Перепады настроения
- Депрессия
- Просыпание с сухостью, болью в горле
- Утренние головные боли
В дополнение к этим симптомам, многим людям с апноэ во сне супруги или члены семьи сказали, что они храпят, задыхаются, задыхаются или даже на мгновение перестают дышать во время сна.У вас больше шансов заболеть апноэ во сне, если у вас избыточный вес, увеличены миндалины или вы принимаете успокаивающие средства перед сном.
Обструктивное апноэ во сне (СОАС) встречается у 2% женщин среднего возраста и 4% мужчин среднего возраста, особенно у тех, кто страдает ожирением. Если не лечить, апноэ во сне может вызвать потенциально серьезные осложнения для здоровья, включая гипертонию (высокое кровяное давление), ишемическую болезнь сердца, инсульт и сердечную недостаточность.
Слово от Verywell
Большинство людей испытают одно или несколько из этих расстройств в течение своей жизни.Во время посещения врача обсуждение ваших симптомов может помочь врачу поставить диагноз ЛОР-расстройства.
Синусит (инфекция носовых пазух) | Причины, симптомы, лучшее лечение
Вы слышали о синусите, заложенности носа, носовых пазухах дренаж, инфекция носовых пазух, головная боль и аллергия.
Вы задались вопросом и попытались определить:
- У меня инфекция носовых пазух?
- Нужны ли мне антибиотики?
- Мне нужен специалист по уху, горлу, носу, чтобы вылечить мои симптомы?
- Мне нужна операция?
- А как насчет лечения лазером или баллона?
Проблемы с носовыми пазухами или ощущение, что инфекции носовых пазух вызывают проблемы, которые просто не проходят, являются одними из наиболее частых причин посещения врача.
Холод против носовых пазух
Многие люди считают, что простуда раздражает, но инфекции носовых пазух — это то, чего следует опасаться. На самом деле, оба, вероятно, являются «инфекциями носовых пазух», одна из которых вызвана вирусом, а другая, возможно, бактериями. Очень трудно различить эти два симптома — симптомы простуды по сути такие же, как симптомы инфекции носовых пазух, особенно на ранней стадии. И вирусы, и бактерии могут вызывать воспаление слизистой оболочки носа и слизистой оболочки носовых полостей.(Придаточные пазухи носа или пазухи)
Именно это воспаление приводит (или, как мы иногда предполагаем, приводит к) симптомам, которые мы считаем раздражающими:
- заложенность носа
- повышенная слизь, которая собирается скапливаться в горле
- боль в горле
- синусовое давление и
- общее ощущение, что все закупорено
Во времена, когда еще не было антибиотиков, невылеченные бактериальные инфекции иногда приводили к смертельным осложнениям для глаз и мозга.Таким образом, стало обычной практикой назначать антибиотики при симптомах, которые могут быть вызваны бактериальной инфекцией носовых пазух.
В действительности бактериальные инфекции носовых пазух встречаются только у 15% пациентов, и примерно половина этих инфекций вызвана бактериями, с которыми большинство людей обычно борется. Однако многие люди по-прежнему испытывают страх и неуверенность.
Как врачи, мы знаем, что пациенты быстрее поправляются, когда получают антибиотики для лечения инфекции носовых пазух, вызванной бактериями.Мы также знаем, что около 85% пациентов (с вирусами) не получат помощи от антибиотиков. Обычно они поправляются сами.
Итак, ОТДЫХАЕМ!
В большинстве случаев вы не причините себе вреда, если дождетесь, чтобы увидеть, как проявятся ваши симптомы.
Мы предлагаем попробовать следующие советы по лечению носовых пазух в первые дни инфекции:
- Попробуйте использовать 12-часовой противозастойный спрей в течение трех или четырех дней
- Примите стандартную дозу ибупрофена — он может облегчить многие симптомы и является противовоспалительным средством.Это также может предотвратить развитие более серьезной проблемы.
- Избегайте сморкания. Многие медицинские эксперты считают, что при сморкании бактерии, которые обычно живут в носу, попадают в пазухи носовых пазух. Воспаление носовых пазух не позволяет бактериям вымываться при обычном очищении, что может привести к более серьезной бактериальной инфекции носовых пазух.
Когда обращаться к специалисту по ушам, носу и горлу
Вам следует обратиться за советом к специалисту, если симптомы не исчезают, ухудшаются или не проходят через несколько дней.Большинство симптомов носовых пазух можно контролировать с помощью медикаментозной терапии. Хирургия используется в крайнем случае или при тяжелых инфекциях.
Многие пациенты, которым не удается облегчить симптомы хирургическим вмешательством, вероятно, сталкиваются с другой основной проблемой, которая, по всей видимости, является проблемой носовых пазух. Специалист по ушам, носу и горлу может помочь вам разобраться в этом.

 Традиционно в центре внимания клиническая эффективность, антибиотикорезистентность, целесообразность назначения тех или иных антибактериальных средств и современные подходы к антибактериальной терапии при инфекционных заболеваниях. Какое место отводится антибиотикотерапии в оториноларингологии, работе хирурга общей практики? Об этом корреспонденту «Еженедельника АПТЕКА» рассказывает доктор медицинских наук, профессор кафедры оториноларингологии Львовского государственного медицинского университета им. Данила Галицкого, действительный член Украинской академии наук НП и Международного института последипломного образования оториноларингологов им. Ж. Портмана (Франция) Мирослав Крук и кандидат медицинских наук, ассистент кафедры хирургии Киевской медицинской академии последипломного образования им. П.Л. Шупика, практикующий хирург Киевской областной клинической больницы Руслан Палиенко.
Традиционно в центре внимания клиническая эффективность, антибиотикорезистентность, целесообразность назначения тех или иных антибактериальных средств и современные подходы к антибактериальной терапии при инфекционных заболеваниях. Какое место отводится антибиотикотерапии в оториноларингологии, работе хирурга общей практики? Об этом корреспонденту «Еженедельника АПТЕКА» рассказывает доктор медицинских наук, профессор кафедры оториноларингологии Львовского государственного медицинского университета им. Данила Галицкого, действительный член Украинской академии наук НП и Международного института последипломного образования оториноларингологов им. Ж. Портмана (Франция) Мирослав Крук и кандидат медицинских наук, ассистент кафедры хирургии Киевской медицинской академии последипломного образования им. П.Л. Шупика, практикующий хирург Киевской областной клинической больницы Руслан Палиенко.
 П.Л. Шупика, практикующий хирург Киевской областной клинической больницы
П.Л. Шупика, практикующий хирург Киевской областной клинической больницы