Разведение антибиотиков № 25
Цель: Развести антибиотики.
Показания: По назначению врача.
Противопоказания: Индивидуальная непереносимость.
Оснащение:
Шприцы стерильные.
Иглы стерильные для в/м инъекций и для набора лекарственных веществ.
Раствор хлорида натрия 0,9%, стерильный.
Шарики стерильные.
Спирт 70%.
Флаконы с антибиотиками.
Лоток для сброса.
Пилочки.
Пинцет не стерильный (или ножницы).
Пинцет стерильный.
Полотенце.
Последовательность действий м/с:
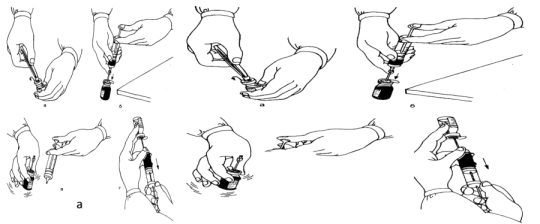
Вымойте руки и обработайте шариком со спиртом.
Возьмите флакон с антибиотиком.
Прочтите надпись на флаконе (название, доза, срок годности).
Вскройте алюминиевую крышку в центре не стерильным пинцетом.
Обработайте шариком со спиртом резиновую пробку.
Возьмите ампулу с растворителем 0,9 % раствор хлорида натрия, прочтите еще раз название.
Обработайте ампулу шариком со спиртом.
Надпилите и вскройте ампулу с растворителем.
Наберите в шприц нужное количество растворителя из расчета 1 мл (0,5 мл) растворителя на каждые 100 000 ЕД. антибиотика.

Возьмите флакон и введите в него набранный растворитель.
Отсоедините шприц, иглу оставьте во флаконе.
Встряхните флакон с иглой до полного растворения антибиотика.
Наденьте иглу с флаконом на подигольный конус шприца.
Снимите флакон вместе с иглой с подыгольного конуса шприца.
Наденьте и закрепите на подыгольном конусе шприца иглу для в/м инъекций.
Проверьте проходимость этой иглы, пропустив немного раствора через иглу.
Антибиотики разведены.
Выполнение внутрикожных инъекций № 26
Цель: Ввести внутрикожно лекарственное вещество.
Показания: По назначению врача.
Противопоказания: Выявляются в процессе обследования.
Оснащение:
Шприц стерильный 1 мл.
Иглы стерильные для в/к инъекции и для набора лекарственных веществ.
Лекарственные вещества для введения (сыворотки, аллергены, анатоксины, антибиотики и др.).
Спирт 70 %.
Шарики ватные стерильные.
Пинцет стерильный.
Пилочки.
Перчатки резиновые.
Лоток для сброса
Емкость с дез. растворами.
Полотенце.
Возможные проблемы:
Непереносимость лекарственного вещества.
Страх инъекции.
Последовательность действий м/с:
Информируйте пациента о предстоящей манипуляции и ходе ее выполнения.
Информируйте пациента о вводимом лекарственном веществе.
Помогите пациенту занять нужное положение.
Вымойте руки.
Наденьте перчатки и обработайте их шариком со спиртом.
Соберите шприц и наберите в него нужное количество лекарственного вещества.
Обработайте место инъекции спиртом, делая мазки в одном направлении.
Обхватите левой рукой предплечье пациента снаружи и натяните кожу в месте инъекции.
Возьмите шприц с иглой в правую руку.
Введите в кожу конец иглы, держа ее срезом вверх почти параллельно коже.
Перенесите на поршень левую руку и введите назначенную дозу лекарственного вещества.
Извлеките быстрым движением иглу и приложите сухой стерильный шарик.
Обработайте шприц, иглы, использованные шарики в соответствии с требованиями санэпидрежима.
Объясните пациенту, что на место инъекции не должна попадать вода в течение определенного времени (если инъекция выполнялась с диагностической целью).
Лекарственное вещество введено внутрикожно.
Цефтазидим, 1 г, порошок для приготовления раствора для внутривенного и внутримышечного введения, 1 шт.
Препарат Цефтазидим-АКОС применяют только парентерально: внутривенно (струйно или капельно) или внутримышечно. Доза препарата устанавливается индивидуально, с учетом тяжести течения заболевания, локализации инфекции, вида и чувствительности возбудителя, возраста и функции почек.
Препарат вводят внутривенно (струйно или капельно) или глубоко внутримышечно в область верхнего наружного квадранта большой ягодичной мышцы или в область латеральной части бедра. Раствор цефтазидима можно вводить непосредственно в вену или в трубку инфузионной системы.
Обычная доза для взрослых и детей старше 12 лет составляет 1 г внутримышечно или внутривенно каждые 8-12 часов.
При неосложненных инфекциях мочевыводящих путей — внутримышечно или внутривенно по 250 мг каждые 12 часов.
При осложненных инфекциях мочевыводящих путей — в/м или внутривенно по 0.5-1 г каждые 8-12 ч.
При неосложненной пневмонии, инфекциях кожи и мягких тканей — внутримышечно или внутривенно по 0.5-1 г каждые 8 часов.
При муковисцидозе, инфекциях дыхательных путей, вызванных Pseudomonas spp. — внутривенно в дозе 100-150 мг/кг/сут, кратность введения — 3 раза/сут (применение дозы до 9 г/сут у таких пациентов не вызывало осложнений).
При инфекциях костей и суставов — внутривенно по 2 г каждые 12 часов.
При тяжелых инфекциях, включая внутрибольничные — внутривенно по 2 г каждые 8 часов.
При крайне тяжелых или жизнеугрожающих инфекциях — внутривенно по 2 г каждые 8 часов.
Пациентам пожилого возраста максимальная суточная доза не должна превышать 3 г.
Пациентам с почечной недостаточностью требуется снижение дозы, т.к. цефтазидим выводится почками в неизмененном виде. Начальная доза составляет 1 г. Поддерживающую дозу подбирают в зависимости от скорости гломерулярной фильтрации.
Клиренс креатинина Доза >50 мл/мин (>0.83 мл/сек)Обычная доза для взрослых и детей старше 12 лет35-50 мл/мин (0.52-0.83 мл/сек)по 1 г каждые 12 часов16-30 мл/мин (0.27-0.5 мл/сек)по 1 г каждые 24 часа6-15 мл/мин (0.1-0.25 мл/сек)по 500 мг каждые 24 часапо 500 мг каждые 48 часовПациенты, находящиеся на гемодиализепо 1 г после каждого сеанса гемодиализаПациенты, находящиеся на перитонеальном диализепо 500 мг каждые 24 часа
Пациентам с тяжелыми инфекциями можно увеличить поддерживающую дозу на 50% или увеличить частоту введения препарата. В этом случае следует контролировать уровень цефтазидима в сыворотке крови, сывороточная концентрация цефтазидима при этом не должна превышать 40 мг/л.
В этом случае следует контролировать уровень цефтазидима в сыворотке крови, сывороточная концентрация цефтазидима при этом не должна превышать 40 мг/л.
Для детей клиренс креатинина рассчитывается в соответствии с идеальной массой или площадью поверхности тела.
T1/2 препарата во время гемодиализа составляет 3-5 часов. Соответствующую дозу препарата следует повторять после каждого периода диализа.
При перитонеальном диализе цефтазидим можно включать в диализный раствор в дозе от 125 мг до 250 мг на 2 л диализного раствора.
У пациентов с почечной недостаточностью, находящихся на непрерывном гемодиализе с использованием артериовенозного шунта, и у пациентов, находящихся на гемофильтрации высокой скорости в отделении интенсивной терапии , рекомендуемые дозы — 1 г/сутки ежедневно (в 1 или несколько введений).
У пациентов, находящихся на гемофильтрации низкой скорости , назначают дозы, рекомендуемые при нарушении функции почек.
Детям в возрасте до 2 месяцев назначают 25-60 мг/кг/сутки (в 2 введения).
Детям от 2 месяцев до 12 лет назначают 30-100 мг/кг/сутки (в 2-3 введения).
Детям со сниженным иммунитетом, муковисцидозом и менингитом — 150 мг/кг/сутки (в 3 введения).
Максимальная суточная доза цефтазидима для детей составляет 6 г.
Продолжительность лечения
Длительность лечения цефтазидимом составляет 7-14 дней. При инфекциях, вызванных Pseudomonas aeruginosa (пневмония, муковисцидоз, менингит), курс лечения может быть увеличен до 21 дня.
Правила приготовления растворов
При растворении порошка выделяется углекислый газ (диоксид углерода). После введения растворителя флакон необходимо встряхивать, чтобы получился прозрачный раствор. В полученном готовом растворе препарата могут присутствовать небольшие пузырьки углекислого газа (диоксида углерода).
Полученный раствор может иметь цвет от светло-желтого до темно-желтого. Если соблюдены все рекомендуемые правила разведения препарата, то его эффективность не зависит от оттенка.
Первичное разведение
Доза Объем расторителя для внутримышечного введения Объем расторителя для внутривенного введения 500 мг1.5 мл воды для инъекций или 0.5% или 1% раствора лидокаина гидрохлорида5 мл воды для инъекций1 г или 2 г3 мл воды для инъекций или 0.5% или 1% раствора лидокаина гидрохлорида10 мл воды для инъекций
Вторичное разведение
Для внутривенно капельного введения полученный вышеописанным способом раствор препарата Цефтазидим-АКОС дополнительно разводят в 50-100 мл одного из следующих растворителей, предназначенных для внктривенного введения (0.9% раствор натрия хлорида, раствор Рингера, 5% или 10% раствор декстрозы (глюкозы), 5% раствор декстрозы (глюкозы) с 0.9% раствором натрия хлорида. Для вторичного разведения следует использовать только свежеприготовленный раствор.
Медицинские ошибки при применении антибактериальных препаратов группы цефалоспоринов Текст научной статьи по специальности «Клиническая медицина»
КМ АХ
www.antibiotic.ru/cmac/
Медицинские ошибки при применении антибактериальных препаратов группы цефалоспоринов
Кузьмина А.В.1, Асецкая И.Л.1,2, Поливанов В.А.1, Зырянов С.К.2, Глаголев С.В.3
1 ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора, Москва, Россия
2 ФГАОУ ВО «Российский университет дружбы народов» Минобрнауки России, Москва, Россия
3 Федеральная служба по надзору в сфере здравоохранения, Москва, Россия
Цель. Изучить структуру медицинских ошибок, совершаемых при применении антибиотиков группы цефалоспоринов, на основе анализа российской базы спонтанных сообщений о нежелательных реакциях.
Материалы и методы. В данное исследование было включено 2324 спонтанных сообщения, поступивших в российскую базу данных нежелательных реакций за период с 01.01.2012 по 01.08.2014 года, где в качестве подозреваемого препарата указан антибиотик группы цефалоспоринов. Для выявления случаев медицинских ошибок использовались утвержденные в РФ инструкции по медицинскому применению лекарственных препаратов, а также стандарты оказания медицинской помощи и клинические рекомендации по отдельным нозологиям.
Результаты. Частота медицинских ошибок при использовании антибактериальных препаратов группы цефалоспоринов выявлена нами в 25,2% спонтанных сообщений, включенных в исследование. При этом в 13,1% из этих случаев при лечении пациента было допущено одновременно 2 и более ошибок. Была выявлена высокая частота неверных назначений при использовании цефалоспоринов в педиатрической практике — 53,2% всех ошибок приходится на возрастную группу до 1 8 лет. Наиболее распространенным видом медицинских ошибок (35,9%) является назначение антибиотика при отсутствии показаний/по незарегистрированному показанию, при этом в 60,0% случаев в качестве такого показания выступали различные заболевания вирусной этиологии.
Выводы. Результаты проведенного исследования демонстрируют эффективность использования метода спонтанных сообщений для выявления случаев медицинских ошибок при применении лекарственных препаратов. Следует обратить особое внимание врачей, в особенности педиатров, на нерациональность превентивного назначения антибиотиков при вирусных инфекциях.
Medication errors associated with the use of cephalosporins
Kuzmina A.V.1, Asetskaya I.L.1,2, Polivanov V.A.1, Zyryanov S.K.2, Glagolev S.V.3
1 Federal State Budget Institution «Information and Methodological Center for Expertise, Stocktaking and Analysis of Circulation of Medical Products» of Roszdravnadzor, Moscow, Russia
2 RUDN University, Moscow, Russia
3 Federal Service for Surveillance in Healthcare, Moscow, Russia
Objective. To discover the prevalence and types of medication errors associated with the use of cephalosporins through analysis of national spontaneous reporting database.
To discover the prevalence and types of medication errors associated with the use of cephalosporins through analysis of national spontaneous reporting database.
Materials and Methods. We conducted a retrospective analysis of 2324 spontaneous reports concerning adverse drug reactions associated with the cephalosporins. All the reports were submitted to the Russian pharmacovigilance database between 01.01.2012 and 01.08.2014. Approved prescribing drug information, standards of medical care and practical guidelines for certain conditions were used to identify medication errors associated with specific products.
Results. Medication errors were detected for 25.2% of all the spontaneous reports. In 13.1% of these cases two or more errors were made. High prevalence of incorrect use of cephalosporins was discovered in pediatric population — in 53.2% of all the cases of medication errors the patients were under 1 8 years old. In 35.9% cases of wrong prescription the indication was absent or inappropriate, in 60.0% of these cases antibiotic was used for viral infections.
Conclusions. In our opinion, spontaneous reporting is an effective method of identification of medication errors. We suggest emphasizing the importance of the following aspect: doctors should avoid prescribing antibiotics in viral infections, especially in children.
КЛИНИЧЕСКАЯ МИКРОБИОЛОГИЯ И АНТИМИКРОБНАЯ ХИМИОТЕРАПИЯ
Том 19 №1
2017
Контактный адрес:
Анна Вячеславовна Кузьмина
Эл. почта: [email protected]
Ключевые слова: антибактериальные препараты, цефалоспорины, медицинские ошибки, фармаконад-зор, спонтанные сообщения.
Contacts:
Anna V. Kuzmina
E-mail: [email protected]
Key words: antibiotics, cephalosporins, medication errors, pharmacovigilance spontaneous reports.
Кузьмина А.В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
Введение
Антибактериальные препараты (АБП) являются одним из самых многочисленных и широко используемых в практическом здравоохранении классов лекарственных средств. В России в тройку наиболее востребованных групп антибиотиков по валовым объемам продаж в течение многих лет входят цефалоспорины, макролиды и пенициллины; на них приходится более половины рынка антибактериальных средств [1]. По данным аптечного аудита фармацевтического рынка России, проводимого DSM Group, первое место в рейтинге брендов по натуральным объемам продаж (упаковок) за первый квартал 2016 года занимает препарат цефтриаксон. Этот же препарат являлся лидером рейтинга и в 2015 году. Другие представители группы цефалоспори-нов — цефазолин и цефотаксим — занимали, соответственно, 3 и 5 место по объемам продаж за 2015 год [2].
В связи с широким использованием в клинической практике антибиотиков, и, в частности, цефалоспоринов, следует особенно серьезно относиться к изучению и оценке рисков, связанных с антибактериальной терапией. Особое место занимает проблема медицинских ошибок (МО), допускаемых при применении антибактериальных препаратов.
Исполнительный комитет Всемирной Организации Здравоохранения (ВОЗ) еще в январе 2002 г. рассмотрел специальную резолюцию «Качество здравоохранения и безопасность больных», где отмечается, что, несмотря на возрастающий интерес к теме безопасности лечения, в мире еще нет осознания чрезвычайной важности проблемы неблагоприятных побочных реакций и ошибок при оказании медицинской помощи.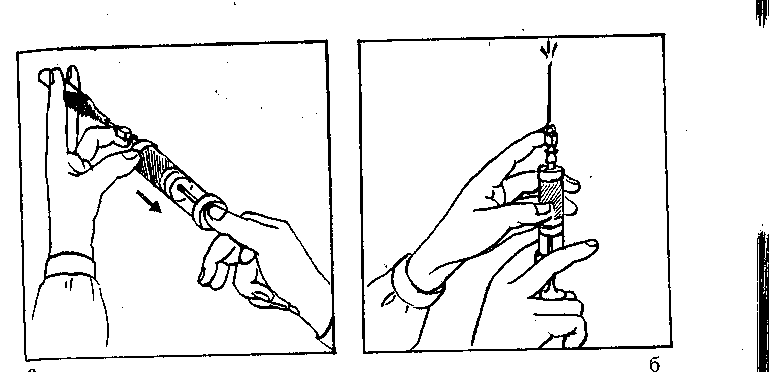 В основном это связано с недостаточностью специальных исследований и фактических данных по этому вопросу [3].
В основном это связано с недостаточностью специальных исследований и фактических данных по этому вопросу [3].
В Правилах надлежащей практики фармаконадзора — руководстве, разработанном регуляторными органами государств-членов Евразийского экономического союза -представлено следующее определение: ошибка применения лекарственного препарата (ЛП) — это любая непреднамеренная ошибка работника системы здравоохранения, пациента или потребителя в назначении, отпуске, дозировке или введении/приеме лекарственного препарата [4].
Согласно статистике Европейского Агентства по лекарственным средствам (EMA) в Европе при оказании амбулаторной помощи частота лекарственных медицинских ошибок составляет 7,5% на этапе выписки рецептов и 0,08% — на этапе отпуска препарата, в стационаре частота ошибок колеблется от 0,3 до 9,1% на этапе выбора и от 1,6 до 2,1% на этапах отпуска и введения ЛП [5].
Проблема медицинских ошибок при применении проти-вомикробных препаратов особенно актуальна, так как неверное, в том числе избыточное, использование ЛП данной группы приводит к росту лекарственной устойчивости микроорганизмов, что может иметь существенные последствия для всего мирового здравоохранения.
Учитывая клиническую значимость антибиотиков, чрезвычайно важным является получение объективной информации обо всех возможных эффектах противомикробной фармакотерапии. Только постоянный фармаконадзор за находящимися в обращении лекарственными препаратами позволяет составить адекватное представление о профиле их безопасности. Одним из основных методов фармаконадзора
Кузьмина А.В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
во многих странах, в том числе в РФ, является метод спонтанных сообщений (СС). Метод основан на информировании специалистами здравоохранения уполномоченного федерального органа (в РФ — Росздравнадзора) о выявляемых нежелательных реакциях (НР) лекарственных препаратов. СС вносятся в национальную компьютерную базу данных, детальный анализ которой позволяет не только получить ценные сведения о безопасности ЛП, в том числе антибиотиков, при их применении в широкой клинической практике, но и выявить случаи их ошибочного использования, определить приоритетные проблемы в этой области и разработать меры, направленные на снижение рисков антибактериальной терапии.
Метод основан на информировании специалистами здравоохранения уполномоченного федерального органа (в РФ — Росздравнадзора) о выявляемых нежелательных реакциях (НР) лекарственных препаратов. СС вносятся в национальную компьютерную базу данных, детальный анализ которой позволяет не только получить ценные сведения о безопасности ЛП, в том числе антибиотиков, при их применении в широкой клинической практике, но и выявить случаи их ошибочного использования, определить приоритетные проблемы в этой области и разработать меры, направленные на снижение рисков антибактериальной терапии.
Цель работы
Изучить структуру медицинских ошибок, совершаемых при применении антибиотиков группы цефалоспоринов, на основе анализа национальной базы спонтанных сообщений о нежелательных реакциях.
Материалы и методы
Объектом исследования в данной работе были спонтанные сообщения о нежелательных реакциях, возникших на фоне применения АБП группы цефалоспоринов, зарегистрированные в базе данных подсистемы «Фармаконадзор» АИС Росздравнадзора за период с 01.01.201 2 года по 01.08.2014 года.
Анализу подлежали первичные сообщения с учетом важной информации, содержащейся в некоторых повторных сообщениях. Исключались из исследования дубликаты и невалидные СС.
Для выявления случаев медицинских ошибок, связанных с назначением АБП, использовались утвержденные в Российской Федерации инструкции по медицинскому применению ЛП, доступные на сайте государственного реестра лекарственных средств по электронному адресу: http://grls.rosminzdrav.ru/, а также стандарты оказания медицинской помощи и клинические рекомендации по отдельным нозологиям, которые встречались в нашем исследовании.
В работе использовалась классификация возрастных периодов человека, основанная на принятой Всемирной Организацией Здравоохранения в 201 2 году периодизации [6]. Были выделены следующие группы: от рождения до 1 7 лет — детский возраст, от 18 до 44 лет — молодой возраст, 45-59 лет — средний возраст, 60-74 года — пожилые, 75-89 лет — старческий возраст, а после 90 — долгожители.
Были выделены следующие группы: от рождения до 1 7 лет — детский возраст, от 18 до 44 лет — молодой возраст, 45-59 лет — средний возраст, 60-74 года — пожилые, 75-89 лет — старческий возраст, а после 90 — долгожители.
В анализ вошли АБП группы цефалоспоринов, зарегистрированные в РФ, со следующими МНН: цефазолин, цефотаксим, це-фуроксим, цефоперазон, цефоперазон/сульбактам, цефтазидим, цефтриаксон, цефиксим, цефтибутен, цефепим, цефалексин, це-фокситин, цефаклор, цефамандол, цефдиторен, цефпиром, цеф-подоксим, цефтаролина фосамил, цефтизоксим, цефтобипрол.
Результаты исследования
Общая структура медицинских ошибок при назначении антибактериальных препаратов группы цефалоспоринов
В базу данных «Фармаконадзор» за период с 01.01.201 2 по 01.08.2014 гг. поступило 2324 первичных СС о НР, развившихся на фоне использования АБП группы цефалоспоринов, что составило 6,2% от общего количества всех
первичных СС за указанный временной интервал. Также нами учитывалась информация повторных СС в 62 случаях. При анализе факты совершения МО при применении антибиотиков группы цефалоспоринов были выявлены в 586 сообщениях, т.е. в 25,2% случаев, при этом отправители самостоятельно указали на ошибки при использовании лекарственного препарата только в 13 СС (2,2%). В большинстве СС (509) содержалась информация о совершении 1 медицинской ошибки, в 72 СС — о 2-х МО, в 5 СС — о 3-х МО. Таким образом, общее количество обнаруженных ошибок составило 668.
Следует отметить, что мы исключили из анализа 1 02 СС, где, предположительно, могли быть МО, связанные с игнорированием аллергологического анамнеза, так как по нашему опыту подобные ситуации могут объясняться неверным заполнением формы-извещения о НР: незнанием репортера, что в графе «аллергия» следует отражать данные аллергоанамнеза, т. е. предыдущий (а не настоящий) опыт использования препарата [7].
е. предыдущий (а не настоящий) опыт использования препарата [7].
В 56,4% всех сообщений с фактами МО указывался женский пол пациентов, в 42,3% — мужской, в 1,2 % — информация по данному разделу отсутствовала.
Важным представляется тот факт, что самая высокая частота ошибок, допускаемых при использовании изучаемой группы препаратов, приходится на педиатрическую популяцию — 53,2% всех случаев (312 СС) неверных назначений было выявлено у детей до 18 лет. В 121 сообщении о МО (20,6%) пациенты были молодого возраста (от 18 до 44 лет). Доля ошибок при применении АБП у лиц среднего и пожилого возраста составила 11,4% (67 СС) и 8,2% (48 СС) соответственно. При использовании АБП у лиц старческого возраста (75-89 лет) МО выявлены в 5,1% случаев (30 сообщений). 1 СС касается использования цефалоспоринового антибиотика у больного старше 90 лет. В 7 СС (1,2%) возраст больных не был указан (Рисунок 1).
Так как большинство цефалоспоринов выпускаются в инъекционных формах и являются препаратами для стационаров, частота лекарственных медицинских ошибок была значительно выше на госпитальном этапе оказания помощи, чем на амбулаторном — 85,8% и 7,6% соответственно (519 и 46 сообщений). Несмотря на то, что данные ЛП не предназначены
312
Рисунок 1. Количество СС с МО при применении цефалоспоринов у пациентов разных возрастных групп
для терапии неосложненных форм заболеваний в домашних условиях и должны отпускаться из аптек по рецепту врача, нами был выявлен 31 случай использования препаратов этой группы, в том числе для парентерального введения, при самолечении (Рисунок 2). В нашем исследовании в большинстве случаев ошибки при самостоятельном использовании АБП больными приводили к развитию серьезных НР, что для одной пациентки закончилось летальным исходом (см. ниже).
ниже).
Виды медицинских ошибок при применении антибиотиков группы цефалоспоринов.
Все группы выявленных нами ошибок представлены в Таблице 1.
Медицинские ошибки, связанные с применением антибиотика при отсутствии показаний и/или наличии противопоказаний
Как видно из таблицы 1, самой частой ошибкой является назначение антибиотика при отсутствии к нему показаний, либо по незарегистрированному показанию. Данный вид МО составляет более трети всех случаев (35,9%) ошибочного применения антибактериальных препаратов. При этом в 60,0% из этих случаев АБП использовали для лечения вирусных заболеваний: в 132 сообщениях (55,0%) — при ОРВИ, в 5 (2,1%) — для лечения больных с аденовирусной инфекцией, в 4 (1,7%) — с целью терапии других вирусных инфекций (без дополнительных уточнений), в 3 случаях (1,3%) — при инфекционном мононуклеозе. В настоящее время доказано, что превентивное назначение антибиотиков при вирусных заболеваниях не предотвращает возможность развития бактериальных осложнений, но при этом чревато формированием устойчивости бактерий к данным противо-микробным лекарственным препаратам [8]. Кроме того, использование антибиотиков в подобных случаях при сомнительной их эффективности может сопровождаться развитием нежелательных реакций (в частности, аллергических), что приводит к неблагоприятному соотношению польза/риск такого лечения. Результаты нашего исследования показали, что из 1 32 случаев использования антибиотиков группы цефалоспоринов при ОРВИ у 61 пациента
■ Стационарное
■ Амбулаторное Самолечение
86%
Рисунок 2. Распределение сообщений с МО в зависимости от этапов оказания медицинской помощи
Кузьмина А. В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
(46,2%) развились серьезные НР, в том числе 8 случаев анафилактического шока и 2 эпизода тяжелого ангионевроти-ческого отека. К другим неверным показаниям мы относили также случаи назначения цефалоспоринов для лечения лихорадки (13 сообщений — 5,4%) или с целью противовоспалительной терапии (13 сообщений — 5,4%).
20,8% всех выявленных МО касаются использования АБП при наличии противопоказаний к его применению. Согласно нашим результатам, в большинстве подобных сообщений (в 88 из 139 — 63,3%) таким противопоказанием
Таблица 1. Виды и распространенность медицинских ошибок
при применении антибиотиков группы цефалоспоринов
Тип ошибки Число случаев %
Использование по незарегистрированному показанию/при отсутствии показаний
Назначение при наличии противопоказаний
Использование в дозе, превышающей рекомендуемую
Нарушение кратности применения ЛП
Использование в более низких дозах, чем рекомендовано
Большая длительность терапии
Несвоевременная отмена ЛП при развитии НР
Нерациональная смена АБП при его неэффективности
Неверное приготовление раствора ЛП
Несвоевременная смена АБП при его неэффективности
Применение по неоговоренному в инструкции пути введения
Нерациональная комбинация ЛП
Неверная оценка эффективности
Неверная тактика лечения
Неверная схема лечения
Итого
являлось наличие в прошлом у пациента аллергии на данный препарат или на другие бета-лактамные антибиотики. Еще в 35,3% случаев (49 СС из 1 39) ошибки были обусловлены игнорированием возрастных ограничений на использование ЛП, в том числе, определенных путей их введения. В частности, в большом количестве сообщений (44 СС) содержалась информация о внутримышечном введении цефотаксима детям до 2,5 лет (согласно инструкции к препарату, такой способ применения в данной возрастной группе противопоказан). В 3 случаях ошибка заключалась в назначении цефе-пима детям младше 2 месяцев.
Еще в 35,3% случаев (49 СС из 1 39) ошибки были обусловлены игнорированием возрастных ограничений на использование ЛП, в том числе, определенных путей их введения. В частности, в большом количестве сообщений (44 СС) содержалась информация о внутримышечном введении цефотаксима детям до 2,5 лет (согласно инструкции к препарату, такой способ применения в данной возрастной группе противопоказан). В 3 случаях ошибка заключалась в назначении цефе-пима детям младше 2 месяцев.
Кузьмина А.В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
Медицинские ошибки, связанные с нарушением дозового режима
Почти четверть всех случаев медицинских ошибок (196 СС — 24,7%) в целом связаны с различными нарушениями дозового режима: несоблюдение кратности применения препарата встречается в 55 СС (8,2%), в 92 случаях (13,8%) имело место превышение рекомендуемой дозы АБП, в 9 случаях (1,3%) — использование антибиотика в низкой дозе, еще в 9 случаях (1,3%) указана слишком большая длительность терапии.
Следует подчеркнуть, что особенностью фармакодина-мики цефалоспоринов является их принадлежность к лекарственным препаратам с время-зависимым антимикробным действием. Цель режимов дозирования таких препаратов — сохранение в сыворотке крови и очаге инфекции концентрации препарата в 3-4 раза превышающей минимальную подавляющую концентрацию в течение не менее 40-60% временного интервала между дозами [9]. Поэтому для повышения эффективности цефалоспоринов более важно соблюдать кратность введения, а не увеличивать однократные дозы.
Хотя ни в одном сообщении, где была выявлена меньшая кратность применения АБП, не указывалось на неэффективность проводимой антибактериальной терапии, следует отметить, что в международной практике подобные отклонения от представленных в инструкциях рекомендаций рассматриваются как серьезные из-за повышенного риска развития резистентных штаммов микроорганизмов.
Нами был обнаружен только один случай, когда использование АБП в дозе ниже, чем того требует инструкция, могло явиться причиной неэффективности лечения, но практика использования низких доз АБП также активно критикуется в рамках проблемы бактериальной резистентности.
Ошибки, связанные с нарушением длительности приема препарата, не всегда выявляются методом спонтанных сообщений, так как при появлении нежелательной реакции подозреваемый ЛП в большинстве случаев отменяют — досрочно прекращают лечение, либо проводят смену терапии. Нам удалось установить МО подобного рода только в тех сообщениях, где НР носили отстроченный характер и возникали через некоторое время после окончания полного курса лечения.
В 37 сообщениях (5,5%) описаны случаи, когда после появления начальных признаков аллергических реакций, прием подозреваемого ЛП был продолжен. Подобные действия чреваты нарастанием тяжести НР, что может увеличить временные и финансовые затраты на устранение возникших симптомов.
Медицинские ошибки, связанные с неправильной тактикой применения антибиотика
В 28 сообщениях (4,2%) имелась информация о нерациональной смене АБП. Примером может служить следующая ситуация. Женщина 40 лет получала стационарное лечение по поводу внебольничной пневмонии: в течение 5 дней проводилось внутривенное введение цефоперазона/сульбактама (антибиотик группы цефалоспоринов III поколения + ингибитор бета-лактамаз), затем пациентку перевели на цефтазидим (це-фалоспориновый антибиотик III поколения) внутримышечно, инъекции делали в течение еще трех дней, после чего по тому же показанию был назначен цефтриаксон (также цефалоспорин III поколения) внутримышечно. В первый день использования цефтриаксона у пациентки развилась аллергическая реакция
240 139 92 55
9
9
37 28 27
10
7
6
3 3 1
668
35,9%
20,8%
13,8%
8,2%
1,3% 1,3%
5,5%
4,2%
4,0%
1,5%
1,0%
0,9%
0,4% 0,4% 0,1% 100%
по типу крапивницы, которая потребовала отмены противомик-робного препарата и назначения лекарственной терапии в виде преднизолона и супрастина. Нежелательная реакция полностью разрешилась в течение суток. О причинах смены антибиотиков и результатах лечения пневмонии не сообщается.
Нежелательная реакция полностью разрешилась в течение суток. О причинах смены антибиотиков и результатах лечения пневмонии не сообщается.
Нам удалось выявить 10 случаев (1,5% СС с МО), когда пациенты продолжали принимать антибиотик в течение недели и даже более при отсутствии признаков эффективности назначенного лечения. В еще в 3-х сообщениях (0,4%) имела место неверная оценка эффективности терапии, когда о неуспешности лечения судили уже через сутки после начала применения АБП. Согласно общепринятым рекомендациям, первоначальная оценка эффективности антибактериальной терапии проводится через 48-72 часа после начала лечения. Основными критериями эффективности являются, прежде всего, уменьшение выраженности симптомов заболевания, снижение температуры тела ниже 37,5 градусов, улучшение лабораторных показателей [10, 11]. Если в течение первых трех суток с начала приема антибиотика улучшения не наступает, следует провести смену АБП [11].
Ошибки, связанные с нерациональной комбинацией лекарственных препаратов, в основном включали в себя случаи одновременного назначения двух антибиотиков группы цефа-лоспоринов. Примером такой ситуации может быть сообщение, когда у ребенка 8 месяцев для лечения острого инфекционного гастроэнтероколита (возбудитель не указан) применялись два цефалоспорина III поколения с разными путями введения — це-фиксим перорально и цефтриаксон внутримышечно. На фоне лечения на лице и груди пациента появилась сыпь по типу крапивницы. Также в эту группу ошибок вошли два сообщения о неблагоприятном лекарственном взаимодействии: в 1 случае мужчине 78 лет с пиелонефритом и хронической почечной недостаточностью был назначен цефотаксим в сочетании с ами-кацином, в другом случае женщина 61 года также для лечения пиелонефрита получала цефотаксим в комбинации с гентами-цином. Повышение креатинина в плазме крови, нарушение работы почек являются хорошо известными, описанными нежелательными реакциями как для цефотаксима, так и для амикацина и гентамицина. При одновременном приеме цефо-таксима с аминогликозидами увеличивается риск нефротоксич-ности, что у пациентов с уже имеющимися нарушениями почечной функции может приводить к серьезным последствиям.
При одновременном приеме цефо-таксима с аминогликозидами увеличивается риск нефротоксич-ности, что у пациентов с уже имеющимися нарушениями почечной функции может приводить к серьезным последствиям.
Ошибки, связанные с неверной лечебной тактикой, включали в себя 2 случая назначения лоперамида пациентам с развившейся на фоне антибиотикотерапии Clostridium difficile -ассоциированной диареей (в обоих случаях в кале больных были обнаружены клостридиальные цитотоксины). Применение антидиарейных препаратов при данном заболевании строго противопоказано из-за опасности развития тяжелого осложнения — токсического мегаколона.
К ошибкам, связанным с отклонениями от существующей схемы лечения заболевания, было отнесено следующее сообщение: мужчине 35 лет в течение 8 дней вводили цефурок-сим внутривенно по показанию пневмония. Согласно инструкции по применению данного препарата, при пневмонии рекомендовано внутривенное введение этого антибиотика в течение первых трех дней лечения, далее следует перевести пациента на пероральный прием цефуроксима в форме таблеток. Безусловно, подобное отклонение от инструкции не является серьезным нарушением, так как не может негативно повлиять на эффективность проводимой терапии либо нанести другой
вред больному. Однако при назначении лечения следует принимать во внимание фармакоэкономические аспекты, а также удобство использования препарата. По двум указанным пунктам выбранная в данном случае схема лечения не является оптимальной.
Медицинские ошибки, связанные с нарушением способа введения антибиотика
4,0% ошибок (27 СС) были связаны с неверным приготовлением раствора антибиотика. Данные ошибки были выявлены для цефалоспоринов со следующими МНН: цефтриаксон — 7,9% всех МО при применении этого препарата (20 СС), цефотаксим — 3,4% МО (6 СС), цефуроксим — 3,6% МО (1 СС). В 20 СС указано, что в качестве растворителя для антибиотика перед его внутримышечным введением применялся новокаин, в то время как по инструкции допустимо использование только 1% лидокаина или воды для инъекций. В 5 сообщениях применялся лидокаин 2%. Имеется одно сообщение о случае с летальным исходом: пациентка 50 лет в домашних условиях без назначения врача развела цефтриаксон 10%-ным раствором лидокаина, после внутримышечного введения препаратов наступила смерть больной, причина смерти не указана, дополнительная информация по данному случаю недоступна. В одном сообщении содержится информация о получении при неправильном разведении цефуроксима вязкой суспензии, кристаллы порошка забивали просвет инъекционной иглы, что делало невозможным введение препарата, в результате чего ошибка была своевременно обнаружена. Использовавшийся первоначально растворитель в сообщении не назван, но указано, что после разведения порошка цефуроксима водой для инъекций, согласно инструкции, физико-химические свойства получившегося раствора были удовлетворительными.
В 20 СС указано, что в качестве растворителя для антибиотика перед его внутримышечным введением применялся новокаин, в то время как по инструкции допустимо использование только 1% лидокаина или воды для инъекций. В 5 сообщениях применялся лидокаин 2%. Имеется одно сообщение о случае с летальным исходом: пациентка 50 лет в домашних условиях без назначения врача развела цефтриаксон 10%-ным раствором лидокаина, после внутримышечного введения препаратов наступила смерть больной, причина смерти не указана, дополнительная информация по данному случаю недоступна. В одном сообщении содержится информация о получении при неправильном разведении цефуроксима вязкой суспензии, кристаллы порошка забивали просвет инъекционной иглы, что делало невозможным введение препарата, в результате чего ошибка была своевременно обнаружена. Использовавшийся первоначально растворитель в сообщении не назван, но указано, что после разведения порошка цефуроксима водой для инъекций, согласно инструкции, физико-химические свойства получившегося раствора были удовлетворительными.
Примером применения препарата по неоговоренному в инструкции пути введения может служить случай введения цефазо-лина в брюшную полость с целью лечения перитонита. В данном сообщении имеют место сразу две медицинских ошибки: во-первых, цефазолин не должен использоваться для лечения осложненных интраабдоминальных инфекций, так как этот антибиотик обладает узким спектром действия, а во-вторых, согласно существующим рекомендациям, антибактериальные препараты при перитоните следует вводить внутривенно [1 2-14]. В инструкции по медицинскому применению цефазолина указано, что раствор препарата предназначен для внутримышечного и внутривенного введения.
Обсуждение результатов
Проведенный нами анализ СС о НР, возникших на фоне применения АБП группы цефалоспоринов, показал, что лекарственный препарат назначался с МО в 25,2% случаев. Согласно нашим данным, средняя частота ошибок при использовании цефалоспоринов оказалась ниже, чем при использовании антибиотиков пенициллинового ряда, для которых ошибки были выявлены в 36,9% назначений [7].
Согласно нашим данным, средняя частота ошибок при использовании цефалоспоринов оказалась ниже, чем при использовании антибиотиков пенициллинового ряда, для которых ошибки были выявлены в 36,9% назначений [7].
В данном исследовании мы зарегистрировали высокую долю неверных назначений цефалоспоринов у детей — 53,2% всех ошибок приходится на возрастную группу до 1 8 лет. Проведенный нами литературный поиск среди отечественных и зарубежных источников не выявил подобных работ по изучению МО данной группы антибиотиков в детской практике. Следует отметить, что у цефалоспоринов, безусловно, широкое поле использования в педиатрии, причем они могут применяться и
Кузьмина А.В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
амбулаторно (оральные), и в стационаре — при тяжелых инфекционных заболеваниях, приводящих к госпитализации пациентов, и в случаях развития нозокомиальных инфекций. Цефалоспорины отвечают основным требованиям, предъявляемым к антибиотикам для их использования у детей, в том числе первого года жизни, — обладают высокой степенью безопасности и системностью действия, в связи с чем в настоящее время это одна из наиболее широко применяемых групп про-тивомикробных препаратов в педиатрии [15]. Наряду с этим, в последнее время появляется все больше статей о злоупотреблении в использовании противомикробных препаратов у детей, необоснованном назначении данных ЛП с превентивной целью и без учета утвержденных показаний к их применению [16-18]. Согласно информации, представленной в публикациях, теоретически большинство врачей знает и понимает нецелесообразность антибактериальной терапии при острых респираторных вирусных инфекциях, однако на практике под влиянием различных причин (профилактика осложнений, ранний возраст, административные установки и др.) антибактериальные препараты назначаются, причем нередко проводятся неадекватные курсы лечения или применяются явно заниженные возрастные дозы [1 7]. Результаты нашего исследования согласуются с имеющимися литературными данными: наиболее частым видом МО при применении цефалоспоринов является назначение антибиотика при отсутствии показаний к его применению/по незарегистрированному показанию. Но также нам удалось выявить и другие проблемы, которые существуют при использовании антибиотиков в педиатрической практике, в частности, игнорирование возрастных ограничений на использование определенных ЛП или путей их введения.
Не теряет актуальности вопрос качества сбора лекарственного анамнеза у пациента. 13,2% всех выявленных МО были связаны с назначением антибиотика больным, у которых в прошлом уже отмечались аллергические реакции на этот препарат или на другие бета-лактамные антибиотики. Согласно нашим данным, при использовании антибиотиков пенициллиновой группы аналогичные ошибки встречаются почти с такой же частотой — 1 2,0% [7]. Несмотря на то, что в различных исследованиях было показано, что только небольшая доля пациентов, сообщавших о наличии у них аллергических реакций на антибиотики, страдала в действительности от истинной гиперчувствительности, именно клинико-анамнестические данные служат основными критериями выявления вероятной аллергии на антибиотики. Кожные пробы на препараты цефалоспоринов не стандартизированы, отрицательные результаты тестирования не исключают наличия аллергии. Также нельзя не упомянуть о недопустимости использования ЛП бензилпенициллина для проведения кожных тестов, что иногда практикуется в ряде российских лечебных учреждений. В связи с этим, при наличии клинико-анамнестических данных о непереносимости пациентом бета-лактамов, единственным приемлемым вариантом является рассмотрение использования альтернативных антибиотиков [19].
Другая важная проблема, которую позволило выявить наше исследование, — отклонение от рекомендаций по кратности введения антибиотика (8,2% всех МО). Все бета-лактамы, в том числе и цефалоспорины, обладают время-зависимой бактерицидной активностью, которая характеризуется таким показателем, как время воздействия антибиотика, необходимое для гибели конкретного микроорганизма. Основная цель при разработке режимов дозирования время-зависимых АБП за-
Кузьмина А.В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
ключается в достижении оптимальной длительности воздействия антибиотика на патоген. Основным параметром, определяющим клиническую и микробиологическую эффективность этих препаратов, является время, в течение которого концентрация антибиотика в крови превышает его минимальную подавляющую концентрацию для конкретного возбудителя [20]. Нарушения дозового режима чреваты серьезными последствиями, такими как неэффективность лечения и формирование резистентности у микроорганизмов.
Необходимо также подчеркнуть, что 5,3% ошибок были допущены при самолечении. Вероятно, количество ошибок, которые совершают пациенты при самостоятельном подборе терапии, значительно большее, но подобные эпизоды очень сложны для выявления и обнаруживаются только в тех случаях, когда у больного возникают серьезные нежелательные реакции, требующие медицинской помощи. Далеко не все ошибки при применении лекарств приводят к ухудшению самочувствия пациента, но неверное использование антибиотиков опасно развитием у возбудителя устойчивости к противомик-робным препаратам. Свободная продажа антибиотиков в аптеках, безусловно, является важным фактором, способствующим росту как числа медицинских ошибок, так резистентности бактерий.
Выводы
При анализе российской базы о нежелательных реакциях мы установили, что в 25,2% спонтанных сообщений, где в качестве подозреваемого лекарства указывался антибиотик группы цефалоспоринов, были допущены МО при использовании данных препаратов.
Нами зарегистрирована высокая доля неверных назначений цефалоспоринов при их использовании в педиатрической практике — 53,2% всех ошибок приходится на возрастную группу до 18 лет.
Наиболее распространенным видом МО (35,9%) является назначение антибиотика при отсутствии показаний/по незарегистрированному показанию. В большинстве случаев (60,0%) в качестве такого показания выступали различные заболевания вирусной этиологии.
До настоящего времени важной проблемой остается частое назначение АБП пациенту без учета его аллергологиче-ского анамнеза. При подборе антибиотика больным с реакциями гиперчувствительности в анамнезе следует помнить о возможности возникновения перекрестной аллергии на препараты того же класса или сходной химической структуры.
Особенности фармакодинамики цефалоспоринов обусловливают важность соблюдения правильной кратности применения этих лекарственных препаратов. При этом частота ошибок, связанных с меньшей кратностью введения антибиотика, достаточно высока и составляет 8,2% всех МО.
Метод анализа спонтанных сообщений является эффективным способом выявления ошибок при применении лекарственных препаратов. Очень важно направлять информацию обо всех случаях развития нежелательных реакций в результате неверного использования лекарственных средств в органы фармаконадзора для ее учета, дальнейшего анализа и разработки мер по предотвращению подобных эпизодов. Это позволит повысить эффективность и безопасность медикаментозной терапии и тем самым улучшить качество оказания медицинской помощи.
Литература
1. Центр маркетинговых исследований: ЦМИ «Фармэксперт» — Аналитический обзор фармацевтического рынка 2009;10:9-31.
2. DSM Group. Рейтинг продаж антибиотиков в России. 29.06.2016. Available from: URL: http://www.dsm.ru/news/269/?sphrase_id=5665.
3. Quality of Care Patient Safety. WHO, 2002, Resolution EB,109,16. Available from: URL:
http://www.who.int/iris/bistream/10665/79460/1/reb109r16.pdf.
4. Правила «Надлежащей практики фармаконадзора». Термины и определения. Проект, редакция от 06.1 1.2014, согласована РБ, РК, РФ. Available from: URL: http://www.eurasiancommission.org/ru/act/texn-reg/deptexreg/konsultComitet/Documents/.pdf.
5. Council of Europe Expert Group on Safe Medication Practices. Creation of a better medication safety culture in Europe: Building up safe medication practices 2006.
6. Интернет-ресурс. Available from: URL: http://www.who.int/topics/clas-sification/ru/.
7. Кузьмина АВ, Поливанов ВА, Асецкая ИЛ, Зырянов СК. Медицинские ошибки при применении антибиотиков пенициллиновой группы. Клин микробиол антимикроб химиотер 201 6;1 8(2) :93-1 03.
8. Геппе НА, Снегоцкая МН, Евдокимов ЕМ. Внебольничные пневмонии. Диагностика и лечение. Практика педиатра 2005;(10):3-5.
9. Белоусов ЮБ, Кукес ВГ, Лепахин ВК, Петров ВИ, под ред. Клиническая фармакология: национальное руководство. М.: ГЭОТАР-Медиа;
2014:398.
10. Хамитов РФ, Визель АА, Амиров НБ, Потапова МВ, Лысенко ГВ. Клинические рекомендации по диагностике и лечению внебольничных пневмоний у взрослых. Казань 201 1:28-41.
1 1. Козлов СН, Страчунский ЛС. Современная антимикробная химиотерапия: руководство для врачей. М., 2009:448.
1 2. Прудков МИ, Щулутко АМ, Антоненко ИВ, Барыков ВН, Дарвин ВВ, Гиберт БК и соавт. Неотложная хирургия. Клинические рекомендации по оказании. Медицинской помощи населению Уральского федерального округа. Екатеринбург 201 3:82.
1 3. Иванов ЮВ, Истомин НП, Соловьев НА. Проблема перитонита на современном этапе развития медицины. Клиническая практика 2011;3:71-7.
14. Гельфанд ЕБ, Бурневич СЗ, Бражник ТБ. Антибактериальная терапия абдоминальных хирургических инфекций. РМЖ 2002;8:400.
15. Самсыгина ГА. Цефалоспорины в педиатрии. В мире лекарств: Клин фармакол фармакотер 2000; 1:7.
16. Самсыгина ГА, Коваль ГС. Часто болеющие дети: проблемы диагностики, патогенеза и терапии. Лечащий врач 2009;1:10-5.
1 7. Пономарева ЮВ. Актуальные аспекты антибиотикотерапии в педиатрической практике. Лекарственный вестник 2011 ;6(41 ):1 9-27.
1 8. Бондарь ГН, Лучанинова ВН. Применение антибактериальных препаратов у детей при острых респираторных инфекциях в амбулаторной практике Владивостока. Педиатрическая фармакология 2007;4(1 ):1 9-22.
19. Андреева ИВ., Стецюк ОУ. Аллергия на антибиотики у детей: кто виноват и что делать? Педиатрическая фармакология 2012;10(6):42-52.
20. Зырянов СК, Козлов РС, Макушкин ББ. Новый взгляд на известные антибиотики: как правильно использовать фармакодинамические параметры. Клин микробиол антимикроб химиотер 2016; 1 8(2): 1 25-8.
References
1. Center of marketing research «Pharmexpert» — Analytical review of pharmaceutical market 2009;10:9-31.
2. DSM Group. Antimicrobials selling rating in Russia. 29.06.201 6. Available from URL: http://www.dsm.ru/news/269/?sphrase_id=5665
3. Quality of Care Patient Safety. WHO, 2002, Resolution EB, 109, 16. Available from URL: http://www.who.int/iris/bit-stream/1 0665/79460/1 /reb109r16.pdf
4. Guidelines-Nadlezhashchej-praktiki-farmakonadzora-terminy-i-opredeleniya-proekt-redakciya-ot-06-1 1 -201 4-soglasovana-RB-RK-RF. Available from URL: http://www.eurasiancommission.org/ru/act/texn-reg/deptexreg/konsultComitet/Documents/.pdf
5. Council of Europe Expert Group on Safe Medication Practices. Creation of a better medication safety culture in Europe: Building up safe medication practices 2006.
6. WHO website. Available from URL: http://www.who.int/topics/classifi-cation/ru/
7. Kuzmina AV, Polivanov VA, Asetskaya IL, Zyryanov SK. Medication Errors Associated with the Use of Penicillins. Clin Microbiol Antimicrob Chemother 2016;18:93-103.
8. Geppe NA, Snegotskaya MN, Evdokimov EM. Community-acquired pneumonia. Aiagnostika-i-Lechenie. Praktika-Pediatra 2005;(10):3-5.
9. Belousov YuB, Kukes VG, Lepakhin VK, Petrov VI, editors. Klinicheskaya-Farmakologiya. Nacionalnoe-rukovodstvo. M-GEHOTAR-media,
2014:398.
10. Khamitov RF, Vizel AA, Amirov NB, Potapova MV, Lysenko G.V. Klinich-eskie-rekomendacii-po-diagnostike-i-lecheniyu-vnebolnichnyh-pnevmonij-u-vzroslyh. Kazan, 201 1:28-41.
1 1. Kozlov SN, Strachunsky LS. Sovremennaya-antimikrobnaya-himioterapiya: rukovodstvo-dlya-vrachej. M., 2009: 448.
1 2. Prudkov MI, Shulutko AM, Antonenko IV, Barykov VN, Darvin VV, Gibert BK, et al. Neotlozhnaya-hirurgiya. Klinicheskie-rekomendacii-po-okazanii-medicinskoj-pomoshchi-naseleniyu-Uralskogo-federalnogo-okruga. Ekaterinburg, 2013: 82.
13. Ivanov YuV, Istomin NP, Solovyev NA. Problema-peritonita-na-sovremennom-ehtape-razvitiya-mediciny. Klinicheskaya-praktika 201 1;
3:71-7.
14. Gelfand EB, Burnevich SZ, Brazhnik TB. Antibakterialnaya-terapiya-abdominalnyh-hirurgicheskih-infekcij. Rossijskij-Medicinskij-Zhurnal 2002;8:400.
15. Samsygina GA. Cefalosporiny-v-pediatrii. V-mire-lekarstv. Klinicheskaya-farmakologiya-i-farmakoterapiya 2000;1:7.
16. Samsygina GA, Koval GS. Chasto-boleyushchie-deti-problemy-diagnostiki-patogeneza-i-terapii. Lechashchij-vrach 2009;1: 1 0—5.
17. Ponomareva YuV. Aktualnye-aspekty-antibiotikoterapii-v-pediatricheskoj-praktike. Lekarstvennyj-vestnik 201 1 ;6(41 ):19-27.
18. Bondar GN, Luchaninova VN. Primenenie-antibakterialnyh-preparatov-u-detej-pri-ostryh-respiratornyh-infekciyah-v-ambulatornoj-praktike-Vladivostoka. Pediatricheskaya-farmakologiya 2007;4(1):19-22.
19. Andreeva IV, Stetsiouk OU. Allergiya-na-antibiotiki-u-detej-kto-vinovat-i-chto-delat? Pediatricheskaya-farmakologiya 2012;10(6):42-52.
20. Zyryanov SK, Kozlov RS, Makushkin BB. A Novel View on Common Antibiotics: How to Properly Use Pharmacodynamic Parameters. Clin Microbiol Antimicrob Chemother 2016;18(2):125-8.
Кузьмина А.В., Асецкая И.Л., Поливанов В.А., Зырянов С.К., Глаголев С.В.
Что должен помнить каждый на случай анафилактического шока на лекарство
В Борисове 20 января после введения антибиотика с анафилактическим шоком в реанимацию попал школьник. Инъекцию цефтриаксона российского производства с лидокаином ему сделали дома. Тем временем в связи с гибелью 16 января жительницы Молодечненского района в Беларуси приостановлена продажа и применение определенной партии одноименных препаратов белорусского производства. О том, как часто возникает анафилактический шок на лекарства и что должен помнить каждый пациент, рассказала начальник главного управления организации медицинской помощи Минздрава Елена Богдан.
В каких случаях развивается анафилактический шок?
Анафилактический шок может внезапно развиться у любого человека на любое лекарственное средство. Даже если раньше аллергии на него не было.
— Организм нарабатывает критическую точку сенсибилизации (чувствительности. — Прим. TUT.BY). Ни одному из этих пациентов (ни подростку из Борисова, ни женщине из Молодечненского района. — Прим. TUT.BY) не вводили это лекарство в первый раз. И я не знаю, почему настолько активно эти два случая муссируются. Анафилактический шок всегда был, есть и, поверьте, он будет, что бы мы ни делали. Организм человека так устроен, что аллергические реакции проявляются. Например, накрасился тушью, вроде красился ею до этого, и все было хорошо, а вдруг приходишь с шелушащимися веками. Это тоже аллергическая реакция, — рассказывает Елена Богдан.
Анафилактический шок начинается резко, появляется одышка, свистящее дыхание, падает артериальное давление, человек теряет сознание.
Проба на аллергию не защитит от анафилактического шока. Он может развиться даже от капельки лекарства.
— Проба делается с антибиотиком. Вам вводится это лекарство. И на пробу вы дадите точно такую же анафилаксию, как вы бы ее дали на дозу, — поясняет медик.
Как часто лекарства вызывают анафилактический шок?
Это редкая реакция организма: встречается один раз на 700 тысяч — 1 млн инъекций.
— Анафилактический шок может быть не только на антибактериальные препараты и другие лекарства, но и на пищевые продукты (часто на мед, арахис, продукты, содержащие куриный белок и другие белки), пищевые красители, — отмечает специалист. — Аллергия вплоть до анафилактического шока может развиваться на различные моющие и чистящие средства, дезодоранты, средства с отдушками и запахами, духи, латекс. Чаще всего в практике мы сталкиваемся с пищевой аллергией. Она, к счастью, редко протекает в виде анафилактического шока, чаще всего это отек Квинке (аллергия, которая проявляется отеком кожи, подкожной клетчатки, мышц. — Прим. TUT.BY). Анафилактическая реакция при антибиотиках, других лекарствах и продуктах выглядит одинаково.
Зачем одновременно вводить антибиотик и анестетик?
В обоих случаях анафилактического шока за последнюю неделю антибиотик вводили одновременно с лидокаином. Анестетик делает укол цефтриаксона менее болезненным.
— Цефтриаксон — порошок, его внутримышечно ввести невозможно, он должен быть растворен. Растворен он может быть в воде для инъекций или лидокаине. Это разрешено инструкцией по применению и международными нормами. Цефтриаксон сам по себе достаточно болезненный препарат. У каждого свой порог боли.
Можно ли установить: источником аллергии стал цефтриаксон или лидокаин?
— Установить это (при одновременном введении. — Прим. TUT.BY) невозможно. Аллергия возникает по одинаковому механизму на любое лекарственное средство. Не может быть, что на лидокаин — такая аллергическая реакция, а на цефтриаксон — совершенно другая. И у цефтриаксона, как и других антибиотиков, и лидокаина в побочных реакциях есть анафилактическая, — говорит Елена Богдан.
По ее словам, именно потому что нельзя установить, на какой именно препарат была аллергия, мальчику из Борисова ни цефтриаксон, ни лидокаин больше назначать не будут.
Как часто возникает аллергия на лидокаин, с которым смешивают лекарство?
— Если брать аллергические реакции, включая крапивницы, зуд, то при введении препарата с лидокаином они возникали меньше чем в четверти случаях. То есть в трех случаях из четырех, когда мы видим нежелательные побочные реакции, препарат был разведен на воде для инъекций и всего в одном случае — в сочетании с лидокаином, — отмечает собеседница.
Выписывают и применяют ли сейчас цефтриаксон?
И выписывают, и применяют.
— Есть ситуации, когда этот препарат является стартовым антибиотиком, — рассказывает Елена Богдан. — Когда поступает пациент с тем или иным заболеванием, мы приблизительно знаем, что в 90% случаев это заболевание вызывается вот таким вот возбудителем. И мы даем антибиотики широкого спектра действия, антибактериальные препараты, в том числе и цефтриаксон. У него достаточно широкий спектр действий, и он достаточно хорошо действует на патогенную флору.
Тогда почему ограничили применение цефтриаксона и лидокаина определенных партий?
Это обычная практика Минздрава, когда ведомство получает информацию о тяжелой реакции на препарат.
— Мы изымаем эту партию, ограничиваем применение, препарат не уничтожается. Просто приостанавливается его применение и начинаются специфические лабораторно-диагностические мероприятия, анализируются свойства только этой партии. Получение результата занимает не меньше двух недель. Если все хорошо, лекарство возвращается в сеть. Также сейчас мы напомнили врачам, что если есть тяжелая патология, она должна лечиться в стационарах. Коек у нас достаточно.
Информацию об анафилактическом шоке на российский цефтриаксон белорусские медики передадут коллегам из России. Там эту партию также должны изъять из продажи и проверить.
Что нужно делать, чтобы избежать анафилактического шока?
Помнить о том, на какие продукты, средства гигиены, лекарства у вас была необычная реакция. Это могла быть сыпь, одышка, отек лица, губ, языка, верхних дыхательных путей, появление пятен, схожих с ожогами крапивы, низкое артериальное давление, изменения в голосе. Об этих реакциях нужно обязательно рассказать врачу, перед тем как он назначит лекарство.
После инъекции, например, в поликлинике или фельдшерско-акушерском пункте, 15 минут нужно посидеть и подождать возможной аллергической реакции.
— Хотя анафилактоидные реакции бывают замедленного типа. Они развиваются в период до 72 часов после введения антибиотика. Но, как правило, они не такие тяжелые. Тяжелая реакция имеет молниеносное течение, — добавляет специалист.
Есть ли препараты в процедурном кабинете, чтобы помочь при анафилактическом шоке?
Должны быть. С 2016 года раз в квартал медики должны сдавать зачет по оказанию помощи при анафилаксии. Также в каждом процедурном кабинете, кабинете, где делают прививки, в скорой медицинской помощи, у врачей, которые выполняют визиты на дом, у медицинских сестер, которые вводят те или иные лекарства на дому, должны быть специальные укладки медикаментов для оказания неотложной помощи при анафилактическом шоке.
— В плане укладок поликлиническое звено должно быть закрыто абсолютно от фельдшерско-акушерского пункта до центральной районной поликлиники. Точно так же в стационарах, приемном отделении, кабинете анестезиологии и реанимации, в операционных должны быть сформированы укладки по анафилактическому шоку. Здесь мы говорим абсолютно обо всех специалистах, которые работают в нашей системе: это и стоматологи, и акушеры-гинекологи, и офтальмологи, и ЛОРы, и врачи терапевтического звена. При анафилактическом шоке в первую очередь пациенту внутримышечно или (если есть возможность и позволяет время) внутривенно вводят препарат эпинефрин, — говорит медик.
Информио
×Неверный логин или пароль
×Все поля являются обязательными для заполнения
×Сервис «Комментарии» — это возможность для всех наших читателей дополнить опубликованный на сайте материал фактами или выразить свое мнение по затрагиваемой материалом теме.
Редакция Информио.ру оставляет за собой право удалить комментарий пользователя без предупреждения и объяснения причин. Однако этого, скорее всего, не произойдет, если Вы будете придерживаться следующих правил:
- Не стоит размещать бессодержательные сообщения, не несущие смысловой нагрузки.
- Не разрешается публикация комментариев, написанных полностью или частично в режиме Caps Lock (Заглавными буквами). Запрещается использование нецензурных выражений и ругательств, способных оскорбить честь и достоинство, а также национальные и религиозные чувства людей (на любом языке, в любой кодировке, в любой части сообщения — заголовке, тексте, подписи и пр.)
- Запрещается пропаганда употребления наркотиков и спиртных напитков. Например, обсуждать преимущества употребления того или иного вида наркотиков; утверждать, что они якобы безвредны для здоровья.
- Запрещается обсуждать способы изготовления, а также места и способы распространения наркотиков, оружия и взрывчатых веществ.
- Запрещается размещение сообщений, направленных на разжигание социальной, национальной, половой и религиозной ненависти и нетерпимости в любых формах.
- Запрещается размещение сообщений, прямо либо косвенно призывающих к нарушению законодательства РФ. Например: не платить налоги, не служить в армии, саботировать работу городских служб и т.д.
- Запрещается использование в качестве аватара фотографии эротического характера, изображения с зарегистрированным товарным знаком и фотоснимки с узнаваемым изображением известных людей. Редакция оставляет за собой право удалять аватары без предупреждения и объяснения причин.
- Запрещается публикация комментариев, содержащих личные оскорбления собеседника по форуму, комментатора, чье мнение приводится в статье, а также журналиста.
Претензии к качеству материалов, заголовкам, работе журналистов и СМИ в целом присылайте на адрес
×Информация доступна только для зарегистрированных пользователей.
×Уважаемые коллеги. Убедительная просьба быть внимательнее при оформлении заявки. На основании заполненной формы оформляется электронное свидетельство. В случае неверно указанных данных организация ответственности не несёт.
Внутримышечный путь — обзор
Введение общей анестезии
Общая анестезия индуцируется парентерально внутримышечно или внутривенно. Внутривенное введение может быть выполнено на животных, удерживаемых вручную или механически, и обеспечивает преимущество уменьшения времени индукции и восстановления. Однако у более крупных животных внутривенное введение механически удерживаемого животного может вызвать затруднения при извлечении быстро вызванного животного из удерживающего устройства.Как правило, внутримышечная индукция животного при соответствующем режиме в затемненном тихом вольере обеспечивает относительно быстрое и плавное введение и может минимизировать потребность в добавлении анестетика из-за большей продолжительности действия. Введение анестетиков внутримышечно (IM) можно проводить вручную, с помощью шприца или метательного дротика. Использование дротиков и систем дистанционного впрыска ранее рассматривалось 27 и требует тщательного планирования и опыта. Планирование анестезиологического мероприятия должно включать такие соображения, как температура окружающей среды, приближение, размер вольера, препятствия и присутствие других животных.Отсутствие точной и быстрой доставки соответствующей дозы животному в дикой природе или в большом вольере может привести к чрезмерным травмам при беге или кардиостимуляции, стрессу или миопатии и смерти. Мышечные массы крупа, плеча и шеи являются предпочтительными местами для удаленной инъекции. Отсутствие индукции в течение подходящего времени (обычно от 5 до 15 минут, в зависимости от режима) может быть вызвано многими факторами, включая отказ дротика, неправильное дозирование и ошибку оператора. Частично анестезированное животное подвержено захватной миопатии, поэтому решение о повторной индукции следует принимать в течение 20 минут после первоначального размещения дротика.Прием добавок дистанционным способом обычно требует полной дозы анестетика, поскольку животное может быстро усваивать анестетик из-за стресса и активности.
Многие схемы анестезии были описаны для вилорогов и коров, 3,10,29, 53 , и эти схемы обычно состоят из сверхактивных наркотиков (карфентанил, эторфин, тиафентанил), с седативными или транквилизаторами или без них (α 2 — агонисты, бутирофеноны), диссоциативные циклогексамины (кетамин или тилетамин) или и то, и другое.Недавно было рассмотрено использование смешанного опиоидного агониста-антагониста буторфанола тартрата в качестве компонента анестезирующих коктейлей. 6 Исторически сложилось так, что сверхпотентные опиоидные (наркотические) агенты карфентанил цитрат, эторфин и тиафентанил оксалат были основными компонентами анестезирующих коктейлей, используемых у не домашних животных, по многим причинам: (1) Опиоидные агенты имеют относительно большой запас безопасности для пациенту и обладают высокой эффективностью, позволяя хранить небольшие объемы в дротиках для удаленной доставки; (2) они быстродействующие, обеспечивают эффективную индукцию и сводят к минимуму риск гипертермии; и (3) они обратимы.Однако сверхпотентные опиоиды связаны со значительными побочными эффектами, такими как подавление дыхания и моторики желудочно-кишечного тракта, слабое расслабление мышц и ренаркотизация 46 , и несут риск для безопасности человека, поскольку смертельная доза некоторых агентов для человека составляет всего 20 микрограммов. (мкг). 29 Сверхактивные опиоиды являются веществами из Списка II, контролируемыми Агентством по борьбе с наркотиками, и поэтому практикующий врач должен обладать специальной лицензией и соблюдать определенные правила владения, хранения и ведения документации.Протоколы безопасности и специальная подготовка по обращению с наркотиками и в чрезвычайных ситуациях должны поддерживаться для всего персонала, участвующего в процедурах с использованием сверхмощных наркотиков. Цитрат карфентанила является наиболее сильнодействующим из трех агентов. Эторфин и оксалат тиафентанила могут вызывать желательные эффекты, такие как улучшение мышечной релаксации и снижение подавления дыхания у некоторых видов. Опиоиды, особенно карфентанил, могут вызывать общую анестезию при введении отдельно; однако комбинация с другими агентами может снизить дозу наркотика, облегчить индукцию и восстановление, увеличить расслабление мышц и уменьшить подавление дыхания.
Агонисты α 2 , о которых сообщалось в схемах анестезии для коров, включают ксилазин, детомидин и медетомидин. В целом, коровы более чувствительны к α 2 -агонистам по сравнению с непарнокопытными, и эти агенты могут улучшать расслабление мышц, снижать дозы наркотиков и облегчать индукцию и восстановление. У более мелких рогатых животных и вилорогов эти препараты можно комбинировать с циклогексаминами, бензодиазепинами, буторфанолом или их комбинацией, что устраняет необходимость в сверхактивных опиоидах.α 2 -агонистов, однако, требуется 20 минут для достижения полного эффекта при внутримышечном введении; приближение к лежачему животному до этого времени может привести к спонтанному выздоровлению и необходимости повторного введения индукционной дозы. α 2 -агонисты, особенно медетомидин, вызывают сужение периферических сосудов, что может привести к гипертензии, брадикардии, плохому цвету слизистой оболочки и атриовентрикулярной блокаде второй степени. Использование парасимпатомиметиков, таких как атропин или гликопирролат, для увеличения частоты сердечных сокращений является спорным, так как в результате повышенный сердечный выброс может усугубить гипертензию.Медетомидин доступен в высококонцентрированных формах (Wildlife Pharmaceuticals, Inc., Форт-Коллинз, Колорадо), что улучшает его пригодность для удаленной доставки у крупных животных.
Диссоциативные анестетики включают гидрохлорид кетамина циклогексамина и тилетамин (который производится в сочетании с бензодиазепин золазепамом). Эти препараты быстродействующие, обладают высоким запасом прочности и часто используются в качестве дополнительных или дополнительных анестетиков внутривенно (IV) или внутримышечно при 0.От 3 до 1,0 мг / кг. Однако циклогексамины необратимы и, таким образом, могут влиять на продолжительность наркоза и восстановление после него. Когда кетамин используется в качестве добавки, антагонизм обратимых анестетиков следует отложить до 20 минут после введения кетамина. Это способствует метаболизму кетамина и может предотвратить бурное выздоровление. Тилетамин, особенно при использовании без отмены компонента золазепама (см. Таблицу 63-6), может быть связан с длительным выздоровлением.
Неполный список предлагаемых схем общей анестезии коров и вилорогов по видам представлен в Таблице 63-5, а предлагаемые реверсивные агенты и дозы перечислены в Таблице 63-6.
Пенициллин G для инъекций — информация о назначении FDA, побочные эффекты и использование
Общее название: пенициллин G, калий
Лекарственная форма: раствор для инъекций, порошок, для раствора
Медицинский осмотр на сайте Drugs.com. Последнее обновление 1 мая 2019 г.
Athenex
Только приемник
Чтобы уменьшить развитие лекарственно-устойчивых бактерий и поддерживать эффективность пенициллина G, калия для инъекций, USP и других антибактериальных препаратов, Penicillin G Kalium для инъекций, USP следует использовать только для лечения или предотвращения инфекций, которые доказаны или сильно подозреваются быть вызвано бактериями.
ОПИСАНИЕ
Пенициллин G Калий, USP — это натуральный пенициллин. Он химически обозначается как 4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновая кислота, 3,3-диметил-7-оксо-6 — [(фенилацетил) амино] -, монокалиевая соль, [2S- ( 2α, 5α, 6β)]. Калий пенициллин G представляет собой бесцветные или белые кристаллы или белый кристаллический порошок без запаха или практически без запаха и умеренно гигроскопичен. Он легко растворим в воде, в изотоническом растворе хлорида натрия и в растворе декстрозы.Структурная формула показана ниже.
| С16х27КН2О4С | МВт 372,48 |
Буферный калий пенициллин G для инъекций, USP представляет собой стерильный апирогенный порошок для восстановления. Забуференный калий пенициллин G для инъекций, USP представляет собой антибактериальное средство для внутримышечного, непрерывного внутривенного капельного, внутриплеврального или другого местного вливания и интратекального введения.
Пенициллин G Калий для инъекций, USP поставляется во флаконах, эквивалентных 5 000 000 единиц (5 миллионов единиц) или 20 000 000 единиц (20 миллионов единиц) пенициллина G в виде калиевой соли. Каждый миллион единиц содержит приблизительно 6,8 миллиграмма натрия (0,3 мг-экв) и 65,6 миллиграмма калия (1,68 мг-экв). Забуферен цитратом натрия до pH от 6,0 до 8,5.
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
После внутривенной инфузии пенициллина G пиковые концентрации в сыворотке достигаются сразу после завершения инфузии.В исследовании с участием десяти пациентов, которым вводили однократную 5-миллионную стандартную дозу пенициллина G внутривенно в течение 3-5 минут, средние сывороточные концентрации составляли 400 мкг / мл, 273 мкг / мл и 3 мкг / мл через 5-6 минут 10 минут. и через 4 часа после завершения инъекции соответственно. В отдельном исследовании пяти здоровым взрослым людям вводили один миллион единиц пенициллина G внутривенно либо в виде болюса в течение 4 минут, либо в виде инфузии в течение 60 минут. Средняя концентрация в сыворотке через восемь минут после завершения болюса составила 45 мкг / мл, а через восемь минут после завершения инфузии — 14.4 мкг / мл. Средний период полувыведения пенициллина G в сыворотке крови в β-фазе, вводимого внутривенно, у десяти пациентов с нормальной функцией почек составлял 42 минуты с диапазоном от 31 до 50 минут.
Клиренс пенициллина G у нормальных людей происходит преимущественно через почки. Почечный клиренс, который происходит чрезвычайно быстро, является результатом клубочковой фильтрации и активного канальцевого транспорта, причем последний путь преобладает. Сообщается, что выздоровление с мочой составляет от 58 до 85% введенной дозы.Почечный клиренс пенициллина задерживается у недоношенных детей, новорожденных и пожилых людей из-за снижения функции почек. Период полувыведения пенициллина G из сыворотки обратно пропорционален возрасту и клиренсу креатинина и колеблется от 3,2 часа у детей в возрасте от 0 до 6 дней до 1,4 часа у детей в возрасте 14 дней и старше.
Ненальный клиренс включает метаболизм в печени и, в меньшей степени, выведение с желчью. Последние пути становятся более важными при почечной недостаточности.
Пробенецид блокирует секрецию пенициллина почечными канальцами.Следовательно, одновременное введение пробенецида продлевает выведение пенициллина G и, как следствие, увеличивает его концентрацию в сыворотке.
Пенициллин G распространяется в большинстве частей тела, включая легкие, печень, почки, мышцы, кости и плаценту. При воспалении уровни пенициллина в абсцессах, среднем ухе, плевральной, перитонеальной и синовиальной жидкости достаточны для подавления большинства восприимчивых бактерий. Проникновение в глаз, мозг, спинномозговую жидкость (CSF) или простату плохое при отсутствии воспаления.При воспалении мозговых оболочек проникновение пенициллина G в СМЖ улучшается, так что соотношение СМЖ / сыворотка составляет от 2 до 6%. Воспаление также усиливает его проникновение в перикардиальную жидкость. Пенициллин G активно секретируется с желчью, что приводит к его уровню, по крайней мере, в 10 раз превышающему одновременно достигнутый в сыворотке крови. Пенициллин G плохо проникает в полиморфно-ядерные лейкоциты человека.
При нарушении функции почек период полувыведения пенициллина G в β-фазе сыворотки увеличивается.Период полураспада β-фазы в сыворотке крови от одного до двух часов наблюдался у пациентов с азотемией с концентрацией креатинина в сыворотке <3 мг / 100 мл и достигал 20 часов у пациентов с анурией. Между константой скорости элиминации сыворотки и функцией почек, измеренной по клиренсу креатинина, обнаружена линейная зависимость, включая самый низкий диапазон почечной функции.
У пациентов с нарушенной функцией почек наличие печеночной недостаточности дополнительно влияет на выведение пенициллина G.В одном исследовании период полувыведения из сыворотки у двух пациентов с анурией (с выделением <400 мл мочи / день) составлял 7,2 и 10,1 часа. У пациента с анурией и терминальным циррозом печени период полувыведения пенициллина составлял 30,5 часов, в то время как у другого пациента с анурией и заболеванием печени период полувыведения из сыворотки крови составлял 16,4 часа. Дозировка пенициллина G должна быть уменьшена у пациентов с тяжелой почечной недостаточностью, с дополнительными модификациями, когда заболевание печени сопровождает почечную недостаточность. Было показано, что гемодиализ снижает уровень пенициллина в сыворотке крови.
Микробиология
Пенициллин G обладает бактерицидным действием в отношении чувствительных к пенициллину микроорганизмов на стадии активного размножения. Он действует путем ингибирования биосинтеза мукопептида клеточной стенки. Он не активен в отношении бактерий, продуцирующих пенициллиназу, к которым относятся многие штаммы стафилококков. Пенициллин G высокоактивен in vitro в отношении стафилококков (кроме штаммов, продуцирующих пенициллиназу), стрептококков (группы A, B, C, G, H, L и M), пневмококков и Neisseria meningitidis.
Другими микроорганизмами, чувствительными к пенициллину G in vitro, являются Neisseria gonorrhoeae, Corynebacterium diphtheriae, Bacillus anthracis, clostridia, виды Actinomyces, Spirillum minus, Streptobacillus moniliformis, Listeria monocytogenes и лептоспира; Бледная трепонема чрезвычайно восприимчива.
Некоторые виды грамотрицательных бактерий ранее считались чувствительными к очень высоким внутривенным дозам пенициллина G (до 80 миллионов единиц в день), включая некоторые штаммы Escherichia coli, Proteus mirabilis, сальмонеллы, шигеллы, Enterobacter aerogenes (ранее Aerobacter aerogenes) и Alcaligenes faecalis.Пенициллин G больше не считается препаратом выбора при инфекциях, вызванных этими организмами.
Тест на чувствительность
Для получения конкретной информации о критериях интерпретации теста на чувствительность и связанных с ним методах тестирования и стандартах контроля качества, признанных FDA для этого препарата, см. Https://www.fda.gov/STIC.
ПОКАЗАНИЯ И ИСПОЛЬЗОВАНИЕ
Терапия
Пенициллин G Калий для инъекций, USP показан при лечении серьезных инфекций, вызванных чувствительными штаммами указанных микроорганизмов в условиях, перечисленных ниже.Перед лечением следует провести соответствующие тесты на культуру и чувствительность, чтобы изолировать и идентифицировать микроорганизмы, вызывающие инфекцию, и определить их чувствительность к пенициллину G.
Терапия калием пенициллина G для инъекций, USP, может быть начата до того, как станут известны результаты таких тестов, если есть основания полагать, что инфекция может затронуть любой из перечисленных ниже организмов; однако, как только эти результаты станут доступны, следует продолжить соответствующую терапию.
| КЛИНИЧЕСКИЕ ПОКАЗАНИЯ | ИНФЕКЦИОННЫЙ ОРГАНИЗМ | |
| Септицемия, эмпиема, пневмония, перикардит, эндокардит, менингит | Streptococcus pyogenes (β-гемолитический стрептококк группы A), другие β-гемолитические стрептококки, включая группы C, H, G, L и M, виды Streptococcus pneumoniae и Staphylococcus (штаммы, не продуцирующие пенициллиназу) | |
| Сибирская язва | Bacillus anthracis | |
| Актиномикоз (шейно-лицевое заболевание, а также заболевание грудной клетки и брюшной полости) | Actinomyces israelii | |
| Ботулизм (дополнительная терапия к антитоксину), газовая гангрена и столбняк (дополнительная терапия к иммуноглобулину столбняка человека) | Вид Clostridium | |
| Дифтерия (дополнительная терапия к антитоксину и профилактика носительства) | Коринебактерии дифтерии | |
| Эндокардит, вызванный Erysipelothrix | Erysipelothrix rhusiopathiae | |
| Фузоспирохетоз (тяжелые инфекции ротоглотки [болезнь Винсента], нижних дыхательных путей и области гениталий) | Виды Fusobacterium и спирохеты | |
| Инфекции, вызванные листериями, включая менингит и эндокардит | Listeria monocytogenes | |
| Инфекции, вызванные Pasteurella, включая бактериемию и менингит | Pasteurella multocida | |
| Хаверхиллская лихорадка | Streptobacillus moniliformis | |
| Лихорадка укуса крысы | Spirillum minus или Streptobacillus moniliformis | |
| Диссеминированные гонококковые инфекции | Neisseria gonorrhoeae (чувствительная к пенициллину) | |
| Сифилис (врожденный и нейросифилис) | Бледная трепонема | |
| Менингококковый менингит и / или сепсис | Neisseria meningitidis | |
| Грамотрицательные бациллярные инфекции (бактериемии) Пенициллин G не является препаратом выбора при лечении грамотрицательных бактериальных инфекций | Грамотрицательные бациллярные организмы (т.е. Enterobacteriaceae) | |
Чтобы уменьшить развитие лекарственно-устойчивых бактерий и поддерживать эффективность пенициллина G, калия для инъекций, USP и других антибактериальных препаратов, пенициллина G, калия для инъекций, USP следует использовать только для лечения или предотвращения инфекций, которые доказаны или сильно подозреваются. вызванные чувствительными бактериями. Когда доступна информация о культуре и чувствительности, их следует учитывать при выборе или изменении антибактериальной терапии.В отсутствие таких данных местная эпидемиология и особенности восприимчивости могут способствовать эмпирическому выбору терапии.
ПРОТИВОПОКАЗАНИЯ
Противопоказанием является наличие в анамнезе гиперчувствительной (анафилактической) реакции на любой пенициллин.
ПРЕДУПРЕЖДЕНИЯ
Сообщалось о серьезных и иногда фатальных реакциях гиперчувствительности (анафилактических) у пациентов, принимающих пенициллин. Эти реакции чаще возникают у людей с гиперчувствительностью к пенициллину в анамнезе и / или с повышенной чувствительностью к нескольким аллергенам.Были сообщения о лицах с гиперчувствительностью к пенициллину в анамнезе, которые испытали тяжелые реакции при лечении цефалоспоринами. Перед началом терапии пенициллином G следует тщательно изучить предыдущие реакции гиперчувствительности на пенициллины, цефалоспорины или другие аллергены. При возникновении аллергической реакции прием пенициллина G следует прекратить и назначить соответствующую терапию. Серьезные анафилактические реакции требуют немедленной неотложной терапии адреналином.Кислород, внутривенные стероиды и управление дыхательными путями, включая интубацию, также следует вводить в соответствии с показаниями.
О диарее, связанной с Clostridium difficile (CDAD), сообщалось при использовании почти всех антибактериальных средств, включая пенициллин G Калий для инъекций, USP, и ее тяжесть может варьироваться от легкой диареи до фатального колита. Лечение антибактериальными средствами изменяет нормальную флору толстой кишки, что приводит к чрезмерному росту C. difficile.
C. difficile продуцирует токсины A и B, которые способствуют развитию CDAD.Штаммы C. difficile, продуцирующие гипертоксин, вызывают повышенную заболеваемость и смертность, поскольку эти инфекции могут быть невосприимчивыми к противомикробной терапии и могут потребовать колэктомии. CDAD следует рассматривать у всех пациентов с диареей после применения антибиотиков. Необходим тщательный сбор анамнеза, поскольку сообщалось, что CDAD возникает в течение более двух месяцев после приема антибактериальных средств.
Если есть подозрение или подтверждение CDAD, продолжающееся использование антибиотиков не направлено против C.difficile, возможно, потребуется прекратить прием. Соответствующий контроль жидкости и электролитов, добавление белков, лечение антибиотиками C. difficile и хирургическое обследование должны проводиться в соответствии с клиническими показаниями.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Общий
Пенициллин следует использовать с осторожностью у лиц с историей серьезных аллергий и / или астмы (см. ПРЕДУПРЕЖДЕНИЯ). При возникновении аллергических реакций пенициллин следует отменить, если, по мнению врача, заболевание, которое лечат, не является опасным для жизни и поддается только терапии пенициллином.Пенициллин G Калий, USP для внутривенного введения в высоких дозах (более 10 миллионов единиц) следует вводить медленно из-за потенциальных побочных эффектов электролитного дисбаланса из-за содержания калия в пенициллине. Пенициллин G Калий для инъекций, USP содержит 1,68 мг-экв калия и 0,3 мг-экв натрия на миллион единиц. Использование антибиотиков может способствовать чрезмерному росту нечувствительных организмов, включая грибы. Постоянные внутривенные катетеры способствуют развитию суперинфекций. В случае возникновения суперинфекции следует принять соответствующие меры.По показаниям в сочетании с антибактериальной терапией следует выполнять разрез и дренирование или другие хирургические процедуры.
Назначение пенициллина G для инъекций, USP при отсутствии доказанной или сильно подозреваемой бактериальной инфекции или профилактических показаний вряд ли принесет пользу пациенту и увеличивает риск развития устойчивых к лекарствам бактерий.
Лабораторные испытания
Периодическая оценка функции системы органов, включая частую оценку электролитного баланса, печеночной, почечной и кроветворной систем, а также сердечного и сосудистого статуса, должна выполняться во время длительной терапии высокими дозами пенициллина G внутривенно (см. ПОБОЧНЫЕ РЕАКЦИИ).Если подозревается или известно о каком-либо нарушении функции, следует рассмотреть возможность снижения общей дозировки (см. АДМИНИСТРАЦИЯ И ДОЗИРОВКА). При подозрении на стафилококковые инфекции следует провести надлежащие лабораторные исследования, включая тесты на чувствительность. Все инфекции, вызванные бета-гемолитическими стрептококками группы А, следует лечить не менее 10 дней.
Пациенты, получающие лечение от гонококковой инфекции, должны пройти серологический тест на сифилис до приема пенициллина. Все случаи сифилиса, леченного пенициллином, должны получить адекватное последующее наблюдение, включая клинические и серологические исследования.Рекомендуемое наблюдение зависит от стадии лечения сифилиса.
Лекарственные взаимодействия
Бактериостатические антибактериальные препараты (например, хлорамфеникол, эритромицины, сульфаниламиды или тетрациклины) могут противодействовать бактерицидному эффекту пенициллина, поэтому следует избегать одновременного применения этих препаратов. Это было задокументировано in vitro; однако клиническое значение этого взаимодействия недостаточно документировано.
Уровень пенициллина в крови может быть увеличен путем одновременного приема пробенецида, который блокирует секрецию пенициллинов почечными канальцами.Другие препараты могут конкурировать с пенициллином G за секрецию почечных канальцев и, таким образом, увеличивать период полувыведения пенициллина в сыворотке крови. Эти препараты включают: аспирин, фенилбутазон, сульфаниламиды, индометацин, тиазидные диуретики, фуросемид и этакриновую кислоту.
Взаимодействие с наркотиками / лабораторными испытаниями
После лечения пенициллином G может возникнуть ложноположительная реакция на глюкозу в моче с раствором Бенедикта, раствором Фелинга или таблеткой CLINITEST®, но не с ферментными тестами, такими как CLINISTIX® и TES-TAPE®.
Пенициллин G был связан с псевдопротеинурией с помощью определенных методов тестирования.
Канцерогенез, мутагенез, нарушение фертильности
Долгосрочных исследований этого препарата на животных не проводилось.
Беременность
Тератогенные эффектыКатегория беременности B
Исследования репродукции, проведенные на мышах, крысах и кроликах, не выявили доказательств нарушения фертильности или вреда для плода из-за пенициллина G.Человеческий опыт применения пенициллинов во время беременности не показал каких-либо положительных доказательств неблагоприятного воздействия на плод. Однако нет никаких адекватных и хорошо контролируемых исследований с участием беременных женщин, убедительно доказывающих, что вредное воздействие этих препаратов на плод можно исключить. Поскольку исследования репродукции животных не всегда позволяют предсказать реакцию человека, этот препарат следует использовать во время беременности только в случае крайней необходимости.
Кормящие матери
Пенициллины выделяются с грудным молоком.Следует соблюдать осторожность при введении пенициллинов кормящей женщине.
Использование в педиатрии
Неполностью развитая функция почек у новорожденных может задерживать выведение пенициллина; Таким образом, этим пациентам следует уменьшить дозировку и частоту приема. Все новорожденные, получающие пенициллины, должны находиться под тщательным наблюдением на предмет клинических и лабораторных доказательств токсических или побочных эффектов (см. МЕРЫ ПРЕДОСТОРОЖНОСТИ).
Педиатрические дозы обычно определяются на основе веса и должны рассчитываться для каждого пациента индивидуально.Рекомендуемые руководящие принципы для педиатрических дозировок представлены в АДМИНИСТРАЦИИ И ДОЗИРОВКА.
Для гериатрических больных
Клинические исследования инъекции пенициллина G не включали достаточное количество субъектов в возрасте 65 лет и старше, чтобы определить, реагируют ли они иначе, чем более молодые субъекты. Другой зарегистрированный клинический опыт не выявил различий в ответах пожилых и молодых пациентов. В общем, выбор дозы для пожилого пациента должен быть осторожным, обычно начиная с нижнего предела диапазона дозирования, что отражает большую частоту снижения функции печени, почек или сердца, а также сопутствующего заболевания или другой лекарственной терапии.
Известно, что этот препарат в значительной степени выводится почками, и риск токсических реакций на этот препарат может быть выше у пациентов с нарушением функции почек. Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы, и может быть полезно контролировать функцию почек.
Пенициллин G для инъекций содержит 6,8 мг (0,3 мг-экв) натрия на миллион единиц. В обычных рекомендуемых дозах пациенты получали от 6.8 и 163,2 мг / день (0,3 и 7,2 мэкв) натрия. Гериатрическое население может реагировать притуплением натрийуреза на солевую нагрузку. Это может иметь клиническое значение при таких заболеваниях, как застойная сердечная недостаточность.
Информация для пациентов
Пациентам следует сообщить, что антибактериальные препараты, включая пенициллин G Калий для инъекций, USP, следует использовать только для лечения бактериальных инфекций. Они не лечат вирусные инфекции (например, простуду). Когда Пенициллин G Калий для инъекций, USP назначается для лечения бактериальной инфекции, пациенты должны быть проинформированы о том, что, хотя обычно в начале курса лечения наблюдается улучшение самочувствия, препарат следует принимать точно в соответствии с указаниями.Пропуск доз или неполный курс лечения может (1) снизить эффективность немедленного лечения и (2) повысить вероятность того, что у бактерий разовьется резистентность и они не будут лечиться с помощью пенициллина G для инъекций, USP или других антибактериальных препаратов. в будущем.
Диарея — распространенная проблема, вызванная приемом антибиотиков, которая обычно заканчивается, когда прием антибиотика прекращается. Иногда после начала лечения антибиотиками у пациентов может развиться водянистый и кровянистый стул (с желудочными спазмами и лихорадкой или без них) даже спустя два или более месяцев после приема последней дозы антибиотика.В этом случае пациенты должны как можно скорее связаться со своим врачом.
Внутримышечная терапия
Следует проявлять осторожность, чтобы избежать внутривенного или случайного внутриартериального введения, а также инъекции в основные периферические нервы или кровеносные сосуды или рядом с ними, поскольку такие инъекции могут вызвать повреждение сосудов нервной системы. Особую осторожность следует соблюдать при внутривенном введении из-за возможности тромбофлебита.
Побочные реакции
Кузов в целом
Реакция Яриша-Герксхаймера — системная реакция, которая может возникнуть после начала терапии пенициллином у пациентов с сифилисом или другими спирохетальными инфекциями (т.е., болезнь Лайма и возвратный тиф). Реакция начинается через 1-2 часа после начала терапии и исчезает в течение 12-24 часов. Для него характерны лихорадка, озноб, миалгии, головная боль, обострение кожных поражений, тахикардия, гипервентиляция, расширение сосудов с приливом крови и умеренная гипотензия. Патогенез реакции Герксхаймера может быть связан с высвобождением из спирохет термостабильного пирогена.
Реакции гиперчувствительности
Сообщаемая частота аллергических реакций на все пенициллины колеблется от 0.От 7 до 10 процентов в различных исследованиях (см. ПРЕДУПРЕЖДЕНИЯ). Сенсибилизация обычно является результатом предыдущего лечения пенициллином, но у некоторых людей при первом лечении наблюдаются немедленные реакции. В таких случаях предполагается, что предыдущее воздействие пенициллина могло произойти через следовые количества, присутствующие в молоке или вакцинах.
Клинически отмечаются два типа аллергических реакций на пенициллин — немедленная и отсроченная. Немедленные реакции обычно возникают в течение 20 минут после введения и варьируются по степени тяжести от крапивницы и зуда до ангионевротического отека, ларингоспазма, бронхоспазма, гипотензии, сосудистого коллапса и смерти (см. ПРЕДУПРЕЖДЕНИЯ).Такие немедленные анафилактические реакции очень редки и обычно возникают после парентеральной терапии, но сообщалось о нескольких случаях анафилаксии после пероральной терапии. Другой тип немедленной реакции, ускоренная реакция, может возникнуть между 20 минутами и 48 часами после приема и может включать крапивницу, зуд, лихорадку и, иногда, отек гортани.
Отсроченные реакции на терапию пенициллином обычно возникают в течение 1-2 недель после начала терапии. Проявления включают симптомы, похожие на сывороточную болезнь, т.е.е. лихорадка, недомогание, крапивница, миалгия, артралгия, боль в животе и различные кожные высыпания, от макулопапулезных высыпаний до эксфолиативного дерматита.
Контактный дерматит наблюдался у лиц, готовящих растворы пенициллина.
Желудочно-кишечный тракт
Сообщалось о псевдомембранозном колите с началом во время или после лечения пенициллином G. Могут возникнуть тошнота, рвота, стоматит, черный или волосатый язык и другие симптомы раздражения желудочно-кишечного тракта, особенно во время пероральной терапии.
Гематологическая система
Реакции включают нейтропению, которая проходит после прекращения терапии пенициллином; Кумбс-положительная гемолитическая анемия, необычная реакция, возникает у пациентов, получавших пенициллин G внутривенно в дозах более 10 миллионов единиц / день и которые ранее получали большие дозы препарата; а при приеме больших доз пенициллина кровоточащий диатез может развиться вторично по отношению к дисфункции тромбоцитов.
Метаболический
Пенициллин G Калий, USP (1 миллион единиц содержит 1.68 мЭкв иона калия) при внутривенном введении в больших дозах может вызвать серьезные и даже фатальные электролитные нарушения, то есть гиперкалиемию.
Нервная система
Сообщалось о нейротоксических реакциях, включая гиперрефлексию, миоклонические подергивания, судороги и кому, после введения массивных внутривенных доз, которые более вероятны у пациентов с нарушением функции почек.
Мочеполовая система
Поражение почечных канальцев и интерстициальный нефрит были связаны с введением больших внутривенных доз пенициллина G.Проявления этой реакции могут включать лихорадку, сыпь, эозинофилию, протеинурию, эозинофилурию, гематурию и повышение уровня азота мочевины в сыворотке. Прекращение приема пенициллина G приводит к выздоровлению у большинства пациентов.
Местные реакции
Могут возникать флебит и тромбофлебит, и при внутривенном введении сообщалось о боли в месте инъекции.
Чтобы сообщить о ПОДОЗРЕВАЕМЫХ ПОБОЧНЫХ РЕАКЦИЯХ, свяжитесь с Athenex Pharmaceutical Division, LLC. по телефону 1-855-273-0154 или FDA по телефону 1-800-FDA-1088 или www.fda.gov/medwatch.
ПЕРЕДОЗИРОВКА
Дозозависимая токсичность может возникнуть при использовании больших доз пенициллинов внутривенно (от 40 до 100 миллионов единиц в день), особенно у пациентов с тяжелой почечной недостаточностью (см. МЕРЫ ПРЕДОСТОРОЖНОСТИ). Проявления могут включать возбуждение, спутанность сознания, астериксис, галлюцинации, ступор, кому, мультифокальный миоклонус, судороги и энцефалопатию. Также возможна гиперкалиемия (см. ПОБОЧНЫЕ РЕАКЦИИ, Метаболические).
В случае передозировки прекратите прием пенициллина, проведите симптоматическое лечение и при необходимости примите меры поддержки.При необходимости можно использовать гемодиализ для снижения уровня пенициллина G в крови, хотя степень эффективности этой процедуры сомнительна.
ДОЗИРОВКА И ПРИМЕНЕНИЕ
Пенициллин G Калий для инъекций, USP можно вводить внутривенно или внутримышечно. Обычные рекомендации по дозировке следующие:
Взрослые пациенты
(*) Из-за короткого периода полувыведения пенициллин G вводят в разделенных дозах, обычно каждые 4-6 часов, за исключением менингококкового менингита / сепсиса, т.е.е., каждые 2 часа.
| КЛИНИЧЕСКИЕ ПОКАЗАНИЯ | ДОЗИРОВКА |
Серьезные инфекции, вызванные чувствительными штаммами стрептококков (включая S. pneumoniae)
| От 12 до 24 миллионов единиц в день в зависимости от инфекции и ее тяжести, вводимых равными дозами каждые 4-6 часов |
Серьезные инфекции, вызванные чувствительными штаммами стафилококков
| От 5 до 24 миллионов единиц в день в зависимости от инфекции и ее тяжести, вводимых равными дозами каждые 4-6 часов |
| Сибирская язва | Минимум 8 миллионов единиц / день в разделенных дозах каждые 6 часов.В зависимости от восприимчивости организма могут потребоваться более высокие дозы. |
| Актиномикоз Заболевания шейно-лицевой области Заболевания органов грудной клетки и брюшной полости | от 1 до 6 миллионов единиц в день (*) от 10 до 20 миллионов единиц в день (*) |
| Клостридиальные инфекции Ботулизм (дополнительная терапия к антитоксину) Газовая гангрена (санация и / или хирургическое вмешательство по показаниям) Столбняк (дополнительная терапия к иммуноглобулину столбняка человека) | 20 миллионов единиц / день (*) |
| Дифтерия (дополнительная терапия к антитоксину и для предотвращения носительства) | 2–3 миллиона единиц в день в разделенных дозах в течение 10–12 дней (*) |
| Эндокардит, вызванный Erysipelothrix | от 12 до 20 миллионов единиц в день в течение 4-6 недель (*) |
| Фузоспирохетоз (тяжелые инфекции ротоглотки [болезнь Винсента], нижних дыхательных путей и области гениталий) | от 5 до 10 миллионов единиц в день (*) |
| Инфекции листерий Менингит Эндокардит | от 15 до 20 миллионов единиц в день в течение 2 недель (*) от 15 до 20 миллионов единиц в день в течение 4 недель (*) |
| Инфекции Pasteurella, включая бактериемию и менингит | от 4 до 6 миллионов единиц в день в течение 2 недель (*) |
| Хаверхилл, лихорадка от укусов крыс | от 12 до 20 миллионов единиц в день в течение 3-4 недель (*) |
| Диссеминированные гонококковые инфекции, такие как менингит, эндокардит, артрит и т. Д., вызванные чувствительными к пенициллину микроорганизмами | 10 миллионов единиц / день (*), продолжительность зависит от типа инфекции |
| Сифилис (нейросифилис) | от 12 до 24 миллионов единиц в день, от 2 до 4 МЕ каждые 4 часа в течение 10–14 дней; многие эксперты рекомендуют дополнительную терапию бензатином PCN G 2,4 MU IM еженедельно в виде 3 доз после завершения внутривенной терапии |
| Менингококковый менингит и / или сепсис | 24 миллиона единиц в день как 2 миллиона единиц каждые 2 часа |
Пациенты педиатрического профиля
Этот продукт не следует назначать пациентам, которым требуется менее одного миллиона единиц на дозу (см. МЕРЫ ПРЕДОСТОРОЖНОСТИ, Использование в педиатрии).
| КЛИНИЧЕСКИЕ ПОКАЗАНИЯ | ДОЗИРОВКА |
| Серьезные инфекции, такие как пневмония и эндокардит, вызванные чувствительными штаммами стрептококков (включая S. pneumoniae) и менингококков | от 150 000 до 300 000 единиц / кг / день, разделенных на равные дозы каждые 4-6 часов, продолжительность зависит от заражающего организма и типа инфекции |
| Менингит, вызванный чувствительными штаммами пневмококка и менингококка | 250 000 единиц / кг / день, разделенных на равные дозы каждые 4 часа в течение 7-14 дней в зависимости от возбудителя инфекции (максимальная доза от 12 до 20 миллионов единиц / день) |
| Диссеминированные гонококковые инфекции (штаммы, чувствительные к пенициллину) | Масса менее 45 кг: |
| Артрит | 100000 единиц / кг / день в 4 поровну разделенных дозах в течение 7-10 дней |
| Менингит | 250 000 единиц / кг / день равными дозами каждые 4 часа в течение 10-14 дней |
| Эндокардит | 250 000 единиц / кг / день равными дозами каждые 4 часа в течение 4 недель |
| Артрит, менингит, эндокардит | Вес 45 кг или больше: 10 миллионов единиц в день в 4 поровну разделенных дозах, продолжительность терапии зависит от типа инфекции |
| Сифилис (врожденный и нейросифилис) после новорожденного | От 200000 до 300000 единиц / кг / день (вводится в дозе 50000 единиц / кг каждые 4-6 часов) в течение 10-14 дней |
| Дифтерия (дополнительная терапия к антитоксину и для предотвращения носительства) | от 150 000 до 250 000 единиц / кг / день равными дозами каждые 6 часов в течение 7-10 дней |
| Крысиная лихорадка; Лихорадка Хаверхилла (при эндокардите, вызванном S.moniliformis) | от 150 000 до 250 000 единиц / кг / день равными дозами каждые 4 часа в течение 4 недель |
Почечная недостаточность
Пенициллин G относительно нетоксичен, и корректировка дозировки обычно требуется только в случаях тяжелой почечной недостаточности. Рекомендуемые режимы дозирования следующие:
Клиренс креатинина менее 10 мл / мин / 1,73 м2; вводить полную нагрузочную дозу (см. рекомендуемые дозировки в таблицах выше), а затем половину ударной дозы каждые 8-10 часов.
Пациенты с уремией и клиренсом креатинина более 10 мл / мин / 1,73 м2; вводить полную нагрузочную дозу (см. рекомендуемые дозировки в таблицах выше), а затем половину ударной дозы каждые 4–5 часов. У пациентов с заболеваниями печени и почек следует вносить дополнительные изменения в дозировку.
При большинстве острых инфекций лечение следует продолжать в течение не менее 48-72 часов после того, как у пациента исчезнут симптомы. Антибактериальная терапия β-гемолитических стрептококковых инфекций группы А должна продолжаться не менее 10 дней, чтобы снизить риск ревматической лихорадки.Лекарственные препараты для парентерального введения следует проверять визуально на предмет наличия твердых частиц и обесцвечивания перед введением, если это позволяют раствор и контейнер.
Восстановление
В следующей таблице показано количество растворителя, необходимое для раствора различной концентрации:
| Прибл. Желаемая концентрация (единиц / мл) | Прибл. Объем 1,000,000 единиц (мл) | Растворитель для флакона 5 000 000 единиц (мл) | Только инфузия 20000000 единиц (мл) |
| 50 000 | 20 | – | – |
| 100 000 | 10 | – | – |
| 250 000 | 4 | 18.2 | 75 |
| 500 000 | 1,8 | 8,2 | 33 |
| 750 000 | – | 4,8 | – |
| 1 000 000 | – | 3,2 | 11,5 |
Когда требуемый объем растворителя превышает вместимость флакона, пенициллин можно растворить, сначала введя во флакон только часть растворителя, затем удалив полученный раствор и смешав его с остатком растворителя в стерильный контейнер большего размера.
Буферный калий пенициллин G для инъекций, USP хорошо растворим в воде. Его можно растворить в небольших количествах воды для инъекций или стерильного изотонического раствора хлорида натрия для парентерального применения.
Буферизованный пенициллин G Калий для инъекций, USP можно вводить внутримышечно или путем непрерывного внутривенного капельного введения в дозах 500 000, 1 000 000 или 5 000 000 единиц. Он также подходит для внутриплевральных, внутрисуставных и других местных инстилляций.
ДОЗИРОВКА 20 000 000 ЕДИНИЦ МОЖЕТ БЫТЬ ВВЕДЕНА ТОЛЬКО ПРИ ВНУТРИВЕННОЙ ИНФУЗИИ.
(1) Внутримышечная инъекция
Держите общий объем инъекции небольшим. Внутримышечный путь является предпочтительным путем введения. Растворы, содержащие до 100 000 единиц пенициллина на мл разбавителя, можно использовать с минимальным дискомфортом. Более высокая концентрация пенициллина G на мл физически возможна и может использоваться там, где требуется терапия. Когда требуются большие дозы, может быть целесообразно вводить водные растворы пенициллина посредством непрерывного внутривенного капельного введения.
(2) Непрерывное внутривенное вливание
Определите объем жидкости и скорость ее введения, которые требуются пациенту в течение 24 часов, как обычно для инфузионной терапии, и добавьте в эту жидкость соответствующую суточную дозу пенициллина. Например, если взрослому пациенту требуется 2 литра жидкости за 24 часа и суточная доза 10 миллионов единиц пенициллина, добавьте 5 миллионов единиц к 1 литру и отрегулируйте скорость потока, чтобы литр вводился за 12 часов.
(3) Внутриплевральная или другая местная инфузия
Если жидкость аспирирована, дайте инфузию в объеме, равном или ½ объема аспирированной жидкости, в противном случае приготовьтесь как для внутримышечной инъекции.
(4) Интратекальное использование
Интратекальное применение пенициллина при менингите должно быть строго индивидуализировано. Его следует использовать только с полным учетом возможных раздражающих эффектов пенициллина при использовании этого пути. Предпочтительный путь терапии бактериальных менингитов — внутривенный, дополненный внутримышечной инъекцией.
Лекарственные препараты для парентерального введения следует проверять визуально на предмет наличия твердых частиц и обесцвечивания перед введением, если позволяют раствор и контейнер.
Стерильный раствор можно оставить в холодильнике на одну неделю без значительной потери активности.
КАК ПОСТАВЛЯЕТСЯ
Калий пенициллин G для инъекций, USP поставляется следующим образом:
| НДЦ | Пенициллин G Калий для инъекций, USP | Коэффициент упаковки |
| 70860-126-20 | 5 000 000 единиц на флакон | 10 флаконов в коробке |
| 70860-127-51 | 20000000 единиц на флакон | 1 флакон в коробке |
Условия хранения
Хранить сухой порошок при температуре от 20 до 25 ° C (от 68 до 77 ° F).[См. Контролируемую комнатную температуру USP.]
Стерильные составные растворы можно хранить в холодильнике при температуре от 2 до 8 ° C (от 36 до 46 ° F). В холодильнике растворы пенициллина можно хранить в течение семи дней без потери активности. ОТКАЗАТЬСЯ ОТ НЕИСПОЛЬЗОВАННОГО РЕШЕНИЯ ПОСЛЕ 7 ДНЕЙ.
Стерильно, непирогенно, без консервантов.
Крышка контейнера не изготовлена из натурального латекса.
Указанные бренды являются товарными знаками соответствующих владельцев.
Athenex
Mfd.для Athenex
Schaumburg, IL 60173 (США)
Mfd. Автор: Istituto Biochimico Italiano
Сделано в Италии
© 2019 Athenex.
мая 2019
ЭТИКЕТКА ПАКЕТА — ГЛАВНАЯ ПАНЕЛЬ ДИСПЛЕЯ — ЭТИКЕТКА VIAL
НДЦ 70860-126-20
Пенициллин G Калий для инъекций, USP
5 000 000 единиц на флакон (5 миллионов единиц на флакон)
Для внутримышечного или внутривенного применения
Rx только
ЭТИКЕТКА ПАКЕТА — ГЛАВНАЯ ПАНЕЛЬ ДИСПЛЕЯ — ЭТИКЕТКА VIAL
НДЦ 70860-127-51
Пенициллин G Калий для инъекций, USP
20000000 единиц на флакон (20 миллионов единиц на флакон)
Только для внутривенной инфузии
Rx только
| ПЕНИЦИЛЛИН G КАЛИЙ пенициллин g калий для инъекций, порошок, для раствора | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| ПЕНИЦИЛЛИН G КАЛИЙ пенициллин g калий для инъекций, порошок, для раствора | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Этикетировщик — Athenex Pharmaceutical Division, LLC.(080318964) |
Athenex Pharmaceutical Division, LLC.
Подробнее о пенициллин g Калий
Потребительские ресурсы
Профессиональные ресурсы
- Другие бренды
- Pfizerpen
Сопутствующие лечебные руководства
Заявление об отказе от ответственности
Введение лекарств и экспериментальных соединений на мышах и крысах
Комитет по уходу и использованию институциональных животных
Бостонский университет
Введение
Введение соединений играет большую роль в дизайне экспериментов с использованием животных.Эта политика касается вопросов, связанных с введением соединений в рамках протокола, с целью облегчения процедуры для человека, вводящего соединение, а также минимизации дискомфорта и поддержания благополучия животного. Более 90% животных, используемых в исследованиях, — это крысы и мыши, и эта политика касается только крыс и мышей.
«Использование химикатов фармацевтического класса и других веществ гарантирует, что токсические или нежелательные побочные эффекты не будут внесены в исследования, проводимые на экспериментальных животных.Поэтому их следует использовать, если они доступны, для всех процедур, связанных с животными ». 1
«Перед введением какого-либо вещества (терапевтического или экспериментального) животному-субъекту необходимо учитывать pH, стерильность и химическую природу (запах, вкус, раздражительность слизистой оболочки, осмолярность, растворимость, светочувствительность и статус опасности). соединения и принять соответствующие решения о вводимой дозе, частоте введения, вводимом объеме, растворителе (при необходимости) и пути введения.” 2
Эта политика решает эти вопросы, а также требования по наблюдению и уходу за животным во время и после введения.
I. Политика
A. Любое вводимое соединение должно быть рассмотрено и одобрено IACUC.
Соединения, которые вводятся в экстренных случаях в рамках ветеринарной помощи, не требуют предварительной подготовки IACUC Институциональный комитет по уходу и использованию животных IACUC контролирует … одобрение. Они могут включать жидкости, анестетики, анальгетики, антибиотики или другие фармацевтические соединения.
B. Параметры, которые должны быть определены в протоколе IACUC, включают:
- Название соединения или краткое химическое описание, если оно не является общеизвестным (если оно не является частным).
- Доза (мг / кг) соединения.
- Способ введения
- Объем администрирования. См. Таблицы 1 и 2 внизу этой страницы для получения информации о рекомендуемых размерах и объемах игл.
- Частота администрации и интервалы между повторным введением; например, «один раз», один раз в день в течение 6 недель »или« непрерывно в течение двух недель с помощью осмотического насоса ».
- Информация о растворителе / носителе, включая pH и другие химические характеристики.
- Эффекты соединения и / или носителя, включая предполагаемые эффекты и побочные эффекты.
- Использование любого химического вещества или соединения нефармацевтического качества должно быть описано и обосновано в протоколе IACUC.
- Конкретную информацию для мышей и крыс можно найти в таблицах 1 и 2 внизу этой страницы.
C. После введения соединения необходимо наблюдать за животным и документировать полученные результаты.
Результаты должны быть доступны в помещении для животных или в лаборатории.Форма для документирования результатов мониторинга и реакции животных доступна в Интернете.
Частота мониторинга зависит от исследования и определяется главным исследователем (PIPrincipal Investigator). Ознакомьтесь с политикой Бостонского университета в отношении …) и IACUC, и это указано в утвержденном протоколе.
D. Экспериментальные соединения, добавляемые в корм или воду животного, должны иметь четкую маркировку.
См. Политику IACUC в отношении добавок к питьевой воде.
II. Процедуры: пути введения обозначены как энтеральное или парентеральное
A.Энтерально или
Per Os (устно) Пути введения- Добавки к питьевой воде: Когда добавки добавляются в питьевую воду, исследователь несет ответственность за наблюдение за животным (ами) и обеспечение того, чтобы происходит прием жидкости. См. Политику IACUC в отношении добавок к питьевой воде.
- Добавки к корму: Когда добавки добавляются в корм, исследователь несет ответственность за наблюдение за животным (ами) и обеспечение адекватного потребления корма.
- Внутрижелудочное через желудочный зонд: Исследователь должен пройти обучение и иметь опыт проведения этой процедуры до ее проведения. Этот способ введения обеспечивает точную пероральную (пероральную) дозу. Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- Ректальное введение: 2 Это энтерально (в желудочно-кишечный тракт), но не per os (перорально). Ректальную установку раствора лекарственного средства можно выполнить с помощью мягкой гибкой трубки малого диаметра (3.5 французская красная резиновая трубка для кормления). Края трубки должны быть гладкими / закругленными. Присоедините дозирующий шприц к концу трубки, убедившись, что все пузырьки воздуха удалены. Ограничьте объем инъекции до 0,5 мл для мыши и 1-2 мл для крысы. 1
B. Парентеральные пути введения
Путь, выбранный для введения, будет зависеть от вида, объема и вводимого материала, а также от желаемой скорости абсорбции.
Исследователь должен знать физиологические свойства вводимого вещества (см. Раздел «Характеристики соединения и растворителя» ниже), поскольку повреждение тканей и дискомфорт могут быть вызваны раздражающими средствами или лекарствами.Перед самой инъекцией всегда следует определять точное расположение иглы, прикладывая небольшое отрицательное давление к шприцу и наблюдая за оттоком крови или другой биологической жидкости. 3
Информацию о конкретных объемах введения и калибрах игл см. В таблицах 1 и 2 внизу этой страницы.
- Подкожные (SC) инъекции: Вручную удерживайте животное. Лучшее место для инъекций — это дряблая кожа на задней части шеи. Один человек может легко ввести мышь, в то время как крысе может потребоваться сдерживание одним человеком и инъекция другим.Анестезия не требуется. Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- Состав для подкожного введения с медленным высвобождением: Если требуется повторное или долгосрочное п / к дозирование, и состав подходит для этого, можно имплантировать гранулы с медленным высвобождением или капсулы Silastic. См. Осмотические насосы у мышей и крыс.
- Внутрибрюшинное (IP): Обычно используемое у крыс и мышей IP-введение приводит к более быстрому всасыванию в сосудистую сеть, чем п / к введение, и, таким образом, похоже на внутривенное введение.Любое раздражающее соединение, такое как кетамин или пентобарбитал, вызывает меньшее раздражение при внутрибрюшинном введении. Один человек может легко ввести мышь, в то время как крысе может потребоваться сдерживание одним человеком и инъекция другим. Анестезия не требуется.
Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре. - Внутрисосудистое — внутривенное (IV) и внутриартериальное (IA): Обычно используется внутривенное введение. Администрация IA не поощряется и должна быть научно обоснована и одобрена в протоколе IACUC.
- Инъекции в хвостовую вену обычно выполняются мышам и крысам и используют боковые хвостовые вены, расположенные по обе стороны от хвоста. Анестезия для этой процедуры не требуется. Максимальный объем болюсных инъекций составляет 5 мл / кг. При постоянном применении максимальный объем внутривенного введения составляет 4 мл / кг / час. 4 Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- У крыс яремная вена является еще одним местом для внутривенного введения. Для этого требуется анестезия и асептическая подготовка места.Наконец, непрерывное внутривенное или внутривенное введение может быть достигнуто с помощью осмотического насоса. См. Осмотические насосы у мышей и крыс.
- Если раздражающее соединение, предназначенное для внутривенного введения, например пентобарбитал, должно экстравазироваться (случайно вводиться за пределы вены), рекомендуется во избежание некроза тканей развести его в окружающих тканях путем введения стерильного 0,9% физиологического раствора.
- Ретроорбитальные инъекции: Не рекомендуется для мышей и должно быть обосновано в протоколе IACUC.У мышей можно использовать ретроорбитальный путь введения 5 в ретроорбитальный синус. Для этой процедуры требуется анестезия. Этот способ может использоваться как альтернатива введению в хвостовую вену и приемлем при условии, что оператор обучен и владеет этой техникой. Суспензии клеток следует профильтровать или встряхнуть перед инъекцией, чтобы предотвратить скопление клеток. При введении клеточных линий этим путем рекомендуется соблюдать осторожность из-за возможности выхода клеток в окружающие ткани и введения ретроорбитальной опухолевой массы.
- Внутримышечно (IM): Не рекомендуется для мышей и крыс из-за их небольшой мышечной массы и должно быть научно обосновано в протоколе IACUC. Когда это делается у крыс, в квадрицепсы или ягодичные мышцы, которые являются самыми большими, можно вводить <0,2 мл / участок. При инъекции в ягодичные кости избегайте седалищного нерва, который проходит вдоль каудальной части бедренной кости. Свяжитесь с BU ASC по адресу [email protected] для обучения этой процедуре.
- Для местного применения: Политика BU заключается в том, чтобы участки с повреждениями или обработанными кожными повреждениями не превышали 10-20% от общей поверхности тела животного и не превышали 25% от общей поверхности тела.Поверхность тела мыши весом 20 г составляет 36 см 2 , а мыши массой 25 г 42 см 2 . Процент обрабатываемой поверхности должен быть предварительно согласован с ветеринаром и утвержден им. Если кожа должна быть предварительно обработана перед нанесением тестируемого соединения, например, с использованием Наира или восковой эпиляции, эта обработка должна выполняться обученным и квалифицированным персоналом, а предварительно обработанная область не должна превышать 25% общей поверхности тела. . После местного лечения животных следует разместить поодиночке, чтобы животные не слизывали соединение друг с другом.
- Intradermal (ID): Одобрено только в том случае, если это научно обосновано протоколом IACUC. Используется в основном для исследований воспаления и иммунологических исследований. См. Политику IACUC в отношении адъювантов.
- Глазное: Только соединения, предназначенные и одобренные для глазного введения.
- Верхние дыхательные пути — интраназально: Может потребоваться анестезия. Максимальный объем для инъекции взрослым мышам может достигать 62 мкл, но рекомендуется поддерживать этот объем на уровне 30 мкл на ноздрю. 6
- Верхние дыхательные пути — интратрахеально: Максимальный объем для инъекции взрослым мышам составляет 50 мкл. Этот метод, требующий анестезии, должен быть подробно описан в протоколе IACUC. Возможны вариации этой процедуры. Как правило, после анестезии изофлураном мышь помещают в почти вертикальное положение, голову вверх, язык втягивают, а настой помещают в рот. Как только язык втянут, жидкость аспирируется и не может быть проглочена.
- Внутричерепной: Этот метод, требующий анестезии и стереотаксической хирургии для установки канюли и используемый в фармакологических и нейробиологических исследованиях, должен быть подробно описан в протоколе IACUC. Введение может быть болюсным или непрерывным.
- Через хирургически имплантированную церебральную канюлю
- Через прямую инъекцию
- Через катетер осмотического насоса. См. Осмотические насосы у мышей и крыс.
- Внутригрудное введение: Для любого соединения, вводимого чрескожно в грудную клетку, животное должно быть помещено под анестезию.Эта специализированная процедура должна быть подробно описана в протоколе IACUC.
- Внутрисердечное введение: Любое соединение, вводимое чрескожно или непосредственно через открытую грудную клетку в сердце, требует помещения животного под общий наркоз. Эта специализированная процедура должна быть подробно описана в протоколе IACUC.
- Осмотические насосы: Используются для непрерывного введения, включая подкожно, внутрибрюшинно, внутривенно и внутривенно, или в определенные органы. Размещение осмотического насоса рекомендуется всякий раз, когда введение соединения должно продолжаться в течение нескольких дней или недель.См. Осмотические насосы у мышей и крыс.
C. Иглы
- Чем выше номер (калибр), тем меньше игла.
- Всегда используйте самую маленькую иглу (самый высокий калибр), которая подходит для работы. Рекомендованные размеры игл см. В таблицах 1 и 2 внизу этой страницы.
- Для введения стерильного раствора необходимы стерильные иглы и шприцы. Не используйте иглы повторно.
- Не забивать игл.
- Выбрасывайте использованные иглы и шприцы в специальный контейнер для острых предметов.
D. Частота приема и интервалы между приемами
- Ограничьте частоту приема, насколько это возможно, в соответствии с медицинскими или экспериментальными требованиями.
- По возможности избегайте введения более одного раза в день. Обратите внимание, что это невозможно со многими анальгетиками и антибиотиками, которые имеют ограниченную продолжительность действия.
- Для повторного введения экспериментальных соединений рассмотрите возможность имплантации осмотического насоса.
E. Характеристики соединения и растворителя (носителя)
- pH
- Знайте pH соединения И носителя. Стремитесь к pH ~ 7. Если pH выше или ниже, попробуйте одно из следующего:
- Буфер до pH 7, если возможно
- Разбавьте раствор стерильным физиологическим раствором или PBS
- Не вводите препарат с высоким или низким pH IM или SC, так как это будет болезненны и вызывают некроз тканей. Рекомендуемые альтернативные пути введения — IP или IV.
- Примеры
- Пентобарбитал имеет очень щелочной pH (~ 11). Только администрирование IV или IP; никогда не управляйте IM или SC.
- Кетамин имеет кислый pH (~ 4). У грызунов кетамин всегда вводят внутрибрюшинно. В / м введение может вызвать некроз тканей.
- Знайте pH соединения И носителя. Стремитесь к pH ~ 7. Если pH выше или ниже, попробуйте одно из следующего:
- Стерильность: Соединение и растворитель должны быть стерилизованы путем стерилизации или фильтрации. Животным можно вводить только соединения фармацевтического качества.Ожидается, что исследователи будут использовать лекарства фармацевтического класса, когда они доступны, даже при острых процедурах. 1
- Запах: Зловонный запах ограничивает произвольное потребление любого соединения.
- Вкус: Некоторые соединения, вводимые с питьевой водой, имеют горький вкус и лучше воспринимаются при добавлении сахарозы. К ним относятся, но не ограничиваются ими, тетрациклин, доксициклин и метронидазол. Добавление 2,5-5,0 г сахарозы / л воды улучшает вкусовые качества.См. Политику IACUC в отношении добавок к питьевой воде.
- Раздражительность слизистой оболочки: ИП для проверки совместимости тканей при введении любых соединений на поверхности слизистой оболочки, то есть глаза, рот и трахею.
- Осмолярность: Соединения для парентерального введения должны быть ~ изоосмолярными (280 осмолей). Обратите внимание, что 5% раствор декстрозы в лактатном растворе Рингера (LRS), которые являются изоосмолярными сами по себе, могут быть исключением и могут вводиться в небольших количествах подкожно или внутрибрюшинно, поскольку декстроза метаболизируется до СО2 и воды, обеспечивая полученную инфузию. изоосмотический.Однако следует соблюдать осторожность при обезвоживании животных.
- Растворимость: Некоторые соединения могут быть нерастворимыми и требуют введения в виде суспензии. Примером может служить сульфаметоксазол-триметоприм, вводимый с питьевой водой. Эту суспензию необходимо ежедневно встряхивать, чтобы обеспечить правильную дозировку.
- Светочувствительность: Для защиты от воздействия света используйте цветное стекло или накройте прозрачное стекло или пластик фольгой. Примеры включают, но не ограничиваются ими, антибиотики, такие как Септра, Цефалексин и Сульфатрим.
- Токсичность: ИП для документирования (поиск литературы) любого нового соединения или носителя, вводимого животным, с целью определения ограничений использования и побочных эффектов.
F. Характеристики растворителей (носитель)
- Вода: Только для энтерального введения. Инъекционные соединения должны быть изоосмотическими, за исключением, возможно, 50% декстрозы. Небольшое количество 50% -ной декстрозы можно вводить внутрибрюшинно или внутривенно при гипогликемическом кризисе.
- Солевой раствор с фосфатным буфером (PBS): По возможности используйте стерильный физиологический раствор с нормальным буфером (PBS) в качестве растворителя.Если вводимое соединение не растворяется в PBS, другие возможные носители включают:
- ДМСО (диметилсульфоксид) 0,5% — 5%: Антиоксидант, ДМСО [(Ch4) 2SO] является высокореактивной амфипатической молекулой с высокополярный домен и две аполярные группы, что делает его растворимым как в водных, так и в органических средах. Благодаря своим противовоспалительным свойствам и способности улавливать реактивные частицы кислорода, ДМСО был разработан для лечения ряда заболеваний. Терапевтические и токсические агенты, не растворимые в воде, часто растворяются в ДМСО. 7, 8
- Метилцеллюлоза 2%: Используется в качестве загустителя и эмульгатора в различных пищевых и косметических продуктах, а также для лечения запоров. PO (через желудочный зонд) или местное введение кажется безопасным. Другие способы введения должны быть научно обоснованы. Метилцеллюлоза — это стабильный сахар с низкой токсичностью и один из самых безопасных и широко используемых носителей, доступных при пероральном введении. Характеристики метилцеллюлозы, влияющие на ее вязкость, включают процентное содержание и степень вязкости, которые необходимо учитывать при введении животным.
- Кукурузное масло: Только для введения через желудочный зонд. См. Таблицы 1 и 2 внизу этой страницы для получения рекомендованных объемов.
- Кунжутное масло: Только для введения через желудочный зонд. См. Таблицы 1 и 2 внизу этой страницы для получения информации о рекомендуемых объемах.
- Этанол: Этанол может быть смертельным при внутривенном введении в высокой концентрации. Следовательно, если экспериментальное соединение было очищено или растворено в этаноле, ИП следует учитывать концентрацию EtOH, возможное разбавление, если концентрация высокая, и альтернативные пути введения для обеспечения безопасности животных.
Ссылки
- Руководство по уходу и использованию лабораторных животных. NCR. ILAR. Восьмое изд. 2011. С. 31.
- Управление по лекарствам. 444-454. Дюйм. 13. Биометодология и хирургические методы у мышей в биомедицинских исследованиях Том 3. Второй Эд. 2007. Academic Press. Фокс, Дж. et. al. Ред.
- MIT Политика IACUC.
- Hawk, C. Terrance et.al. Формуляр для лабораторных животных. Третье изд. 2005.
- Калифорнийский университет в Сан-Франциско (UCSF) Ретроорбитальные инъекции мышам.http://www.iacuc.ucsf.edu/Policies/awSPretroorbitalinjection.asp
- Джексон Эрика Л. и др. Анализ инициации и прогрессирования опухоли легких с использованием условной экспрессии онкогенных генов K-ras Dev. 2001, 15 (24) декабря: 3243-3248.
- Син, Л. и Ремик, Д.Г. Механизмы увеличения продукции IL-1β диметилсульфоксидом. Журнал иммунологии, 2005, 174: 6195-6202.
- Brayton, C.F. Диметилсульфоксид (ДМСО): обзор. Cornell Vet. 1986, январь: 76 (1): 61-90.
БУ IACUC утвержден в апреле 2009 г .; пересмотрено в январе 2014 г., пересмотрено в феврале 2019 г., утверждено в марте 2019 г.
Таблица 1: Объемы, введенные мышам
| SC | IM | IP | Болюс внутривенного введения | Внутривенное вливание | |
| Участок | Загиб или бок | Не рекомендуется // Если научно обосновано и одобрено IACUC // Квадрицепсы или ягодицы | Нижний правый квадрант предпочтителен, чтобы избежать прокола слепой кишки в нижнем левом квадранте | Боковая хвостовая вена | |
| Объем | ≤1-2 мл | ≤0.03-0,05 мл на участок; Не более 2 участков | ≤1-2 мл, в зависимости от размера мыши | ≤0,2 мл (5 мл / кг) | 4 мл / кг / час = 0,1 мл на мышь 25 г |
| Игла калибр | ≤22-25 | <25-30 | ≤22-25 г | ≤25 г | ≤25 г |
| Требуется анестезия | Нет | Нет | Нет | Нет |
| Ретроорбитальный | Воздушный зонд | Внутричерепной | Осмотический насос | ID6 -28 г | Полость рта через пищевод | Обычно требуется хирургическая установка канюли | Обычно SC на спине или IP | Спина или бок | | |||
| Объем | До 200 мкл | 0.125-0,25 мл в 25 г мыши | ~ 1 мкл | Варьируется | ≤0,05 мл / участок | |||||||
| Датчик размера иглы | 27-39 г | Игла для искусственного желудочного зондирования 22-24 г | Шприц Гамильтона | н / д | 29-30 г | |||||||
| Требуется анестезия | Да | Нет | Да / Возможно | Да / Возможно | Да |
Таблица 2: Объемы, введенные в крысах
| Крысы | SC | IM | IP | Болюс для внутривенного введения | Инфузия для внутривенного введения |
| Участок | рекомендуется | Нижний правый квадрант | Боковая Хвостовая вена | ||
| Объем | 5-10 мл> 5 мл доп.с заданными интервалами | При необходимости и с одобрения IACUC <0,1 мл на участок | 5-10 мл> 5 мл доп. с заданными интервалами | ≤0,5 мл (5 мл / кг) | 4 мл / кг / час 1,0 мл / час в a 250 г крыса |
| Калибр размера иглы | ≤20 г | ≤25 г | ≤22 г | ≤25 г | ≤25 г |
| Требуется анестезия | Нет | Нет | Нет | Нет |
| Rats | Ретроорбитальный | Воздушный зонд | Внутричерепной | Осмотический насос | ID |
| Участок | 23-28 г | Обычно через пищевод | через канюлю | Обычно SC на спине или IP | Спинка (рекомендуется) или сбоку |
| Объем | 300 мкл | 5-10 мл / кг | мкл / час | 9 0064 Зависит от0.05-0,1 мл на участок | |
| Калибр размера иглы | ≤27-39 г | Игла для желудочного зондирования 22-24 г | 20-25 г | н / д | ≤26 г |
| Требуется анестезия | Да | Нет | Да / Возможно | Да / Возможно | Да |
Форма мониторинга после процедуры
Доступ к форме
Рекомендации по дозированию колистина и формуляры | Внутренняя медицина
Колистин — это полимиксиновый антибиотик, применяемый в виде пролекарства колистиметата.Из-за плохой фармакокинетики внутривенное введение колистина рекомендуется только при инфекциях мочевыводящих путей или в качестве ингаляционной терапии для бактерий с множественной лекарственной устойчивостью. 1 Полимиксин B является предпочтительным агентом этого класса для большинства системных инфекций. Связь колистина с побочными эффектами, включая нефротоксичность и нейротоксичность, после того, как впервые была представлена в конце 1950-х годов, привела к сокращению использования колистина. 2-4 Произошло возрождение использования антибиотиков класса полимиксинов, вызванное увеличением распространенности трудно поддающихся лечению грамотрицательных микроорганизмов с множественной лекарственной устойчивостью (МЛУ) (например,грамм. P. aeruginosa, Acinetobacter sp. И устойчивые к карбапенемам Enterobacteriaceae).
Хотя оптимальная дозировка колистина не совсем ясна, были опубликованы международные руководства, разъясняющие передовой опыт. 1 Первые опыты с препаратом произошли до появления современной фармакокинетики, фармакодинамики и токсикодинамики. Таким образом, существуют только ограниченные данные о дозировке. 5-8 Чтобы усложнить вопрос, флаконы помечены как колистиметат для инъекций, но дозировка всех одобренных FDA продуктов в США определяется исходя из количества колистинового основания, а не пролекарства колистиметата. 9 Международные единицы часто упоминаются в литературе со всего мира. Это регулярно приводит к путанице в клинической практике и представляет собой потенциальную возможность ошибок при приеме лекарств, как было подчеркнуто в недавнем предупреждении Национального координационного совета по отчетности и профилактике ошибок при приеме лекарств. 10
Конверсия дозы колистина:
- 12500 МЕ = 1 мг колистиметата
- 2,67 мг колистиметата = 1 мг основания колистина
- Таким образом, 2 миллиона МЕ = 160 мг колистиметата = 60 мг основания колистина
В связи с тем, что колистин занимает уникальное место в арсенале антибиотиков в качестве спасательной терапии для пациентов, инфицированных грамотрицательными микроорганизмами с множественной лекарственной устойчивостью, а также ввиду сложности дозирования и значительного риска токсичности, рекомендуются следующие рекомендации по его применению:
Ограничения:
- Использование колистина будет ограничено службами инфекционных заболеваний и легочными службами
- Относится как к внутривенным, так и к ингаляционным препаратам
- Для использования в других службах требуется официальная консультация отдела инфекционных заболеваний или отделения легких.
- Препарат будет отпускаться только в течение 24 часов, если только одна из этих групп не была официально проконсультирована и не одобрила использование
- Компания Nebraska Medicine заказывает колистиметат для «колистина» в качестве основного действия
- Пример: Колистин (основа) 150 мг внутривенно, разделенный каждые 12 часов
Рекомендации по дозированию
1, 7, 12- Внутривенно при нормальной функции почек:
- Используйте ударную дозу 300 мг внутривенно; начать поддерживающую дозу через 12 часов после ударной дозы
CrCl (мл / мин) Доза > 90 180 мг каждые 12 часов от 80 до <90 170 мг каждые 12 часов 70 до <80 150 мг каждые 12 часов
- Используйте ударную дозу 300 мг внутривенно; начать поддерживающую дозу через 12 часов после ударной дозы
- Внутривенно при нарушении функции почек
- Используйте ударную дозу 300 мг внутривенно; начальная поддерживающая доза через 24 часа после нагрузочной дозы у пациентов с CrCl≤40 мл / мин
- Дозы <300 мг можно вводить каждые 24 часа
CrCl (мл / мин) Доза от 60 до <70 275 мг / сут от 50 до <60 245 мг / сут от 40 до <50 220 мг / сут от 30 до <40 195 мг / сут от 20 до <30 175 мг / сут от 10 до <20 160 мг / сут от 5 до <10 145 мг / сут 0 130 мг / сут
- Внутривенное дозирование для пациентов, получающих заместительную почечную терапию
- HD: 130 мг / сут + 50 мг в дни диализа после типичного 4-часового HD
- Дополнительная 40 мг вместо 3-часового сеанса HD
- CRRT: 220 мг каждые 12 часов
- Устойчивый низкоэффективный диализ (SLED)
- Обычная доза на CrCL (обычно 130 мг / сут) + 10% / час.
- Например, Для 10-часового ночного диализа требуется дополнительная доза 130 мг
- Обычная доза на CrCL (обычно 130 мг / сут) + 10% / час.
- HD: 130 мг / сут + 50 мг в дни диализа после типичного 4-часового HD
- Ингаляция Дозирование: 8, 11, 12 Ингаляционная основа колистина не должна использоваться в качестве монотерапии пневмонии, но может быть единственным средством лечения трахеобронхита или колонизации бактериями МЛУ (обострение муковисцидоза в легких). Его следует сочетать с внутривенным антимикробным препаратом при серьезных инфекциях. Колистин для внутривенного введения можно использовать в сочетании с колистином при вдыхании, учитывая, что вдыхаемое лекарство не всасывается системно.
- Взрослые: 75 мг или 150 мг основания колистина при вдыхании каждые 12 часов
- При пневмонии, связанной с вентилятором: можно использовать 150 мг каждые 8 часов 13
- Дети <13 лет: 30 мг или 75 мг основы колистина при вдыхании каждые 12 часов
- Взрослые: 75 мг или 150 мг основания колистина при вдыхании каждые 12 часов
Артикул:
- Tsuji BT, Pogue JM, Zavascki AP, et al. Международное согласованное руководство по оптимальному использованию полимиксинов: одобрено Американским колледжем клинической фармации (ACCP), Европейским обществом клинической микробиологии и инфекционных заболеваний (ESCMID), Американским обществом инфекционных заболеваний (IDSA), Международным обществом по борьбе с инфекциями. Фармакология (ISAP), Общество интенсивной терапии (SCCM) и Общество фармацевтов-инфекционистов (SIDP).Фармакотерапия. 2019 Янв; 39 (1): 10-39. DOI: 10.1002 / phar.2209.
- Lim L, et al. Фармакотерапия 2010; 30 (12): 1279–1291) .
- Hartzell JD, et al. Clin Infect Dis. 15 июня 2009 г .; 48 (12): 1724-8.
- Molina J, et al. Expert Opin Pharmacother 2009; 10: 2811–28.
- Markou N, et al. Clin Ther. 2008 Янв; 30 (1): 143-51.
- Plachouras D, et al. Противомикробные агенты Chemother. Август 2009 г., стр. 3430–3436
- Гаронзик С.М. и др. Противомикробные агенты Chemother. 2011 Июль; 55 (7): 3284-94.
- Ratjen F, et al. J Antimicrob Chemother 2006; 57: 306–311
- Monarch Pharmaceuticals, Inc. 5/2009. Колистиметат. Вставка пакета. Monarch Pharmaceuticls, Inc. Бристоль, TN
- https://www.nccmerp.org/sites/default/files/NANAlertJune2011.pdf
- Rattanaumpawan P, et al. J Antimicrob Chemother 2010; 65: 2645–2649
- Kofteridis DP, et al. Клинические инфекционные болезни 2010; 51 (11): 1238–1244
- https://www.medscape.com/viewarticle/848388
Разведение цефтриаксона — роцефин ®
Этикетка : охладить.Общая суточная доза не должна превышать 4 грамма.Данные об устойчивости: | |||||
| Лекарство | Стабильность Холодильный | Стабильность Темп. | Восстановленный Флакон / порошок | Банкноты | P-Insert Обновлено |
| Цефтриаксон порошок | 10 дней Охлаждение (4 ° C) | Стерильный порошок следует хранить при температуре от 20 до 25 ° C (от 68 до 77 ° F) в защищенном от света месте.После восстановления защита от обычного света не требуется. 2 дня Темп. (25 ° С) | Порошок | Цвет растворов варьируется от светло-желтого до янтарного, в зависимости от продолжительности хранения, концентрации и используемого разбавителя. | 06 06 14 |
| Раствор цефтриаксона | Хранить в морозильной камере, способной поддерживать температуру -20 ° C / -4 ° F. Размороженный раствор стабилен в течение 21 дня при охлаждении (5 ° C / 41 ° F).Не замораживайте размороженные антибиотики повторно. | Размороженный раствор стабилен в течение 48 часов при комнатной температуре (25 ° C / 77 ° F). Не замораживайте размороженные антибиотики повторно. | Раствор | Убедитесь в отсутствии утечек, сильно сжав контейнер. Если обнаружены утечки, откажитесь от раствора, так как это может нарушить стерильность. | 08 15 14 |
Препарат для в / м инъекций:
250 мг / 0,9 мл;
500 мг / 1,8 мл;
1 грамм / 3.6 мл;
2 грамма / 4,2 или 7,2 мл
(h30; BS-h30; от 0,5 до 1% лидокаина)
Обычная доза : 1-2 г внутривенно каждые 24 часа. Тяжелая форма: 2 г внутривенно каждые 12 часов.
При почечной недостаточности корректировки дозы не требуется.
PD: 750 мг внутривенно каждые 12 часов
——————————————- ————————————-
ПОКАЗАНИЯ И ИСПОЛЬЗОВАНИЕ
Перед началом лечения цефтриаксоном, необходимо получить соответствующие образцы для изоляции возбудителя и определения его чувствительности к лекарственному средству.Терапия может быть назначена до получения результатов теста на чувствительность. Чтобы уменьшить развитие устойчивых к лекарственным средствам бактерий и сохранить эффективность цефтриаксона и других антибактериальных препаратов, цефтриаксон следует использовать только для лечения или профилактики инфекций, которые, как доказано или сильно подозреваются, вызваны чувствительными бактериями. Когда доступна информация о культуре и чувствительности, их следует учитывать при выборе или изменении антибактериальной терапии. В отсутствие таких данных местная эпидемиология и особенности восприимчивости могут способствовать эмпирическому выбору терапии.
Цефтриаксон для инъекций показан для лечения следующих инфекций, вызванных чувствительными организмами:
Инфекции нижних дыхательных путей , вызванные Streptococcus pneumoniae, Staphylococcus aureus, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Escherichia coli, Enterobacter aerogenes, Proteus mirabiliscens или Serratia marcescens.
Острый средний бактериальный отит , вызываемый Streptococcus pneumoniae, Haemophilus influenzae (включая штаммы, продуцирующие бета-лактамазу) или Moraxella catarrhalis (включая штаммы, продуцирующие бета-лактамазы).[ПРИМЕЧАНИЕ: В одном исследовании наблюдались более низкие показатели клинического излечения при однократной дозе цефтриаксона для инъекций по сравнению с 10-дневной пероральной терапией. Во втором исследовании наблюдалась сопоставимая частота излечения при применении однократной дозы цефтриаксона для инъекций и препарата сравнения. Потенциально более низкий показатель клинического излечения цефтриаксона для инъекций следует сопоставить с потенциальными преимуществами парентеральной терапии.]
Кожные инфекции и инфекции кожных покровов , вызываемые Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pyogenes, стрептококками группы Viridans, Escherichia coli, Enterobacter cloacae, Klebsiella oxytoca, Klebsiella pneumoniae, Calibriella mirabacetoca, Klebsiella pneumoniae, Caluga mirabacetoca, бактериями marcobolum, Sergabitus mirabacetosae , Bacteroides fragilis * или виды Peptostreptococcus.
Инфекции мочевыводящих путей (сложные и неосложненные) , вызванные Escherichia coli, Proteus mirabilis, Proteus vulgaris, Morganella morganii или Klebsiella pneumoniae.
Неосложненная гонорея (шейная / уретральная и ректальная), вызванная Neisseria gonorrhoeae, включая штаммы, продуцирующие как пенициллиназу, так и непенициллиназу, и глоточную гонорею, вызванную штаммами Neisseria gonorrhoeae, не продуцирующими пенициллиназу.
Воспалительное заболевание тазовых органов , вызванное Neisseria gonorrhoeae.Цефтриаксон для инъекций, как и другие цефалоспорины, не имеет активности против Chlamydia trachomatis. Поэтому, когда цефалоспорины используются для лечения пациентов с воспалительными заболеваниями органов малого таза и Chlamydia trachomatis является одним из подозреваемых возбудителей, следует добавить соответствующее антихламидийное покрытие.
Бактериальная септицемия , вызванная Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli, Haemophilus influenzae или Klebsiella pneumoniae.
Инфекции костей и суставов , вызываемые Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli, Proteus mirabilis, Klebsiella pneumoniae или видами Enterobacter.
Внутрибрюшные инфекции , вызываемые Escherichia coli, Klebsiella pneumoniae, Bacteroides fragilis, видами Clostridium (примечание: большинство штаммов Clostridium difficile устойчивы) или видами Peptostreptococcus.
Менингит , вызванный Haemophilus influenzae, Neisseria meningitidis или Streptococcus pneumoniae. Цефтриаксон для инъекций также успешно применялся в ограниченном числе случаев менингита и шунтирующей инфекции, вызванной Staphylococcus epidermidis * и Escherichia coli.*
* Эффективность этого организма в этой системе органов была изучена менее чем на десяти инфекциях.
Хирургическая профилактика : Предоперационное введение однократной дозы цефтриаксона 1 г для инъекции может снизить частоту послеоперационных инфекций у пациентов, подвергающихся хирургическим процедурам, классифицируемым как загрязненные или потенциально загрязненные (например, вагинальная или абдоминальная гистерэктомия или холецистэктомия при хроническом калькулезном холецистите у пациентов с высоким риском, таких как люди старше 70 лет, с острым холециститом, не требующим терапевтических противомикробных препаратов, механической желтухой или камнями желчных протоков в общих протоках) и у хирургических пациентов, для которых инфекция в месте операции представляет серьезный риск (например,г., во время операции аортокоронарного шунтирования). Хотя было показано, что цефтриаксон для инъекций столь же эффективен, как и цефазолин, в профилактике инфекции после операции аортокоронарного шунтирования, плацебо-контролируемых испытаний для оценки цефалоспориновых антибиотиков в профилактике инфекции после операции аортокоронарного шунтирования не проводилось.
При введении перед хирургическими процедурами, для которых это показано, однократная доза цефтриаксона в 1 г для инъекций обеспечивает защиту от большинства инфекций, вызванных чувствительными микроорганизмами, на протяжении всей процедуры.
ДОЗИРОВКА И ПРИМЕНЕНИЕ
Роцефин можно вводить внутривенно или внутримышечно.
| Не используйте разбавители, содержащие кальций, такие как раствор Рингера или раствор Хартмана, для восстановления роцефина. Это может привести к образованию твердых частиц. Рацефин и кальцийсодержащие растворы, включая продолжительные инфузии, содержащие кальций, такие как парентеральное питание, не следует смешивать или вводить совместно любому пациенту независимо от возраста, даже через разные инфузионные линии в разных местах. НОВОРОЖДЕННЫЕ |
ПЕДИАТРИЧЕСКИЕ ПАЦИЕНТЫ
Для лечения инфекций кожи и кожных структур рекомендуемая общая суточная доза составляет от 50 до 75 мг / кг один раз в день (или в равных дозах два раза в день). Общая суточная доза не должна превышать 2 грамма.
Для лечения острого бактериального среднего отита рекомендуется однократная внутримышечная доза 50 мг / кг (не более 1 грамма) (см. ПОКАЗАНИЯ И ПРИМЕНЕНИЕ).
Для лечения серьезных различных инфекций, отличных от менингита, рекомендуемая общая суточная доза составляет от 50 до 75 мг / кг в разделенных дозах каждые 12 часов. Общая суточная доза не должна превышать 2 грамма.
При лечении менингита рекомендуется, чтобы начальная терапевтическая доза составляла 100 мг / кг (не более 4 граммов). После этого рекомендуется общая суточная доза 100 мг / кг / день (но не более 4 граммов в день). Суточная доза может вводиться один раз в день (или поровну каждые 12 часов).Обычная продолжительность терапии составляет от 7 до 14 дней.
ВЗРОСЛЫЕ
Обычная суточная доза для взрослых составляет 1-2 грамма один раз в день (или поровну два раза в день) в зависимости от типа и тяжести инфекции. Общая суточная доза не должна превышать 4 грамма.
Если предполагается, что возбудителем является Chlamydia trachomatis, необходимо добавить соответствующее антихламидийное покрытие, поскольку цефтриаксон натрия не действует против этого микроорганизма.
Для лечения неосложненных гонококковых инфекций рекомендуется однократная внутримышечная доза 250 мг.
Для предоперационного использования (хирургическая профилактика) рекомендуется однократная доза в 1 грамм, вводимая внутривенно за 1/2–2 часа до операции.
Как правило, терапию роцефином следует продолжать не менее 2 дней после исчезновения признаков и симптомов инфекции. Обычная продолжительность терапии составляет от 4 до 14 дней; при осложненных инфекциях может потребоваться более длительная терапия.
При лечении инфекций, вызванных Streptococcus pyogenes, терапию следует продолжать не менее 10 дней.
Нет необходимости корректировки дозировки для пациентов с нарушением функции почек или печени; однако следует контролировать уровни в крови у пациентов с тяжелой почечной недостаточностью (например, у пациентов на диализе) и у пациентов с нарушением функции почек и печени.
НАПРАВЛЕНИЯ ПО ПРИМЕНЕНИЮ —————-
Внутримышечно Администрация
Восстановите порошок роцефина с помощью соответствующего разбавителя (см. СОВМЕСТИМОСТЬ И СТАБИЛЬНОСТЬ).
Ввести разбавитель во флакон, тщательно встряхнуть флакон до образования раствора.Набрать все содержимое флакона в шприц до полной обозначенной дозы.
После восстановления каждый 1 мл раствора содержит приблизительно 250 мг или 350 мг эквивалента цефтриаксона в зависимости от количества разбавителя, указанного ниже. При необходимости можно использовать более разбавленные растворы. Концентрация 350 мг / мл не рекомендуется для флакона 250 мг, поскольку может оказаться невозможным извлечь все содержимое.
Как и все препараты для внутримышечного введения, Роцефин следует вводить в тело относительно большой мышцы; аспирация помогает избежать непреднамеренной инъекции в кровеносный сосуд.
| Дозировка флакона | Количество добавляемого разбавителя | |
|---|---|---|
| 250 мг / мл | 350 мг / мл | |
| 250 мг | 0,9 мл | – |
| 500 мг | 1,8 мл | 1,0 мл |
| 1 г | 3,6 мл | 2.1 мл |
| 2 г | 7,2 мл | 4,2 мл |
Внутривенно Администрация
Роцефин следует вводить внутривенно путем инфузии в течение 30 минут. Рекомендуются концентрации от 10 мг / мл до 40 мг / мл; однако при желании можно использовать более низкие концентрации. Восстановите флаконы подходящим разбавителем для внутривенных вливаний (см. СОВМЕСТИМОСТЬ И СТАБИЛЬНОСТЬ).
| Дозировка флакона | Количество добавляемого разбавителя |
|---|---|
| 250 мг | 2.4 мл |
| 500 мг | 4,8 мл |
| 1 г | 9,6 мл |
| 2 г | 19,2 мл |
После восстановления каждый 1 мл раствора содержит примерно 100 мг эквивалента цефтриаксона. Удалите все содержимое и разведите до желаемой концентрации подходящим разбавителем для внутривенного введения.
СОВМЕСТИМОСТЬ И СТАБИЛЬНОСТЬ
Было показано, что цефтриаксон совместим с Flagyl®2 IV (метронидазола гидрохлорид).Концентрация не должна превышать 5-7,5 мг / мл гидрохлорида метронидазола с 10 мг / мл цефтриаксона в качестве добавки. Смесь стабильна в течение 24 часов при комнатной температуре только в растворе 0,9% раствора хлорида натрия или 5% раствора декстрозы в воде (D5W). Никаких исследований совместимости с препаратом Flagyl® IV RTU® (метронидазол) или другими разбавителями не проводилось. Метронидазол при концентрациях более 8 мг / мл будет выпадать в осадок. Не охлаждайте смесь, так как может выпадать осадок.
Ванкомицин и флуконазол физически несовместимы с цефтриаксоном в смесях. Когда любой из этих препаратов должен вводиться одновременно с цефтриаксоном путем периодической внутривенной инфузии, рекомендуется вводить их последовательно, с тщательной промывкой внутривенных линий (одной из совместимых жидкостей) между введениями.
Не используйте разбавители, содержащие кальций, такие как раствор Рингера или раствор Хартмана, для восстановления роцефина.Это может привести к образованию твердых частиц.
РастворыРоцефина нельзя физически смешивать с растворами, содержащими другие противомикробные препараты, или с растворами-разбавителями, отличными от перечисленных выше, или добавлять в них из-за возможной несовместимости (см. ПРЕДУПРЕЖДЕНИЯ).
Стерильный порошок роцефина следует хранить при комнатной температуре — 25 ° C (77 ° F) или ниже в защищенном от света месте. После восстановления защита от обычного света не требуется. Цвет растворов варьируется от светло-желтого до янтарного, в зависимости от продолжительности хранения, концентрации и используемого разбавителя.
Внутримышечные растворы роцефина остаются стабильными (потеря активности менее 10%) в течение следующих периодов времени:
| Хранилище | |||
|---|---|---|---|
| Разбавитель | Концентрация мг / мл | Темп. (25 ° С) | Холодильный (4 ° C) |
| Стерильная вода для инъекций | 100 250, 350 | 2 дня 24 часа | 10 дней 3 дня |
| 0.9% раствор хлорида натрия | 100 250, 350 | 2 дня 24 часа | 10 дней 3 дня |
| 5% раствор декстрозы | 100 250, 350 | 2 дня 24 часа | 10 дней 3 дня |
| Бактериостатическая вода + 0,9% бензиловый спирт | 100 250, 350 | 24 часа 24 часа | 10 дней 3 дня |
| 1% раствор лидокаина (без адреналина) | 100 250, 350 | 24 часа 24 часа | 10 дней 3 дня |
Растворы роцефина для внутривенного введения в концентрациях 10, 20 и 40 мг / мл остаются стабильными (потеря активности менее 10%) в течение следующих периодов времени при хранении в стеклянных или ПВХ контейнерах:
| Хранилище | ||
|---|---|---|
| Разбавитель | Темп. (25 ° С) | Холодильный (4 ° C) |
| * Данные доступны для концентраций от 10 до 40 мг / мл в этом разбавителе только в контейнерах из ПВХ. | ||
| Стерильная вода | 2 дня | 10 дней |
| 0,9% раствор хлорида натрия | 2 дня | 10 дней |
| 5% раствор декстрозы | 2 дня | 10 дней |
| 10% раствор декстрозы | 2 дня | 10 дней |
| 5% Декстроза + 0.9% раствор хлорида натрия * | 2 дня | Несовместимый |
| 5% декстроза + 0,45% раствор хлорида натрия | 2 дня | Несовместимый |
Следующие растворы роцефина для внутривенного введения стабильны при комнатной температуре (25 ° C) в течение 24 часов при концентрациях от 10 мг / мл до 40 мг / мл: лактат натрия (контейнер из ПВХ), 10% инвертный сахар (стеклянный контейнер ), 5% бикарбонат натрия (стеклянный контейнер), Freamine III (стеклянный контейнер), Normosol-M в 5% декстрозе (стеклянный и поливинилхлоридный контейнеры), Ionosol-B в 5% декстрозе (стеклянный контейнер), 5% маннитол (стеклянный контейнер). ), 10% маннитола (стеклянная тара).
По истечении указанного периода времени стабильности неиспользованные части решений следует выбросить.
ПРИМЕЧАНИЕ. Перед введением лекарственные препараты для парентерального введения необходимо визуально проверить на наличие твердых частиц.
Роцефин, восстановленный 5% -ным раствором декстрозы или 0,9% -ным раствором хлорида натрия в концентрациях от 10 до 40 мг / мл, а затем хранящийся в замороженном состоянии (-20 ° C) в контейнерах из ПВХ или полиолефина, остается стабильным в течение 26 недель.
Замороженные растворы роцефина перед использованием необходимо разморозить при комнатной температуре.После размораживания неиспользованные порции следует выбросить. НЕ ЗАМОРАЖИВАТЬ.
КАК ПОСТАВЛЯЕТСЯ
Роцефин поставляется в виде стерильного кристаллического порошка в стеклянных флаконах. Доступны следующие пакеты:
Флаконы, содержащие 250 мг эквивалента цефтриаксона. Коробка из 1 (NDC 0004-1962-02) и коробка из 10 (NDC 0004-1962-01).
Флаконы, содержащие 500 мг эквивалента цефтриаксона. Коробка из 1 (NDC 0004-1963-02) и коробка из 10 (NDC 0004-1963-01).
Флаконы, содержащие 1 г эквивалента цефтриаксона.Коробка из 1 (НДЦ 0004-1964-04) и коробка из 10 (НДЦ 0004-1964-01).
Флаконы, содержащие 2 г эквивалента цефтриаксона. Вставка 10 (НДЦ 0004-1965-01).
Аптечные контейнеры для массовых грузов, содержащие 10 г эквивалента цефтриаксона. Коробка из 1 (НДЦ 0004-1971-01). НЕ ДЛЯ ПРЯМОГО УПРАВЛЕНИЯ.
ПРИМЕЧАНИЕ. Стерильный порошок роцефина следует хранить при комнатной температуре, 77ºF (25ºC) или ниже, в защищенном от света месте.
Roche Pharmaceuticals
Roche Laboratories, Inc.
340 Kingsland Street
Nutley, NJ 07110–1199
10087320
Пересмотрено: август 2007 г.
Информация для медицинских работников о вакцине Pfizer / BioNTech COVID-19
Положение 174 Информация для специалистов здравоохранения Великобритании
Это лекарство было разрешено на временную поставку Министерством здравоохранения и социального обеспечения Великобритании и Агентством по регулированию лекарственных средств и товаров медицинского назначения.У него нет разрешения на продажу, но это временное разрешение дает разрешение на использование лекарства для активной иммунизации для предотвращения заболевания COVID-19, вызванного вирусом SARS-CoV-2, у лиц в возрасте от 16 лет и старше.
Как и в случае с любым новым лекарством в Великобритании, этот продукт будет тщательно контролироваться, чтобы обеспечить быстрое выявление новой информации о безопасности. Медицинских работников просят сообщать о любых предполагаемых побочных реакциях. См. Раздел 4.8, чтобы узнать, как сообщить о побочных реакциях.
1. Название лекарственного препарата
COVID-19 мРНК Вакцина BNT162b2 концентрат для раствора для инъекций
2. Качественный и количественный состав
Это многодозовый флакон, который необходимо разбавить перед использованием. 1 флакон (0,45 мл) содержит 6 доз по 30 мкг РНК BNT162b2 (встроенной в липидные наночастицы), см. Раздел 4.2.
мРНК COVID-19 Вакцина BNT162b2 представляет собой высокоочищенную одноцепочечную информационную РНК с 5′-кэпами (мРНК), полученную путем внеклеточной транскрипции in vitro с соответствующих матриц ДНК, кодирующих вирусный спайковый (S) белок SARS-CoV- 2.
Вспомогательные вещества с известным эффектом: Полный список вспомогательных веществ см. В разделе 6.1.
3. Лекарственная форма
Концентрат для раствора для инъекций.
Вакцина представляет собой замороженный раствор от белого до почти белого цвета.
4. Клинические данные
4.1 Показания к применению
Активная иммунизация для предотвращения COVID-19, вызванного вирусом SARS-CoV-2, у лиц в возрасте 16 лет и старше.
Использование вакцины мРНК COVID-19 BNT162b2 должно осуществляться в соответствии с официальными инструкциями.
4.2 Дозировка и способ применения
Позология
Физические лица в возрасте 16 лет и старше:
Вакцина мРНК COVID-19 BNT162b2 вводится внутримышечно после разведения сериями из двух доз (по 0,3 мл каждая) с интервалом не менее 21 дня (см. Раздел 5.1).
Нет доступных данных о взаимозаменяемости вакцины мРНК COVID-19 BNT162b2 с другими вакцинами COVID-19 для завершения серии вакцинаций. Лица, получившие одну дозу вакцины мРНК COVID-19 BNT162b2, должны получить вторую дозу вакцины мРНК COVID-19 BNT162b2 для завершения серии вакцинаций.
Люди не могут быть максимально защищены до, по крайней мере, 7 дней после приема второй дозы вакцины.
Для получения дополнительной информации об эффективности см. Раздел 5.1.
Педиатрия
Безопасность и эффективность вакцины мРНК COVID-19 BNT162b2 у детей в возрасте до 16 лет еще не установлены.
Способ применения
Ввести вакцину BNT162b2 вакцины мРНК COVID-19 внутримышечно в дельтовидную мышцу после разведения.
После разбавления флаконы с мРНК вакцины COVID-19 BNT162b2 содержат 6 доз вакцины по 0,3 мл. Для извлечения 6 доз из одного флакона следует использовать шприцы и / или иглы с малым мертвым объемом. Если используются стандартные шприцы и иглы, может не хватить объема для извлечения шестой дозы из одного флакона. Независимо от типа шприца и иглы:
- Каждая доза должна содержать 0,3 мл вакцины.
- Если количество вакцины, оставшееся во флаконе, не может обеспечить полную дозу 0.3 мл, выбросьте флакон и любой лишний объем.
- Не объединяйте избыток вакцины из нескольких флаконов.
Не вводите вакцину внутрисосудисто, подкожно или внутрикожно.
Приготовление: Многодозовый флакон хранится в замороженном виде, и его необходимо разморозить перед разбавлением.
Замороженные флаконы необходимо разогреть до температуры от 2 ° C до 8 ° C. В качестве альтернативы замороженные флаконы также можно разморозить и хранить при температуре до 25 ° C не более двух часов для подготовки к разбавлению для использования.
После извлечения из морозильной камеры неразбавленная вакцина имеет максимальный срок хранения до 5 дней (120 часов) при температуре от 2 ° C до 8 ° C и дополнительно 2 часа при температуре до 25 ° C в процессе подготовки к разбавлению.
Когда размороженный флакон нагреется до комнатной температуры, осторожно переверните 10 раз перед разбавлением. Не трясите. Перед разбавлением размороженная дисперсия может содержать непрозрачные аморфные частицы от белого до почти белого цвета.
Размороженную вакцину необходимо развести в исходном флаконе 1.8 мл раствора натрия хлорида 9 мг / мл (0,9%) для инъекций с использованием иглы 21 калибра или более узкой и асептических методов.
Предупреждение: раствор натрия хлорида 9 мг / мл (0,9%) без консервантов для инъекций является единственным разбавителем, который следует использовать. Этот разбавитель не входит в комплект поставки вакцины.
Выровняйте давление во флаконе перед извлечением иглы из флакона, набрав 1,8 мл воздуха в пустой шприц для разбавителя.
Осторожно переверните разбавленный раствор 10 раз.Не трясите.
Разбавленная вакцина должна представлять собой раствор грязно-белого цвета без видимых частиц. Выбросьте разбавленную вакцину, если присутствуют частицы или обесцвечивание.
На флаконах с разведенным раствором должны быть указаны дата и время разведения, и они должны храниться при температуре от 2 ° C до 25 ° C.
Использовать как можно скорее и в течение 6 часов после разбавления.
После разведения во флаконе 6 доз по 0,3 мл. С помощью стерильной иглы и шприца извлеките необходимую дозу разбавленной вакцины 0,3 мл и введите ее.
Для извлечения 6 доз из одного флакона следует использовать шприцы и / или иглы с низким мертвым объемом.
Если используются стандартные шприцы и иглы, может не хватить объема для извлечения шестой дозы из одного флакона.
Каждая доза должна содержать 0,3 мл вакцины.
Если количество вакцины, оставшееся во флаконе, не может обеспечить полную дозу 0,3 мл, утилизируйте флакон и любой лишний объем.
Любую неиспользованную вакцину следует выбросить через 6 часов после разведения.
После разведения вакцину нельзя отвозить (перевозить) автомобильным транспортом от места разведения. Любая транспортировка (транспортировка) автомобильным транспортом после разбавления флакона находится на риске специалиста в области здравоохранения.
Инструкции по утилизации см. В разделе 6.6.
4.3 Противопоказания
Повышенная чувствительность к активному веществу или любому из вспомогательных веществ, перечисленных в разделе 6.1.
4.4 Особые предупреждения и меры предосторожности при использовании
Гиперчувствительность и анафилаксия
Сообщалось о случаях анафилаксии.Соответствующее медицинское лечение и наблюдение всегда должны быть доступны в случае анафилактической реакции после введения вакцины.
После вакцинации рекомендуется пристальное наблюдение в течение как минимум 15 минут. Вторую дозу вакцины не следует вводить тем, кто испытал анафилаксию после первой дозы вакцины мРНК COVID-19 BNT162b2.
Прослеживаемость
Чтобы улучшить отслеживаемость биологических лекарственных препаратов, следует четко записывать название и номер партии вводимого препарата.
Общие рекомендации
Введение вакцины мРНК COVID-19 BNT162b2 следует отложить лицам, страдающим острым тяжелым лихорадочным заболеванием.
Лицам, получающим антикоагулянтную терапию, или лицам с нарушением свертываемости крови, которые противопоказаны внутримышечные инъекции, не следует вводить вакцину, если потенциальная польза явно не превышает риск введения.
Лица с ослабленным иммунитетом, включая людей, получающих терапию иммунодепрессантами, могут иметь ослабленный иммунный ответ на вакцину.Нет данных о одновременном применении иммунодепрессантов.
Как и любая вакцина, вакцинация мРНК COVID-19 Вакцина BNT162b2 может не защитить всех реципиентов вакцины.
Нет данных об использовании вакцины мРНК COVID-19 BNT162b2 у лиц, которые ранее получали серию полной или частичной вакцинации с другой вакциной COVID-19.
Информация о наполнителе
Эта вакцина содержит менее 1 ммоль (39 мг) калия на дозу, т. Е.по существу «не содержит калия».
Эта вакцина содержит менее 1 ммоль натрия (23 мг) на дозу, т.е. практически не содержит натрия.
4.5 Взаимодействие с другими лекарственными средствами и другие формы взаимодействия
Исследования взаимодействия не проводились.
Одновременное введение вакцины BNT162b2 мРНК COVID-19 с другими вакцинами не изучалось (см. Раздел 5.1).
Не смешивайте вакцину мРНК COVID-19 BNT162b2 с другими вакцинами / продуктами в одном шприце.
4.6 Фертильность, беременность и лактация
Беременность
Имеется ограниченный опыт использования вакцины мРНК COVID-19 BNT162b2 у беременных женщин. Исследования на животных не указывают прямого или косвенного вредного воздействия на беременность, развитие эмбриона / плода, роды или послеродовое развитие (см. Раздел 5.3). Введение вакцины мРНК COVID-19 BNT162b2 во время беременности следует рассматривать только в том случае, если потенциальные преимущества перевешивают любые потенциальные риски для матери и плода.
Кормление грудью
Неизвестно, выделяется ли вакцина против мРНК COVID-19 BNT162b2 с грудным молоком.
Плодородие
Исследования на животных не указывают прямого или косвенного вредного воздействия в отношении репродуктивной токсичности (см. Раздел 5.3).
4.7 Влияние на способность управлять автомобилем и работать с механизмами
Вакцина мРНК COVID-19 BNT162b2 не оказывает или оказывает незначительное влияние на способность управлять автомобилем и машинами. Однако некоторые из побочных реакций, упомянутых в разделе 4.8 может временно повлиять на способность управлять автомобилем или работать с механизмами.
4.8 Нежелательные эффекты
Краткое изложение профиля безопасности
Безопасность вакцины мРНК COVID-19 BNT162b2 оценивалась у участников в возрасте 16 лет и старше в двух клинических исследованиях, проведенных в США, Европе, Турции, Южной Африке и Южной Америке. В исследовании BNT162-01 (исследование 1) приняли участие 60 участников в возрасте от 18 до 55 лет. В исследовании C45 (исследование 2) приняли участие около 44 000 участников в возрасте от 12 лет и старше.В исследовании 2 в общей сложности 21 720 участников в возрасте 16 лет и старше получили по крайней мере одну дозу вакцины мРНК COVID19 BNT162b, а 21 728 участников в возрасте 16 лет и старше получали плацебо. Из них на момент анализа 19067 (9531 вакцина мРНК COVID-19 BNT162b2 и 9536 плацебо) были оценены на безопасность через 2 месяца после второй дозы вакцины мРНК COVID-19 BNT162b2.
Демографические характеристики были в целом схожими в отношении возраста, пола, расы и этнической принадлежности среди участников, получивших вакцину мРНК COVID-19, и тех, кто получал плацебо.В целом среди участников, получивших вакцину против мРНК COVID-19 BNT162b2, 51,5% были мужчинами, 48,5% — женщинами, 82,1% были белыми, 9,6% — черными или афроамериканцами, 26,1% — латиноамериканцами / латиноамериканцами, 4,3% — азиатами и 0,7%. % были коренными американцами / коренными жителями Аляски.
Наиболее частыми побочными реакциями у участников в возрасте 16 лет и старше были боль в месте инъекции (> 80%), усталость (> 60%), головная боль (> 50%), миалгия (> 30%), озноб (> 30%), артралгии (> 20%) и гипертермии (> 10%) и обычно были легкой или умеренной интенсивности и исчезли в течение нескольких дней после вакцинации.При необходимости может использоваться симптоматическое лечение обезболивающими и / или жаропонижающими лекарственными средствами (например, препаратами, содержащими парацетамол).
Побочные реакции в результате клинических исследований
Побочные реакции, о которых сообщалось в клинических исследованиях, перечислены в этом разделе по классам органов системы MedDRA в порядке убывания частоты и серьезности. Частота определяется следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 до <1/10), нечасто (≥ 1/1000 до <1/100), редко (≥ 1/10 000 до < 1/1000), очень редко (<1/10 000), неизвестно (невозможно оценить по имеющимся данным).
Заболевания крови и лимфатической системы
- Нечасто: лимфаденопатия
Нарушения иммунной системы
- Не известно: анафилаксия; гиперчувствительность
Нарушения нервной системы
- Очень часто: головная боль
- Редко: острый периферический паралич лицевого нерва
Нарушения со стороны скелетно-мышечной и соединительной ткани
- Очень часто: артралгия; миалгия
Общие нарушения и нарушения в месте введения
- Очень часто: боль в месте инъекции; усталость; озноб; пирексия
- Часто: покраснение в месте инъекции; опухоль в месте инъекции
- Необычное: недомогание
Желудочно-кишечные расстройства
На протяжении всего периода наблюдения за безопасностью до настоящего времени об остром периферическом параличе лицевого нерва (или параличе) сообщили четыре участника группы вакцины мРНК COVID-19.Начало было на 37 день после дозы 1 (участник не получал дозу 2) и на 3, 9 и 48 день после дозы 2. В группе плацебо не было зарегистрировано случаев острого периферического паралича лицевого нерва (или паралича).
Пост-авторизационные отчеты о гриппоподобных заболеваниях
Некоторые реципиенты сообщали об ознобе, дрожи (в некоторых случаях — ознобе) и повышении температуры тела, возможно, с потоотделением, головной болью (включая головные боли, напоминающие мигрень), тошнотой, миалгией и недомоганием, начиная с первого дня вакцинации.Эти эффекты обычно длятся день или два.
Если пациент сообщает о необычно высокой и продолжительной лихорадке или других стойких симптомах, следует рассмотреть альтернативные причины и дать соответствующие рекомендации для диагностического исследования и лечения, если это необходимо.
Сообщение о предполагаемых побочных реакциях
Если вы обеспокоены нежелательным явлением, о нем следует указать желтую карточку. Формы отчетности и информацию можно найти на сайте сообщений о желтой карточке коронавируса или выполнить поиск желтой карточки MHRA в Google Play.В отчете укажите марку вакцины и номер партии / партии, если таковые имеются.
В качестве альтернативы, о нежелательных явлениях, вызывающих беспокойство, связанных с вакциной BNT 162b2 на основе мРНК Pfizer BioNTech COVID-19, можно сообщить в Pfizer Medical Information по телефону 01304 616161 или через Pfizer Safety Reporting.
Пожалуйста, не сообщайте об одном и том же нежелательном явлении в обе системы, так как все отчеты будут передаваться между Pfizer и MHRA (в анонимной форме), а двойное сообщение создаст ненужные дубликаты.
4.9 Передозировка
Участники, получившие 58 мкг вакцины мРНК COVID-19 в клинических испытаниях, не сообщили об увеличении реактогенности или побочных эффектах.
В случае передозировки рекомендуется мониторинг жизненно важных функций и возможное симптоматическое лечение.
5. Фармакодинамические свойства
5.1 Фармакодинамические свойства
Фармакотерапевтическая группа: вакцины, другие вирусные вакцины, код АТХ: J07BX03
Механизм действия
Модифицированная нуклеозидами информационная РНК в мРНК COVID-19 Вакцина BNT162b2 сформулирована в виде липидных наночастиц, которые обеспечивают доставку РНК в клетки-хозяева, чтобы обеспечить экспрессию антигена SARSCoV-2 S.Вакцина вызывает как нейтрализующие антитела, так и клеточный иммунный ответ на спайковый (S) антиген, что может способствовать защите от заболевания COVID-19.
Эффективность у участников в возрасте 16 лет и старше
Эффективность вакцины мРНК COVID-19 BNT162b2 оценивалась у участников в возрасте 16 лет и старше в двух клинических исследованиях, проведенных в США, Европе, Турции, Южной Африке и Южной Америке. В исследовании 1 приняли участие 60 человек в возрасте от 18 до 55 лет.Исследование 2 — это многоцентровое плацебо-контролируемое исследование эффективности с участием участников в возрасте 12 лет и старше. Рандомизация была стратифицирована по возрасту: от 12 до 15 лет, от 16 до 55 лет или от 56 лет и старше, с минимум 40% участников в страте ≥ 56 лет. В исследование были исключены участники с ослабленным иммунитетом и те, у кого ранее был клинический или микробиологический диагноз COVID-19. Были включены участники с ранее существовавшим стабильным заболеванием, определяемым как заболевание, не требующее значительных изменений в терапии или госпитализации из-за обострения заболевания в течение 6 недель до включения в исследование, а также участников с известной стабильной инфекцией вируса иммунодефицита человека (ВИЧ), вируса гепатита С ( HCV) или вирус гепатита B (HBV).Не было необходимости в профилактическом применении парацетамола или анальгетиков. Вакцины против гриппа можно вводить вне окна ± 14 дней от доз вакцины.
В исследовании 2 примерно 44000 участников в возрасте 12 лет и старше были рандомизированы в равной степени и получили 2 дозы вакцины мРНК COVID-19 или плацебо с запланированным интервалом в 21 день. В анализ эффективности были включены участники, получившие вторую вакцинацию в течение 19–42 дней после первой вакцинации.Планируется, что за участниками будут наблюдать до 24 месяцев для оценки безопасности и эффективности против COVID-19.
Популяция для анализа первичной конечной точки эффективности включала 36 621 участника в возрасте 12 лет и старше (18 242 в группе вакцины мРНК COVID-19 и 18 379 в группе плацебо), у которых не было доказательств предшествующей инфекции SARS-CoV. -2 через 7 дней после второй дозы. Демографические характеристики были в целом схожими в отношении возраста, пола, расы и этнической принадлежности среди участников, получивших вакцину мРНК COVID-19 BNT162b2, и тех, кто получал плацебо.В целом, среди участников, которые получили вакцину мРНК COVID-19, 51,1% были мужчинами и 48,9% женщинами, 82,8% были белыми, 8,9% были чернокожими или афроамериканцами, 26,8% были латиноамериканцами / латиноамериканцами, 4,5% были азиатами и 0,6% были коренными американцами / коренными жителями Аляски. 57,2% были в возрасте от 16 до 55 лет, 42,6% были в возрасте> 55 лет и 21,8% были в возрасте ≥ 65 лет.
Эффективность против COVID-19
На момент анализа Исследования 2 представленная информация основана на участниках от 16 лет и старше.Участники наблюдались на предмет симптоматического заболевания COVID-19 в течение не менее 2214 человеко-лет для вакцины мРНК COVID-19 и не менее 2222 человеко-лет в группе плацебо. Было выявлено 8 подтвержденных случаев COVID-19 в группе вакцины против мРНК COVID-19 и 162 случая в группе плацебо, соответственно. В этом анализе эффективность вакцины мРНК COVID-19 BNT162b2 в предотвращении первого появления COVID-19 через 7 дней после приема дозы 2 по сравнению с плацебо составила 95,0% (95% доверительный интервал от 90,3% до 97.6%) у участников в возрасте 16 лет и старше без признаков предшествующей инфекции SARS-CoV-2. У участников в возрасте 65 лет и старше и 75 лет и старше без доказательств предшествующих инфекций SARS-CoV-2 эффективность вакцины мРНК COVID-19 BNT162b2 составила 94,7% (двусторонний 95% доверительный интервал от 66,7% до 99,9%) и 100% (двусторонний 95% доверительный интервал от -13,1% до 100,0%) соответственно.
Во втором первичном анализе эффективность вакцины мРНК COVID-19 BNT162b2 в предотвращении первого появления COVID-19 через 7 дней после приема дозы 2 по сравнению с плацебо составила 94.6% (95% доверительный интервал от 89,9% до 97,3%) у участников в возрасте 16 лет и старше с доказательствами предшествующей инфекции SARS-CoV-2 или без них.
Не было значимых клинических различий в общей эффективности вакцины у участников, которые подвергались риску тяжелого заболевания COVID-19, включая участников с одной или несколькими сопутствующими заболеваниями, которые увеличивают риск тяжелого заболевания COVID-19 (например, астма, ИМТ ≥30 кг / м2. , хроническая болезнь легких, сахарный диабет, гипертония).
Подтвержденные случаи были определены с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) и по крайней мере 1 симптом соответствовал болезни COVID-19.
- Определение случая (по крайней мере, 1 из): лихорадка, новый или усиленный кашель, новая или усиленная одышка; озноб, новая или усиленная мышечная боль, новая потеря вкуса или запаха, боль в горле, диарея или рвота.
5.2 Фармакокинетические свойства
Не применимо.
5.3 Доклинические данные по безопасности
Доклинические данные, основанные на традиционных исследованиях токсичности при повторном введении, не показывают особой опасности для человека.
Репродуктивная токсичность
Токсичность для репродуктивной функции и развития была исследована на крысах в комбинированном исследовании токсичности для фертильности и развития, в котором самкам крыс внутримышечно вводили вакцину мРНК COVID-19 BNT162b2 до спаривания и во время беременности (получение 4 полных доз для человека, которые генерируют относительно более высокие уровни у крыс. из-за различий в массе тела между 21-м днем беременности и 20-м днем гестации).Ответы нейтрализующих антител против SARS-CoV-2 присутствовали у материнских животных с момента спаривания до конца исследования на 21-й постнатальный день, а также у плодов и потомков. Воздействия вакцины на фертильность, беременность, эмбриональный плод или развитие потомства отсутствовали. Нет данных о вакцине BNT162b2 мРНК COVID-19 о переносе вакцины через плаценту или выделении с молоком.
6. Фармацевтические данные
6.1 Список вспомогательных веществ
Эта вакцина содержит полиэтиленгликоль / макрогол (ПЭГ) как часть ALC-0159.
- ALC-0315 = (4-гидроксибутил) азандиил) бис (гексан-6,1-диил) бис (2-гексилдеканоат)
- ALC-0159 = 2 — [(полиэтиленгликоль) -2000] -N, N-дитетрадецилацетамид
- 1,2-Дистеароил-sn-глицеро-3-фосфохолин
- холестерин
- хлорид калия
- дигидрофосфат калия
- натрия хлорид
- дигидрат гидрофосфата динатрия
- сахароза
- вода для инъекций
6.2 Несовместимости
При отсутствии исследований совместимости этот лекарственный препарат нельзя смешивать с другими лекарственными средствами.
6.3 Срок годности
6 месяцев при температуре от -80 ° C до -60 ° C.
6.4 Особые меры предосторожности при хранении
Хранить в морозильной камере при температуре от -80 ° C до -60 ° C.
Хранить в термическом контейнере при температуре от -90 ºC до -60 ºC.
Хранить в оригинальной упаковке в защищенном от света месте.
После извлечения из морозильной камеры неразбавленная вакцина может храниться до 5 дней при температуре от 2 ° C до 8 ° C и до 2 часов при температуре до 25 ° C перед использованием.Во время хранения минимизируйте воздействие комнатного света и избегайте воздействия прямых солнечных лучей и ультрафиолета. Размороженные флаконы можно использовать при комнатной температуре.
После разведения храните вакцину при температуре от 2 ° C до 25 ° C и используйте как можно скорее и в течение 6 часов. Вакцина не содержит консервантов. Выбросьте неиспользованную вакцину.
После разбавления флаконы следует пометить временем разбавления и выбросить в течение 6 часов после разбавления.
После размораживания вакцину нельзя повторно замораживать.
6.5 Тип и содержимое контейнера
Концентрат для раствора для инъекций на 6 доз в прозрачном флаконе объемом 2 мл (стекло типа I) с пробкой (бромбутил) и откидной пластиковой крышкой с алюминиевой пробкой. См. Раздел 4.2 для получения дополнительной информации.
Размер упаковки: 195 ампул
6.6 Особые меры предосторожности при утилизации и другом обращении
После извлечения вакцины из морозильной камеры максимальный срок хранения вакцины составляет до 5 дней при хранении при 2–8 ºC (этикетка добавляется после извлечения коробки из морозильной камеры).Для оттаивания упаковки на 195 флаконов может потребоваться 3 часа при 2-8oC.
В качестве альтернативы продукт можно разморозить и выдержать до 2 часов при температуре до 25 ºC перед разбавлением для использования. Это облегчает немедленное размораживание и использование при извлечении непосредственно из морозильной камеры до 25 ºC. В этом случае продукт необходимо разбавить в течение 2 часов после извлечения из морозильной камеры.
После размораживания вакцину нельзя повторно замораживать.
После разведения вакцину следует использовать как можно скорее и в течение 6 часов после разведения; в этот период его можно хранить при 2-25 ºC.С микробиологической точки зрения, обычно не считается хорошей практикой хранить разбавленный продукт в течение 6 часов при 25ºC перед введением. В идеале продукт следует использовать как можно скорее после разбавления.
Вакцина не содержит консервантов. Отменить любую неиспользованную вакцину
Любой неиспользованный лекарственный препарат или отходы следует утилизировать в соответствии с местными требованиями.
Инструкции по приготовлению дозы лекарственного средства перед введением см. В разделе 4.2.
7. Держатель торговой лицензии
Не применимо.
8. Номер (а) регистрационного удостоверения
Не применимо.
9. Дата первой авторизации / продления авторизации
Не применимо.
10. Дата пересмотра текста
Март 2021 г.
Внутримышечная инъекция, внутривенная инфузия и внутривенная болюсная инъекция окситоцина в третьем периоде родов для предотвращения послеродового кровотечения: рандомизированное контрольное исследование с тремя группами | BMC по беременности и родам
Беременные женщины, поступившие по поводу вагинальных родов в две третичные больницы Египта, были обследованы на предмет участия в этом открытом, параллельном, рандомизированном контролируемом исследовании с тремя группами.Было получено одобрение комитетов по этике исследований обеих больниц: учебной больницы Эль-Галаа в Каире (крупнейший родильный дом в Каире) и родильного дома Шатби в Александрии (университетская больница Александрийского университета), где применялись все три способа введения окситоцина. обычно используется.
Женщины имели право на участие, если они родили живые роды естественным путем, не получали утеротоники перед родами для стимулирования или усиления родов и могли дать информированное согласие.Письменное согласие было получено после поступления в родильное отделение. Впоследствии измеряли и регистрировали кровяное давление и гемоглобин перед родами, последнее — с помощью HemoCue® hb 201+ (HemoCue, Ängelholm, Швеция).
Женщины были рандомизированы для получения 10 МЕ окситоцина внутримышечно, внутривенно или болюсно внутривенно сразу после рождения ребенка. Внутримышечная инъекция обычно вводилась в бедро. Для внутривенной инфузии окситоцин смешивали с 500 мл жидкости и вводили путем инфузии под действием силы тяжести при полностью открытом роликовом зажиме, чаще всего с использованием иглы 18 калибра.Внутривенный болюс вводился непосредственно в порт для внутривенного вливания в течение примерно 1 мин.
Информация о других профилактических мерах, проводимых в третьем периоде родов, в том числе контролируемом тракции пуповины и массаже матки, регистрировалась в стандартных формах сбора данных. Также регистрировались послеродовое артериальное давление и любые побочные эффекты или нежелательные явления, возникшие после введения окситоцина. Послеродовую кровопотерю измеряли через 1 час после родов, используя пластиковую салфетку для сбора крови, направленную в калиброванный контейнер.У женщин с диагнозом ПРК кровопотеря также регистрировалась во время постановки диагноза ПРК и при активном прекращении кровотечения. Женщины с диагнозом ПРК получали стандартное лечение в каждой больнице. Были задокументированы вмешательства, в том числе введение дополнительных утеротоников или переливание крови. Послеродовой гемоглобин измерялся по крайней мере через 24 часа после родов и по крайней мере через 12 часов после удаления внутривенного введения жидкости, если возможно, или непосредственно перед выпиской, если женщины выписывались раньше.
Нашими первичными результатами были средняя кровопотеря и доля женщин с кровопотерей ≥500 мл. Вторичные исходы включали долю женщин с кровопотерей ≥350 мл и ≥ 1000 мл, изменение уровня гемоглобина до и после родов, время до родов плаценты, введение дополнительного окситоцина или других утеротоников и наблюдаемые побочные эффекты в течение 1 часа после родов.
Расчет размера выборки производился на основе ожидаемого количества женщин с кровопотерей ≥500 мл в двух сравнениях этого исследования с тремя группами: внутримышечная инъекция vs.Внутривенная инфузия и внутримышечная инъекция по сравнению с болюсным введением. Основываясь на предыдущих исследованиях, мы ожидали немного большей разницы в результатах кровопотери для сравнения внутривенного болюса и внутримышечной инъекции, поэтому для этого сравнения требовался меньший размер выборки [23, 29]. Мы увеличили размер выборки, чтобы компенсировать проведение двух 80% коррелированных сравнений (что эквивалентно требованию уровня значимости 0,0435 для каждого теста) и для учета 2% коэффициента отсева. Результирующая потребность в размере выборки составляла 4900 женщин при соотношении 3: 3: 1 (2100 в каждой из групп внутримышечной инъекции и внутривенной инфузии и 700 в группе болюсной внутривенной инъекции), при 80% мощности для сравнения внутримышечной инъекции с внутривенной инфузией. инфузия и мощность 85% для сравнения внутримышечной инъекции с внутривенным болюсным введением.Размер выборки также был достаточным для выявления средней разницы в кровопотере 50 мл между исследуемыми группами.
Простой код рандомизации был сгенерирован компьютером блоками по семь в Gynuity Health Projects в Нью-Йорке, и каждое назначение содержалось в последовательно пронумерованном, запечатанном, непрозрачном конверте. Каждая больница была независимо рандомизирована. Персонал больницы, проводивший исследование, не имел доступа к коду рандомизации, и ему было приказано открыть следующий конверт перед родами женщины во время второго периода родов.
Анализ проводился с использованием подхода намерения лечить. P Значения для исходных характеристик были рассчитаны с использованием критерия ассоциации хи-квадрат для категориальных переменных и одностороннего дисперсионного анализа (ANOVA) для непрерывных переменных. Различия считались значимыми при α = 0,0435, чтобы учесть множественные сравнения, сделанные в этом исследовании с тремя группами. Лог-биномиальная регрессия использовалась для расчета относительных рисков (ОР) и связанных 95% доверительных интервалов (ДИ) для категориальных исходов.Линейная регрессия использовалась для расчета коэффициентов регрессии и связанных 95% доверительных интервалов для непрерывных результатов. Сначала мы оценили предположение о нормальном распределении всех непрерывных вторичных исходов (включая послеродовую кровопотерю, время до родов плаценты в минутах, общую кровопотерю и изменение гемоглобина до и после родов). Ни один из них не был распределен нормально, поэтому преобразование (с использованием натурального логарифма ln) было выполнено для всех непрерывных результатов. Чтобы облегчить интерпретацию оценок, полученных в результате линейной регрессии этих логарифмически преобразованных результатов, мы использовали следующую формулу для получения оценки процентного изменения среднего результата (y), связанного с рассматриваемой группой лечения (d): y = 100 · [exp (βd) — 1], где β равно коэффициенту регрессии для логарифмически преобразованного результата.
