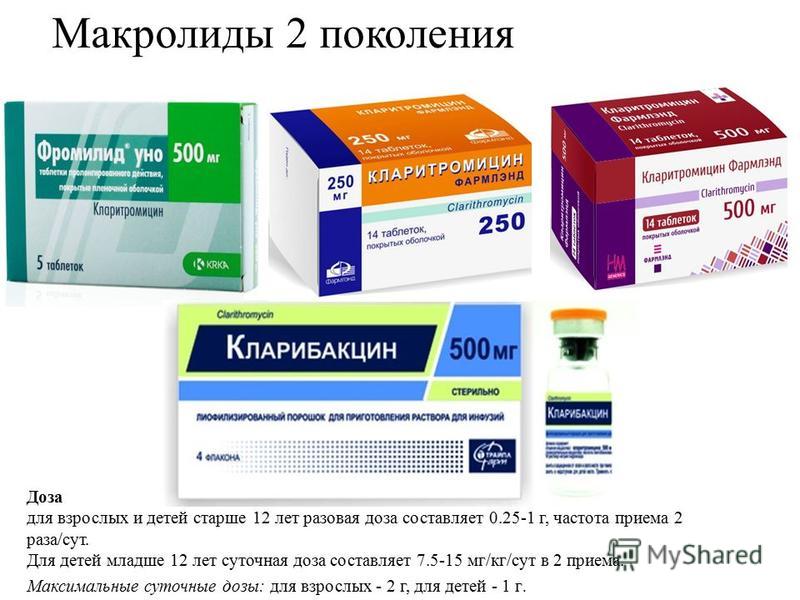
Место макролидов и азалидов в современном лечении респираторных инфекций у детей
27.03.2015
Макролидные антибиотики давно заняли в клинической практике достойное место. С 80-90 годов ХХ века увеличился интерес к использованию макролидов в терапии бактериальных инфекций, что было обусловлено потребностью в новых действенных антибактериальных препаратах для оптимизации традиционной химиотерапии больных, клиническая эффективность которой снизилась. Расширению показаний к применению макролидов способствовали такие факторы: повсеместный рост резистентности возбудителей к b-лактамным антибиотикам, увеличение числа штаммов микроорганизмов, продуцирующих b-лактамазы, явный рост роли внутриклеточных возбудителей (хламидии, микоплазмы, легионеллы) в этиологии пневмоний, бронхитов и обструктивных синдромов до 25-40%, особенно у детей в возрасте до года и после 10 лет (рис. 1) (Г.А. Самсыгина и соавт., 1999; Е.В. Сорокина, 2002; В.Г. Майданник, 2003).
1) (Г.А. Самсыгина и соавт., 1999; Е.В. Сорокина, 2002; В.Г. Майданник, 2003).
Особенности спектра действия и возрастной фармакокинетики определили их место в современном лечении респираторных инфекций (Л.С. Страчунский, С.Н. Козлов, 1998; А.Н. Попкова и соавт., 2000; В.Г. Майданник, 2002; С.В. Яковлев, 2003).
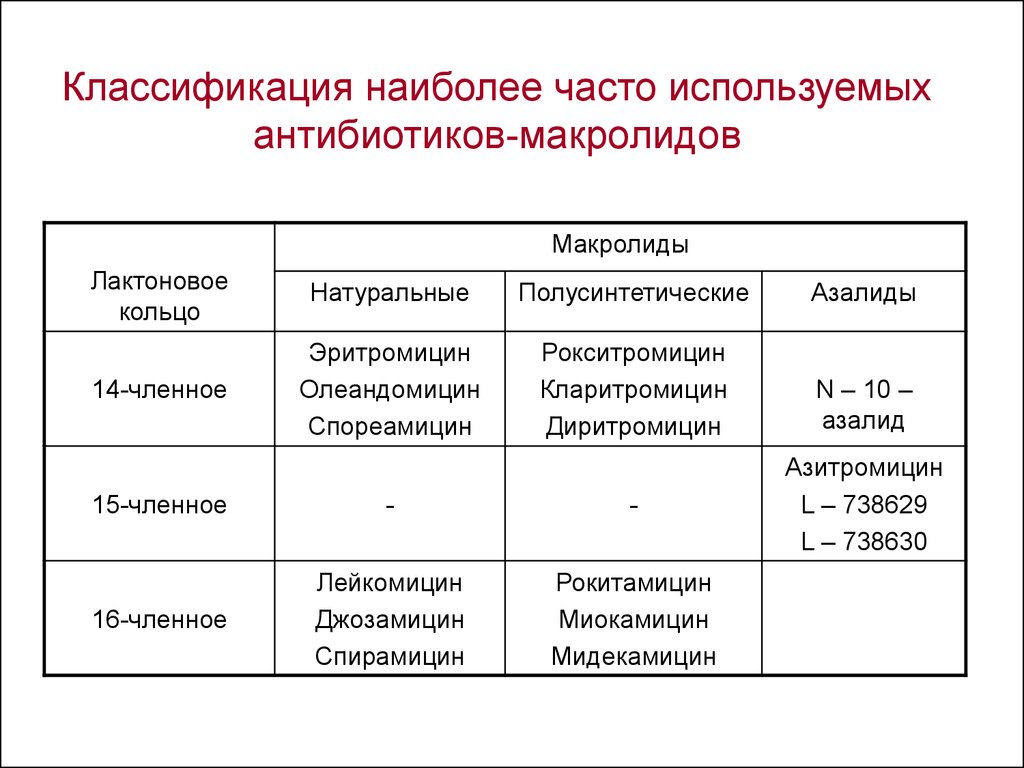
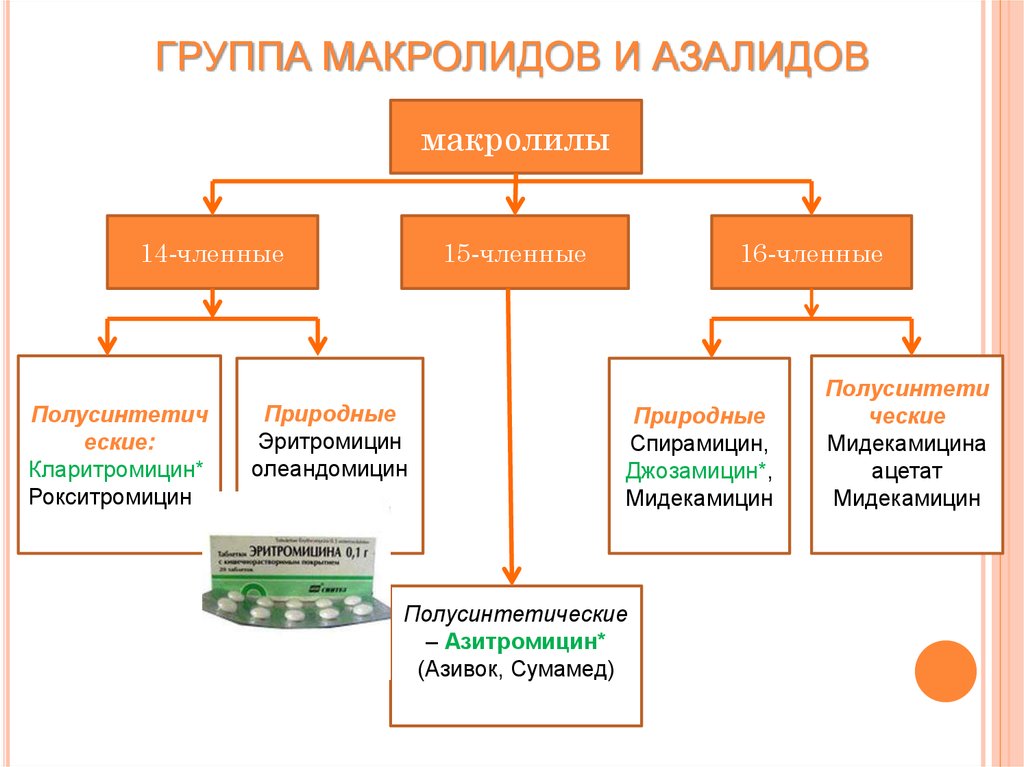
Макролидные антибиотики получили название из-за наличия в молекуле макроциклического лактонного кольца из 14, 15, 16 атомов углерода, связанного с одним или несколькими углеводными остатками (J. Retsema, 2001) (рис. 2).
 influenzae, B. pertussis) и кокки (M. catarrhalis) и, что особенно важно, факультативно/облигатные внутриклеточные микроорганизмы, в отношении которых макролиды считаются препаратами выбора (Ю.Б. Белоусов, В.В. Омельяновский, 1996; А.А. Зайцев, К.В.Минкевич, 1997; J.O. Klein, 1997). Макролиды не активны против грамотрицательных бацилл (например, энтеробактерий) из-за гидрофобности и высокого молекулярного веса. Они плохо проникают сквозь клеточную стенку грамотрицательных бактериальных клеток. Так, если величины минимально подавляющей концентрации (МПК) макролидов в отношении пневмококков составляют десятые и сотые мкг/мл, то в отношении гемофильной палочки МПК значительно выше – около 2 мкг/мл (С.В. Сидоренко, 2002).
influenzae, B. pertussis) и кокки (M. catarrhalis) и, что особенно важно, факультативно/облигатные внутриклеточные микроорганизмы, в отношении которых макролиды считаются препаратами выбора (Ю.Б. Белоусов, В.В. Омельяновский, 1996; А.А. Зайцев, К.В.Минкевич, 1997; J.O. Klein, 1997). Макролиды не активны против грамотрицательных бацилл (например, энтеробактерий) из-за гидрофобности и высокого молекулярного веса. Они плохо проникают сквозь клеточную стенку грамотрицательных бактериальных клеток. Так, если величины минимально подавляющей концентрации (МПК) макролидов в отношении пневмококков составляют десятые и сотые мкг/мл, то в отношении гемофильной палочки МПК значительно выше – около 2 мкг/мл (С.В. Сидоренко, 2002).

Конец 80-х годов ознаменовался созданием полусинтетических макролидных антибиотиков с улучшенными фармакокинетическими свойствами, которые в отличие от эритромицина, более стабильны в кислой среде желудка и характеризуются более высокой биодоступностью, длительным периодом полувыведения, а также лучшей переносимостью (С.В. Яковлев, 2001).
Макролидные антибиотики относятся к ингибиторам белкового синтеза в клетках микроорганизма. Mеханизм действия их связан со взаимодействием с 50S или 30S субъединиц рибосомы бактериальных клеток (Б.
 Албертс, 1994).
Албертс, 1994).
Способность создавать высокие концентрации в тканях при воспалительных процессах, превышающие таковые в плазме, делает возможным двукратное и даже однократное назначение их в сутки и позволяет уменьшить длительность курса лечения, частоту и выраженность побочных явлений. Всасывание макролидов колеблется от 20 до 90%. По величине этого параметра их можно расположить следующим образом:
Макролиды являются слабыми основаниями, их активность возрастает в щелочной среде (рН 5,5-8,5), так как при этом они меньше ионизируются и лучше проникают внутрь микробной клетки. Кроме того, молекулы макролидов имеют значительную молекулярную массу, что позволяет им легко проникать сквозь крупноячеистую клеточную стенку грамположительных бактерий. Устойчивость к макролидам грамотрицательных бактерий связана вероятно с непроницаемостью наружной клеточной мембраны для этих соединений.
По особенностям фармакодинамики макролиды относятся к времязависимым антибиотикам. Их эффективность зависит от промежутка времени, в течение которого концентрация препарата в крови превышает показатели МПК антибиотика в отношении выделяемых возбудителей. Если этот промежуток составляет не менее 40% интервала времени между введениями очередных доз антибиотика, можно прогнозировать клиническую эффективность данного препарата.

Как видно из таблицы, наиболее высокие сывороточные концентрации отмечаются при приеме рокситромицина, что, по-видимому, обусловлено высокой степенью связывания с белками крови (92-96%). Самые низкие сывороточные концентрации характерны для азитромицина, что обусловлено его высокой биодоступностью, низким уровнем связывания с белками плазмы крови (7-12%), липофильностью и, вследствие этого, быстрым проникновением в ткани. Важной фармакокинетической особенностью макролидов является наличие двух пиков концентрации в крови. Феномен второго пика обусловлен всасыванием в кишечнике части препарата, первично депонированного в желчном пузыре. У эритромицина величина второго сывороточного пика может превышать величину первого. При использовании азитромицина параллельно второму пику в сыворотке крови наблюдается повторный подъем концентрации препарата в других биологических жидкостях, например в лимфе.
 Наиболее чувствительны к соляной кислоте эритромицин и олеандомицин, наименее – кларитромицин. Основное всасывание макролидов происходит в тонком кишечнике. Среди макролидов эритромицин имеет самую низкую и не стабильную биодоступность (от 30 до 66%), причем она значительно снижается в присутствии пищи. Биодоступность спирамицина и рокситромицина (30-40%), кларитромицина (50-55%), азитромицина (37%) более стабильна (Л.С. Страчунский и соавт., 2000). Применение препаратов в виде капсул или гранул с энтерорастворимым покрытием, а также прием антибиотиков за 1 час до или через 2-3 часа после еды существенно повышают их биодоступность.
Наиболее чувствительны к соляной кислоте эритромицин и олеандомицин, наименее – кларитромицин. Основное всасывание макролидов происходит в тонком кишечнике. Среди макролидов эритромицин имеет самую низкую и не стабильную биодоступность (от 30 до 66%), причем она значительно снижается в присутствии пищи. Биодоступность спирамицина и рокситромицина (30-40%), кларитромицина (50-55%), азитромицина (37%) более стабильна (Л.С. Страчунский и соавт., 2000). Применение препаратов в виде капсул или гранул с энтерорастворимым покрытием, а также прием антибиотиков за 1 час до или через 2-3 часа после еды существенно повышают их биодоступность.


Внутриклеточное проникновение и накопление препаратов в 90-123 раза больше в альвеолярных макрофагах, в 4-12 раз больше в клеточных культурах разных тканей человеческих органов и в 10-13 раз больше в нейтрофильных лейкоцитах (A. Ldfener, H. Lampen, M. Leitald et al., 1993; Л.С. Страчунский, С.Н. Козлов, 1998).
Учитывая противовоспалительную активность макролидов и способность ингибировать эластазу нейтрофилов человека, их целесообразно применять в лечении больных муковисцидозом, при обострении хронического бронхита (C. Agen et al., 1993; A. Bryskier et al., 1995). Эти препараты также обладают стимулирующими свойствами, они повышают фагоцитарную активность (M.N. Labro et al., 1986; W. Horn et al., 1989).
Наличие постантибиотического эффекта проявляется прекращением роста бактерий после ограниченного периода воздействия антибиотика, что имеет важное клиническое значение. Наиболее продолжительный постантибиотический эффект отмечен у азитромицина (H. Lode, 1991; I.
 Odenholt-Torngvist et al., 1995; Л.С. Страчунский, С.Н. Козлов, 1998).
Odenholt-Torngvist et al., 1995; Л.С. Страчунский, С.Н. Козлов, 1998).
Макролиды новых генераций, имеющие более усовершенствованные фармацевтические и фармакологические характеристики, являются более эффективными к резистентным микробным агентам. Они не обладают перекрестными аллергическими реакциями с антибиотиками, содержащими b-лактамное кольцо. Это позволяет их применение у больных в случаях повышенной чувствительности к пенициллинам, цефалоспоринам и аминогликозидам (М.К. Кевра, Г.Н. Бушкевич, 1996; В.Г. Майданник, 2002; Л.А. Амисанян и соавт., 2000).
Появление на фармацевтическом рынке макролидов, обладающих по сравнению с эритромицином лучшей переносимостью, позволяет широко использовать их даже у детей грудного возраста (И.И. Евсюкова и соавт., 1998). Фармакокинетические особенности «новых» макролидов повышают комплайентность лечения (Л.С. Страчунский, С.Н. Козлов, 1998).
Макролиды метаболизируются в печени при участии цитохрома Р450 с образованием активных (например, 14-гидрокси-кларитромицин) и неактивных метаболитов.
 Метаболиты выделяются преимущественно через желудочно-кишечный тракт и почки. Метаболизм макролидных антибиотиков может существенно нарушаться при ферментопатиях, гепатитах и других заболеваниях печени (Л.С. Страчунский и соавт., 2000).
Метаболиты выделяются преимущественно через желудочно-кишечный тракт и почки. Метаболизм макролидных антибиотиков может существенно нарушаться при ферментопатиях, гепатитах и других заболеваниях печени (Л.С. Страчунский и соавт., 2000).
Для макролидных антибиотиков характерно синергическое действие с иммунной системой. Они концентрируются в фагоцитах и повышают чувствительность бактерий к фагоцитозу и внутриклеточное уничтожение бактерий в фагоцитах.
К достоинствам макролидов относится низкий аллергогенный потенциал. Частота гиперчувствительности при их применении не превышает 0,5%, что значительно ниже, чем при лечении пенициллинами (до 10%) и цефалоспоринами (до 4%). Аллергические реакции проявляются у лиц, имеющих отягощенный аллергологический анамнез (Л.С. Страчунский, С.Н. Козлов, 1994).
Главной проблемой при применении макролидов является стимуляция моторики пищеварительного тракта в результате прямого возбуждения мотилиновых рецепторов (В.Б. Кузин, А.
 А. Монахов, Т.М. Канышкина и др., 1997; G.H. McCracken, 1997). То есть это никакой ни дисбактериоз, а просто химическая стимуляция моторики пищеварительного тракта. В этом плане азитромицин занимает среди макролидов промежуточное положение.
А. Монахов, Т.М. Канышкина и др., 1997; G.H. McCracken, 1997). То есть это никакой ни дисбактериоз, а просто химическая стимуляция моторики пищеварительного тракта. В этом плане азитромицин занимает среди макролидов промежуточное положение.
Азалиды
В настоящее время большие перспективы имеет близкий к макролидам класс азалидов. В 1983 году фармацевтическая компания PLIVA впервые разработала азитромицин (Сумамед) – первый представитель новой группы 15-членных макролидных антибиотиков – азалидов. Азитромицин (Сумамед) отличается от классических макролидов (эритромицина) наличием азота с метильной группой в 9-м положении лактонного кольца. Такая перестройка молекулы эритромицина придала полученному соединению преимущества: быстрое и интенсивное проникновение в клетки и ткани, создание высоких уровней распределения в них, значительно превышающих концентрации в крови (уникальная клеточная кинетика), и другие свойства, существенно отличающие его от антибиотиков группы макролидов.
Азитромицин (Сумамед) сходен по спектру антибактериального действия с эритромицином, однако он более активен против следующих грамположительных и грамотрицательных штаммов микроорганизмов: Н. influenzae (включая ампициллинрезистентные штаммы), Н. parainfluenzae, M. catarrhalis, С. trachomatis (D.H. Peters, S.P. Сlissold, 1991; J.D. Williams, 1991), S. pyogenes, эритромицин- и пенициллинрезистентных штаммов S. pneumoniae и метициллинрезистентных штаммов S. aureus (H.D. Langtry, J.A. Balfour, 1998). По отношению к Н. influenzae он проявляет и бактериостатические и бактерицидные свойства (M. Merkel, J. Kretowicz, 1985; H.D. Langtry, J.A. Barfour, 1998). Он является препаратом первоочередного выбора при респираторных инфекциях, вызываемых «атипичными» возбудителями (Clamydia spp., Mycoplasma spp.).
Азитромицин по степени активности превышает некоторые макролиды в отношении таких клинически значимых микроорганизмов, как Н. influenzae, M. catarrhalis, M. рneumoniae, С. trachomatis (табл. 2).
2).
Химическая структура азитромицина обусловливает повышенную кислотоустойчивость по сравнению с эритромицином в 300 раз, что приводит к быстрому всасыванию из желудочно-кишечного тракта и большей биодоступности (37%).
Азитромицин быстро проникает из плазмы в клетки тканей, причем значительная часть концентрируется в полинуклеарах, моноцитах, лимфоцитах, альвеолярных макрофагах, фибробластах (рис. 3).
Защитные механизмы организма хозяина, работая в тандеме с азитромицином, обеспечивают быструю эрадикацию возбудителя и клинический эффект – даже при значениях МПК 32 мг/л для фагоцитированного возбудителя.
Пик концентрации антибиотика в гранулоцитах составляет >80 мг/л. В еще более высоких концентрациях препарат обнаруживается в моноцитах и фибробластах (100 мг/л). Затем переносится в зону бактериального воспаления, где возбудитель подвергается воздействию бактерицидных концентраций препарата. В связи с особенностями химического строения азитромицин концентрируется в «кислых» органеллах фагоцитов, в фосфолипидном слое лизосом. Попадая в кислую среду, молекула азитромицина изменяет электрический заряд и в этом виде она более не может проходить через мембрану. Азитромицин, попав внутрь фаголизосомы, как бы запирается там и очень медленно выходит, а входит намного быстрее. Это приводит к тому, что практически вся доза препарата, потребляемая человеком, достаточно быстро (через кишечник, сосудистое русло, межклеточное пространство, цитоплазматическую мембрану, цитоплазму) уходит в фаголизомосы, то есть именно в то место, где находятся внутриклеточные патогены. Это обеспечивает азитромицину преимущество в лечении инфекций, вызванных микроорганизмами, размножающимися внутри клеток хозяина.
Попадая в кислую среду, молекула азитромицина изменяет электрический заряд и в этом виде она более не может проходить через мембрану. Азитромицин, попав внутрь фаголизосомы, как бы запирается там и очень медленно выходит, а входит намного быстрее. Это приводит к тому, что практически вся доза препарата, потребляемая человеком, достаточно быстро (через кишечник, сосудистое русло, межклеточное пространство, цитоплазматическую мембрану, цитоплазму) уходит в фаголизомосы, то есть именно в то место, где находятся внутриклеточные патогены. Это обеспечивает азитромицину преимущество в лечении инфекций, вызванных микроорганизмами, размножающимися внутри клеток хозяина.
Дополнительным важным свойством азитромицина, способствующим быстрой реализации терапевтического эффекта, даже при коротких схемах применения, является концентрация антибиотика в фибробластах, превращающихся в своеобразный резервуар, из которого препарат освобождается в очаге инфекции.
С клинической точки зрения важна величина соотношения показателей площади под фармакокинетической кривой препарата к его МПК (AUC0-24/МПК) в очагах локализации бактерий, в которых он ведет себя как «концентрация – независимый киллер». Благодаря образованию фаголизосом в клетках крови, антибиотик получает возможность непосредственно воздействовать на микроорганизмы, фагоцитированные, но не уничтоженные фагоцитами. Значение соотношения показателей AUC и МПК в отношении возбудителя, обозначаемое как терапевтический индекс, имеет прогностическое значение, по величине которого можно сделать заключение о возможном исходе инфекции, вызываемой конкретными возбудителями.
Благодаря образованию фаголизосом в клетках крови, антибиотик получает возможность непосредственно воздействовать на микроорганизмы, фагоцитированные, но не уничтоженные фагоцитами. Значение соотношения показателей AUC и МПК в отношении возбудителя, обозначаемое как терапевтический индекс, имеет прогностическое значение, по величине которого можно сделать заключение о возможном исходе инфекции, вызываемой конкретными возбудителями.
Рассчитанный фармакокинетический профиль азитромицина, а также экспериментальные данные, полученные при использовании бронхоскопической техники с получением кусочков легочной ткани, отделяемого бронхов, лаважной жидкости, содержащей альвеолярные макрофаги, показывают, что пик концентрации азитромицина после приема единственной дозы в 500 мг составляет для мокроты 1,56 мг/л, слизистой бронхов – 3,89 мг/кг, интерстициальной жидкости легких – 2,18 мг/л, альвеолярных макрофагов – 23 мг/кг (табл. 3).
В слизистой оболочке бронхов через 12 ч после однократного приема 500 мг концентрация препарата превышала сывороточную в 15 раз, через 48 ч – в 195, а через 96 – в 240 раз (J. J. Schentag, C.Н. Ballow, 1998).
J. Schentag, C.Н. Ballow, 1998).
В клинике изучена тканевая кинетика азитромицина с выявлением его в миндалинах, аденоидах. Концентрация азитромицина в инфицированных миндалинах и аденоидах спустя 24-96 часов после завершения лечения (10 мг/кг/сут в течение 3 дней) превышала таковую в сыворотке крови в 227-956 раз (И.П. Фомина и соавт., 1996, R.C. Mollering, 1991) (рис. 4).
Соотношение внутри и внеклеточной концентрации для моноцитов составляло 200, для полинуклеаров – 298, для фибробластов – 437 и для альвеолярных макрофагов – от 668 (A. Wildfeuer et al., 1989). Для сравнения в нейтрофилах аналогичный показатель у кларитромицина приблизительно равен 12, у эритромицина колеблется от 2 до 14.
Самый длительный среди макролидов период полувыведения позволяет назначать его внутрь по 10 мг/кг/сут в течение 3 дней. После завершения приема уровни азитромицина в инфицированных тканях превышают МПК для чувствительных возбудителей еще в течение 4-7 дней (Н.С. Neu 1992; G. Foulds et аl., 1990).
Foulds et аl., 1990).
Азитромицин может использоваться в педиатрической практике с первых дней жизни ребенка (И.И. Евсюкова и соавт., 1998). В педиатрии основные показания к применению азитромицина: инфекции ЛОР- органов, нижних дыхательных путей (бактериальный острый бронхит, обострение хронического бронхита, внебольничная пневмония, в том числе вызываемая атипичными возбудителями, внутриутробная хламидийная инфекция (И.И. Евсюкова и соавт., 1998). Азитромицин может применяться как препарат выбора для лечения коклюша у детей в течение 7 дней. При этом по бактериологической эффективности (стойкая эрадикация Bordetella pertussis из носоглотки) азитромицин превосходит эритромицин, который назначался по 40-50 мг/кг/сут в течение 2 недель (G.W. Amsden, 2001). Высокая клиническая и микробиологическая эффективность азитромицина при инфекциях нижних дыхательных путей отмечена многими исследователями (Р.И. Карпов, 1997; М.М. Илькович, 1998).
Из тканей Сумамед элиминируется медленно: период полувыведения (Т1/2) после приема внутрь составляет 11-14 часов, в течение последующих 48 часов значение Т1/2 существенно возрастает, 50% препарата выделяется желчью в неизмененном виде и всего 6% выводится почками.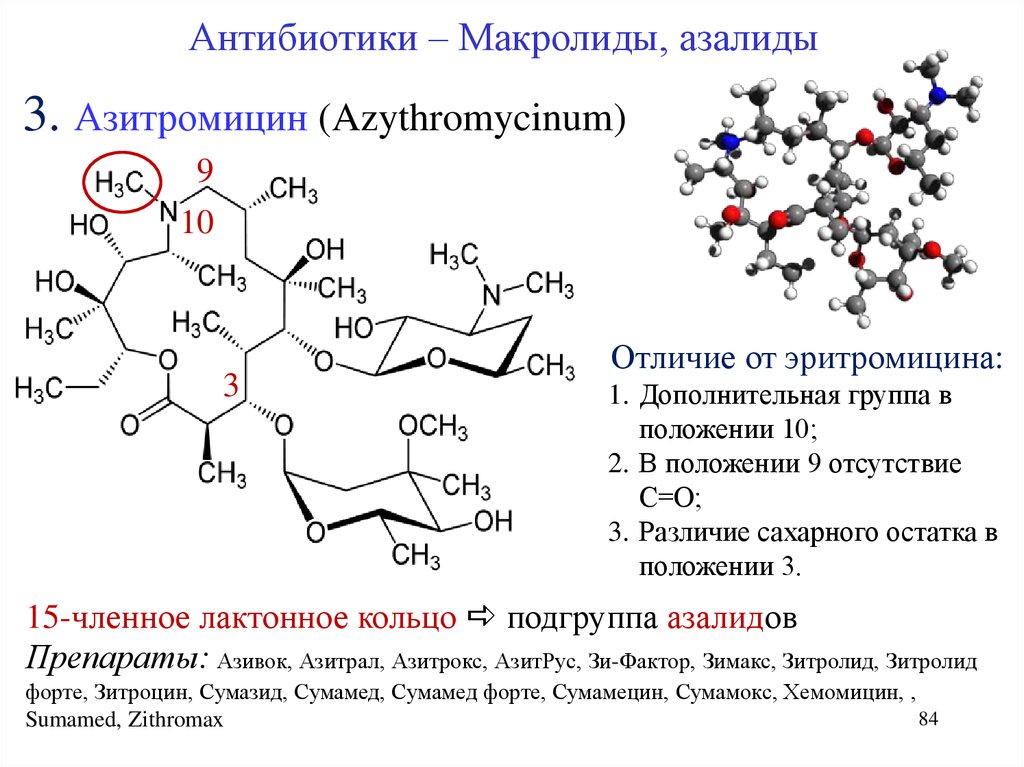 Печеночной трансформации азитромицин подвергается в незначительном количестве. В связи с этим препарат не влияет на метаболизм других лекарственных средств, осуществляющийся системой цитохрома Р450 (в частности, теофиллина), что исключает необходимость коррекции дозы одновременно вводимого препарата.
Печеночной трансформации азитромицин подвергается в незначительном количестве. В связи с этим препарат не влияет на метаболизм других лекарственных средств, осуществляющийся системой цитохрома Р450 (в частности, теофиллина), что исключает необходимость коррекции дозы одновременно вводимого препарата.
Фармакоэкономическая эффективность азитромицина представлена в таблице 4.
Использование азитромицина при различных нозологических формах заболеваний респираторного тракта у детей в амбулаторных условиях выявило еще один положительный аспект – низкую частоту побочных эффектов. Нежелательные реакции со стороны желудочно-кишечных тракта (тошнота, диарея, боли в подложечной области), повышение активности ферментов печени не превышают 2-3%, что обусловлено более короткими схемами лечения и однократным приемом препарата в сутки – в отличие от других макролидов (2-3 раза в сутки).
Таким образом, азитромицин входит в число эффективных и безопасных антибиотиков и по ряду параметров остается непревзойденным и не имеет аналогов.
- Номер:
- № 106 ноябрь — Общетерапевтический номер
17.04.2023 Пульмонологія та оториноларингологіяШвидке й ефективне полегшення болю в пацієнтів із риногенним болем: очевидні та приховані переваги
Своєчасне та ефективне лікування гострого болю є одним із найважливіших завдань сучасної медицини. Сьогодні чимало пацієнтів, які звертаються по медичну допомогу, страждають через неконтрольований біль. Добре відомо, що некупіруваний (або несвоєчасно купіруваний) гострий біль не лише значно погіршує якість життя пацієнтів, а й зумовлює зростання ризику низки ускладнень. Одним із найпоширеніших видів інтенсивного болю, з яким доводиться мати справу лікарю загальної практики, є головний біль за гострого риносинуситу (РС). Саме тому клініцисти повинні добре розуміти основні підходи до лікування цього типу болю, а також прогностичне значення швидкого й ефективного знеболення….
Одним із найпоширеніших видів інтенсивного болю, з яким доводиться мати справу лікарю загальної практики, є головний біль за гострого риносинуситу (РС). Саме тому клініцисти повинні добре розуміти основні підходи до лікування цього типу болю, а також прогностичне значення швидкого й ефективного знеболення….
15.04.2023 Терапія та сімейна медицинаAcino виступила партнером проєкту «Мобільні госпіталі для перемоги»
Швейцарська фармацевтична компанія Acino стала партнером проєкту із забезпечення прифронтової зони та зруйнованих лікарень в областях надсучасними мобільними госпіталями для надання невідкладної допомоги пораненим….
13.04.2023 Терапія та сімейна медицинаАнтисептичні властивості повідон-йоду крізь призму сучасної реальності
Розвиток і становлення поглядів щодо застосування антисептичних заходів потребували декількох століть, протягом яких спочатку емпірично, а потім доказово були визначені ефективні антисептики: повідон-йод, хлоргексидин, спирт, полігексанід, октенідин, перекис водню, нітрат та сульфадіазин срібла, гіпохлорит натрію. Із зазначених антисептичних засобів лише три препарати потрапили
до переліку життєво необхідних та надзвичайно важливих ліків, який кожні 2 роки оновлює
Всесвітня організація охорони здоров’я: 22-й перегляд цього переліку містить тільки повідон-йод, хлоргексидин та етанол (WHO, 2021)….
Із зазначених антисептичних засобів лише три препарати потрапили
до переліку життєво необхідних та надзвичайно важливих ліків, який кожні 2 роки оновлює
Всесвітня організація охорони здоров’я: 22-й перегляд цього переліку містить тільки повідон-йод, хлоргексидин та етанол (WHO, 2021)….
13.04.2023 Терапія та сімейна медицинаСечова кислота: фізіологічні функції та патогенетичний потенціал
9-10 березня за сприяння Української асоціації нефрологів і фахівців з трансплантації нирки (м. Київ), ДУ «Інститут нефрології НАМН України» (м. Київ), БО «Національний нирковий фонд України» (м. Київ) в онлайн-форматі відбулася науково-практична конференція «Готуємося до несподіванок. Підтримуємо найбільш вразливих». Захід присвятили Всесвітньому дню нирки, що має на меті привернути увагу світової спільноти до найактуальніших проблем в урології та нефрології, висвітлити нові можливості лікування і профілактики в онконефрології, трансплантології, обговорити між експертами й глядачами сучасні аспекти вакцинації у великої когорти урологічних хворих. Досить цікавою виявилася доповідь доцента кафедри педіатрії Одеського національного медичного університету, кандидата медичних наук Максима Володимировича Федіна щодо основних функцій та патогенетичної ролі сечової кислоти (СК).
…
Досить цікавою виявилася доповідь доцента кафедри педіатрії Одеського національного медичного університету, кандидата медичних наук Максима Володимировича Федіна щодо основних функцій та патогенетичної ролі сечової кислоти (СК).
…
Какие бывают антибиотики? – статья на сайте Аптечество, Нижний Новгород
Антибиотики– это группа препаратов, которые используются в лечении бактериальных инфекций. Бактерии – это живые микроорганизмы, которые проникнув в организм человека, начинают активную жизнедеятельность и размножение. Эффект антибактериальной терапии заключается в непосредственном уничтожении возбудителя, а также замедлении размножения болезнетворных микроорганизмов. В связи с эти антибактериальные препараты делятся на 2 большие группы: бактерицидные – уничтожающие саму бактерию, а также бактериостатические, подавляющие их рост. Кроме этого, антибиотики обладают узким и широким спектром действия. Препараты узкого спектра действия уничтожают инфекцию избирательно, в то время как лекарства широкого спектра уничтожают большую часть микроорганизмов, в том числе и тех, которые приносят пользу человеку. Какие антибиотики принимать для лечения различных заболеваний должен решать врач после постановки диагноза. Принимать такие препараты на свое усмотрение чревато осложнениями.
Какие антибиотики принимать для лечения различных заболеваний должен решать врач после постановки диагноза. Принимать такие препараты на свое усмотрение чревато осложнениями.
Фторхинолоны
Подавляют активность ферментов, принимающих участие в формировании бактериальной ДНК, в результате чего инфекция погибает. Препараты выпускаются в виде таблеток, инъекций, офтальмологических капель. Показания к назначению:
Препараты этой группы:
-
Ципрофлоксацин;
-
Офлоксацин;
-
Пефлоксацин;
-
Норфлоксацин.
Аминогликозиды
Средства обширного спектра действия, уничтожающие большинство видов грамотрицательных аэробных и факультативных бактерий. Действующее вещество нарушает процесс синтеза белка, в результате чего патоген разрушается и погибает.
Аминогликозиды плохо усваиваются при пероральном приеме, поэтому, как правило, они назначаются в виде внутривенных или внутримышечных инъекций. Представители этой группы:
-
Амикацин;
-
Гентамицин;
-
Канамицин;
-
Неомицин;
-
Плазомицин;
-
Стрептомицин.
Как правило, эти препараты применяются в комбинации с другими антибиотиками для лечения таких инфекционных заболеваний:
Тетрациклины
Антибиотики бактериостатического действия, которые задерживают рост патогенных микрорганизмов, но не уничтожают их полностью. В результате размножение инфекции прекращается, и она постепенно погибает.
Тетрациклины обладают широким спектром действия, обладая выраженной активностью в отношении аэробных грамположительных и грамотрицательных бактерий. Тетрациклины не назначаются детям младше 8 лет, так как при длительном приеме вызывают ряд серьезных осложнений.
Тетрациклины не назначаются детям младше 8 лет, так как при длительном приеме вызывают ряд серьезных осложнений.
Препараты этой группы могут назначаться и в таблетированных формах и в виде инъекций. Для лечения офтальмологических инфекций выпускаются мази, действующим веществом которых выступает тетрациклин.
Лекарства:
-
Доксициклин;
-
Миноциклин;
-
Тетрациклин;
-
Окситетрациклин.
Заболевания, при которых назначаются тетрациклины:
Макролиды
Подавляют жизнедеятельность и препятствуют размножению анаэробных и аэробных грамположительных бактерий. Препараты этой группы используются при лечении бронхолегочных инфекций, тонзиллита, отита, скарлатины, кишечных инфекций. Лекарства, которые входят в эту группу:
-
Эритромицин;
-
Азитромицин;
-
Кларитромицин;
-
Спирамицин.

Пенициллы
Группа антибиотиков, продуцируемых плесневыми грибами Penicillium. Пенициллы активны в отношении большинства грамположительных, а также некоторых грамотрицательных бактерий. Препараты этой группы:
-
Амоксициллин;
-
Аугуметин;
-
Амоксиклав;
-
Флемоксин Слютаб.
Цефалоспорины
Это бактерицидные бета- бета-лактамные антибиотики, нарушающие синтез белков клетки. Существует 5 поколений цефалоспоринов. Действующее вещество хорошо проникает в большинство жидкостей организма, обладая выраженным бактерицидным эффектом. Цефалоспорины используются при неосложненных инфекциях кожи и мягких тканей, вызванных стафилококковой и стрептококковой бактерией. Препараты этой группы:
-
Цефтриаксон;
-
Цефодокс;
-
Цефикс;
-
Цепефим.

Бактерии – организмы, которые живут недолго, но, чтобы восстановить свою популяцию, они быстро размножаются, и, соответственно, быстро мутируют, приспосабливаясь к новым жизненным условиям. Микроорганизмы, выжившие после приема антибиотиков, приобретают устойчивость к ним. Их потомки тоже становятся неуязвимыми к определенному препарату.
Антибиотикорезистентность – распространенная проблема современного человека, которая становится причиной серьезных осложнений. Человек, который перепробовал множество антибиотиков, то есть, занимался самолечением, входит в группу риска пациентов, обладающих антибиотикоустойчивостью. Очень часто они погибают раньше, чем специалист сможет подобрать препарат, работающий против конкретного возбудителя. Поэтому важно соблюдать рекомендации доктора и принимать антибактериальные средства строго по индивидуальной схеме.
Макролидные антибиотики — LiverTox — Книжная полка NCBI
Последнее обновление: 10 августа 2017 г.
ОБЗОР
Макролиды представляют собой бактериостатические антибиотики с широким спектром действия против многих грамположительных бактерий. Доступные в настоящее время макролиды хорошо переносятся, доступны для приема внутрь и широко используются для лечения инфекций легкой и средней степени тяжести. Несколько макролидных антибиотиков были связаны с повреждением печени.
В настоящее время для использования в США доступны пять макролидных антибиотиков: эритромицин, кларитромицин, азитромицин, фидаксомицин и телитромицин, причем последний является родственным кетолидом. Эритромицин впервые был выделен в 1952 из Streptomyces erythreus; остальные макролидные антибиотики являются полусинтетическими производными. Пять макролидных антибиотиков обладают сходным спектром активности, проявляя бактериостатическое действие в отношении многих штаммов стрептококков, стафилококков, клостридий, коринебактерий, листерий, гемофильных палочек, моксицелл и Neisseria meningitidis. Кларитромицин и азитромицин более активны, чем эритромицин, в отношении некоторых грамотрицательных бактерий, а также Mycoplasma pneumonia, Helicobacter pylori, Toxoplasma gondii, криптоспоридий и некоторых атипичных микобактерий.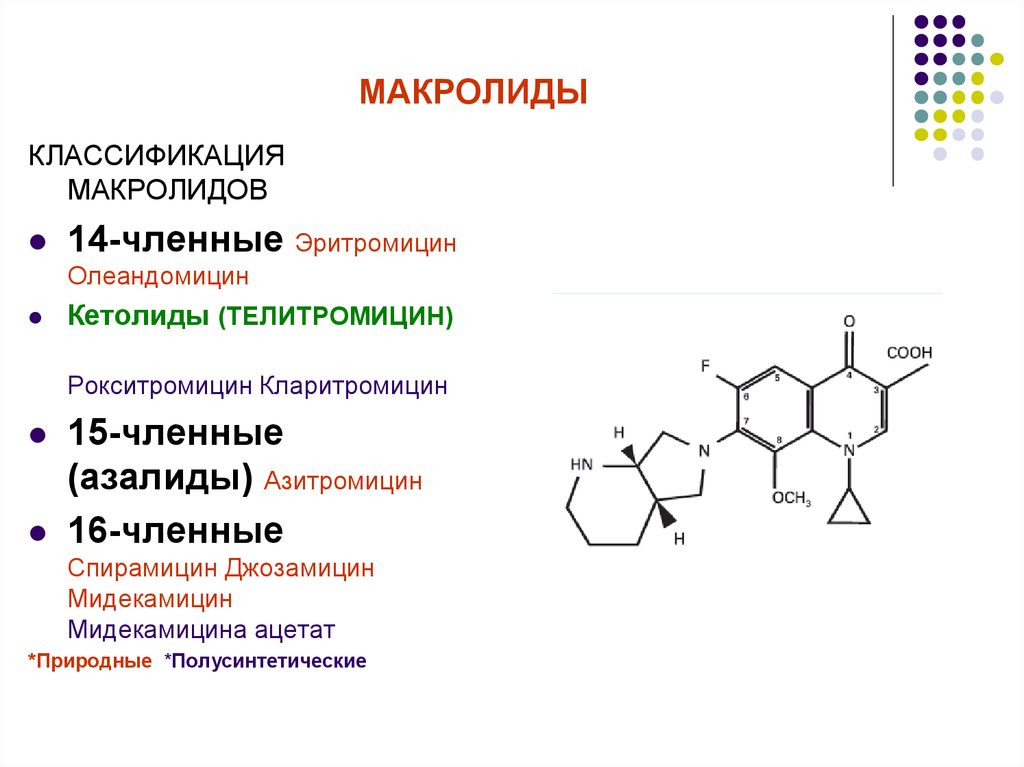 Фидаксомицин не всасывается перорально и используется в виде десятидневных пероральных курсов для лечения диареи, связанной с Clostridium difficile. Антибиотики-макролиды действуют путем ингибирования синтеза белка бактерий путем связывания с 50S рибосомальным элементом. Резистентность возникает по нескольким механизмам.
Фидаксомицин не всасывается перорально и используется в виде десятидневных пероральных курсов для лечения диареи, связанной с Clostridium difficile. Антибиотики-макролиды действуют путем ингибирования синтеза белка бактерий путем связывания с 50S рибосомальным элементом. Резистентность возникает по нескольким механизмам.
A. Низкая частота бессимптомного повышения уровня аминотрансфераз в сыворотке крови, которое может наблюдаться при приеме любого из четырех перорально всасываемых макролидных антибиотиков, частота составляет от 1% до 5% пролеченных пациентов (в зависимости от продолжительности лечения и интенсивности наблюдения) . Эти повышения, как правило, бывают от легкой до умеренной степени, бессимптомны, самоограничены и имеют преходящее течение, редко требующие изменения дозы или отмены.
Более важным является клинически очевидное поражение печени макролидными антибиотиками, которое было описано для всех четырех перорально всасываемых препаратов. Поражение печени обычно представляет собой самокупирующийся холестатический гепатит, возникающий в течение 1–3 недель после начала терапии. Симптомы включают утомляемость, потемнение мочи и желтуху, часто с болью в правом подреберье и лихорадкой. Повреждение обычно самокупирующееся и доброкачественное, но в некоторых случаях наблюдается длительный холестаз и сохранение отклонений печеночных тестов более 6 месяцев. Гистология печени в этих случаях обычно показывает синдром исчезновения желчных протоков или, по крайней мере, некоторую степень потери желчных протоков. Второй формой клинически выраженной гепатотоксичности макролидных антибиотиков является острое гепатоцеллюлярное повреждение, которое обычно возникает в течение нескольких дней после начала терапии, часто при повторном воздействии. Это гепатоцеллюлярное повреждение с желтухой может привести к острой печеночной недостаточности и имеет значительную смертность (либо смерть, либо необходимость экстренной трансплантации печени). Этот гепатоцеллюлярный паттерн чаще всего встречается при применении телитромицина, но также описан при применении азитромицина и реже при применении кларитромицина и эритромицина.
Симптомы включают утомляемость, потемнение мочи и желтуху, часто с болью в правом подреберье и лихорадкой. Повреждение обычно самокупирующееся и доброкачественное, но в некоторых случаях наблюдается длительный холестаз и сохранение отклонений печеночных тестов более 6 месяцев. Гистология печени в этих случаях обычно показывает синдром исчезновения желчных протоков или, по крайней мере, некоторую степень потери желчных протоков. Второй формой клинически выраженной гепатотоксичности макролидных антибиотиков является острое гепатоцеллюлярное повреждение, которое обычно возникает в течение нескольких дней после начала терапии, часто при повторном воздействии. Это гепатоцеллюлярное повреждение с желтухой может привести к острой печеночной недостаточности и имеет значительную смертность (либо смерть, либо необходимость экстренной трансплантации печени). Этот гепатоцеллюлярный паттерн чаще всего встречается при применении телитромицина, но также описан при применении азитромицина и реже при применении кларитромицина и эритромицина.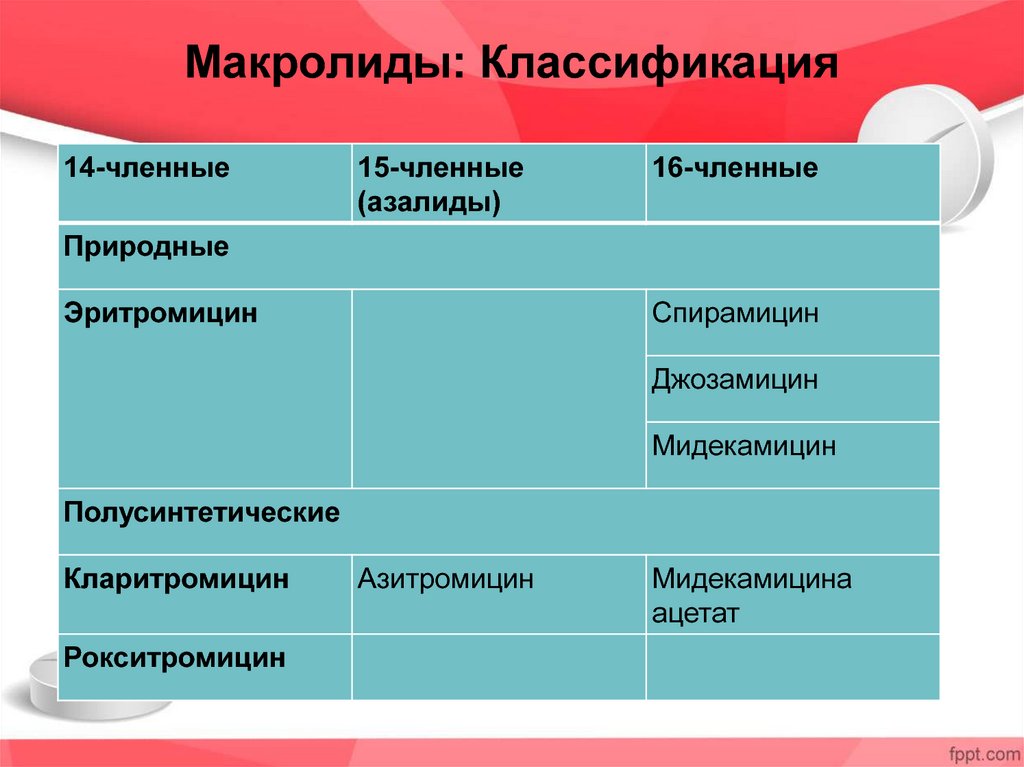
Фидаксомицин имеет небольшую системную абсорбцию и не связан с эпизодами клинически очевидного повреждения печени. Вероятно, существует некоторая степень перекрестной чувствительности к повреждению печени среди различных макролидных антибиотиков, но это не было точно определено.
Класс препаратов: Противоинфекционные агенты
Следующие ссылки относятся к записям отдельных препаратов.
Азитромицин
Кларитромицин
Эритромицин
Фидаксомицин
Телитромицин
АННОТИРОВАННАЯ БИБЛИОГРАФИЯ
Ссылки обновлены: 10 августа 2017 г. Эритромицины. В, Циммерман Х.Дж. Гепатотоксичность: неблагоприятное воздействие лекарств и других химических веществ на печень. 2-е изд. Филадельфия: Липпинкотт, 1999, стр. 594-5.
(Экспертный обзор поражений печени, вызванных эритромицином, опубликованный в 1999 г. Эритромицин наиболее тесно связан с холестатическим гепатитом с началом через 10–20 дней после первоначального воздействия и в течение недели при повторном воздействии, что проявляется болью в животе [75%] , лихорадка [50%], желтуха [50%], эозинофилия [60%] и зуд [25%], обычно с самокупирующимся и доброкачественным течением).
Мозли Р.Х. Макролидные антибиотики. Гепатотоксичность противомикробных и противогрибковых средств. В, Капловиц Н., ДеЛев Л.Д., ред. Медикаментозное заболевание печени. 3-е изд. Амстердам: Эльзевир, 2013, стр. 466-7.
(Экспертный обзор поражений печени, вызванных макролидными антибиотиками, упоминает поражение печени, связанное с эритромицином, азитромицином и кларитромицином, и что телитромицин был связан с несколькими случаями тяжелого острого повреждения печени, некоторые из которых были смертельными).
Макдугал С., Чемберс Х.Ф. Макролиды и кетолиды. В, Брантон Л.Л., Чабнер Б.А., Ноллман Б.К., ред. Гудман и Гилман, фармакологическая основа терапии. 12-е изд. Нью-Йорк: McGraw-Hill, 2011, стр. 1529-34.
(Учебник фармакологии и терапии).
Браун П. Гепатотоксичность эритромицина. J Infect Dis 1969; 119: 300-6. [PubMed: 4888905]
[PubMed: 4888905]
(Тщательный обзор литературы по гепатотоксичности макролидов до 1969; к тому времени было сообщено о 45 опубликованных случаях эстилата эритромицина [ни одного со стеаратом], проявляющихся в течение 1-3 недель желтухой [67%], болью в животе, тошнотой и лихорадкой [~50%], а также эозинофилией [62%], повышением АЛТ [100%: в среднем 338 Ед/л] и Алк Р [51%]; 13 повторных заражений, за которыми неизменно следует быстрый рецидив, часто тяжелый).
Эритромицины. Еще один отчет Австралийского комитета по оценке лекарств. Мед J, август 1973 г.; 2: 192-3. [В паблике: 4741351]
(По состоянию на май 1973 г. было зарегистрировано 113 австралийских случаев желтухи, связанной с эритромицином [все с эстолатом], включая пациентов всех возрастов, в основном в течение 14 дней после начала приема препарата, но некоторые > 21, и травма обычно длилась менее 28 дней, без смертей).
Zafrani ES, Ishak KG, Rudzki C. Холестатическое и гепатоцеллюлярное повреждение, связанное с эфирами эритромицина: отчет о девяти случаях. Dig Dis Sci 1979; 24: 385-96. [PubMed: 456225]
Холестатическое и гепатоцеллюлярное повреждение, связанное с эфирами эритромицина: отчет о девяти случаях. Dig Dis Sci 1979; 24: 385-96. [PubMed: 456225]
(Классический гистологический обзор 9 случаев поражения печени эритромицином из архивов Института патологии вооруженных сил, в основном холестатический или смешанный ферментный паттерн, все самокупирующиеся, АЛТ 128-560 ЕД/л, Алк Р в 2-12 раз выше ВГН , билирубин 2,1-12,0 мг/дл, гистология показала холестаз и гепатоцеллюлярное повреждение).
Пессейр Д., Ларри Д., Фанк-Брентано С., Бенхаму Дж.П. Лекарственные взаимодействия и гепатит, вызванный некоторыми макролидными антибиотиками. J Antimicrob Chemother 1985; 16 Приложение А: 181-94. [PubMed: 3877043]
(Обзор эффектов макролидов на печень, включая 55 случаев гепатита от эритромицинэстолата, 10 от этилсукцината и 3 от пропионата; часто встречалась «смешанная» картина ферментов, лихорадка в 59%, эозинофилия в 45%, «исход всегда благоприятный»).
Bojarska-Dahlig H. Гепатотоксичность макролидных антибиотиков. J Antimicrob Chemother 1990; 25: 475-7. [PubMed: 2338425]
(Обсуждение относительной частоты повреждения печени у крыс на основе молекулярной массы и эквивалентов эритромицина).
Карсон Д.Л., Стром Б.Л., Дафф А., Гупта А., Шоу М., Лундин Ф.Е., Дас Кл. Острое заболевание печени, связанное с эритромицинами, сульфаниламидами и тетрациклинами. Энн Интерн Мед 1993; 119 (7 ч. 1): 576-83. [PubMed: 8363168]
(В записях Medicaid в период с 1980 по 1987 год 107 пациентов были госпитализированы с острым гепатитом неизвестной этиологии, 5 [4,7%] из которых получали эритромицины по сравнению с 0,9% в контрольной группе; ни один случай не получал эстолатную форму ).
Дерби Л.Э., Джик Х., Генри Д.А., Дин А.Д. Эритромицин-ассоциированный холестатический гепатит.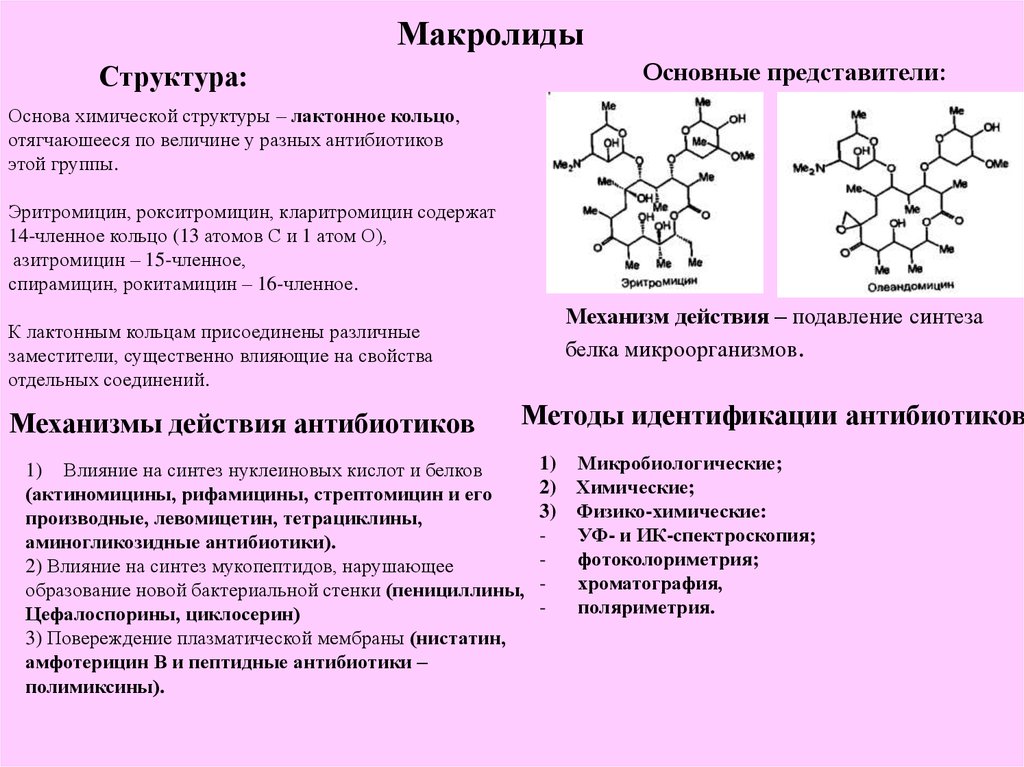 Med J Aust 1993; 158: 600-2. [PubMed: 8479375]
Med J Aust 1993; 158: 600-2. [PubMed: 8479375]
(Ретроспективное когортное исследование 366 064 человек, получавших эритромицин в базе данных Великобритании, выявило 13 случаев холестатического гепатита неизвестной причины в течение 45 дней после назначения: риск = 3,6/100 000, аналогичный для этилсукцината и основных препаратов [эстолат и стеарат используется редко]: риск увеличивается с возрастом, независимо от пола).
Перес Гуттанн С., Гарсия Родригес Л.А. Повышенный риск госпитализации по поводу острого повреждения печени у населения, принимавшего несколько лекарств. Эпидемиология 1993; 4: 496-501. [PubMed: 8268277]
(исследование «случай-контроль» из записей Canadian Health Plan за период с 1982 по 1986 год, риск госпитализации по поводу повреждения печени составлял 1/100 000 для НПВП и 14/100 000 для эстилата эритромицина [ни одного случая, связанного с другими видами эритромицина ] и риск увеличивается, если используются несколько известных причин гепатотоксичности).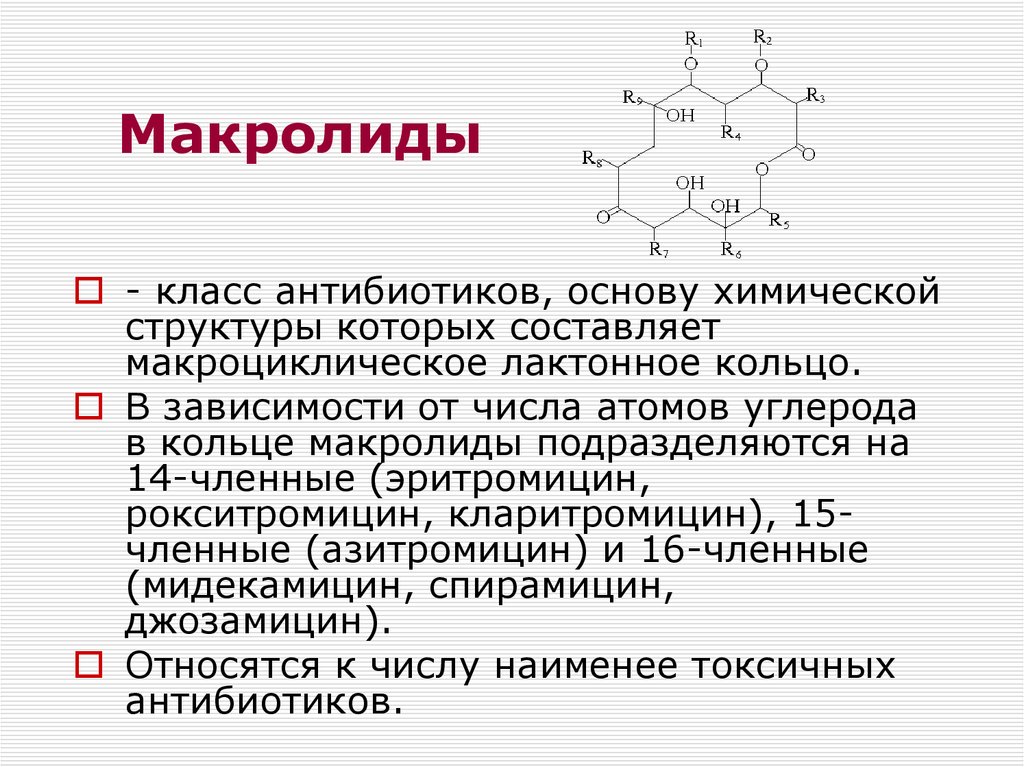
Periti P, Mazzei T, Mini E, Novelli A. Побочные эффекты макролидных антибиотиков. Безопасность наркотиков 1993; 9: 346-64. [PubMed: 8280403]
(обширный обзор литературы о нежелательных явлениях, зарегистрированных при применении макролидных антибиотиков).
Hautekeete ML. Гепатотоксичность антибиотиков. Acta Gastroenterol Belg 1995; 58: 290-6. [PubMed: 7491842]
(Обзор гепатотоксичности, связанной с антибиотиками, включая эритромицины, хорошо известными причинами холестатического гепатита).
фон Розенштайл Н.А., Адам Д. Антибактериальные макролиды. Лекарственные взаимодействия клинического значения. Безопасность наркотиков 1995; 13: 105-22. [PubMed: 7576262]
Пилланс PI. Лекарственно-ассоциированные печеночные реакции в Новой Зеландии: 21-летний опыт. NZ Med J 1996; 109: 315-9. [PubMed: 8816722]
(Эритромицин занимал первое место в качестве причины нежелательных реакций со стороны печени в Новой Зеландии с 1974 по 1995 год, что составляет ~ 12% случаев).
Вилюксела М., Вайнио П.Дж., Туоминен Р.К. Цитотоксичность макролидных антибиотиков в культивируемой линии клеток печени человека. J Antimicrob Chemother 1996; 38: 465-73. [PubMed: 8889721]
(исследование цитотоксичности макролидов in vitro).
Vial T, Biour M, Descotes J, Trepo C. Антибиотик-ассоциированный гепатит: обновленная информация за 1990 г. Ann Pharmacother 1997; 31: 204-20. [PubMed:
23]
(Обширный обзор, включая обсуждение макролидов [эритромицина, кларитромицина и азитромицина], повышение уровня АЛТ у 0,4–1,2% пациентов, получавших лечение, но аналогичные показатели наблюдались в плацебо-контроле; сообщалось о редких случаях холестатического гепатита. со всеми тремя макролидами).
Читтури С., Фаррелл Г.К. Медикаментозный холестаз. Семин Гастроинтест Дис 2001; 12: 113-24. [PubMed: 11352118]
(Обзор холестатических форм лекарственного заболевания печени с отчетом о продолжительной желтухе и зуде, начавшихся через 8 недель после 1-недельного курса эритромициновой основы).
Björnsson E, Jerlstad P, Bergqvist A, Olsson R. Фульминантная лекарственная печеночная недостаточность, ведущая к смерти или трансплантации печени в Швеции. Scand J Gastroenterol 2005; 40: 1095-101. [PubMed: 16165719]
(Все отчеты о смертельных побочных эффектах от лекарств с поражением печени в Швеции в период с 1966 по 2002 год выявили 103 случая, только один из которых был связан с эритромицином).
Björnsson E, Olsson R. В базу данных ВОЗ поступили сообщения о предполагаемых случаях смерти от болезней печени, вызванных приемом лекарств. Dig Liver Dis 2006; 38: 33-8. [PubMed: 16054882]
(Среди 4690 сообщений о лекарственном поражении печени со смертельным исходом, поступивших в ВОЗ, кларитромицин вошел в число 20 основных причастных агентов [51 случай]).
Чанг С.И., Шиано Т.Д. Лекарственная гепатотоксичность. Aliment Pharmacol Ther 2007; 25: 1135-51. [PubMed: 17451560]
Aliment Pharmacol Ther 2007; 25: 1135-51. [PubMed: 17451560]
(обзорная статья, обобщающая большие когортные исследования, в которых эритромицин или макролиды часто были среди наиболее частых причин повреждения печени).
Чаласани Н., Фонтана Р.Дж., Бонковский Х.Л., Уоткинс П.Б., Даверн Т., Серрано Дж., Ян Х., Рошон Дж.; Сеть лекарственных повреждений печени (DILIN). Причины, клинические признаки и результаты проспективного исследования лекарственного поражения печени в США. Гастроэнтерология 2008; 135: 1924-34. [Статья бесплатно PMC: PMC3654244] [PubMed: 18955056]
(Среди 300 случаев лекарственного заболевания печени в США, собранных с 2004 по 2008 год, 5 случаев были связаны с телитромицином и 3 с азитромицином в качестве монотерапии, но ни один эритромицин или кларитромицин).
Феррайоло К., Капуано А., Верхамме К.М., Шуми М., Росси Ф., Стрикер Б.Х., Стуркенбум М.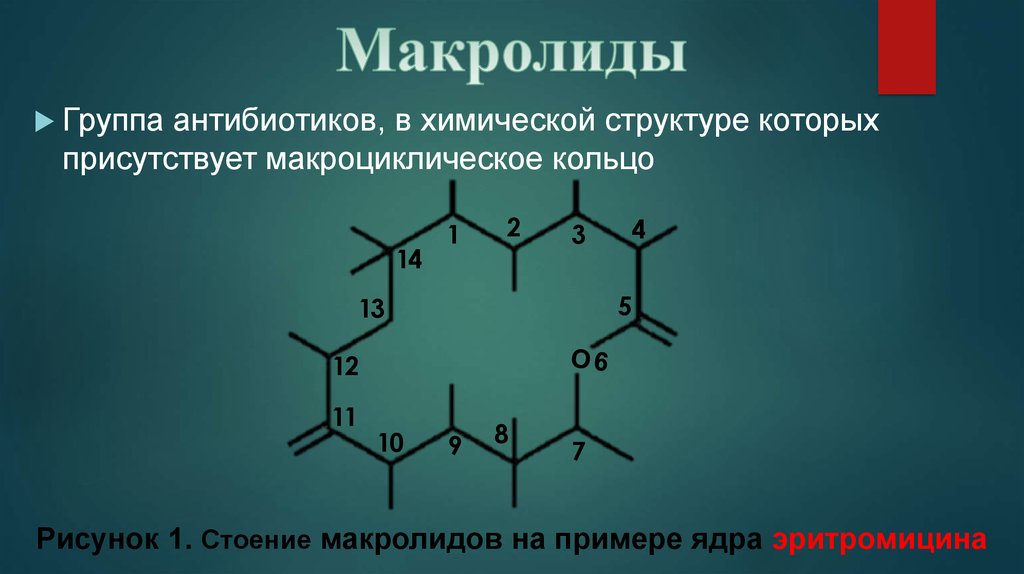 К. Медикаментозное поражение печени у детей: случай/неслучайное исследование подозреваемых побочных реакций на лекарства в VigiBase. Br J Clin Pharmacol 2010; 70: 721-8. [Бесплатная статья PMC: PMC2997312] [PubMed: 21039766]
К. Медикаментозное поражение печени у детей: случай/неслучайное исследование подозреваемых побочных реакций на лекарства в VigiBase. Br J Clin Pharmacol 2010; 70: 721-8. [Бесплатная статья PMC: PMC2997312] [PubMed: 21039766]
(Всемирная база данных фармаконадзора, содержащая 9036 побочных реакций со стороны печени у детей, включая 63 случая, связанных с азитромицином, 60 — с эритромицином и 35 — с кларитромицином).
Лейтнер Дж. М., Гранинджер В., Талхаммер Ф. Гепатотоксичность антибактериальных препаратов: патомеханизмы и клинические данные. Инфекция 2010; 38: 3-11. [PubMed: 20107858]
(Обзор; антибиотики-макролиды могут вызывать холестатический гепатит с расчетной частотой 3,6 для эритромицина, 3,8 для кларитромицина и 5,5 случаев на 100 000 назначений для телитромицина по сравнению с 10 для сульфаниламидов и 2000 на 000 на 100, изониазид).
Рубен А., Кох Д. Г., Ли В.М.; Группа по изучению острой печеночной недостаточности. Лекарственно-индуцированная острая печеночная недостаточность: результаты многоцентрового проспективного исследования в США. Гепатология 2010; 52: 2065-76. [Статья бесплатно PMC: PMC3992250] [PubMed: 20949552]
Г., Ли В.М.; Группа по изучению острой печеночной недостаточности. Лекарственно-индуцированная острая печеночная недостаточность: результаты многоцентрового проспективного исследования в США. Гепатология 2010; 52: 2065-76. [Статья бесплатно PMC: PMC3992250] [PubMed: 20949552]
(Среди 1198 пациентов с острой печеночной недостаточностью, включенных в проспективное исследование в США в период с 1998 по 2007 год, 133 были связаны с лекарственным поражением печени, в том числе 66 из-за противомикробных агентов, но только один из-за макролидов [кларитромицин] и ни одного из-за телитромицина).
Андраде Р.Дж., Тюлькенс П.М. Печеночная безопасность антибиотиков, используемых в первичной медико-санитарной помощи. J Antimicrob Chemother 2011; 66: 1431-46. [Статья бесплатно PMC: PMC3112029] [PubMed: 21586591]
(Обзор: краткое описание клинических и гистологических особенностей гепатотоксичности, связанной с эритромицином, кларитромицином, азитромицином и телитромицином).
Ганье Дж.Дж., Глинн Р.Дж., Рассен Дж.А., Уокер А.М., Дэниел Г.В., Сридхар Г., Шнивейс С. Активный мониторинг безопасности новых лекарств, поступающих в продажу в распределенной сети данных: применение полуавтоматической системы мониторинга. Clin Pharmacol Ther 2012; 92: 80-6. [Статья бесплатно PMC: PMC3947906] [PubMed: 22588606]
(Описание результатов полуавтоматической последовательной оценки склонности с подходом согласованной когорты для мониторинга безопасности лекарств на основе электронных баз данных; среди 106 658 новых потребителей телитромицина и аналогичного числа пользователей азитромицина, выявленных за 5-летний период, был обнаружен 41 случай гепатита, 23 из которых были связаны с телитромицином при коэффициенте риска 2 на 10 000 пользователей, что незначительно выше, чем при использовании азитромицина).
Бьернссон Э.С., Бергманн О.М., Бьернссон Х.К., Кваран Р. Б., Олафссон С. Заболеваемость, клиническая картина и исходы у пациентов с лекарственным поражением печени в общей популяции Исландии. Gastroenterology 2013 Feb 15. [Epub перед печатью] [PubMed: 23419359]
Б., Олафссон С. Заболеваемость, клиническая картина и исходы у пациентов с лекарственным поражением печени в общей популяции Исландии. Gastroenterology 2013 Feb 15. [Epub перед печатью] [PubMed: 23419359]
(В популяционном исследовании лекарственного поражения печени в Исландии за 2-летний период было выявлено 96 случаев, в том числе 28 из-за антибиотиков, но ни один из них не был связан с азитромицином или другими макролидами).
Эрнандес Н., Бессоне Ф., Санчес А., ди Паче М., Брам Дж., Запата Р., А. Чирино Р. и др. Профиль идиосинкразического поражения печени, вызванного лекарствами, в Латинской Америке: анализ опубликованных отчетов. Энн Хепатол, 2014 г.; 13: 231-9. [PubMed: 24552865]
(Среди 176 сообщений о лекарственном поражении печени из Латинской Америки, опубликованных в период с 1996 по 2012 год, только одно было связано с макролидным антибиотиком: кларитромицином).
Чаласани Н. , Бонковский Х.Л., Фонтана Р., Ли В., Штольц А., Талвалкар Дж., Редди К.Р. и др.; Сеть США по лекарственным повреждениям печени. Особенности и исходы 899 пациентов с лекарственным поражением печени: проспективное исследование DILIN. Гастроэнтерология 2015; 148: 1340-52.е7. [Статья без PMC: PMC4446235] [PubMed: 25754159]
, Бонковский Х.Л., Фонтана Р., Ли В., Штольц А., Талвалкар Дж., Редди К.Р. и др.; Сеть США по лекарственным повреждениям печени. Особенности и исходы 899 пациентов с лекарственным поражением печени: проспективное исследование DILIN. Гастроэнтерология 2015; 148: 1340-52.е7. [Статья без PMC: PMC4446235] [PubMed: 25754159]
(Среди 899 случаев лекарственного поражения печени, включенных в проспективное исследование в США в период с 2004 по 2013 год, 233 [36%] были связаны с антибиотиками, в том числе 29 [3,2%] из макролидных антибиотиков: 18 за счет азитромицина, 2 кларитромицина, 2 эритромицина и 7 телитромицина).
Ferrajolo C, Verhamme KM, Trifiro G, ‘t Jong GW, Picelli G, Giaquinto C, Mazzaglia G и др. Повреждение печени, вызванное антибиотиками, у педиатрических амбулаторных больных: исследование случай-контроль в базах данных первичной медико-санитарной помощи. Безопасность наркотиков 2017; 40: 305-15. [Бесплатная статья PMC: PMC5362651] [PubMed: 28025733]
(В базе данных здравоохранения 429 772 детей в Италии и Нидерландах, за которыми наблюдали в период с 2008 по 2010 год, было выявлено 938 случаев поражения печени неизвестной причины, причем частота была выше у тех, кто в настоящее время принимает антибиотики [12% против 3,6]. %] для скорректированного отношения шансов [aOR] 3,2; наиболее часто встречающимися антибиотиками были фторхинолоны [19,0], цефалоспорины [4,5], макролиды [3,5] и пенициллины [2,6] и специфическое aOR для азитромицина 2,4).
%] для скорректированного отношения шансов [aOR] 3,2; наиболее часто встречающимися антибиотиками были фторхинолоны [19,0], цефалоспорины [4,5], макролиды [3,5] и пенициллины [2,6] и специфическое aOR для азитромицина 2,4).
Бонковский Х.Л., Кляйнер Д.Е., Гу Дж., Один Дж.А., Руссо М.В., Наварро В.М., Фонтана Р.Дж. и др.; Американская сеть исследователей травм печени, вызванных наркотиками. Клинические проявления и исходы потери желчных протоков, вызванные лекарствами, растительными и диетическими добавками. Гепатология 2017; 65: 1267-77. [Статья бесплатно PMC: PMC5360519] [PubMed: 27981596]
(Среди 363 пациентов с лекарственным поражением печени, которым была проведена биопсия печени, у 26 [7%] была потеря желчных протоков, в том числе 2 случая, связанные с азитромицином, у обоих были обнаружены доказательства при хроническом повреждении печени, свидетельствующем о синдроме исчезающих желчных протоков).
Макролиды — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Макролиды — это класс препаратов, используемых для лечения различных бактериальных инфекций.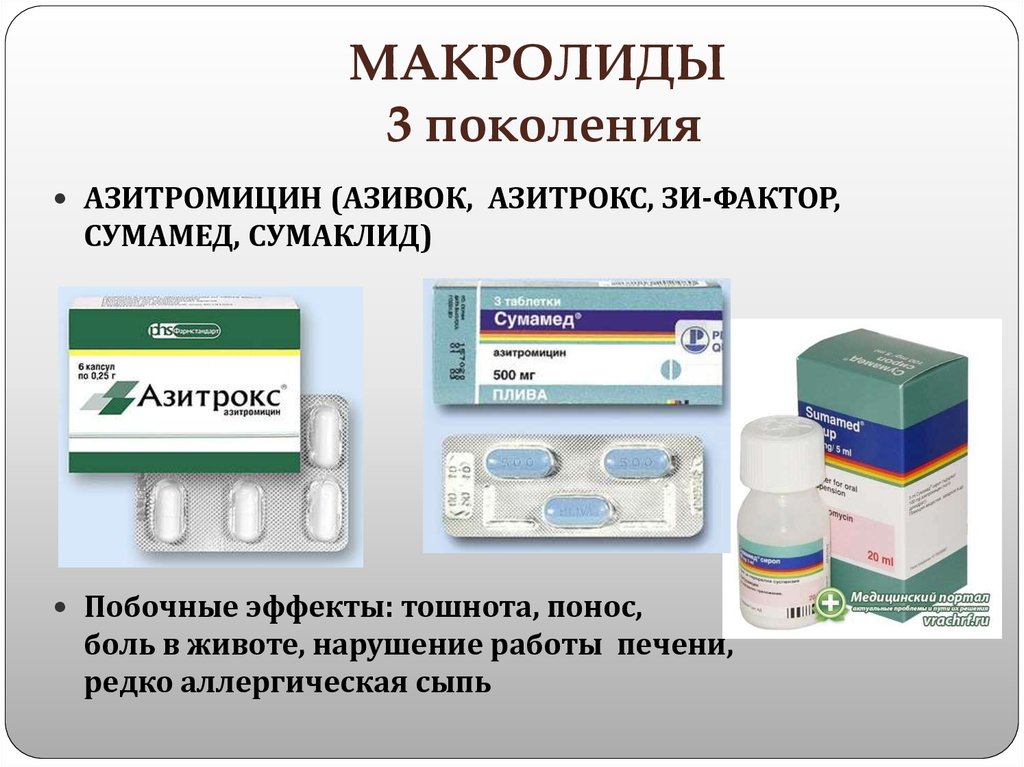 Азитромицин, кларитромицин и эритромицин обычно используются для лечения инфекций, таких как пневмония, синусит, фарингит и тонзиллит. Они также используются при неосложненных кожных инфекциях и среднем отите у детей. Кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori, в рамках стандартного протокола тройной терапии независимо от статуса резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. В этом задании рассматривается механизм действия, показания, противопоказания и другие ключевые факторы (например, использование вне зарегистрированных показаний, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), связанные с макролидами.
Азитромицин, кларитромицин и эритромицин обычно используются для лечения инфекций, таких как пневмония, синусит, фарингит и тонзиллит. Они также используются при неосложненных кожных инфекциях и среднем отите у детей. Кларитромицин используется для лечения инфекций, вызванных Helicobacter pylori, в рамках стандартного протокола тройной терапии независимо от статуса резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. В этом задании рассматривается механизм действия, показания, противопоказания и другие ключевые факторы (например, использование вне зарегистрированных показаний, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), связанные с макролидами.
Цели:
Определите механизм действия антибиотиков класса макролидов.
Опишите потенциальные побочные эффекты антибиотиков класса макролидов.
Рассмотрите надлежащий мониторинг, необходимый для пациентов, принимающих препараты класса макролидов.
Опишите стратегии межпрофессиональной бригады по улучшению надлежащего назначения и лечения макролидными антибиотиками.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Макролиды представляют собой встречающиеся в природе соединения, состоящие из лактонового кольца с присоединенными дезоксисахарами. Некоторые макролиды обладают антибиотическими или противогрибковыми свойствами и используются в фармацевтической противомикробной терапии. Первым макролидом, использованным таким образом, был эритромицин в 1952 году; его часто использовали при инфекциях у пациентов с аллергией на пенициллин или у пациентов с резистентными к пенициллину инфекциями.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование макролидных антибиотиков для лечения широкого спектра бактериальных инфекций.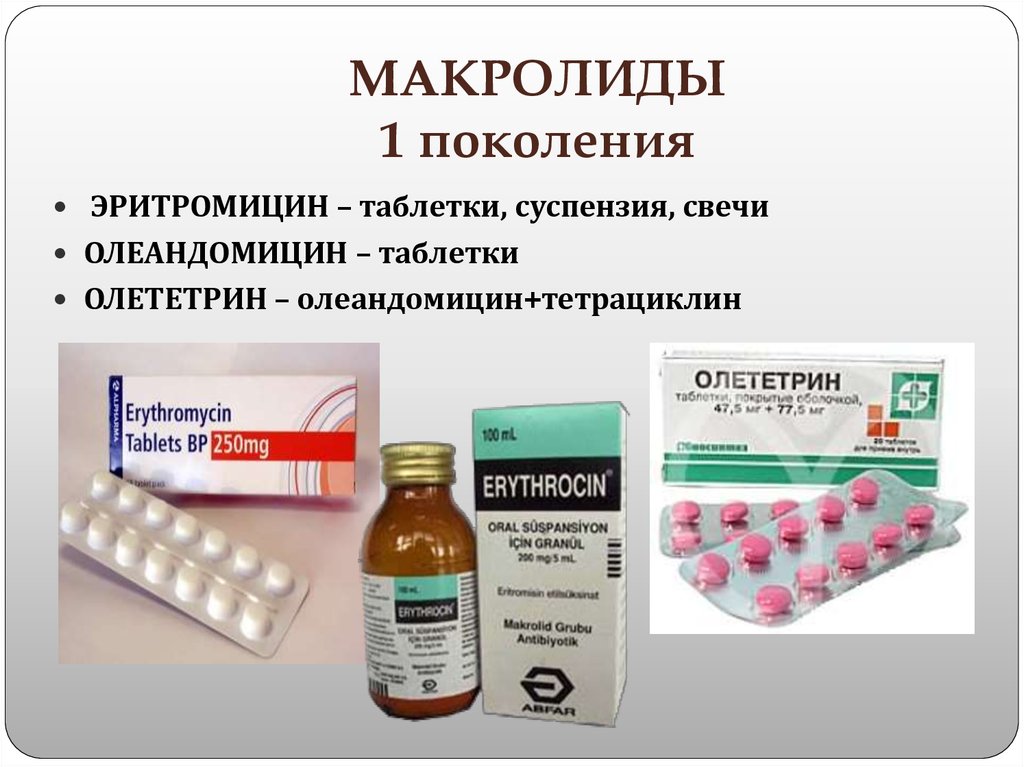 В частности, азитромицин, кларитромицин и эритромицин обычно используются для лечения таких инфекций, как пневмония, синусит, фарингит и тонзиллит. Кроме того, FDA одобрило его использование при неосложненных кожных инфекциях и среднем отите у детей. Кроме того, кларитромицин используется для лечения инфекций Helicobacter pylori в рамках стандартного протокола тройной терапии независимо от резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. Большая часть использования макролидов, как и других антибиотиков, продиктована статусом чувствительности и резистентности целевого организма. Макролиды также были одними из основных препаратов, используемых для лечения атипичной пневмонии, обычно вызываемой такими микроорганизмами, как 9.0051 Mycoplasma pneumoniae , Legionella и Chlamydia pneumoniae . Кроме того, было показано, что эти агенты уменьшают количество обострений бронхоэктатической болезни.
В частности, азитромицин, кларитромицин и эритромицин обычно используются для лечения таких инфекций, как пневмония, синусит, фарингит и тонзиллит. Кроме того, FDA одобрило его использование при неосложненных кожных инфекциях и среднем отите у детей. Кроме того, кларитромицин используется для лечения инфекций Helicobacter pylori в рамках стандартного протокола тройной терапии независимо от резистентности к кларитромицину. Макролиды также широко используются для лечения инфекций, передающихся половым путем, таких как гонококковая и хламидийная инфекции. Большая часть использования макролидов, как и других антибиотиков, продиктована статусом чувствительности и резистентности целевого организма. Макролиды также были одними из основных препаратов, используемых для лечения атипичной пневмонии, обычно вызываемой такими микроорганизмами, как 9.0051 Mycoplasma pneumoniae , Legionella и Chlamydia pneumoniae . Кроме того, было показано, что эти агенты уменьшают количество обострений бронхоэктатической болезни. Однако эти исследования не выявили снижения числа госпитализаций по поводу обострений.[6]
Однако эти исследования не выявили снижения числа госпитализаций по поводу обострений.[6]
Макролиды остаются неотъемлемой частью схем лечения обострений ХОБЛ. Использование этих препаратов при ХОБЛ обусловлено их противовоспалительными и иммуномодулирующими свойствами.[7]
Механизм действия
Макролы ингибируют синтез бактериального белка. Механизм действия макролидов основан на их способности связывать 50S субъединицу бактериальной рибосомы, вызывая прекращение синтеза бактериального белка. После связывания препарат предотвращает трансляцию мРНК, особенно растущей пептидной цепи, не позволяя ферменту пептидилтрансферазе добавлять последующую аминокислоту, присоединенную к тРНК. Поскольку бактериальная рибосомная структура в высокой степени консервативна у большинства, если не у всех, видов бактерий, она считается широкоспектральной.[8] Макролиды являются бактериостатическими агентами, поскольку они ингибируют только синтез белка, хотя в высоких дозах они могут оказывать бактерицидное действие.
Противовоспалительное и иммуномодулирующее действие макролидов, особенно азитромицина, связано с взаимодействием с фосфолипидами, а также факторами транскрипции AP-1, NF-kappaB и другими воспалительными цитокинами. Более поздние изменения, наблюдаемые в макрофагах, которые взаимодействуют с макролидами, включают ингибирование клеточной функции, клеточного транспорта и регуляцию экспрессии поверхностных рецепторов. Все это завершается иммуномодулирующим действием макролидов на организм.[2]
Из-за чрезмерного назначения антибиотиков резко возросла резистентность ко многим основным методам лечения. Макролиды не являются исключением в этой ситуации, и многие организмы обладают чрезмерной устойчивостью к ним. Основной причиной устойчивости бактерий к макролидам является посттранскрипционное метилирование бактериальной 23S рибосомной РНК. Эта приобретенная устойчивость может возникать по двум механизмам: она может быть опосредованной плазмидами, хромосомной.[9] Исследования показывают прочную связь с генетическими мутациями у бактерий и способность распространять эти гены через мобильные элементы. Рассматриваемый ген позволяет бактериям быть устойчивыми одновременно к макролидам, линкозамидам и стрептограминовым группам антибиотиков.[10]
Рассматриваемый ген позволяет бактериям быть устойчивыми одновременно к макролидам, линкозамидам и стрептограминовым группам антибиотиков.[10]
Администрация
Состав препарата требует обсуждения с лечащим врачом. Факторами, которые необходимо учитывать, являются сила, дозировка, путь, клинические цели лечения и т. д. Макролиды выпускаются в различных формах для введения, в зависимости от желаемого лекарства и причины их использования. Чаще всего используются пероральные составы в форме таблеток, но они также бывают в виде кремов для местного применения, внутривенных составов, а также офтальмологических препаратов.[4]
Следующий список включает наиболее распространенные макролиды и их наиболее распространенные составы; однако существуют другие составы и дозировки:
Эритромицин
ТАБЛИЧНЫЕ ПЕТАЛЫ: 250 мг / 500 мг
Офтальмическая мазь: 0,5%
.
Таблетки для приема внутрь: 125 мг / 250 мг / 500 мг (пролонгированного действия) – таблетки для приема внутрь
Порошок для разведения: 125 мг/5 мл (суспензия для приема внутрь)
Азитромицин
Таблетки для приема внутрь: 100 мг/250 мг/500 мг/600 мг – таблетки для приема внутрь
Порошок для инъекций: 500 мг
Порошок для разведения: 1000 мг/0,5 мл/5 мл Пакет с дозой г (суспензия для приема внутрь)
Фидаксомицин
Побочные эффекты
Как и любой другой антибиотик, макролиды несут определенный уровень риска из-за типичных побочных эффектов, таких как тошнота, рвота, боль в животе и диарея.
 Абдоминальные симптомы в значительной степени являются результатом того, что макролиды являются агонистами мотилина, вызывая повышенный риск желудочно-кишечных расстройств и побочных эффектов.[11] Кроме того, кишечная флора чувствительна к действию макролидов; следовательно, это может вызвать дисбаланс между комменсальными бактериями, обитающими в кишечнике человека, и патогенными бактериями, которые необходимо контролировать.
Абдоминальные симптомы в значительной степени являются результатом того, что макролиды являются агонистами мотилина, вызывая повышенный риск желудочно-кишечных расстройств и побочных эффектов.[11] Кроме того, кишечная флора чувствительна к действию макролидов; следовательно, это может вызвать дисбаланс между комменсальными бактериями, обитающими в кишечнике человека, и патогенными бактериями, которые необходимо контролировать.Другим распространенным побочным эффектом применения макролидов является их склонность к удлинению интервалов QT и QTc в сердечном цикле. Эритромицин имеет самую высокую тенденцию, а азитромицин — самую низкую. Увеличение интервалов подвергает пациентов риску сердечных аритмий, таких как пируэтная тахикардия, желудочковая тахикардия и фибрилляция желудочков. Наиболее распространенной аритмией, возникающей при использовании макролидов, будет пируэтная желудочковая тахикардия [12].
Недавние исследования макролидов также показали, что использование этих препаратов коррелирует с нейросенсорной тугоухостью.
 В то время как большинство случаев были обратимы при прекращении приема препарата, несколько случаев приводили к необратимой сенсоневральной тугоухости. Исследования показали, что потеря слуха может произойти как при стандартных, так и при повышенных дозах.[13]
В то время как большинство случаев были обратимы при прекращении приема препарата, несколько случаев приводили к необратимой сенсоневральной тугоухости. Исследования показали, что потеря слуха может произойти как при стандартных, так и при повышенных дозах.[13]Серьезные побочные эффекты, такие как синдром Стивенса-Джонсона и токсический эпидермальный некролиз, хотя и редки, но возможны, и их следует учитывать при назначении этих препаратов.[14]
Эритромицин также коррелирует с гепатотоксичностью у беременных женщин. Более того, эти препараты увеличивают вероятность стеноза привратника у новорожденных.[4]
Противопоказания
В целом макролиды представляют собой безопасную группу антибиотиков для приема, но существуют относительные противопоказания из-за профиля побочных эффектов и их способности взаимодействовать с другими препаратами. Пациентам с удлиненным интервалом QT на электрокардиограмме следует избегать макролидов из-за их аритмогенных свойств.
 Кроме того, пациентам с врожденными заболеваниями, такими как синдром удлиненного интервала QT 2 типа, также следует избегать этих препаратов. Пациентам, принимающим антиаритмические препараты классов Ia и III, также следует избегать макролидов, поскольку оба этих класса препаратов вызывают увеличение интервала QT и индуцируют аритмии [15].
Кроме того, пациентам с врожденными заболеваниями, такими как синдром удлиненного интервала QT 2 типа, также следует избегать этих препаратов. Пациентам, принимающим антиаритмические препараты классов Ia и III, также следует избегать макролидов, поскольку оба этих класса препаратов вызывают увеличение интервала QT и индуцируют аритмии [15].Макролиды могут проявлять неблагоприятные взаимодействия с некоторыми широко используемыми препаратами. Взаимодействие карбамазепина, циклоспорина, терфенадина, астемизола и теофиллина наиболее часто встречается при применении макролидных антибиотиков. Как ингибитор CYP3A4 эритромицин более склонен к межлекарственным взаимодействиям, опосредованным CYP3A4; кларитромицин гораздо менее склонен к такому взаимодействию, а азитромицин не участвует в этих взаимодействиях.[16]
Беременные женщины также должны стараться избегать использования макролидов, особенно эритромицина, из-за возможных побочных эффектов, воздействующих на мать или новорожденного.
 [17]
[17]В связи с увеличением уровня устойчивости к антибиотикам макролиды следует назначать с осторожностью, и врач, назначающий препарат, должен учитывать местный статус резистентности распространенных патогенов.
Мониторинг
При назначении макролидов врач должен учитывать различные побочные эффекты со стороны желудочно-кишечного тракта и кардиальные эффекты, с которыми пациент может столкнуться при применении макролидов. У большинства пациентов побочные эффекты со стороны желудочно-кишечного тракта будут наиболее распространенными, и команда должна быть готова принять надлежащие меры для противодействия этим эффектам. Из-за риска удлинения интервала QT следует проводить тщательное наблюдение за пациентами с сердечными заболеваниями, а также за теми, кто принимает антиаритмические средства или препараты, о которых известно, что они вызывают взаимодействие. Врачи, назначающие препараты, также должны знать о возможных дерматологических побочных эффектах и, таким образом, консультировать пациентов по поводу побочных эффектов.
 Что касается возможных побочных эффектов у беременных женщин и новорожденных, пациенты нуждаются в консультации о побочных эффектах этих препаратов во время беременности, включая вероятное неблагоприятное воздействие на новорожденного при назначении этих препаратов.
Что касается возможных побочных эффектов у беременных женщин и новорожденных, пациенты нуждаются в консультации о побочных эффектах этих препаратов во время беременности, включая вероятное неблагоприятное воздействие на новорожденного при назначении этих препаратов.Токсичность
Из-за серьезности побочных эффектов со стороны сердца у пациентов с высоким риском следует проводить мониторинг интервала QT на ЭКГ, чтобы избежать индукции смертельных аритмий, таких как Torsades de Pointes. У пациентов с высоким риском перед введением лекарств необходимо проверить электролиты, особенно кальций, калий и магний. [4] Прекращение приема препарата необходимо, если у пациента возникают серьезные побочные эффекты. Если возможно, у этих пациентов с высоким риском вместо макролидов следует использовать другой антибиотик, чтобы избежать вероятности индукции аритмий.
Улучшение результатов медицинского персонала
Несмотря на то, что макролиды относятся к очень безопасному классу антибиотиков, для минимизации нежелательных явлений необходимо обеспечить надлежащее медицинское обслуживание всей многопрофильной командой.
 Все члены межпрофессиональной медицинской бригады должны следить за пациентами на предмет общих побочных эффектов, а также необычных. Все участники должны быть осведомлены о распространенных побочных эффектах со стороны желудочно-кишечного тракта и серьезных сердечных последствиях этого препарата. Каждый член медицинской бригады разделяет ответственность за оказание первоклассной помощи своим пациентам и всегда должен следить за возможными побочными эффектами.
Все члены межпрофессиональной медицинской бригады должны следить за пациентами на предмет общих побочных эффектов, а также необычных. Все участники должны быть осведомлены о распространенных побочных эффектах со стороны желудочно-кишечного тракта и серьезных сердечных последствиях этого препарата. Каждый член медицинской бригады разделяет ответственность за оказание первоклассной помощи своим пациентам и всегда должен следить за возможными побочными эффектами.Принимая решение о начале терапии макролидами, клиницист (MD, DO, NP или PA) должен включить консультацию фармацевта, которая будет состоять из проверки целесообразности выбранного агента, проверки правильной дозировки и проверки наличия лекарственные взаимодействия. Фармацевты также могут помочь пациенту, отвечая на его вопросы, предупреждая о признаках нежелательных явлений, подкрепляя указания врача и сообщая врачу о любых проблемах, которые могут у них возникнуть. Сестринское дело может контролировать и отвечать на вопросы пациентов об их терапии и сообщать лечащему врачу о ходе лечения или его отсутствии или наличии побочных эффектов.
 Все члены межпрофессиональной команды должны знать наиболее распространенные способы применения антибиотиков класса макролидов и прилагать совместные усилия для обеспечения оптимальных результатов лечения пациентов. [Уровень 5]
Все члены межпрофессиональной команды должны знать наиболее распространенные способы применения антибиотиков класса макролидов и прилагать совместные усилия для обеспечения оптимальных результатов лечения пациентов. [Уровень 5]Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Клейн Д.О. История применения макролидов в педиатрии. Pediatr Infect Dis J. 1997 Apr;16(4):427-31. [PubMed: 9109154]
- 2.
Parnham MJ, Erakovic Haber V, Giamarellos-Bourboulis EJ, Perletti G, Verleden GM, Vos R. Азитромицин: механизмы действия и их значение для клинического применения. Фармакол Тер. 2014 г., август; 143(2):225–45. [В паблике: 24631273]
- 3.
Yeo YH, Shiu SI, Ho HJ, Zou B, Lin JT, Wu MS, Liou JM, Wu CY., Taiwan Gastrointestinal Disease and Helicobacter Consortium.
 Эрадикационная терапия первой линии Helicobacter pylori в странах с высокой и низкой устойчивостью к кларитромицину: систематический обзор и сетевой метаанализ. Кишка. 2018 Янв;67(1):20-27. [PubMed: 27670375]
Эрадикационная терапия первой линии Helicobacter pylori в странах с высокой и низкой устойчивостью к кларитромицину: систематический обзор и сетевой метаанализ. Кишка. 2018 Янв;67(1):20-27. [PubMed: 27670375]- 4.
Farzam K, Nessel TA, Quick J. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 16 июня 2022 г. Эритромицин. [В паблике: 30335282]
- 5.
Кунья Б.А. Атипичные пневмонии: клиника, диагностика и значение. Клин Микробиол Инфект. 2006 Май; 12 Дополнение 3:12-24. [Бесплатная статья PMC: PMC7128183] [PubMed: 16669925]
- 6.
Гао Ю.Х., Гуань В.Дж., Сюй Г., Тан И., Гао И., Линь З.И., Линь З.М., Чжун Н.С., Чен Р.С. Терапия макролидами у взрослых и детей с немуковисцидозными бронхоэктазами: систематический обзор и метаанализ. ПЛОС Один. 2014;9(3):e
- . [Бесплатная статья PMC: PMC3946068] [PubMed: 24603554]
- 7.
Qiu S, Zhong X. Macrolides: перспективная фармакологическая терапия хронической обструктивной болезни легких.
 Тер Ад Респир Дис. 2017 март; 11(3):147-155. [Бесплатная статья PMC: PMC5933650] [PubMed: 28030992]
Тер Ад Респир Дис. 2017 март; 11(3):147-155. [Бесплатная статья PMC: PMC5933650] [PubMed: 28030992]- 8.
Васкес-Ласлоп Н., Манкин А.С. Как работают макролидные антибиотики. Тенденции биохимических наук. 2018 сен; 43 (9): 668-684. [Бесплатная статья PMC: PMC6108949] [PubMed: 30054232]
- 9.
Мунита Дж. М., Ариас, Калифорния. Механизмы антибиотикорезистентности. Микробиологический спектр. 2016 Apr;4(2) [PMC free article: PMC4888801] [PubMed: 27227291]
- 10.
Marosevic D, Kaevska M, Jaglic Z. Резистентность к антибиотикам группы тетрациклинов и макролид-линкозамид-стрептограмина и его генетическая связь — обзор. Энн Агрик Энвайрон Мед. 2017 12 июня; 24 (2): 338-344. [PubMed: 28664720]
- 11.
Картер Б.Л., Вудхед Дж.С., Коул К.Дж., Милавец Г. Побочные эффекты со стороны желудочно-кишечного тракта при приеме препаратов эритромицина. Препарат Интелл Клин Фарм. 1987 Сен; 21 (9): 734-8.
 [PubMed: 3498618]
[PubMed: 3498618]- 12.
Альберт Р.К., Шуллер Дж.Л., Сеть клинических исследований ХОБЛ. Антибиотики-макролиды и риск сердечных аритмий. Am J Respir Crit Care Med. 2014 15 мая; 189(10):1173-80. [Бесплатная статья PMC: PMC4061901] [PubMed: 24707986]
- 13.
Икеда А.К., Принц А.А., Чен Д.С., Лью Д.Е.К., Шин Д.Дж. Нейросенсорная тугоухость, связанная с макролидами: систематический обзор. Ларингоскоп. 2018 Январь; 128 (1): 228-236. [В паблике: 28771738]
- 14.
Уильямс Д.А. Синдром Стивенса-Джонсона после терапии эритромицином в море. Мил Мед. 2000 г., август; 165 (8): 636-7. [PubMed: 10957862]
- 15.
Berger FA, van Weteringen W, van der Sijs H, Hunfeld NGM, Bunge JJH, de Groot NMS, van den Bemt PMLA, van Gelder T. Динамика интервала QTc в течение 24-часовой интервал между дозами после начала внутривенного введения ципрофлоксацина или низких доз эритромицина у пациентов в ОИТ. Фармакол Рез Перспект.

