Лейкотриены | это… Что такое Лейкотриены?
Лейкотриен E4
Лейкотрие́ны — группа липидных высокоактивных веществ, образующаяся в организме из арахидоновой кислоты, содержащей 20-членную углеродную цепь. Подкласс лейкотриенов, вместе с простаноидами, входит в класс эйкозаноидов. Один из основных эффектов лейкотриенов — бронхоспазм — лежит в основе патогенеза бронхиальной астмы.
Содержание
|
История
В 1938 году Киллвэй и Фелдберг, при исследовании воздействия яда кобры на лёгкие морских свинок, случайно обнаружили в лёгочном перфузате неизвестное ранее вещество, обладающее бронхоконстрикторным действием. Бронхоспазм, развивавшийся под воздействием этого неизвестного вещества, отличался от вызванной гистамином бронхоспастической реакции медленным развитием и большей продолжительностью. В связи с этим учёные назвали это вещество медленнореагирующей субстанцией анафилаксии (сокращенно МРСА, англ. slow reacting substance).
Бронхоспазм, развивавшийся под воздействием этого неизвестного вещества, отличался от вызванной гистамином бронхоспастической реакции медленным развитием и большей продолжительностью. В связи с этим учёные назвали это вещество медленнореагирующей субстанцией анафилаксии (сокращенно МРСА, англ. slow reacting substance).
В 1960 году Броклхёрст выделил МРС-А из лёгочной ткани больного бронхиальной астмой после проведения ингаляционной провокации с аллергеном. Этим исследованием он подтвердил, что МРСА обладает выраженным бронхоконстрикторным действием и является важным медиатором в развитии аллергического воспаления у больных БА.
В конце 1970-х годов была расшифрована структура молекулы МРСА. В исследованиях Бенгта Самуэльсона и его сотрудников было показано, что МРСА представляет собой неоднородную химическую структуру, относящуюся к семейству липидных медиаторов. Впервые эти медиаторы были выделены из лейкоцитов и характеризовались наличием конъюгированной триеновой структуры. В связи с этим выделенные вещества были названы «лейкотриенами» (ЛТ).
В связи с этим выделенные вещества были названы «лейкотриенами» (ЛТ).
В настоящее время идентифицированы ЛТА4, ЛТВ4, ЛТС4, ЛТD4, ЛТE4, ЛТF4. Среди них выделяют 2 подгруппы лейкотриенов: к первой относят ЛТC4, ЛТD4, ЛТE4 и ЛТF4, они содержат в боковой цепи пептидные остатки, ко второй относят ЛТВ4, имеющий другое строение.
Синтез
Метаболизм арахидоновой кислоты. Синие стрелки — участие фермента, красные стрелки — блокирование
Как было сказано выше, лейкотриены образуются из арахидоновой кислоты, которая, в свою очередь, отщепляется от фосфолипидов цитоплазматической мембраны, с помощью фермента фосфолипаза A
Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием ЦОГ она превращается в простаноиды, а под влиянием липоксигеназной ферментной системы в лейкотриены.
Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах.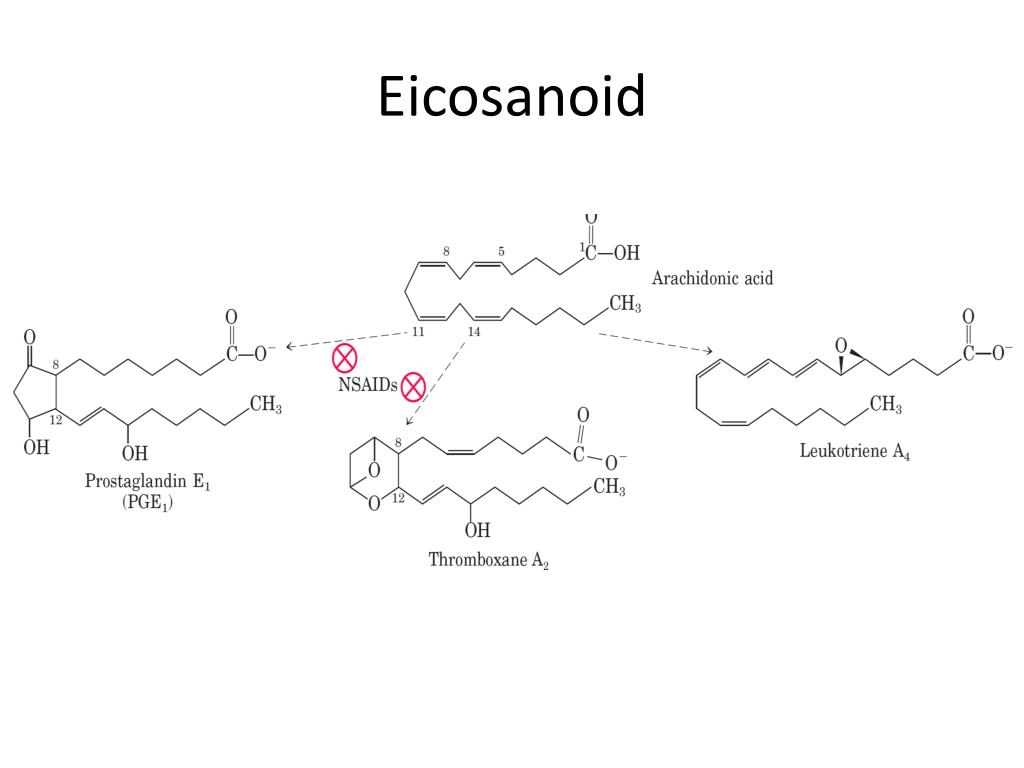 Наиболее важным среди ферментов этой системы является 5-липоксигеназа (5-ЛОГ). Активация перечисленных клеток приводит к перемещению 5-ЛОГ к мембране ядерного аппарата и связыванию со специфическим белком — 5-ЛОГ-активирующим протеином (5-ЛОГ-АП). 5-ЛОГ-АП является кофактором при взаимодействии арахидоновой кислоты и 5-ЛОГ. Таким образом, арахидоновая кислота под воздействием комплекса 5-ЛОГ + 5-ЛОГ-АП превращается в нестабильное соединение 5-гидроксипероксиэйкозатетраеновую кислоту (5-HPETE), из которой в свою очередь образуется ЛТА
Наиболее важным среди ферментов этой системы является 5-липоксигеназа (5-ЛОГ). Активация перечисленных клеток приводит к перемещению 5-ЛОГ к мембране ядерного аппарата и связыванию со специфическим белком — 5-ЛОГ-активирующим протеином (5-ЛОГ-АП). 5-ЛОГ-АП является кофактором при взаимодействии арахидоновой кислоты и 5-ЛОГ. Таким образом, арахидоновая кислота под воздействием комплекса 5-ЛОГ + 5-ЛОГ-АП превращается в нестабильное соединение 5-гидроксипероксиэйкозатетраеновую кислоту (5-HPETE), из которой в свою очередь образуется ЛТА
Далее ЛТА4 может превращаться двумя путями: либо при участии цитозольного фермента ЛТА4-гидролазы в ЛТВ4, либо под воздействием ЛТС4-синтетазы с образованием цисЛТС4. ЛТС ЛТЕ4 является субстратом для образования ЛТF4.
ЛТЕ4 является субстратом для образования ЛТF4.
Химическое строение
Лейкотриен А4
Лейкотриен В4
Лейкотриен С4
Лейкотриен D4
Лейкотриены являются производными арахидоновой кислоты. Последняя является полиненасыщенной кислотой, содержащей 20 атомов углерода, из которых 1-й входит в состав карбоксильной группы (-COOH). Молекула арахидоновой кислоты также содержит 4 двойные связи: первая расположена между 5 и 6 атомом углерода (счет их ведется от -COOH), вторая — между 8 и 9, третья — между 11 и 12, четвёртая — между 14 и 15.
Известно 6 типов лейкотриенов — А, В, С, D, Е и F. Их объединяет — с точки зрения химического строения — наличие карбоксильной группы, общее число атомов углерода в основной цепочке (20) и наличие 4 двойных связей (поэтому после написания названия лейкотриена, указывают индекс 4).
- ЛТА4 — его 4 двойные связи расположены следующим образом: первая — между 7 и 8 атомом углерода, вторая — между 9 и 10, третья — между 11 и 12, четвёртая — между 14 и 15. Кроме того, к 5 и 6 атомам углерода присоединяется одна эпоксидная группа.
- ЛТВ4 — его 4 двойные связи расположены иначе: первая — между 6 и 7 атомом углерода, вторая — между 8 и 9, третья — между 10 и 11, четвёртая — между 14 и 15. Кроме того, к 5 и 13 атомам углерода присоединяются гидроксильные группы.
- ЛТС4 — также отличается расположением 4 двойных связей: первая — между 7 и 8 атомом углерода, вторая — между 9 и 10, третья — между 11 и 12, четвёртая — между 13 и 14. Кроме того, к 5-му атому углерода присоединяются гидроксильная группа, а к шестому глутатион, через сульфидную группу цистеина.
- ЛТD4 — очень похож на лейкотриен С4, но он образуется при отщеплении от глутатиона одной аминокислоты — глутамата.
 Поэтому его боковая пептидная цепочка именуется цистеинилглицином.
Поэтому его боковая пептидная цепочка именуется цистеинилглицином. - ЛТE4 — образутся из ЛТD4, после того как его пептидная цепь лишается ещё одной аминокислоты — глицина.
- ЛТF4 — очень похож на лейкотриен С4, но он образуется при отщеплении от глутатиона глицина. Поэтому его боковая пептидная цепочка именуется γ-глутамилцистеином).
Таким образом, по химическому строению, можно выделить две группы лейкотриенов:
- 1 группа — «пептидные (цистеиновые) лейкотриены», к ним относят ЛТС4, ЛТD4, ЛТЕ4, ЛТF4.
- 2 группа — лейкотриены, без пептидов: ЛТА4, ЛТВ4.
Роль в организме
Лейкотриеновые рецепторы
Выделяют три основных типа рецепторов лейкотриенов.[2] Причём два из них модулируются «пептидными лейкотриенами»:
- «Пептидные лейкотриены» модулируют специфические рецепторы, сопряженные с G-белком. Их обозначают CysLT-R.
- Лейкотриен B4 модулирует другой тип рецепторов — BLT1- и BLT2-рецепторы (другое название LTB4-рецепторы).
Основные эффекты
- ЛТB4 — опосредует хемотаксис, экссудацию плазмы, сокращение паренхимы лёгких, участие в иммунных ответах.
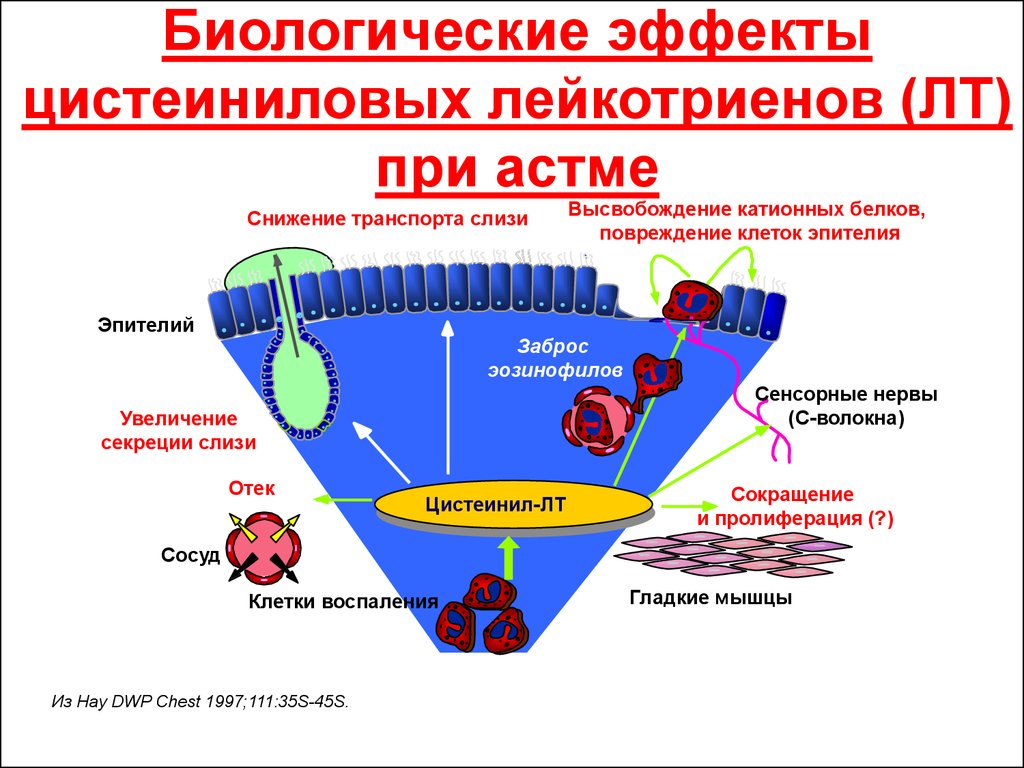
- ЛТC4, ЛТD4, ЛТE4 являются основными компонентами МРСА, поэтому в первую очередь эта группа лейкотриенов относится к мощным бронхоконстрикторам. Также эти лейкотриены способны повышать тонус гладких мышц ЖКТ, опосредовать экссудацию плазмы и сокращение паренхимы лёгких.
Роль в патологии
- Лейкотриены участвуют в патогенезе бронхиальной астмы. Вместе с гистамином лейкотриены относятся к медиаторам ранней фазы аллергической реакции немедленного типа.
 В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм.
В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм.
- Лейкотриены вызывают очень неприятный аспириновый бронхоспазм, возникающий при приёме неселективных НПВС: аспирин и др.

Возможности фармакологической коррекции эффектов
Сингуляр (Монтелукаст)
- В настоящее время разработаны и успешно используются антагонисты CysL-R1: монтелукаст, зафирлукаст и пранлукаст (последний не зарегистрирован в РФ). Препараты могут использоваться в виде монотерапии у больных лёгкой персистирующей бронхиальной астмой. У больных со среднетяжёлым и тяжёлым течением заболевания антагонисты CysLT-R1 используют в качестве дополнительной терапии в комбинации с ингаляционными глюкокортикоидами (ИГКС) с целью уменьшения дозы ИГКС и достижения полного контроля астмы. Отмечено также их положительное влияние на течение аспириновой БА у больных с непереносимостью нестероидных противовоспалительных препаратов.
- Созданы ингибиторы биосинтеза лейкотриенов, подавляющие активность фермента 5-ЛОГ: зилеутон.
 Установлено, что этот препарат оказывает бронхорасширяющее действие (его начало в течение 2-х часов, продолжительность — 5 часов после приема) и предупреждает развитие бронхоспазма, вызываемого аспирином и холодным воздухом.
Установлено, что этот препарат оказывает бронхорасширяющее действие (его начало в течение 2-х часов, продолжительность — 5 часов после приема) и предупреждает развитие бронхоспазма, вызываемого аспирином и холодным воздухом. - В экспериментах созданы блокаторы 5-ЛОГ-активирующего протеина и рецепторов ЛТB4.
Таким образом, можно выделить 4 точки приложения препаратов:
- Прямые ингибиторы 5-ЛОГ (зилеутон, Z-D2138, АВТ-761),
- Ингибиторы 5-ЛОГ-АП предупреждающие связывание этого мембраносвязанного белка с арахидоновой кислотой (МК-0591, МК-886, BAYxl005 и др.),
- Антагонисты CysLT-R (зафирлукаст, монтелукаст, пранлукаст и др.),
- Антагонисты рецепторов лейкотриенов В4 (U-75, 302).[4]
Примечания
- ↑ ЛЕЙКОТРИЕНЫ — Химическая энциклопедия.
- ↑ Голубев Л. А., Бабак С. Л., Григорьянц Г. А. Антагонисты леикотриеновых рецепторов в лечении бронхиальной астмы // Южно-Российский медицинский журнал.
 — 2001. — № 1-2.
— 2001. — № 1-2. - ↑ Княжеская Н. П. Аспириновая бронхиальная астма и антагонисты лейкотриенов // РМЖ. — 2000. — Т. 8. — № 12.
- ↑ Антилейкотриеновые препараты. Зилеутон.
Ссылки
- consilium-medicum.com
- chemport.ru
- xumuk.ru
Лейкотриены | это… Что такое Лейкотриены?
Лейкотриен E4
Лейкотрие́ны — группа липидных высокоактивных веществ, образующаяся в организме из арахидоновой кислоты, содержащей 20-членную углеродную цепь. Подкласс лейкотриенов, вместе с простаноидами, входит в класс эйкозаноидов. Один из основных эффектов лейкотриенов — бронхоспазм — лежит в основе патогенеза бронхиальной астмы.
Содержание
|
История
В 1938 году Киллвэй и Фелдберг, при исследовании воздействия яда кобры на лёгкие морских свинок, случайно обнаружили в лёгочном перфузате неизвестное ранее вещество, обладающее бронхоконстрикторным действием. Бронхоспазм, развивавшийся под воздействием этого неизвестного вещества, отличался от вызванной гистамином бронхоспастической реакции медленным развитием и большей продолжительностью. В связи с этим учёные назвали это вещество медленнореагирующей субстанцией анафилаксии (сокращенно МРСА, англ. slow reacting substance).
Бронхоспазм, развивавшийся под воздействием этого неизвестного вещества, отличался от вызванной гистамином бронхоспастической реакции медленным развитием и большей продолжительностью. В связи с этим учёные назвали это вещество медленнореагирующей субстанцией анафилаксии (сокращенно МРСА, англ. slow reacting substance).
В 1960 году Броклхёрст выделил МРС-А из лёгочной ткани больного бронхиальной астмой после проведения ингаляционной провокации с аллергеном. Этим исследованием он подтвердил, что МРСА обладает выраженным бронхоконстрикторным действием и является важным медиатором в развитии аллергического воспаления у больных БА.
В конце 1970-х годов была расшифрована структура молекулы МРСА. В исследованиях Бенгта Самуэльсона и его сотрудников было показано, что МРСА представляет собой неоднородную химическую структуру, относящуюся к семейству липидных медиаторов. Впервые эти медиаторы были выделены из лейкоцитов и характеризовались наличием конъюгированной триеновой структуры. В связи с этим выделенные вещества были названы «лейкотриенами» (ЛТ).
В связи с этим выделенные вещества были названы «лейкотриенами» (ЛТ).
В настоящее время идентифицированы ЛТА4, ЛТВ4, ЛТС4, ЛТD4, ЛТE4, ЛТF4. Среди них выделяют 2 подгруппы лейкотриенов: к первой относят ЛТC4, ЛТD4, ЛТE4 и ЛТF4, они содержат в боковой цепи пептидные остатки, ко второй относят ЛТВ4, имеющий другое строение.
Синтез
Метаболизм арахидоновой кислоты. Синие стрелки — участие фермента, красные стрелки — блокирование
Как было сказано выше, лейкотриены образуются из арахидоновой кислоты, которая, в свою очередь, отщепляется от фосфолипидов цитоплазматической мембраны, с помощью фермента фосфолипаза A2.
Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием ЦОГ она превращается в простаноиды, а под влиянием липоксигеназной ферментной системы в лейкотриены.
Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным среди ферментов этой системы является 5-липоксигеназа (5-ЛОГ). Активация перечисленных клеток приводит к перемещению 5-ЛОГ к мембране ядерного аппарата и связыванию со специфическим белком — 5-ЛОГ-активирующим протеином (5-ЛОГ-АП). 5-ЛОГ-АП является кофактором при взаимодействии арахидоновой кислоты и 5-ЛОГ. Таким образом, арахидоновая кислота под воздействием комплекса 5-ЛОГ + 5-ЛОГ-АП превращается в нестабильное соединение 5-гидроксипероксиэйкозатетраеновую кислоту (5-HPETE), из которой в свою очередь образуется ЛТА4. Обе эти реакции катализируются активированной 5-ЛОГ, расположенной на перинуклеарной мембране.
Наиболее важным среди ферментов этой системы является 5-липоксигеназа (5-ЛОГ). Активация перечисленных клеток приводит к перемещению 5-ЛОГ к мембране ядерного аппарата и связыванию со специфическим белком — 5-ЛОГ-активирующим протеином (5-ЛОГ-АП). 5-ЛОГ-АП является кофактором при взаимодействии арахидоновой кислоты и 5-ЛОГ. Таким образом, арахидоновая кислота под воздействием комплекса 5-ЛОГ + 5-ЛОГ-АП превращается в нестабильное соединение 5-гидроксипероксиэйкозатетраеновую кислоту (5-HPETE), из которой в свою очередь образуется ЛТА4. Обе эти реакции катализируются активированной 5-ЛОГ, расположенной на перинуклеарной мембране.
Далее ЛТА4 может превращаться двумя путями: либо при участии цитозольного фермента ЛТА4-гидролазы в ЛТВ4, либо под воздействием ЛТС4-синтетазы с образованием цисЛТС4. ЛТС4 выходит во внеклеточное пространство и далее с помощью g-глутамилтрансептидазы превращается в ЛТD4, который затем под влиянием дипептидазы образует ЛТЕ4. ЛТЕ4 является субстратом для образования ЛТF4.
ЛТЕ4 является субстратом для образования ЛТF4.
Химическое строение
Лейкотриен А4
Лейкотриен В4
Лейкотриен С4
Лейкотриен D4
Лейкотриены являются производными арахидоновой кислоты. Последняя является полиненасыщенной кислотой, содержащей 20 атомов углерода, из которых 1-й входит в состав карбоксильной группы (-COOH). Молекула арахидоновой кислоты также содержит 4 двойные связи: первая расположена между 5 и 6 атомом углерода (счет их ведется от -COOH), вторая — между 8 и 9, третья — между 11 и 12, четвёртая — между 14 и 15.
Известно 6 типов лейкотриенов — А, В, С, D, Е и F. Их объединяет — с точки зрения химического строения — наличие карбоксильной группы, общее число атомов углерода в основной цепочке (20) и наличие 4 двойных связей (поэтому после написания названия лейкотриена, указывают индекс 4). Тем не менее, каждая молекула лейкотриенов имеет свои особенности:
Тем не менее, каждая молекула лейкотриенов имеет свои особенности:
- ЛТА4 — его 4 двойные связи расположены следующим образом: первая — между 7 и 8 атомом углерода, вторая — между 9 и 10, третья — между 11 и 12, четвёртая — между 14 и 15. Кроме того, к 5 и 6 атомам углерода присоединяется одна эпоксидная группа.
- ЛТВ4 — его 4 двойные связи расположены иначе: первая — между 6 и 7 атомом углерода, вторая — между 8 и 9, третья — между 10 и 11, четвёртая — между 14 и 15. Кроме того, к 5 и 13 атомам углерода присоединяются гидроксильные группы.
- ЛТС4 — также отличается расположением 4 двойных связей: первая — между 7 и 8 атомом углерода, вторая — между 9 и 10, третья — между 11 и 12, четвёртая — между 13 и 14. Кроме того, к 5-му атому углерода присоединяются гидроксильная группа, а к шестому глутатион, через сульфидную группу цистеина.
- ЛТD4 — очень похож на лейкотриен С4, но он образуется при отщеплении от глутатиона одной аминокислоты — глутамата.
 Поэтому его боковая пептидная цепочка именуется цистеинилглицином.
Поэтому его боковая пептидная цепочка именуется цистеинилглицином. - ЛТE4 — образутся из ЛТD4, после того как его пептидная цепь лишается ещё одной аминокислоты — глицина.
- ЛТF4 — очень похож на лейкотриен С4, но он образуется при отщеплении от глутатиона глицина. Поэтому его боковая пептидная цепочка именуется γ-глутамилцистеином).[1]
Таким образом, по химическому строению, можно выделить две группы лейкотриенов:
- 1 группа — «пептидные (цистеиновые) лейкотриены», к ним относят ЛТС4, ЛТD4, ЛТЕ4, ЛТF4.
- 2 группа — лейкотриены, без пептидов: ЛТА4, ЛТВ4.
Роль в организме
Лейкотриеновые рецепторы
Выделяют три основных типа рецепторов лейкотриенов.[2] Причём два из них модулируются «пептидными лейкотриенами»:
- «Пептидные лейкотриены» модулируют специфические рецепторы, сопряженные с G-белком. Их обозначают CysLT-R.
 В настоящее время выделяют 2 типа CysLT. Взаимодействие лейкотриенов с рецепторами 1 типа (CysLT1) определяет спектр их основных эффектов (бронхоспазм). Связывание ЛТ с рецепторами 2 типа (CysLT2) изменяет тонус и проницаемость сосудов.
В настоящее время выделяют 2 типа CysLT. Взаимодействие лейкотриенов с рецепторами 1 типа (CysLT1) определяет спектр их основных эффектов (бронхоспазм). Связывание ЛТ с рецепторами 2 типа (CysLT2) изменяет тонус и проницаемость сосудов. - Лейкотриен B4 модулирует другой тип рецепторов — BLT1- и BLT2-рецепторы (другое название LTB4-рецепторы).
Основные эффекты
- ЛТB4 — опосредует хемотаксис, экссудацию плазмы, сокращение паренхимы лёгких, участие в иммунных ответах.
- ЛТC4, ЛТD4, ЛТE4 являются основными компонентами МРСА, поэтому в первую очередь эта группа лейкотриенов относится к мощным бронхоконстрикторам. Также эти лейкотриены способны повышать тонус гладких мышц ЖКТ, опосредовать экссудацию плазмы и сокращение паренхимы лёгких.
Роль в патологии
- Лейкотриены участвуют в патогенезе бронхиальной астмы. Вместе с гистамином лейкотриены относятся к медиаторам ранней фазы аллергической реакции немедленного типа.
 В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм.
В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм.
- Лейкотриены вызывают очень неприятный аспириновый бронхоспазм, возникающий при приёме неселективных НПВС: аспирин и др.[3] Аспириновый бронхоспазм порождается следующим образом: ЦОГ, которую ингибируют НПВС, катализирует реакцию превращения арахидоновой кислоты в циклический эндопероксид ПГ h3. Это ведёт к тому, что синтез ПГ резко уменьшается, а на этом фоне преобладающими станут лейкотриены. Однако, активность фосфолипазы A2 остаётся неизменной, соответственно арахидоновой кислоты отщепляется от фосфолипидов цитоплазматической мембраны столько же, сколько и в норме. Если в физиологических условиях арахидоновая кислота равномерно распределялась, поступая на синтез и ПГ и ЛТ, то при ингибировании ЦОГ, она целиком и поностью будет поступать на синтез лейкотриенов. Таким образом, при использовании неселективных НПВС, в тканях человека будет не просто вакатное (лат.
 vacuus — пустой) преобладание ЛТ, но они будут синтезироваться интенсивнее, чем в норме. ЛТC4, ЛТD4, ЛТE4 входят в комплекс МРСА, которая порождает бронхоспазм.
vacuus — пустой) преобладание ЛТ, но они будут синтезироваться интенсивнее, чем в норме. ЛТC4, ЛТD4, ЛТE4 входят в комплекс МРСА, которая порождает бронхоспазм.
Возможности фармакологической коррекции эффектов
Сингуляр (Монтелукаст)
- В настоящее время разработаны и успешно используются антагонисты CysL-R1: монтелукаст, зафирлукаст и пранлукаст (последний не зарегистрирован в РФ). Препараты могут использоваться в виде монотерапии у больных лёгкой персистирующей бронхиальной астмой. У больных со среднетяжёлым и тяжёлым течением заболевания антагонисты CysLT-R1 используют в качестве дополнительной терапии в комбинации с ингаляционными глюкокортикоидами (ИГКС) с целью уменьшения дозы ИГКС и достижения полного контроля астмы. Отмечено также их положительное влияние на течение аспириновой БА у больных с непереносимостью нестероидных противовоспалительных препаратов.
- Созданы ингибиторы биосинтеза лейкотриенов, подавляющие активность фермента 5-ЛОГ: зилеутон.
 Установлено, что этот препарат оказывает бронхорасширяющее действие (его начало в течение 2-х часов, продолжительность — 5 часов после приема) и предупреждает развитие бронхоспазма, вызываемого аспирином и холодным воздухом.
Установлено, что этот препарат оказывает бронхорасширяющее действие (его начало в течение 2-х часов, продолжительность — 5 часов после приема) и предупреждает развитие бронхоспазма, вызываемого аспирином и холодным воздухом. - В экспериментах созданы блокаторы 5-ЛОГ-активирующего протеина и рецепторов ЛТB4.
Таким образом, можно выделить 4 точки приложения препаратов:
- Прямые ингибиторы 5-ЛОГ (зилеутон, Z-D2138, АВТ-761),
- Ингибиторы 5-ЛОГ-АП предупреждающие связывание этого мембраносвязанного белка с арахидоновой кислотой (МК-0591, МК-886, BAYxl005 и др.),
- Антагонисты CysLT-R (зафирлукаст, монтелукаст, пранлукаст и др.),
- Антагонисты рецепторов лейкотриенов В4 (U-75, 302).[4]
Примечания
- ↑ ЛЕЙКОТРИЕНЫ — Химическая энциклопедия.
- ↑ Голубев Л. А., Бабак С. Л., Григорьянц Г. А. Антагонисты леикотриеновых рецепторов в лечении бронхиальной астмы // Южно-Российский медицинский журнал.
 — 2001. — № 1-2.
— 2001. — № 1-2. - ↑ Княжеская Н. П. Аспириновая бронхиальная астма и антагонисты лейкотриенов // РМЖ. — 2000. — Т. 8. — № 12.
- ↑ Антилейкотриеновые препараты. Зилеутон.
Ссылки
- consilium-medicum.com
- chemport.ru
- xumuk.ru
Физиология, лейкотриены — StatPearls — Книжная полка NCBI
Книжная полка NCBI. Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2022 янв.
StatPearls [Интернет].
Показать подробности
Критерий поиска
Брайан Куццо; Сара Л. Лаппин.
Информация об авторе и организациях
Последнее обновление: 22 августа 2022 г.
Введение
Лейкотриены (LT) представляют собой группу медиаторов воспаления, принадлежащих к семейству эйкозаноидов. Их синтез, прежде всего лейкоцитами, стимулируется различными иммунологическими и неиммунологическими стимулами, в том числе антигенами, иммунными комплексами, комплементом, цитокинами, осмотическими факторами и загрязняющими веществами. Эти молекулы в совокупности служат множеству целей, направленных на усиление воспалительного каскада посредством изменения проницаемости сосудов, воздействия на лейкоциты и сокращения гладкой мускулатуры. В частности, бронхоконстрикция, возникающая в результате действия лейкотриенов, играет жизненно важную роль в патофизиологии астмы, что дает возможность использовать таргетную фармакотерапию для лечения астмы и подобных заболеваний.[1]
Их синтез, прежде всего лейкоцитами, стимулируется различными иммунологическими и неиммунологическими стимулами, в том числе антигенами, иммунными комплексами, комплементом, цитокинами, осмотическими факторами и загрязняющими веществами. Эти молекулы в совокупности служат множеству целей, направленных на усиление воспалительного каскада посредством изменения проницаемости сосудов, воздействия на лейкоциты и сокращения гладкой мускулатуры. В частности, бронхоконстрикция, возникающая в результате действия лейкотриенов, играет жизненно важную роль в патофизиологии астмы, что дает возможность использовать таргетную фармакотерапию для лечения астмы и подобных заболеваний.[1]
Клеточный
Синтез лейкотриенов в основном происходит в лейкоцитах. Различные лейкоциты, как правило, преимущественно продуцируют определенный лейкотриен, либо лейкотриен B (LTB), либо цистеиновый класс лейкотриенов. Нейтрофилы являются первичными синтезаторами LTB и продуцируют небольшое количество цистеиниллейкотриенов. Эозинофилы, базофилы и тучные клетки являются первичными продуцентами цистеиниллейкотриенов. У них минимальные мощности по производству LTB. Макрофаги и моноциты служат посредниками, обладая адекватной способностью продуцировать как LTB, так и цистеиниллейкотриены. Другие клетки обычно не продуцируют значительных уровней лейкотриенов, поскольку они часто не экспрессируют 5-липоксигеназу или белок, активирующий 5-липоксигеназу (FLAP). Однако клетки могут поглощать лейкотриен А (LTA), продуцируемый лейкоцитами, и затем синтезировать биоактивные лейкотриены, если они экспрессируют более отдаленные ферменты метаболического пути. Этот процесс получил название «трансцеллюлярный биосинтез».[1]
Эозинофилы, базофилы и тучные клетки являются первичными продуцентами цистеиниллейкотриенов. У них минимальные мощности по производству LTB. Макрофаги и моноциты служат посредниками, обладая адекватной способностью продуцировать как LTB, так и цистеиниллейкотриены. Другие клетки обычно не продуцируют значительных уровней лейкотриенов, поскольку они часто не экспрессируют 5-липоксигеназу или белок, активирующий 5-липоксигеназу (FLAP). Однако клетки могут поглощать лейкотриен А (LTA), продуцируемый лейкоцитами, и затем синтезировать биоактивные лейкотриены, если они экспрессируют более отдаленные ферменты метаболического пути. Этот процесс получил название «трансцеллюлярный биосинтез».[1]
Разработка
Лейкотриены синтезируются по 5-липоксигеназному пути метаболизма арахидоновой кислоты. Арахидоновая кислота представляет собой жирную кислоту, содержащуюся в фосфолипидах, составляющих клеточные мембраны. Когда поступает стимул, требующий выработки лейкотриенов, фосфолипиды в наших клеточных мембранах метаболизируются в арахидоновую кислоту с помощью фосфолипазы А (ФЛА). Затем на арахидоновую кислоту действует 5-липооксигеназа совместно с FLAP с образованием LTA. Внутри клетки LTA используется в качестве субстрата для производства LTB посредством гидролиза или лейкотриена C (LTC) посредством конъюгации с глутатионом. В этот момент LTB и LTC экспортируются из клетки с помощью отдельных транспортных белков. Внеклеточно LTC может впоследствии подвергаться гидролизу с образованием лейкотриена (LTE). LTC, LTD (промежуточное соединение в синтезе LTE) и LTE называются цистеинил-лейкотриенами.[1]
Затем на арахидоновую кислоту действует 5-липооксигеназа совместно с FLAP с образованием LTA. Внутри клетки LTA используется в качестве субстрата для производства LTB посредством гидролиза или лейкотриена C (LTC) посредством конъюгации с глутатионом. В этот момент LTB и LTC экспортируются из клетки с помощью отдельных транспортных белков. Внеклеточно LTC может впоследствии подвергаться гидролизу с образованием лейкотриена (LTE). LTC, LTD (промежуточное соединение в синтезе LTE) и LTE называются цистеинил-лейкотриенами.[1]
Механизм действия
Лейкотриены проявляют свои эффекты путем связывания рецепторов аутокринным или паракринным образом. Эти рецепторы представляют собой рецепторы, связанные с G-белком (GPCR), которые после связывания активируют G-белок. Лейкотриеновые рецепторы либо активируют белок Gq, что приводит к увеличению внутриклеточного кальция, либо белок Gi, что приводит к снижению внутриклеточного цАМФ. Затем любой из этих G-белков сигнализирует о каскаде киназных реакций, что приводит к изменениям как транскрипционной активности, так и клеточной подвижности.
Различные типы лейкотриенов проявляют как общие, так и отличительные эффекты. В общем, LTB и цистеиновые лейкотриены оказывают различное действие за счет связывания разных классов рецепторов. LTB связывается с B-лейкотриеновыми рецепторами 1 и 2 (BLT1 и BLT2) соответственно. LTB в первую очередь действует как мощный хемотаксический рецептор нейтрофилов. Это действие подчеркивает воспалительную природу лейкотриенов, так как нейтрофилы также являются первичными продуктами LTB. Цистеиниллейкотриены связываются с цистеиниллейкотриеновыми рецепторами типа 1 и типа 2 (cysLT1 и cysLT2 соответственно). cysLT1 в первую очередь опосредует изменения дыхательных путей, включая бронхоконстрикцию, отек дыхательных путей и секрецию слизи. cysLT2, с другой стороны, в основном является стимулятором воспаления, поскольку вызывает увеличение проницаемости сосудов и фиброз тканей, но мало влияет на дыхательные пути. Стоит отметить, что лейкотриен-опосредованное увеличение проницаемости сосудов в 3-4 раза сильнее, чем гистамин [2].
В совокупности различные типы лейкотриенов также оказывают общие эффекты. Лейкотриены способствуют перемещению почти всех типов лейкоцитов в ткани и усиливают эффекты Т-хелперов 2 типа. Кроме того, есть предположение, что лейкотриены также оказывают отрицательное инотропное влияние на сердце, стимулируют синтез простагландинов в макрофагах и вызывают сокращение гладкой мускулатуры желудочно-кишечного тракта.
Клиническое значение
Исследования показали, что лейкотриены играют решающую роль в некоторых заболеваниях, особенно в астме. Лейкотриены имеют несколько эффектов, которые приводят к возникновению симптомов астмы. Во-первых, они способствуют сужению бронхов, что приводит к сужению дыхательных путей. В связи с этим они также способствуют пролиферации гладкой мускулатуры, что приводит к повышенной реактивности при сужении дыхательных путей. Во-вторых, они способствуют рекрутированию лейкоцитов и последующему высвобождению цитокинов, что приводит к дальнейшему воспалению дыхательных путей. В-третьих, они действуют непосредственно на бокаловидные клетки дыхательных путей, способствуя секреции слизи. В совокупности эти действия вызывают многие симптомы, наблюдаемые при астме. Учитывая способность лейкотриенов приводить к ремоделированию дыхательных путей с увеличением пролиферации бокаловидных клеток и гладкой мускулатуры, было высказано предположение, что антилейкотриеновая терапия особенно полезна для пациентов с хронической астмой [3].
В-третьих, они действуют непосредственно на бокаловидные клетки дыхательных путей, способствуя секреции слизи. В совокупности эти действия вызывают многие симптомы, наблюдаемые при астме. Учитывая способность лейкотриенов приводить к ремоделированию дыхательных путей с увеличением пролиферации бокаловидных клеток и гладкой мускулатуры, было высказано предположение, что антилейкотриеновая терапия особенно полезна для пациентов с хронической астмой [3].
Показано, что помимо астмы лейкотриены играют роль в развитии сердечно-сосудистых заболеваний. Исследователи отметили, что атеросклеротические сосудистые поражения экспрессируют весь биохимический механизм, необходимый для производства лейкотриенов, включая 5-липооксигеназу, FLAP и другие дистальные ферменты, важные для синтеза лейкотриенов. Более того, уровень 5-липооксигеназы в атеросклеротических сосудах коррелирует с тяжестью заболевания. Основываясь на животных моделях, считается, что увеличение лейкотриенов способствует привлечению макрофагов, а также их дифференцировке в пенистые клетки. Во всем мире исследователи обнаружили, что несколько различных этнических популяций с вариантами генов, связанных с лейкотриенами, которые приводят к перепроизводству лейкотриенов, имеют повышенную частоту инсульта и инфаркта миокарда. Хотя антилейкотриеновая терапия в настоящее время не является стандартной при лечении сердечно-сосудистых заболеваний, появляется все больше данных, подтверждающих роль лейкотриенов в их патогенезе.[4]
Во всем мире исследователи обнаружили, что несколько различных этнических популяций с вариантами генов, связанных с лейкотриенами, которые приводят к перепроизводству лейкотриенов, имеют повышенную частоту инсульта и инфаркта миокарда. Хотя антилейкотриеновая терапия в настоящее время не является стандартной при лечении сердечно-сосудистых заболеваний, появляется все больше данных, подтверждающих роль лейкотриенов в их патогенезе.[4]
Наконец, лейкотриены связаны с различными видами рака. Хроническое воспаление приводит к повышенному риску некоторых видов рака. Например, хроническое воспаление, вызванное воспалительным заболеванием кишечника (ВЗК), по-видимому, способствует трансформации в колоректальную аденокарциному. У таких пациентов эти виды рака имеют повышенную экспрессию cysLT. Исследования также показывают, что LTD способствует активизации Bcl-2 , антиапоптотического белка, который способствует выживанию клеток. Подобные результаты также существуют для других видов рака, включая лейкемию, лимфомы, рак пищевода, легких и кожи. Эти злокачественные новообразования экспрессируют повышенное количество 5-липооксигеназы, FLAP и других ферментов пути синтеза лейкотриенов. Клеточные модели и исследования на животных показали, что антилейкотриеновая терапия снижает выживаемость раковых клеток и снижает заболеваемость некоторыми злокачественными новообразованиями.[1]
Эти злокачественные новообразования экспрессируют повышенное количество 5-липооксигеназы, FLAP и других ферментов пути синтеза лейкотриенов. Клеточные модели и исследования на животных показали, что антилейкотриеновая терапия снижает выживаемость раковых клеток и снижает заболеваемость некоторыми злокачественными новообразованиями.[1]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Peters-Golden M, Henderson WR. Лейкотриены. N Engl J Med. 2007 01 ноября; 357 (18): 1841-54. [PubMed: 17978293]
- 2.
Хаммарстрём С. Лейкотриены. Анну Рев Биохим. 1983; 52:355-77. [PubMed: 6311078]
- 3.
Montuschi P. Роль лейкотриенов и модификаторов лейкотриенов при астме. Фармацевтика (Базель). 2 июня 2010 г .; 3 (6): 1792-1811. [Бесплатная статья PMC: PMC4033953] [PubMed: 27713330]
- 4.

Colazzo F, Gelosa P, Tremoli E, Sironi L, Castiglioni L. Роль цистеиниловых лейкотриенов в патогенезе и развитии сердечно-сосудистых заболеваний. Медиаторы воспаления. 2017;2017:2432958. [Бесплатная статья PMC: PMC5592403] [PubMed: 28932020]
Copyright © 2022, StatPearls Publishing LLC.
Эта книга распространяется на условиях Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) ( http://creativecommons.org/licenses/by-nc-nd/4.0/ ), что позволяет другим распространять произведение при условии, что статья не изменена и не используется в коммерческих целях. Вам не требуется получать разрешение на распространение этой статьи при условии, что вы указываете автора и журнал.
Идентификатор книжной полки: NBK526114PMID: 30252370
- PubReader
- Печать просмотра
- СИТАЙТЕ на эту страницу
На этой странице
Связанная информация
Аналогичные статьи в PubMed
- Тезисы презентаций на собрании Ассоциации ученых-клиницистов 143 (rd) в Луисвилле, Кентукки, 11–14 мая 2022 г. [Ann Clin Lab Sci. 2022]
- Обзор [Роль пептидов-лейкотриенов при бронхиальной астме].[Nihon Yakurigaku Zasshi. 1998]
- Обзор Эпителиальная регуляция продукции эйкозаноидов при астме. [Pulm Pharmacol Ther. 2012]
- Обзор Лейкотриены как медиаторы обструкции дыхательных путей. [Am J Respir Crit Care Med. 1998]
- Обзор роли лейкотриенов в аллергических заболеваниях. [Allergol Int. 2015]
Просмотреть отзывы… Просмотреть все…
Последние действия
ClearTurn OffTurn On
Ваша активность в Интернете пуста.
Запись активности отключена.
Включить запись
Подробнее…
Физиология, лейкотриены — StatPearls — Книжная полка NCBI
Книжная полка NCBI. Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2022 янв.
StatPearls [Интернет].
Показать детали
Критерий поиска
Брайан Куццо; Сара Л. Лаппин.
Информация об авторе и организациях
Последнее обновление: 22 августа 2022 г.
Введение
Лейкотриены (ЛТ) представляют собой группу медиаторов воспаления, принадлежащих к семейству эйкозаноидов. Их синтез, в первую очередь лейкоцитами, стимулируется различными иммунологическими и неиммунологическими стимулами, в том числе антигенами, иммунными комплексами, комплементом, цитокинами, осмотическими факторами и загрязняющими веществами. Эти молекулы в совокупности служат множеству целей, направленных на усиление воспалительного каскада посредством изменения проницаемости сосудов, воздействия на лейкоциты и сокращения гладкой мускулатуры. В частности, бронхоконстрикция, возникающая в результате действия лейкотриенов, играет жизненно важную роль в патофизиологии астмы, что создает возможность использования таргетной фармакотерапии для лечения астмы и подобных заболеваний.[1]
Эти молекулы в совокупности служат множеству целей, направленных на усиление воспалительного каскада посредством изменения проницаемости сосудов, воздействия на лейкоциты и сокращения гладкой мускулатуры. В частности, бронхоконстрикция, возникающая в результате действия лейкотриенов, играет жизненно важную роль в патофизиологии астмы, что создает возможность использования таргетной фармакотерапии для лечения астмы и подобных заболеваний.[1]
Клеточный
Синтез лейкотриенов в основном происходит в лейкоцитах. Различные лейкоциты, как правило, преимущественно продуцируют определенный лейкотриен, либо лейкотриен B (LTB), либо цистеиновый класс лейкотриенов. Нейтрофилы являются первичными синтезаторами LTB и продуцируют небольшое количество цистеиниллейкотриенов. Эозинофилы, базофилы и тучные клетки являются первичными продуцентами цистеиниллейкотриенов. У них минимальные мощности по производству LTB. Макрофаги и моноциты служат посредниками, обладая адекватной способностью продуцировать как LTB, так и цистеиниллейкотриены. Другие клетки обычно не продуцируют значительных уровней лейкотриенов, поскольку они часто не экспрессируют 5-липоксигеназу или белок, активирующий 5-липоксигеназу (FLAP). Однако клетки могут поглощать лейкотриен А (LTA), продуцируемый лейкоцитами, и затем синтезировать биоактивные лейкотриены, если они экспрессируют более отдаленные ферменты метаболического пути. Этот процесс получил название «трансцеллюлярный биосинтез».[1]
Другие клетки обычно не продуцируют значительных уровней лейкотриенов, поскольку они часто не экспрессируют 5-липоксигеназу или белок, активирующий 5-липоксигеназу (FLAP). Однако клетки могут поглощать лейкотриен А (LTA), продуцируемый лейкоцитами, и затем синтезировать биоактивные лейкотриены, если они экспрессируют более отдаленные ферменты метаболического пути. Этот процесс получил название «трансцеллюлярный биосинтез».[1]
Разработка
Лейкотриены синтезируются по 5-липоксигеназному пути метаболизма арахидоновой кислоты. Арахидоновая кислота представляет собой жирную кислоту, содержащуюся в фосфолипидах, составляющих клеточные мембраны. Когда поступает стимул, требующий выработки лейкотриенов, фосфолипиды в наших клеточных мембранах метаболизируются в арахидоновую кислоту с помощью фосфолипазы А (ФЛА). Затем на арахидоновую кислоту действует 5-липооксигеназа совместно с FLAP с образованием LTA. Внутри клетки LTA используется в качестве субстрата для производства LTB посредством гидролиза или лейкотриена C (LTC) посредством конъюгации с глутатионом. В этот момент LTB и LTC экспортируются из клетки с помощью отдельных транспортных белков. Внеклеточно LTC может впоследствии подвергаться гидролизу с образованием лейкотриена (LTE). LTC, LTD (промежуточное соединение в синтезе LTE) и LTE называются цистеинил-лейкотриенами.[1]
В этот момент LTB и LTC экспортируются из клетки с помощью отдельных транспортных белков. Внеклеточно LTC может впоследствии подвергаться гидролизу с образованием лейкотриена (LTE). LTC, LTD (промежуточное соединение в синтезе LTE) и LTE называются цистеинил-лейкотриенами.[1]
Механизм действия
Лейкотриены проявляют свои эффекты путем связывания рецепторов аутокринным или паракринным образом. Эти рецепторы представляют собой рецепторы, связанные с G-белком (GPCR), которые после связывания активируют G-белок. Лейкотриеновые рецепторы либо активируют белок Gq, что приводит к увеличению внутриклеточного кальция, либо белок Gi, что приводит к снижению внутриклеточного цАМФ. Затем любой из этих G-белков сигнализирует о каскаде киназных реакций, что приводит к изменениям как транскрипционной активности, так и клеточной подвижности.
Различные типы лейкотриенов проявляют как общие, так и отличительные эффекты. В общем, LTB и цистеиновые лейкотриены оказывают различное действие за счет связывания разных классов рецепторов. LTB связывается с B-лейкотриеновыми рецепторами 1 и 2 (BLT1 и BLT2) соответственно. LTB в первую очередь действует как мощный хемотаксический рецептор нейтрофилов. Это действие подчеркивает воспалительную природу лейкотриенов, так как нейтрофилы также являются первичными продуктами LTB. Цистеиниллейкотриены связываются с цистеиниллейкотриеновыми рецепторами типа 1 и типа 2 (cysLT1 и cysLT2 соответственно). cysLT1 в первую очередь опосредует изменения дыхательных путей, включая бронхоконстрикцию, отек дыхательных путей и секрецию слизи. cysLT2, с другой стороны, в основном является стимулятором воспаления, поскольку вызывает увеличение проницаемости сосудов и фиброз тканей, но мало влияет на дыхательные пути. Стоит отметить, что лейкотриен-опосредованное увеличение проницаемости сосудов в 3-4 раза сильнее, чем гистамин [2].
LTB связывается с B-лейкотриеновыми рецепторами 1 и 2 (BLT1 и BLT2) соответственно. LTB в первую очередь действует как мощный хемотаксический рецептор нейтрофилов. Это действие подчеркивает воспалительную природу лейкотриенов, так как нейтрофилы также являются первичными продуктами LTB. Цистеиниллейкотриены связываются с цистеиниллейкотриеновыми рецепторами типа 1 и типа 2 (cysLT1 и cysLT2 соответственно). cysLT1 в первую очередь опосредует изменения дыхательных путей, включая бронхоконстрикцию, отек дыхательных путей и секрецию слизи. cysLT2, с другой стороны, в основном является стимулятором воспаления, поскольку вызывает увеличение проницаемости сосудов и фиброз тканей, но мало влияет на дыхательные пути. Стоит отметить, что лейкотриен-опосредованное увеличение проницаемости сосудов в 3-4 раза сильнее, чем гистамин [2].
В совокупности различные типы лейкотриенов также оказывают общие эффекты. Лейкотриены способствуют перемещению почти всех типов лейкоцитов в ткани и усиливают эффекты Т-хелперов 2 типа. Кроме того, есть предположение, что лейкотриены также оказывают отрицательное инотропное влияние на сердце, стимулируют синтез простагландинов в макрофагах и вызывают сокращение гладкой мускулатуры желудочно-кишечного тракта.
Кроме того, есть предположение, что лейкотриены также оказывают отрицательное инотропное влияние на сердце, стимулируют синтез простагландинов в макрофагах и вызывают сокращение гладкой мускулатуры желудочно-кишечного тракта.
Клиническое значение
Исследования показали, что лейкотриены играют решающую роль в некоторых заболеваниях, особенно в астме. Лейкотриены имеют несколько эффектов, которые приводят к возникновению симптомов астмы. Во-первых, они способствуют сужению бронхов, что приводит к сужению дыхательных путей. В связи с этим они также способствуют пролиферации гладкой мускулатуры, что приводит к повышенной реактивности при сужении дыхательных путей. Во-вторых, они способствуют рекрутированию лейкоцитов и последующему высвобождению цитокинов, что приводит к дальнейшему воспалению дыхательных путей. В-третьих, они действуют непосредственно на бокаловидные клетки дыхательных путей, способствуя секреции слизи. В совокупности эти действия вызывают многие симптомы, наблюдаемые при астме. Учитывая способность лейкотриенов приводить к ремоделированию дыхательных путей с увеличением пролиферации бокаловидных клеток и гладкой мускулатуры, было высказано предположение, что антилейкотриеновая терапия особенно полезна для пациентов с хронической астмой [3].
Учитывая способность лейкотриенов приводить к ремоделированию дыхательных путей с увеличением пролиферации бокаловидных клеток и гладкой мускулатуры, было высказано предположение, что антилейкотриеновая терапия особенно полезна для пациентов с хронической астмой [3].
Показано, что помимо астмы лейкотриены играют роль в развитии сердечно-сосудистых заболеваний. Исследователи отметили, что атеросклеротические сосудистые поражения экспрессируют весь биохимический механизм, необходимый для производства лейкотриенов, включая 5-липооксигеназу, FLAP и другие дистальные ферменты, важные для синтеза лейкотриенов. Более того, уровень 5-липооксигеназы в атеросклеротических сосудах коррелирует с тяжестью заболевания. Основываясь на животных моделях, считается, что увеличение лейкотриенов способствует привлечению макрофагов, а также их дифференцировке в пенистые клетки. Во всем мире исследователи обнаружили, что несколько различных этнических популяций с вариантами генов, связанных с лейкотриенами, которые приводят к перепроизводству лейкотриенов, имеют повышенную частоту инсульта и инфаркта миокарда. Хотя антилейкотриеновая терапия в настоящее время не является стандартной при лечении сердечно-сосудистых заболеваний, появляется все больше данных, подтверждающих роль лейкотриенов в их патогенезе.[4]
Хотя антилейкотриеновая терапия в настоящее время не является стандартной при лечении сердечно-сосудистых заболеваний, появляется все больше данных, подтверждающих роль лейкотриенов в их патогенезе.[4]
Наконец, лейкотриены связаны с различными видами рака. Хроническое воспаление приводит к повышенному риску некоторых видов рака. Например, хроническое воспаление, вызванное воспалительным заболеванием кишечника (ВЗК), по-видимому, способствует трансформации в колоректальную аденокарциному. У таких пациентов эти виды рака имеют повышенную экспрессию cysLT. Исследования также показывают, что LTD способствует активизации Bcl-2 , антиапоптотического белка, который способствует выживанию клеток. Подобные результаты также существуют для других видов рака, включая лейкемию, лимфомы, рак пищевода, легких и кожи. Эти злокачественные новообразования экспрессируют повышенное количество 5-липооксигеназы, FLAP и других ферментов пути синтеза лейкотриенов. Клеточные модели и исследования на животных показали, что антилейкотриеновая терапия снижает выживаемость раковых клеток и снижает заболеваемость некоторыми злокачественными новообразованиями. [1]
[1]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Peters-Golden M, Henderson WR. Лейкотриены. N Engl J Med. 2007 01 ноября; 357 (18): 1841-54. [PubMed: 17978293]
- 2.
Хаммарстрём С. Лейкотриены. Анну Рев Биохим. 1983; 52:355-77. [PubMed: 6311078]
- 3.
Montuschi P. Роль лейкотриенов и модификаторов лейкотриенов при астме. Фармацевтика (Базель). 2 июня 2010 г .; 3 (6): 1792-1811. [Бесплатная статья PMC: PMC4033953] [PubMed: 27713330]
- 4.
Colazzo F, Gelosa P, Tremoli E, Sironi L, Castiglioni L. Роль цистеиниловых лейкотриенов в патогенезе и развитии сердечно-сосудистых заболеваний. Медиаторы воспаления. 2017;2017:2432958. [Бесплатная статья PMC: PMC5592403] [PubMed: 28932020]
Copyright © 2022, StatPearls Publishing LLC.
Эта книга распространяется на условиях Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) ( http://creativecommons.org/licenses/by-nc-nd/4.0/ ), что позволяет другим распространять произведение при условии, что статья не изменена и не используется в коммерческих целях. Вам не требуется получать разрешение на распространение этой статьи при условии, что вы указываете автора и журнал.
Идентификатор книжной полки: NBK526114PMID: 30252370
- PubReader
- Печать просмотра
- СИТАЙТЕ на эту страницу
На этой странице
- Введение
- Cellular
- Development
- Meanism
- CLINCICAL CLINICAL.
Связанная информация
Аналогичные статьи в PubMed
- Тезисы презентаций на собрании Ассоциации ученых-клиницистов 143 (rd) в Луисвилле, Кентукки, 11–14 мая 2022 г.

- Тезисы презентаций на собрании Ассоциации ученых-клиницистов 143 (rd) в Луисвилле, Кентукки, 11–14 мая 2022 г.
