Туберкулез у ВИЧ-инфицированных пациентов — Витебский государственный ордена Дружбы народов медицинский университет
Заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ), в настоящее время является одной из главных угроз здоровью населения земли и вполне справедливо названо «чумой XX века». Впервые обнаруженное в странах южнее Сахары в середине XX в. оно в большей или меньшей мере поразило все страны современного мира. В странах с высокой инфицированностью населения ВИЧ более 40% больных туберкулезом оказываются также и ВИЧ-инфицированными.
По последним материалам Европейского регионального бюро ВОЗ заболеваемость туберкулезом в сочетании со СПИДом на 20% выше распространена среди наркоманов. Лица, инфицированные одновременно ВИЧ и туберкулезом, подвержены наиболее высокому риску. У них ежегодная вероятность развития туберкулеза составляет 5–10%, в то время как у остального населения подобная вероятность не превышает 10% на протяжении всей жизни. По прогнозам ВОЗ, заболеваемость туберкулезом может увеличиться в 3 раза, если 10% взрослого населения страны будет инфицировано ВИЧ.
Закономерность подобного сочетания объясняется, прежде всего, преимущественным распространением этих заболеваний среди одних и тех же контингентов: заключенных, наркоманов и асоциальных групп населения. Повышенной опасности подвержены также работники медицинских учреждений и обитатели приютов. Распространение ВИЧ-инфекции внесло радикальные изменения в эпидемиологию туберкулеза. Именно эта инфекция стала одним из факторов нарастания эпидемии туберкулеза в мире. Создавшаяся ситуация требует переосмысливания стратегии борьбы с туберкулезом, включая его профилактику и необходимость вакцинации, а также соотношения между первичным заражением и реактивацией приобретенной ранее инфекции.
Крайне быстро ВИЧ-инфекция распространяется и в нашей стране. Глубокий дефект клеточного иммунитета у пациентов с ВИЧ-инфекцией на поздних стадиях заболевания при инфицировании туберкулезом может обусловить тяжелое течение болезни. Поэтому при наличии у пациентов неуклонно прогрессирующих и распространенных форм туберкулеза, не поддающихся лечению, следует проявить настороженность в отношении ВИЧ-инфекции. Одним из факторов, объясняющих закономерность преимущественного сочетания туберкулеза и ВИЧ-инфекции, являются особенности механизмов патогенеза обоих заболеваний. Доказано, что ВИЧ поражает и приводит к гибели преимущественно Т-лимфоциты, особенно популяцию Т-хелперов (СD4+-клетки), которые играют ключевую роль в противотуберкулезном иммунитете.

Основными клиническими проявлениями туберкулеза на фоне ВИЧ-инфекции являются астения, постоянная или интермиттирующая лихорадка, длительный кашель, значительное снижение массы тела, диарея, увеличение лимфатических узлов, преимущественно шейных и подмышечных, реже паховых, плотной консистенции, бугристых, плохо смещающихся при пальпации. Выраженность клинического проявления туберкулеза у ВИЧ-инфицированных и пациентов с ВИЧ-инфекцией в значительной степени зависит от угнетения клеточного иммунитета. На начальной стадии, когда количество CD4+-лимфоцитов еще остается достаточно высоким, проявления туберкулеза могут быть самыми типичными и не отличаться от клинической и рентгенологической картины у ВИЧ — отрицательных пациентов.
В настоящее время назначение антиретровирусных препаратов становится необходимым элементом лечения туберкулеза с далеко зашедшими формами инфекции. Количество подобных антиретровирусных средств с каждым годом увеличивается, а эффективность их действия обнадеживает. Однако побочные реакции, преимущественно гепато — и гематоксические, при сочетании патологии встречаются значительно чаще.
Кафедра фтизиопульмонологии.
Туберкулез и ВИЧ
Эпидемиология.
Распространение ВИЧ-инфекции значительно осложнило и без того тяжелое положение с заболеваемостью туберкулёзом в большинстве развитых стран Европы и Северной Америки, а не только в развивающихся странах Африки и Латинской Америки. Неуклонное снижение показателей заболеваемости туберкулёзом, происходившее на протяжении последних десятилетий в США и Западной Европе, сменилось постепенным её подъемом, совпавшим именно с наступлением эпидемии ВИЧ-инфекции. В настоящее время обе эти инфекции — туберкулёз и СПИД — рассматриваются как закономерные спутники.
По данным Всемирной организации здравоохранения, в 2000 г. в мире было зарегистрировано более 8,7 млн новых случаев туберкулеза, в том числе в 7-12% это заболевание развилось у ВИЧ-инфицированных. За этот же год от туберкулеза умерло 2,3 млн человек, из них в 18% случаев — при сочетании туберкулеза с синдромом приобретенного иммунодефицита (СПИД).
За этот же год от туберкулеза умерло 2,3 млн человек, из них в 18% случаев — при сочетании туберкулеза с синдромом приобретенного иммунодефицита (СПИД).
Известно, что СПИД и туберкулез могут сочетаться в двух вариантах: 1. Туберкулез у больных СПИДом и ВИЧ-инфицированных; 2. СПИД и ВИЧ-инфицированность у больных туберкулезом на любом этапе развития болезни: у излечившихся, при обострении процесса и в активной фазе туберкулеза.У ВИЧ-инфицированных туберкулез развивается реже, чем у больных туберкулезом — ВИЧ-инфицирование. В России ВИЧ-инфекцию начали регистрировать с 1987 г. Тогда же начали создавать систему эпиднадзора за ВИЧ-инфекцией.
Клинические проявления.
Основными клиническими проявлениями туберкулеза на фоне ВИЧ-инфекции являются астения, постоянная или интермиттирующая лихорадка, длительный кашель, значительное снижение массы тела, диарея, увеличение лимфатических узлов, преимущественно шейных и подмышечных, реже паховых, имеющих плотную консистенцию, бугристых, плохо смещающихся при пальпации.
Лечение.
Обычно при лечении больных туберкулезом и СПИДом необходимо одновременное назначение противотуберкулезных и антиретровирусных препаратов. В последние годы все шире пропагандируется методика так называемой интенсивной атиретровирусной терапии (HAART), направленной на подавление активности ретровирусов, возбудителей СПИДа. Более высокая эффективность комплексной антиретровирусной и противотуберкулезной терапии объясняется восстановлением и нормализацией иммунных реакций организма.
Профилактика.
Вопросы о показаниях, методах и эффективности химиопрофилактики туберкулеза у ВИЧ-инфицированных лиц остаются нерешенными. Прежде всего неясны критерии отбора. Обычно рекомендуется назначение специфической химиопрофилактики ВИЧ-инфицированным лицам при вираже туберкулиновых проб и папуле размером 5 мм и более. Однако выявление подобной реакции бывает затруднительным из-за анергии. Другим показаниям к назначению химиопрофилактики у ВИЧ-инфицированных лиц является снижение уровня CD4-лимфоцитов до 200 в 1 мм3 или 100 в 1 мм3 крови.
COVID-19 и туберкулез: необходима глобальная солидарность
Сейчас, когда мир борется с глобальной пандемией новой коронавирусной инфекции, международная медицинская организация «Врачи без границ» / Médecins Sans Frontières (MSF) обеспокоена положением уязвимых групп населения по всему миру. Во Всемирный день борьбы с туберкулезом мы хотим привлечь внимание к положению людей, больных туберкулезом, — одной из групп, которых пандемия может коснуться сильнее остальных. Необходимо будет особое внимание для обеспечения беспрерывной профилактики, диагностики, лечения туберкулеза и ухода за больными по всему миру.
______________
Смертность от туберкулеза самая высокая среди инфекционных заболеваний. В 2018 году туберкулезом заболели около десяти миллионов людей, полтора миллиона человек умерли. Полмиллиона человек заболели лекарственно-устойчивыми формами, требующими дорогого лечения, которое вызывает множество побочных эффектов. Туберкулез – главная причина смертности среди людей, живущих с ВИЧ. Во многих странах, в том числе Индии и ЮАР, большое количество людей с сочетанной инфекцией туберкулеза и ВИЧ.
Во многих странах, в том числе Индии и ЮАР, большое количество людей с сочетанной инфекцией туберкулеза и ВИЧ.
Как и туберкулез, новая коронавирусная инфекция поражает легкие, и ее симптомы — кашель и повышенная температура — могут напоминать туберкулез. Есть вероятность, что люди с поражением легких, в частности, больные туберкулезом, или люди с ослабленным иммунитетом, как при высокой вирусной нагрузке на фоне ВИЧ, в случае заражения COVID-19 будут переносить коронавирусную инфекцию в более тяжелой форме. Кроме того, туберкулез распространен в густонаселенных районах, что повышает риск заражения коронавирусной инфекцией для больных туберкулезом, особенно в переполненных поселениях с плохим доступом к чистой воде и медицинской помощи.
Эта без того тревожная ситуация усугубится в случае перебоев в диагностике и лечении ВИЧ или туберкулеза. В связи с этим, MSF выражает поддержку позиции Всемирной организации здравоохранения, выраженной в информационном сообщении о стратегиях непрерывного оказания основных услуг: профилактики, диагностики, лечения и поддержки больных туберкулезом и его лекарственно-устойчивыми формами в период пандемии новой коронавирусной инфекции.
Системы здравоохранения, особенно в странах с ограниченными ресурсами, будут испытывать значительную нагрузку в связи с пандемией. Из прошлых примеров мы знаем, что в условиях ограниченного доступа к лекарствам, диагностике и лечению опасных для жизни болезней, в том числе туберкулеза, смертность от таких болезней возрастает. В Гвинее, одной из стран, оказавшихся в эпицентре эпидемии лихорадки Эбола в 2014-2015 гг., за сокращением объема медицинской помощи последовало сокращение выявляемости туберкулеза на 53 процента и двойной рост смертности от него в результате прямых и косвенных эффектов на противотуберкулезную помощь.
Вместе с глобальными мерами реагирования на эпидемию коронавирусной инфекции, органы здравоохранения, организации-партнеры и международные донорские организации должны предпринять все возможные усилия для поддержания основных услуг и сокращения рисков для уязвимых групп.
Нам понадобятся инновационные решения в области предоставления медицинской помощи, чтобы сократить риски, связанные с коронавирусной инфекцией, среди больных туберкулезом и людей, живущих с ВИЧ. Это подразумевает децентрализацию и амбулаторное лечение, доступность медицинской помощи на уровне общины и дистанционные модели лечения, в том числе телемедицину и использование мобильных приложений. Полностью пероральные режимы лечения лекарственно-устойчивого туберкулеза, которые рекомендует ВОЗ, должны быть внедрены безотлагательно, как и лечение при поддержке общины, чтобы сократить необходимость посещения медицинских учреждений.
Это подразумевает децентрализацию и амбулаторное лечение, доступность медицинской помощи на уровне общины и дистанционные модели лечения, в том числе телемедицину и использование мобильных приложений. Полностью пероральные режимы лечения лекарственно-устойчивого туберкулеза, которые рекомендует ВОЗ, должны быть внедрены безотлагательно, как и лечение при поддержке общины, чтобы сократить необходимость посещения медицинских учреждений.
Учитывая высокий риск тяжелого течения коронавирусной инфекции у больных туберкулезом, усилия по сокращению последствий пандемии должны включать обеспечение медицинского персонала и близких, обеспечивающих уход за больными, средствами индивидуальной защиты, диагностику коронавирусной инфекции и изоляцию при подозрении и подтверждении диагноза, чтобы предотвратить дальнейшее заражение.
Глобальную пандемию не победить без глобальной солидарности. Отказ от чрезмерного накопления запасов и запрета на экспорт поможет обеспечить все нуждающиеся страны основными лекарствами и материалами, в том числе средствами персональной защиты.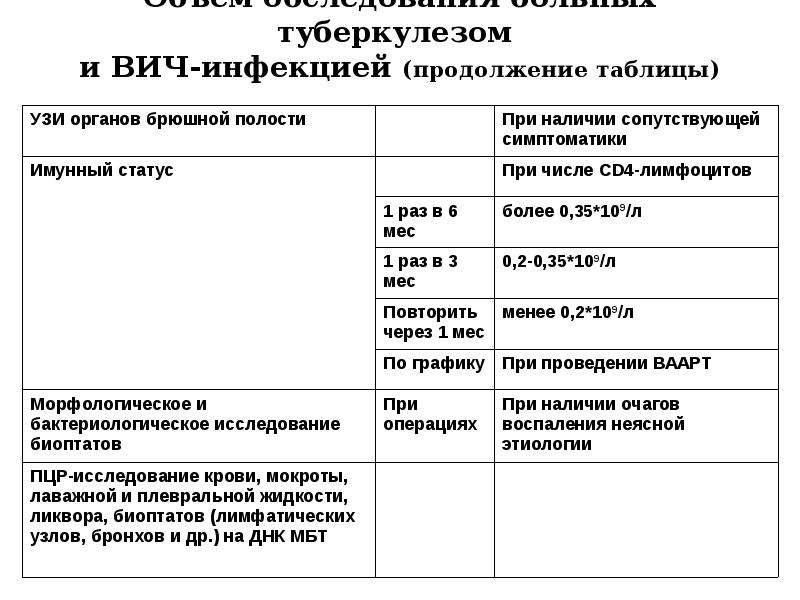 Такое сотрудничество и распределение ресурсов поможет сократить дополнительные риски для больных туберкулезом в случае нехватки лекарств или диагностики. Без такого подхода на страны с уязвимыми системами здравоохранения ляжет двойное бремя. Сейчас, когда страны ведут нелегкую борьбу с глобальной пандемией, мы должны сделать все зависящее от нас, чтобы предотвратить еще одну трагедию, которая может постичь уязвимые группы по всему миру, в том числе людей с ВИЧ и туберкулезом.
Такое сотрудничество и распределение ресурсов поможет сократить дополнительные риски для больных туберкулезом в случае нехватки лекарств или диагностики. Без такого подхода на страны с уязвимыми системами здравоохранения ляжет двойное бремя. Сейчас, когда страны ведут нелегкую борьбу с глобальной пандемией, мы должны сделать все зависящее от нас, чтобы предотвратить еще одну трагедию, которая может постичь уязвимые группы по всему миру, в том числе людей с ВИЧ и туберкулезом.
______________
MSF и туберкулез
MSF – одна из крупнейших неправительственных организаций, занимающихся лечением туберкулеза. Проекты MSF по лечению туберкулеза действуют в более чем 20 странах мира. В 2018 году в них были приняты на лечение более 16 500 пациентов с лекарственно-чувствительным и 2840 пациентов с лекарственно устойчивым туберкулезом. При поддержке партнеров мы проводим два клинических исследования (TB PRACTECAL и endTB), цель которых – найти эффективные и короткие курсы лечения без тяжелых побочных эффектов.
MSF и COVID-19
В большинстве стран, где работает MSF, мы действуем в координации с ВОЗ и службами здравоохранения, чтобы знать, какая от нас может понадобиться помощь в случае высокого количества больных новой коронавирусной инфекцией. Мы также проводим обучение по профилактике распространения инфекций для лечебных учреждений. На настоящий момент MSF начала оказывать помощь Бельгии, Италии, Франции, Испании и Ирану.
Главным приоритетом для MSF остается поддержание работы наших программ для особо уязвимых групп, которым мы оказываем помощь по всему миру.
ВИЧ-инфекция и её профилактика | Государственное бюджетное учреждение здравоохранения «Городская больница» г.Гая
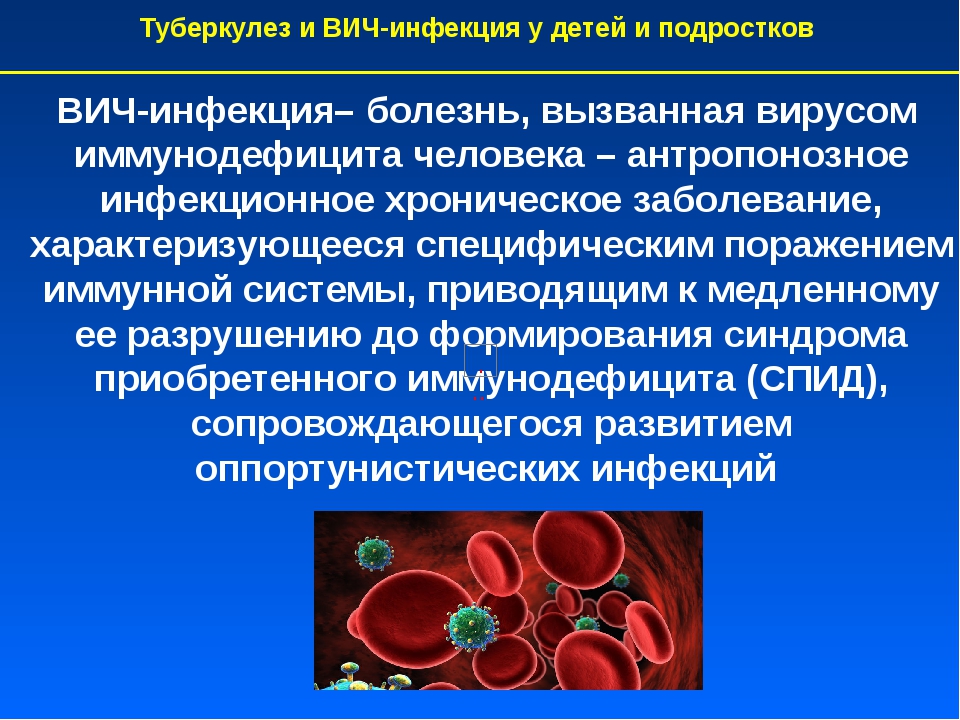
ВИЧ – вирус иммунодефицита человека, который приводит к развитию СПИДа (синдрому приобретенного иммунодефицита человека) – смертельно опасной болезни, разрушающей наш иммунитет.
СПИД – это не только прямая угроза нашему здоровью, но и нашей жизни! Как бы привлекательно ни выглядел незнакомый человек, предлагающий Вам стать его сексуальным партнером, Вы не можете знать, насколько безопасны эти отношения будут для Вашего здоровья. Человек, который поддерживает беспорядочные половые связи, является потенциальным носителем множества инфекций, передающихся половым путем. Будьте внимательны и осторожны при выборе партнера! Любой новый контакт может представлять угрозу для Вашего здоровья или жизни.
Человек, который поддерживает беспорядочные половые связи, является потенциальным носителем множества инфекций, передающихся половым путем. Будьте внимательны и осторожны при выборе партнера! Любой новый контакт может представлять угрозу для Вашего здоровья или жизни.
Опасно:
Случайный сексуальный контакт, даже в случае использования презерватива!
Внутривенное введение лекарственных препаратов или наркотиков с использованием нестерильных шприцев.
Татуировка и пирсинг.
Безопасно:
Рукопожатие, поцелуи, объятия и другие тактильные контакты.
Использование общей посуды и столовых приборов.
Использование общего мыла, стульчака унитаза, полотенца, одежды.
Любые медицинские манипуляции с использованием стерильных инструментов (в т.ч. одноразовых).
Источник ВИЧ-инфекции
1.Зараженный человек, находящийся в любой стадии болезни.
2. Вирусоноситель, человек без признаков болезни.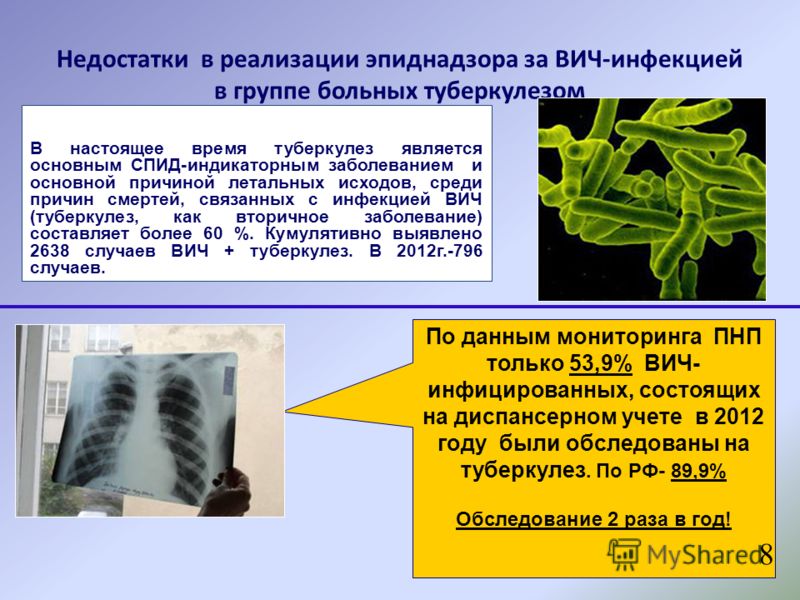
ВИЧ-инфекция относится к долго текущим заболеваниям, с момента заражения до момента проявления болезни может пройти от 2-3 до 10-15 лет. Естественно, что это усредненные показатели.
Поэтому своевременное выявление вируса иммунодефицита в крови позволяет предотвратить возникновение болезни, проведением профилактики.
Вирус иммунодефицита человека может находиться во всех биологических жидкостях: кровь, сперма, вагинальный секрет, грудное молоко.
Однако содержание вирусных частиц в биологических жидкостях различно, что и определяет их неодинаковое эпидемиологическое значение.
Пути передачи вируса иммунодефицита:
Передача ВИЧ воздушно-капельным, пищевым, водным, трансмиссивным путями не доказана.
1)Половой путь заражения
Является ведущим. Отсутствие требований к половому партнеру, незнание его ВИЧ-статуса, ведут к заражению ВИЧ-инфекцией.
У человека, не имеющего случайных половых контактов и не практикующего внутривенное введение наркотиков, риск заражения ВИЧ равен нулю.
Основой в предупреждении заражения ВИЧ должно быть:
- Безопасное и ответственное поведение, здоровый образ жизни.
- Исключение ранних половых отношений. Воздержание от половых отношений до вступления в брак. Соблюдение верности в браке.
- Использование презервативов при случайных половых контактах.
- Использование индивидуальных предметов личной гигиены.
2)Не менее значимым является вертикальный путь заражения, несущий в себе угрозу СПИДа будущему поколению.
Заражение ребенка от ВИЧ-инфицированной матери происходит при проникновении вируса от матери к плоду во время беременности, родов и при кормлении грудью. Поэтому решение о рождении ребенка принимает сама ВИЧ-инфицированная женщина, которая должна подумать о последствиях и принять правильное решение.
Врачи делают все возможное для того, чтобы ребенок родился здоровым.
Дети наше будущее. Каждая женщина хочет стать матерью. Родить здорового ребенка ВИЧ-инфицированной матерью позволяет прием во время беременности противовирусных препаратов, не имеющих побочного влияния на плод; и регулярное наблюдение как у врача гинеколога так и у врача инфекциониста. Кормление новорожденного грудным молоком не рекомендуется.
3) Парентеральный путь – «кровь в кровь» возможен при использовании нестерильных медицинских инструментов и шприцев. Основной фактор при этом пути передачи – употребление наркотиков. Возможность заражения в медицинских учреждениях минимальная.
Рекомендуется:
1)прокалывать уши только в косметических кабинетах,
2)делать татуировки в специальных кабинетах,
3) иметь собственные предметы личной гигиены: бритвы, маникюрные принадлежности и т.д.
Диагностика ВИЧ-инфекции
Лабораторные анализы являются основным звеном в диагностике ВИЧ-инфекции.
Обследоваться на ВИЧ-инфекцию вы можете обратившись:
1)в доврачебный кабинет №15 центральной районной больницы
2)в доврачебный кабинет №5 МСЧ
3)в инфекционный кабинет №22 центральной районной больницы
4)а также взять направление на сдачу анализа при посещении участкового терапевта
Здоровый образ жизни — это основа профилактики СПИДа.
Здоровый образ жизни включает в себя соблюдение правил личной гигиены, занятие физической культурой и закаливанием, правильное питание, воздержание от употребления алкоголя и наркотиков, умение справляться с различными переживаниями.
Профилактика ВИЧ-инфекции
В России в 1995 году принят Федеральный закон «О предупреждении распространения в Российской Федерации заболевания, вызванного вирусом иммунодефицита человека (ВИЧ-инфекции)» (от 30.03.95 №38-ФЗ).
Правовые аспекты проблемы ВИЧ/СПИД
Уголовный кодекс предусматривает наказание в виде лишения мест свободы сроком до трех лет за заведомое поставление другого лица в опасность заражения СПИДом; Лишение свободы сроком до семи лет за заражение другого лица СПИДом лицом, знавшим о наличии у него этой болезни.
Закон «О государственных пособиях семьям, воспитывающим детей» предусматривает пенсионное пособие на детей ВИЧ-инфицированным к больным СПИДом до 16 лет.
Законами «О здравоохранении», «О санитарном благополучии населения» гарантируется:
- предоставление бесплатных лекарств при лечении СПИДа;
- предоставление лечения в любом медицинском учреждении;
- недопущение увольнения с работы, отказа в приеме на работу, учебное заведение, детское учреждение ВИЧ-инфицированных лиц;
- право граждан на медицинское освидетельствование, в том числе анонимное;
- обеспечение медицинским учреждением безопасности и конфиденциальности обследования.
Для получения консультации и помощи по проблеме ВИЧ/СПИД — обращаться в инфекционный каб. — № 22 поликлиники №1 ГБУЗ «ГБ» г. Гая.
Врач инфекционист — Мурзина Р.Б.
Оппортунистические инфекции : ru
Существуют ряд серьезных заболеваний, относящихся к категории оппортунистических инфекций, которые развиваются только на фоне пораженной, ослабленной иммунной системы.
Заболевания, вызываемые условно-патогенными вирусами или клеточными организмами (бактерии, грибы, простейшие), обычно не приводят к болезни у здоровых особей (с нормальной иммунной системой). Если иммунная система работает нормально, то эти инфекции и болезни, либо вообще не развиваются, либо проявляются в неопасном для жизни виде.
Оппортунистические заболевания вызываются: Вирусами (Цитомегаловирус, Вирус Эпштейна — Барр), бактериями (Staphylococcus aureus, Streptococcus pyogenes, Pseudomonas aëruginosa, Acinetobacter baumanni, Clostridium difficile), грибами (Candida albicans, Aspergillus sp., Pneumocystis jirovecii, Cryptococcus neoformans, Histoplasma capsulatum), простейшими (Toxoplasma gondii, Cryptosporidium, внутриклеточными паразитами, к которым относятся возбудители рода Chlamydia.
Больше всего страдает иммунная система при поражении ВИЧ-инфекцией. Люди, с ослабленной иммунной системой проще заражаются оппортунистическими инфекциями! Оппортунистические инфекции часто становятся причиной смерти людей с ВИЧ и больных СПИДом.
Оппортунистическая инфекция может возникнуть не только у ВИЧ-положительных людей, но и у людей с резко ослабленным иммунитетом. К примеру, химиотерапия при различных формах онкологических заболеваний также способна значительно ослабить защитные функции организма.
Оппортунистические инфекции при ВИЧ вызываются разнообразными вирусами, бактериями или простейшими. Однако особо серьезную опасность представляет развитие грибковых инфекций, чаще всего вызванных кандидами (кандидоз) и аспергиллами (аспергиллез). Оппортунистические инфекции включают в себя герпес, кандидоз, вирус папилломы человека, криптококкоз, изопсориаз, малярию, криптоспоридиоз, лимфому, саркому Капоши, пневмоцистную пневмонию, токсоплазмоз, цитомегаловирус, туберкулез.
Наиболее распространенные из них:
Вирус папилломы человека (ВПЧ) –инфекция, развитие которой обусловлено вирусами, объединенными под названием «вирус папилломы человека». Довольно легко осуществляется передача ВПЧ при сексуальных контактах. Вирус обуславливает развитие генитальных бородавок, некоторые виды данного вируса вызывают рак шейки матки. Лекарственных средств от ВПЧ на современном этапе нет, имеются лишь различные методы удаления бородавок, терапии диспластических процессов шейки матки и ануса, которые вызываются ВПЧ.
Вирус обуславливает развитие генитальных бородавок, некоторые виды данного вируса вызывают рак шейки матки. Лекарственных средств от ВПЧ на современном этапе нет, имеются лишь различные методы удаления бородавок, терапии диспластических процессов шейки матки и ануса, которые вызываются ВПЧ.
Кандидоз часто локализуется в ротовой полости, гортани, легких и/или влагалище. Это заболевание зачастую возникает из-за того, что грибки составляют естественную микрофлору человеческого организма, а при снижении иммунитета они активизируются и вызывают развитие кандидоза. Лечится он противогрибковыми препаратами, однако часто возникают рецидивы.
Криптококковый менингит развивается при наличии клеток CD4 ниже 50. Агентом, вызывающим его, является грибок Cryptococcus, который попадает в организм человека при вдыхании пыли. Данному воздействию подвергаются очень многие, но здоровый организм справляется – и болезнь не развивается. Данный вид менингита не передается от человека к человеку.
Пневмоцистная пневмония развивается при попадании микроорганизма Pneumocystis carinii, который обитает в окружающей среде повсеместно. Распространение происходит воздушным путем. Возникновение пневмоцистной пневмонии происходит при наличии иммунного статуса у больного ниже 200 клеток/мл. Профилактика и лечение успешны при данной патологии, однако при отсутствии терапии в должном объеме возможен летальный исход.
Простой герпес вызывает вирус Herpes simplex: образуются язвочки на губах, также возможно их появление на гениталиях или анусе. У ВИЧ-положительных такие высыпания встречаются значительно чаще и выражены сильнее. Существующие препараты против герпеса снимают и предотвращают его проявления, но не вылечивают полностью, так как сохраняется циркуляция вируса в нервной ткани.
Передача токсоплазмоза происходит при употреблении полусырого мяса или от контакта с кошками. Данное заболевание не передается через людей и не развивается при наличии здоровой иммунной системы.
Оппортунистические инфекции необходимо лечить современными антибактериальными, противогрибковыми и противовирусными препараты, иногда на протяжении весьма длительного периода.
Профилактика заключается в том, чтобы избегать заражения возбудителем болезни (бактерии, грибки, вирусы, паразиты), заблаговременно начать принимать лекарства, чтобы подавить активность возбудителя болезни еще до появления симптомов. Некоторые возбудители оппортунистических инфекций живут в организме большинства людей, ничем себя не проявляя. И только при низком иммунном статусе они выходят из-под контроля и вызывают опасные для жизни болезни.
Только врач может назначить Вам необходимое обследование и лечение.
ВИЧ и туберкулез
Туберкулез является инфекцией, которая чаще всего становится причиной смерти людей, живущих с ВИЧ и имеющих низкий иммунный статус. ВИЧ и туберкулез так тесно переплетены, что их часто называют эпидемией в эпидемии. Эти заболевания способствуют взаимному развитию и усиливают друг друга.
Эти заболевания способствуют взаимному развитию и усиливают друг друга.
Связь ВИЧ и туберкулеза
Возбудителем туберкулеза является бацилла Коха (или микобактерия туберкулеза). Микобактерия туберкулеза передается от больного человека здоровому воздушно-капельным путем. Стоит заметить, что микобактерия живет в организме у 1/3 населения земного шара. У людей с высоким уровнем иммунного статуса туберкулез никак себя не проявляет в течение всей жизни. Болезнь развивается тогда, когда ослабевает иммунитет. У всех ВИЧ-положительных рано или поздно (в среднем через 5-15 лет после заражения) иммунитет начинает снижаться.
Что необходимо предпринимать ВИЧ-положительным, чтобы не заболеть туберкулезом?
– Регулярно 2 раза в год проходить обследование на туберкулез методом рентгенологического или флюорографического обследования органов грудной клетки. Эти исследования можно сделать в поликлинике по месту жительства.– Регулярно 2 раза в год проходить кожную пробу Манту.
 Это можно сделать в центре СПИДа.
Это можно сделать в центре СПИДа. – По назначению врача проходить дополнительные исследования (анализ мокроты, которая выделяется при кашле и/или внеочередное рентгенологическое исследование).
– Необходимо выполнять рекомендации по гигиене и питанию, которые помогут не заболеть туберкулезом. Врачи рекомендуют хорошо питаться, употребляя в пищу достаточное количество белка (мяса, рыба, молочные продукты), а также необходимо регулярно проводить влажную уборку и проветривание помещений, где Вы живете и работаете.
– Всем ВИЧ-положительным стоит избегать ситуаций общения с больными туберкулезом, а также нахождения в большом скоплении людей в плохо проветриваемом помещении. Туберкулез очень легко передается воздушно-капельным путем, один больной туберкулезом в год может заразить 10-15 человек. Особенно подвержены риску те, чей иммунный статус не высокий.
– Первые признаки туберкулеза: повышенная утомляемость, потливость по ночам, снижение аппетита, продолжительное повышение температуры, потеря веса.
 При появлении этих симптомов необходимо срочно обратиться к врачу-инфекционисту СПИД-центра с целью исключения диагноза туберкулез!
При появлении этих симптомов необходимо срочно обратиться к врачу-инфекционисту СПИД-центра с целью исключения диагноза туберкулез!Противотуберкулезные профилактические препараты:
– Учитывая высокий риск развития туберкулеза у людей с ослабленной иммунной системой, даже при отсутствии явного заболевания иногда назначаются противотуберкулезные профилактические препараты. Важно, что эти препараты необходимо пропивать курсом, назначенным врачом-фтизиатром. Прерванный курс профилактики впоследствии может привести к возникновению тяжелой лекарственно устойчивой трудноизлечимой формы туберкулеза!Лечение туберкулеза у ВИЧ-положительных:
– Лечение туберкулеза проводится в условиях стационара или дома. Решение об этом принимает врач-фтизиатр.
– Лечение туберкулеза, как правило, длится 3-8 месяцев.
– Доказано, что эффективность противотуберкулезной терапии выше на фоне лечения ВИЧ-инфекции антиретровирусными препаратами.
– Излечение от туберкулеза во многом зависит от отношения больного к режиму лечения. Не следует лечиться неполным набором препаратов, прерывать курс или преждевременно его прекращать. Нарушение режима лечения ведет к возникновению лекарственно устойчивой формы туберкулеза. Эта форма лечится в течение 24 месяцев 8 противотуберкулезными препаратами.
Не следует лечиться неполным набором препаратов, прерывать курс или преждевременно его прекращать. Нарушение режима лечения ведет к возникновению лекарственно устойчивой формы туберкулеза. Эта форма лечится в течение 24 месяцев 8 противотуберкулезными препаратами.
– Важно, что даже после излечения необходимо наблюдаться в противотуберкулезном диспансере по месту жительства.
Профилактика туберкулеза — Ханты–Мансийский клинический противотуберкулезный диспансер
Проблема ликвидации этого заболевания может быть решена с помощью профилактики туберкулеза, направленной на освобождение подрастающего поколения от возбудителя путем прививок, полного излечения больных, а также стимуляции биологического выздоровления ранее инфицированных взрослых лиц. Ближайшей и главной целью национальных программ здравоохранения многих стран мира является профилактика туберкулеза, что является основным способом снизить распространенности этого заболевания на основе прерывания процесса передачи возбудителя от больных людей здоровым.
Социальная направленность профилактики туберкулеза
Профилактика туберкулеза имеет социальную направленность, что заключается в проведении в масштабах государства мероприятий экономического и санитарного характера. К таким мероприятиям относятся:
- улучшение жилищно-бытовых условий жизни населения;
- оптимизация условий труда, предупреждение профессиональных заболеваний легких;
- оздоровление окружающей среды, включая борьбу с загрязнением атмосферного воздуха, водоемов, почвы, озеленение, соблюдение санитарных требований промышленной гигиены;
- улучшение качества питания;
- борьба с алкоголизмом, наркоманией, токсикоманией, курением;
- развитие физической культуры и спорта, культивирование здорового образа жизни;
- расширение сети детских оздоровительных и санаторно-курортных учреждений;
- проведение социальных и санитарно-ветеринарных мероприятий в местах промышленного производства животных и птиц.

Специфическая профилактика туберкулеза
Главная цель специфической профилактики туберкулеза (прививок против туберкулеза) — выработка у детей и взрослого населения до 30-летнего возраста специфического индивидуального и коллективного иммунитета. Это достигается с помощью вакцины БЦЖ — оригинального живого, но ослабленного штамма МБТ. Биологическая активность (иммуногенность) вакцины БЦЖ связана со способностью приживаться в организме привитых, размножаться в месте прививки и давать ответную специфическую реакцию, сопровождающуюся аллергической перестройкой организма, что и позволяет использовать ее для профилактики туберкулеза.
Вакцинацию проводят новорожденным на 4-7-й день жизни. Через несколько лет, в целях профилактики туберкулеза, осуществляется ревакцинация. В России она проводится клинически здоровым детям 7 лет (учащиеся 1-го класса), 12 лет (5-й класс), подросткам 16-17 лет (10-й класс), а затем через каждые 5-7 лет до 30-летнего возраста при наличии соответствующих показаний (контакт с больным туберкулезом или отсутствие инфицированности по результатам туберкулиновой пробы).
Профилактика туберкулеза предполагает отбор кандидатов для ревакцинации с помощью пробы Манту. Ревакцинируют только тех лиц, у которых реакция Манту оказалась отрицательной. Ревакцинация противопоказана: инфицированным туберкулезом лицам любого возраста, переболевшим, туберкулезом в прошлом, больным всеми острыми инфекционными заболеваниями, кожными, аллергическими болезнями, включая ревматизм, экссудативный диатез, а также эпилепсию.
Анализ ряда работ, посвященных оценке эффективности прививок против туберкулеза, показывает, что вакцинация БЦЖ снижает риск развития заболевания на 50%. Профилактика туберкулеза путем вакцинации наиболее эффективна в условиях высокого риска заражения, что имеет место в странах тропического пояса. Чем выше охват прививками, тем ниже заболеваемость туберкулезом. Профилактика туберкулеза путем прививок приводит к уменьшению показателя инфицированности, резкому снижению частоты развития туберкулезного менингита и смертности.
Химиопрофилактика
Особую роль для профилактики туберкулеза играют химиопрофилактика и массовые флюорографические и аллергологические обследования. ская туберкулиновая реакция перешла в гиперергическую;
ская туберкулиновая реакция перешла в гиперергическую;
Всем указанным категориям лиц профилактика туберкулеза путем химиопрофилактики проводится в весенне-осенний период (март-апрель и сентябрь-октябрь) или в другое время года в зависимости от «сезонности» проявлений инфекции и ее рецидивов. Необходимым условием является контроль за ее проведением со стороны медицинского работника, когда препараты выдаются больным на руки для приема в домашних условиях.
Флюорографические обследования
Большую эффективность для профилактики туберкулеза имеют массовые флюорографические обследования взрослого населения. Ежегодное обследование помогает своевременно выявлять больных туберкулезом людей. Флюорография в системе профилактики туберкулеза позволяет начать лечение на ранних этапах заболевания, что является важным условием его успешности. В зависимости от конкретных условий, материально-технической оснащенности органов здравоохранения в разных странах с целью профилактики туберкулеза проводится или сплошное, или выборочное обследование населения. При выборочном обследовании под наблюдением должны находиться группы лиц с высоким риском заражения и развития вторичного туберкулеза.
Противоэпидемические мероприятия по оздоровлению очагов туберкулеза
Важное значения для профилактики туберкулеза имеют противоэпидемические мероприятия по оздоровлению очагов туберкулеза. Эти мероприятия проводятся путем воздействия на все три звена эпидемического процесса: источник инфекции, пути передачи, и лиц, восприимчивых к туберкулезу.
Выделяют три группы очагов туберкулезной инфекции:
- Очаги с высокой степенью эпидемиологической опасности (отягощенные очаги), где проживают больные с массивным бактериовыделе-нивм или скудные выделители МБТ, но при наличии в очаге детей, подростков и беременных женщин.
- Эпидемиологически менее опасные очаги, в которых проживают больные со скудным выделением МБТ, отсутствуют дети, подростки и беременные женщины; сюда же включены очаги «условных» бактериовыде-лителей даже при наличии детей и подростков в их окружении.
- «Благополучные» очаги туберкулезной инфекции, сформированные «условными» бактериовыделителями при отсутствии в них детей, подростков, а также других отягощающих факторов. В эту же группу входят частные хозяйства в сельской местности, в которых выявлен больной туберкулезом скот.
Профилактика туберкулеза в очагах туберкулеза включает:
- госпитализацию больных туберкулезом и особенно явных выделителей МБТ сразу после установления-диагноза;
- проведение заключительной, а впоследствии — текущей дезинфекции;
- систематическое, длительное обследование лиц, находящихся в контакте с больными;
- вакцинацию, ревакцинацию и изоляцию контактных лиц на период выработки иммунитета;
- химиопрофилактику в отношении контактных лиц;
- обучение санитарно-гигиеническим навыкам больного и окружающих лиц;
- улучшение жилищно-бытовых условий семьи больного.

Профилактика туберкулеза в условиях производства
Наряду с противоэпидемическими и профилактическими мероприятиями в очагах по месту жительства больных, существенное значение в борьбе с туберкулезом имеет профилактика туберкулеза в условиях производства. Согласно санитарным правилам больные туберкулезом, у которых наблюдается выделение МБТ, не допускаются к работе на некоторых производствах и в ряде учреждений.
Перечень профессий, на которые распространяются запретительные меры, можно разделить на три категории:
Первая категория — работники детских учреждений дошкольного, школьного и санаторно-курортного профиля.
Вторая категория — это работники общественного питания и пищевой промышленности, которые непосредственно соприкасаются с сырьем, полуфабрикатами и готовой продукцией, а также осуществляют ремонт, очистку и дезинфекцию производственного оборудования. К данной группе относятся также работники аптек, фармацевтических заводов, занятых изготовлением и расфасовкой лекарственных средств, работники водопроводных сооружений, слесари-сантехники, работники предприятий, изготавливающих детские игрушки.
Третья категория — это работники сферы коммунальных услуг, в которой также необходима постоянная профилактика туберкулеза: банщики, парикмахеры, косметологи, лица, обеспечивающие стирку и выдачу белья в прачечных, проводники и кондукторы общественного транспорта, стюардессы и водители такси, работники спортивных сооружений, библиотек.
На предприятиях и в учреждениях, где работают больные туберкулезом, не относящиеся к вышеперечисленным категориям, и есть своя медсанчасть, также осуществляется профилактика туберкулеза: учет больных, контролируемое лечение на амбулаторном этапе, наблюдение за состоянием здоровья пациентов, учет и обследование производственных контактов, рациональное трудоустройство и др.
Методические материалы о профилактики туберкулёза:
Клиническое ведение туберкулеза и коинфекции ВИЧ-1
Реферат
Во многих частях мира самой распространенной серьезной оппортунистической инфекцией, которая встречается у людей, инфицированных ВИЧ-1, является туберкулез (ТБ). Коинфекция ВИЧ-1 изменяет естественное течение и клинические проявления и отрицательно влияет на исход туберкулеза. Тяжелое диссеминированное заболевание хорошо известно, но все больше осознается, что раннее заболевание, характеризующееся очень небольшими симптомами или отсутствием симптомов, также является обычным явлением.Чувствительность иммунодиагностических методов для выявления латентного туберкулеза у ВИЧ-1 инфицированных снижена.
Коинфекция ВИЧ-1 изменяет естественное течение и клинические проявления и отрицательно влияет на исход туберкулеза. Тяжелое диссеминированное заболевание хорошо известно, но все больше осознается, что раннее заболевание, характеризующееся очень небольшими симптомами или отсутствием симптомов, также является обычным явлением.Чувствительность иммунодиагностических методов для выявления латентного туберкулеза у ВИЧ-1 инфицированных снижена.
Химиопрофилактика туберкулеза, связанного с ВИЧ-1, эффективна, ее преимущества ограничиваются теми, которые имеют доказательства иммунной сенсибилизации и оказываются недолговечными в районах с высоким бременем туберкулеза. Хотя в последнее время произошел многообещающий прогресс в микробиологической диагностике туберкулеза, диагностика туберкулеза, ассоциированного с ВИЧ-1, остается трудной из-за более частых проявлений как отрицательного по мокроте или внелегочного заболевания.
Ведение пациентов с коинфекцией может быть сложным из-за дублирования токсичности и взаимодействия лекарств. Тем не менее, наблюдается консенсус в отношении того, что антиретровирусная терапия должна проводиться как можно скорее после начала лечения туберкулеза у лиц с коинфекцией ВИЧ-1. Следствием этого является увеличение частоты воспалительного синдрома восстановления иммунитета, патогенез и лечение которого плохо определены.
Тем не менее, наблюдается консенсус в отношении того, что антиретровирусная терапия должна проводиться как можно скорее после начала лечения туберкулеза у лиц с коинфекцией ВИЧ-1. Следствием этого является увеличение частоты воспалительного синдрома восстановления иммунитета, патогенез и лечение которого плохо определены.
Спустя 30 лет после того, как были впервые обнаружены прогрессивные иммуносупрессивные эффекты ВИЧ-1, туберкулез (ТБ) стал наиболее распространенной серьезной оппортунистической инфекцией.Это особенно верно в отношении Африки к югу от Сахары, где появление пандемии ВИЧ-1 серьезно подорвало борьбу с ТБ. Задача этой статьи — описать модифицирующее влияние инфекции ВИЧ-1 на клинические проявления и лечение ТБ у людей, инфицированных ВИЧ-1.
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ ТБ, СВЯЗАННОГО С ВИЧ-1
Лица с ВИЧ-1-инфекцией подвергаются повышенному риску активного ТБ из-за реактивации латентного ТБ и более быстрого прогрессирования заболевания после инфицирования ТБ. В эндемичных по туберкулезу условиях ежегодный риск активного туберкулеза достигает 30% у лиц с продвинутой стадией ВИЧ-1. 1. Клинические проявления и течение активной формы туберкулеза у ВИЧ-1-инфицированных изменяются, особенно у лиц с развитой иммуносупрессией. (Количество CD4 <200 клеток · мм −3 ): активный легочный ТБ может первоначально протекать бессимптомно; внелегочный туберкулез встречается чаще; клиническое течение ускорено; диагностировать сложнее; и смертность выше.
В эндемичных по туберкулезу условиях ежегодный риск активного туберкулеза достигает 30% у лиц с продвинутой стадией ВИЧ-1. 1. Клинические проявления и течение активной формы туберкулеза у ВИЧ-1-инфицированных изменяются, особенно у лиц с развитой иммуносупрессией. (Количество CD4 <200 клеток · мм −3 ): активный легочный ТБ может первоначально протекать бессимптомно; внелегочный туберкулез встречается чаще; клиническое течение ускорено; диагностировать сложнее; и смертность выше.
В Европе и Северной Америке активный ТБ преимущественно встречается у ВИЧ-1-инфицированных пациентов с низким уровнем CD4 (<200 клеток · мм −3 ) 2, тогда как в эндемичных по ТБ условиях, таких как страны Африки к югу от Сахары, он встречается по всему спектру количества CD4 3.В исследовании, проведенном на золотых приисках Южной Африки, риск туберкулеза удвоился даже в первый год после сероконверсии ВИЧ-1 4. Клинические проявления инфекции ВИЧ-1 зависят от степени иммунодефицита 5–7. У пациентов с CD4> 350 клеток · мм −3 клинические проявления незначительны по сравнению с пациентами, не инфицированными ВИЧ-1, тогда как у пациентов с количеством CD4 <200 клеток · мм −3 атипичные клинические и рентгенографические признаки и более быстрое прогрессирование встречается гораздо чаще 5, 6, 8, 9.ТБ с множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ) также являются новыми проблемами. МЛУ- и ШЛУ-ТБ связаны с высокой ранней смертностью в контексте инфекции ВИЧ-1 10, а инфекция ВИЧ-1 является независимым фактором риска смерти от лекарственно-устойчивого ТБ 11.
У пациентов с CD4> 350 клеток · мм −3 клинические проявления незначительны по сравнению с пациентами, не инфицированными ВИЧ-1, тогда как у пациентов с количеством CD4 <200 клеток · мм −3 атипичные клинические и рентгенографические признаки и более быстрое прогрессирование встречается гораздо чаще 5, 6, 8, 9.ТБ с множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ) также являются новыми проблемами. МЛУ- и ШЛУ-ТБ связаны с высокой ранней смертностью в контексте инфекции ВИЧ-1 10, а инфекция ВИЧ-1 является независимым фактором риска смерти от лекарственно-устойчивого ТБ 11.
ПРЕЗЕНТАЦИЯ ТБ ЛЕГКИХ
Легочный туберкулез остается наиболее частой формой активного туберкулеза у людей, инфицированных ВИЧ-1, даже у людей с низким числом CD4. Хотя клиническая картина туберкулеза легких отличается от проявления туберкулеза легких у пациентов, не инфицированных ВИЧ-1, наиболее частыми симптомами остаются кашель, лихорадка, ночная потливость и значительная потеря веса 12, 13. По сравнению с пациентами, не инфицированными ВИЧ-1, потеря веса и лихорадка встречаются чаще, тогда как кровохарканье менее распространено, и в некоторых исследованиях сообщается о снижении доли пациентов с кашлем 14, 15. Последние наблюдения относятся к снижению воспалительной реакции, что приводит к уменьшению легочной кавитация и эндобронхиальное поражение 8, 9.
По сравнению с пациентами, не инфицированными ВИЧ-1, потеря веса и лихорадка встречаются чаще, тогда как кровохарканье менее распространено, и в некоторых исследованиях сообщается о снижении доли пациентов с кашлем 14, 15. Последние наблюдения относятся к снижению воспалительной реакции, что приводит к уменьшению легочной кавитация и эндобронхиальное поражение 8, 9.
В то время как многие алгоритмы выявления случаев ТБ включают в свои критерии кашель продолжительностью ≥2–3 недель, важно отметить, что кашель продолжительностью менее 3 недель может быть характерной чертой у ВИЧ-1 инфицированных пациентов.В Бразилии у трети пациентов с туберкулезом легких был диагностирован кашель в течение ≤3 недель 16. В Малави среди пациентов (53% из которых были инфицированы ВИЧ-1) с кашлем продолжительностью <3 недель и отсутствие ответа на пероральные антибиотики, у 35% выявлен туберкулез легких. 17. В регионах с высокой заболеваемостью туберкулезом непрекращающийся кашель даже в течение <3 недель вызывает подозрение на активный туберкулез у ВИЧ-1-инфицированных.
Значительная потеря веса наблюдается у 85% пациентов из Африки при диагнозе ТБ 8.В крупном исследовании в Таиланде, посвященном скринингу на туберкулез у ВИЧ-1 инфицированных пациентов, потеря веса произошла у 50% пациентов, прошедших скрининг, и имело отрицательную прогностическую ценность 92% 18. Потеря веса чаще отмечалась у пациентов с CD4 <200 клеток · мм −3 по сравнению с пациентами с более высоким количеством CD4 в Бразилии 16. Это также наблюдалось в Африке, где потеря веса> 10% сильно коррелировала с CD4 <200 клеток · мм −3 3. Было обнаружено, что потеря веса позволяет различать туберкулез легких и другие легочные инфекции ( Pneumocystis jiroveci, пневмония и бактериальная пневмония) у ВИЧ-1-инфицированных пациентов (OR 3.6) в одном исследовании 14. В том же исследовании лихорадка в течение> 7 дней также была тесно связана с диагнозом ТБ (OR 3,9) 14.
АСИМПТОМАТИЧЕСКИЙ АКТИВНЫЙ ТБ ЛЕГКИХ
Обследования распространенности и интенсивные исследования по выявлению случаев, основанные на культуре мокроты, выявили феномен ВИЧ-1-инфицированных пациентов с положительным посевом ТБ при отсутствии симптомов 19–21. Swaminathan et al. 20 описал 10 таких пациентов (диапазон числа CD4 72–552). В ходе активного исследования по выявлению случаев в сообществе с высокой распространенностью ТБ и ВИЧ-1 в Южной Африке среди 762 взрослых включенных исследователей было обнаружено 12 случаев ранее недиагностированного ТБ с положительным результатом посева мокроты, девять из которых были инфицированы ВИЧ-1.Симптомы не были полезным методом скрининга на ТБ у этих пациентов 21. Четыре из 14 танзанийских ВИЧ-1 инфицированных пациентов с CD4 ≤200, у которых диагностирован туберкулез легких (положительный результат микроскопии мокроты или посева) во время скрининга для исследования вакцины, не имели симптомов с нормальной грудной клеткой. рентгенограмма 19. Это явление является одной из причин снижения чувствительности экранов симптомов у ВИЧ-1 инфицированных пациентов 19–21. В Южной Африке один или несколько случаев кашля в течение ≥2 недель, ночного потоотделения, лихорадки или значительной недавней потери веса были зарегистрированы только у 79% пациентов с диагнозом ТБ на основании положительного посева мокроты.
Swaminathan et al. 20 описал 10 таких пациентов (диапазон числа CD4 72–552). В ходе активного исследования по выявлению случаев в сообществе с высокой распространенностью ТБ и ВИЧ-1 в Южной Африке среди 762 взрослых включенных исследователей было обнаружено 12 случаев ранее недиагностированного ТБ с положительным результатом посева мокроты, девять из которых были инфицированы ВИЧ-1.Симптомы не были полезным методом скрининга на ТБ у этих пациентов 21. Четыре из 14 танзанийских ВИЧ-1 инфицированных пациентов с CD4 ≤200, у которых диагностирован туберкулез легких (положительный результат микроскопии мокроты или посева) во время скрининга для исследования вакцины, не имели симптомов с нормальной грудной клеткой. рентгенограмма 19. Это явление является одной из причин снижения чувствительности экранов симптомов у ВИЧ-1 инфицированных пациентов 19–21. В Южной Африке один или несколько случаев кашля в течение ≥2 недель, ночного потоотделения, лихорадки или значительной недавней потери веса были зарегистрированы только у 79% пациентов с диагнозом ТБ на основании положительного посева мокроты. Важно отметить, что 62% пациентов без ТБ имели один или несколько из этих симптомов, что свидетельствует о неоптимальной чувствительности и специфичности этого скрининга 22 симптомов. Напротив, недавнее исследование в Юго-Восточной Азии показало, что инструмент скрининга требует наличия любого из трех симптомов (кашель любой продолжительности, лихорадки любой продолжительности и ночного потоотделения в течение ≥3 недель в предшествующие 4 недели) показали хорошие результаты с чувствительностью 93% среди 1748 ВИЧ-1 инфицированных пациентов, 15% из которых имели ТБ с подтвержденным посевом. В исследование включены 18 больных внелегочным туберкулезом.Это предполагает скрининг на туберкулез у ВИЧ-1 инфицированных лиц в условиях высокого бремени туберкулеза; лучший подход — использовать скрининг симптомов в сочетании с индуцированным посевом мокроты. Однако это создает серьезные программные проблемы, и перекрестное заражение лабораторий также является проблемой в районах с высокой заболеваемостью туберкулезом 23, 24.
Важно отметить, что 62% пациентов без ТБ имели один или несколько из этих симптомов, что свидетельствует о неоптимальной чувствительности и специфичности этого скрининга 22 симптомов. Напротив, недавнее исследование в Юго-Восточной Азии показало, что инструмент скрининга требует наличия любого из трех симптомов (кашель любой продолжительности, лихорадки любой продолжительности и ночного потоотделения в течение ≥3 недель в предшествующие 4 недели) показали хорошие результаты с чувствительностью 93% среди 1748 ВИЧ-1 инфицированных пациентов, 15% из которых имели ТБ с подтвержденным посевом. В исследование включены 18 больных внелегочным туберкулезом.Это предполагает скрининг на туберкулез у ВИЧ-1 инфицированных лиц в условиях высокого бремени туберкулеза; лучший подход — использовать скрининг симптомов в сочетании с индуцированным посевом мокроты. Однако это создает серьезные программные проблемы, и перекрестное заражение лабораторий также является проблемой в районах с высокой заболеваемостью туберкулезом 23, 24. Скрининг симптомов можно повторять при каждом последующем посещении.
Скрининг симптомов можно повторять при каждом последующем посещении.
ВНЕШНИЙ ТБ
Внелегочный туберкулез и диссеминированный туберкулез (активный туберкулез в нескольких несмежных анатомических очагах) чаще встречаются у ВИЧ-1-инфицированных, особенно по мере того, как количество CD4 снижается на 25–28.Может произойти широкое распространение ТБ при запущенной стадии ВИЧ-1 29. Может быть сопутствующий легочный ТБ, а может и не быть. В Замбии среди больных туберкулезом, не инфицированных ВИЧ-1, 72% имели только легочный туберкулез, 16% только внелегочный туберкулез и 12% имели и то, и другое. Среди ВИЧ-1 инфицированных пациентов 40% имели только легочное заболевание, 34% — только внелегочное заболевание и 26% оба — 30. Более разительные различия между неинфицированными ВИЧ-1 и инфицированными пациентами были отмечены в обзоре, объединяющем данные нескольких исследований: ТБ легких. только один присутствовал в 80% против 30%, только внелегочный ТБ у 15%, против 20% и оба в 5%, против 50% 31. В США ВИЧ-1 инфицированные пациенты с ТБ с CD4> 300 имели явные доказательства внелегочного поражения в 28% случаев, в 44% — у пациентов с числом CD4 201–300, у 50% — с числом CD4 101–200 и 70% у лиц с числом CD4 ≤100 7.
В США ВИЧ-1 инфицированные пациенты с ТБ с CD4> 300 имели явные доказательства внелегочного поражения в 28% случаев, в 44% — у пациентов с числом CD4 201–300, у 50% — с числом CD4 101–200 и 70% у лиц с числом CD4 ≤100 7.
Сообщается, что наиболее частыми внелегочными участками у ВИЧ-1 инфицированных и неинфицированных являются лимфаденит (35%) и плевральный выпот (20%) 31, другие участки включают другие серозные поверхности (перикардиальные и перитонеальные), брюшные полости (включая печень, селезенка, поверхность брюшины и / или лимфатические узлы) и неврологические 8, 32.Повышенная плотность селезенки, отражающая множественные микроабсцессы и абдоминальную лимфаденопатию, — частые результаты ультразвукового исследования у ВИЧ-1-инфицированных пациентов с диссеминированным туберкулезом 33. Микобактериемия чаще встречается у ВИЧ-1 20, 34. В Южной Африке у 28% ВИЧ-1-инфицированных пациентов есть мазок. -отрицательный туберкулез имел положительные микобактериальные культуры крови. 35. Сообщалось, что микобактериемия более распространена по мере снижения числа CD4, и у пациентов с CD4 ≤100 микобактериемия регистрировалась до 49% 7. Пациенты с распространенным ВИЧ-1 и микобактериемией могут присутствует с синдромом сепсиса и септическим шоком 36, 37.Тяжелое истощение с сопутствующей диареей или без нее может быть единственным клиническим признаком диссеминированного ТБ у ВИЧ-1 6, 29; хотя у таких пациентов важно исследовать другие оппортунистические инфекции, связанные с ВИЧ-1, которые могут составлять более половины таких проявлений, а не туберкулез (таблица 1) 38.
35. Сообщалось, что микобактериемия более распространена по мере снижения числа CD4, и у пациентов с CD4 ≤100 микобактериемия регистрировалась до 49% 7. Пациенты с распространенным ВИЧ-1 и микобактериемией могут присутствует с синдромом сепсиса и септическим шоком 36, 37.Тяжелое истощение с сопутствующей диареей или без нее может быть единственным клиническим признаком диссеминированного ТБ у ВИЧ-1 6, 29; хотя у таких пациентов важно исследовать другие оппортунистические инфекции, связанные с ВИЧ-1, которые могут составлять более половины таких проявлений, а не туберкулез (таблица 1) 38.
Как и пациенты, не инфицированные ВИЧ-1, пациенты, инфицированные ВИЧ-1, могут иметь ряд неврологических проявлений: туберкулезный менингит (ТБМ), туберкулемы, радикуломиелит и туберкулезный абсцесс мозга 39.У пациентов с туберкулезом менингеальное поражение чаще встречается у ВИЧ-1-инфицированных 40, 41.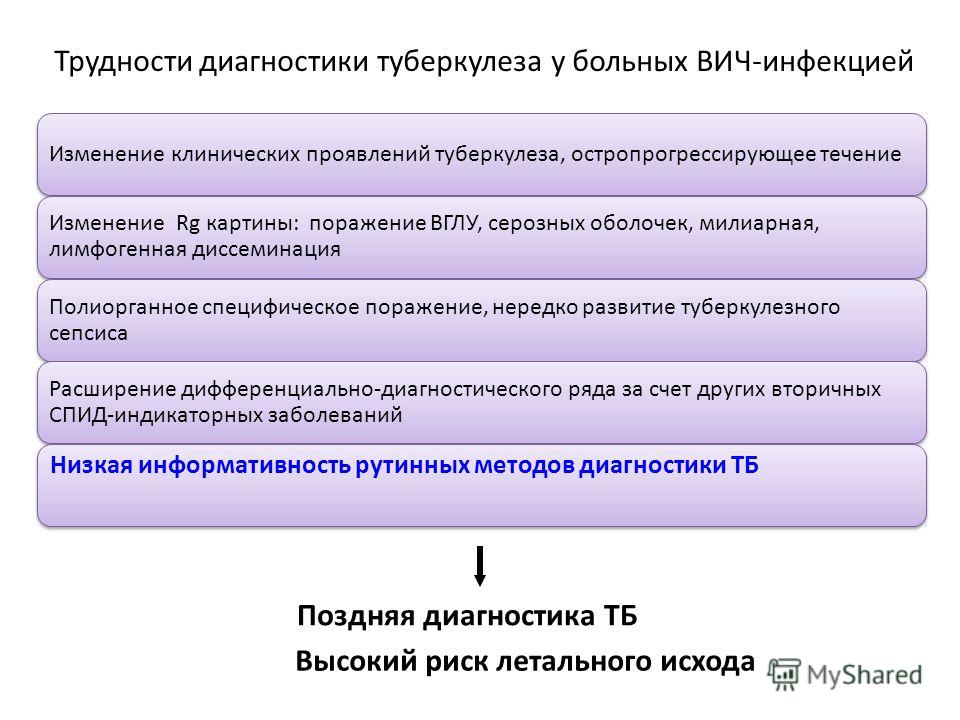 Одно исследование с участием 3710 случаев ТБ продемонстрировало менингеальное поражение у 6,4% ВИЧ-1-инфицированных пациентов по сравнению с 1,2% ВИЧ-1-неинфицированных. Пациенты 41. ТБМ обычно имеет сходные клинические данные и результаты спинномозговой жидкости (CSF) у ВИЧ-1-инфицированных и у неинфицированных ВИЧ-1 пациентов 42. Бесклеточные и полностью нормальные исследования CSF, однако, описаны в ВИЧ-1 -инфицированные пациенты с TBM 40, 43, 44.ВИЧ-1-инфицированные пациенты с ТБМ чаще болеют и экстраменингеальным ТБ 41, 42, 44.
Одно исследование с участием 3710 случаев ТБ продемонстрировало менингеальное поражение у 6,4% ВИЧ-1-инфицированных пациентов по сравнению с 1,2% ВИЧ-1-неинфицированных. Пациенты 41. ТБМ обычно имеет сходные клинические данные и результаты спинномозговой жидкости (CSF) у ВИЧ-1-инфицированных и у неинфицированных ВИЧ-1 пациентов 42. Бесклеточные и полностью нормальные исследования CSF, однако, описаны в ВИЧ-1 -инфицированные пациенты с TBM 40, 43, 44.ВИЧ-1-инфицированные пациенты с ТБМ чаще болеют и экстраменингеальным ТБ 41, 42, 44.
В то время как большинство внелегочных проявлений чаще встречается при ВИЧ-1, экстраспинальный туберкулезный артрит, по-видимому, встречается реже 45. Клинические признаки диссеминированного туберкулеза зависят от анатомического расположения 32, 46, а системные симптомы могут быть неспецифическими. Учитывая, что в 40–60% случаев диссеминированного туберкулеза сопутствует легочный туберкулез 8, у пациентов с признаками диссеминированного туберкулеза всегда следует отправлять мокроту на микроскопию и посев на туберкулез. ВИЧ-1 может модулировать осложнения внелегочного туберкулеза. Например, сообщается, что пациенты, инфицированные ВИЧ-1, менее подвержены развитию сужения как осложнения туберкулеза перикарда 47.
ВИЧ-1 может модулировать осложнения внелегочного туберкулеза. Например, сообщается, что пациенты, инфицированные ВИЧ-1, менее подвержены развитию сужения как осложнения туберкулеза перикарда 47.
БЫСТРЫЙ ПРОГРЕССИРОВАНИЕ И ВЫСШАЯ СМЕРТНОСТЬ
ТБ имеет тенденцию к более быстрому прогрессированию у людей, инфицированных ВИЧ-1, и может проявляться как острое заболевание 6, 48. Среди золотодобытчиков Южной Африки, которым был поставлен диагноз ТБ, средняя продолжительность положительного мазка мокроты до постановки диагноза была значительно короче для ВИЧ-1. -инфицированные по сравнению с неинфицированными больными ТБ (0.17 и 1,15 года соответственно) 48. Это указывает на более быстрое прогрессирование заболевания и последующий диагноз ТБ у ВИЧ-1-инфицированных пациентов по сравнению с больными ТБ, не инфицированными ВИЧ-1. Аналогичные результаты были отмечены в исследовании на уровне местных сообществ в Зимбабве: продолжительность заразности до постановки диагноза ТБ составляла 18 недель для ВИЧ-1-инфицированных по сравнению с 1 год для неинфицированных ВИЧ-1 пациентов 49. ТБ может также проявляться как острая инфекционная болезнь в сообществе. пневмония и должна рассматриваться у любого ВИЧ-1 инфицированного пациента с острым респираторным заболеванием (таблица 1) 50, 51.
ТБ может также проявляться как острая инфекционная болезнь в сообществе. пневмония и должна рассматриваться у любого ВИЧ-1 инфицированного пациента с острым респираторным заболеванием (таблица 1) 50, 51.
Несколько исследований, проведенных в Африке к югу от Сахары, продемонстрировали, что туберкулез присутствует примерно у половины ВИЧ-1 инфицированных на вскрытии , а во многих случаях ТБ не был диагностирован до смерти . Следовательно, крайне важно исследовать, диагностировать и быстро начинать лечение туберкулеза у пациентов, инфицированных ВИЧ-1, чтобы снизить заболеваемость, потребность в госпитализации и смертность, которая может возникнуть в результате быстрого ухудшения состояния 29, 52. Скорость ухудшения состояния у пациентов с ВИЧ-1 с туберкулезом, а также трудности с диагностикой (обсуждаются ниже).Во время лечения смертность среди ВИЧ-1 инфицированных пациентов 53–55 выше, как из-за запущенного туберкулеза на момент постановки диагноза, так и других оппортунистических инфекций. Среди южноафриканских золотодобытчиков шестимесячная смертность среди ВИЧ-1 инфицированных пациентов с туберкулезом составила 13% по сравнению с 0,5% среди неинфицированных ВИЧ-1 пациентов 53. В Бразилии уровень смертности среди ВИЧ-1 инфицированных больных туберкулезом составил 24,7 на 100 пациенто-лет. по сравнению с 2,5 на 100 пациенто-лет среди неинфицированных ВИЧ-1 пациентов. Хотя смертность среди пациентов, получающих антиретровирусную терапию (АРТ), значительно снизилась, она все же была значительно выше, чем у пациентов с ТБ, не инфицированных ВИЧ-1 (HR 6.6) 54.
Среди южноафриканских золотодобытчиков шестимесячная смертность среди ВИЧ-1 инфицированных пациентов с туберкулезом составила 13% по сравнению с 0,5% среди неинфицированных ВИЧ-1 пациентов 53. В Бразилии уровень смертности среди ВИЧ-1 инфицированных больных туберкулезом составил 24,7 на 100 пациенто-лет. по сравнению с 2,5 на 100 пациенто-лет среди неинфицированных ВИЧ-1 пациентов. Хотя смертность среди пациентов, получающих антиретровирусную терапию (АРТ), значительно снизилась, она все же была значительно выше, чем у пациентов с ТБ, не инфицированных ВИЧ-1 (HR 6.6) 54.
ДИАГНОСТИКА ТБ У ВИЧ-1 ИНФИЦИРОВАННЫХ ЛИЦ
Латентный ТБ у ВИЧ-1 инфицированных
Латентный ТБ выводится исключительно на основании свидетельств иммунологической сенсибилизации к микобактериальным белкам положительным туберкулиновым кожным тестом (TST) или положительным тестом на высвобождение гамма-интерферона (IGRA) при отсутствии симптомов или признаков активного заболевания 56, 57. Доказательства для латентности возникает из исторических исследований, в которых Mycobacterium tuberculosis было выделено post mortem из поражений у людей, в остальном здоровых 56. Из исследований TST сделан вывод, что одна треть населения мира страдает латентной формой туберкулеза. Это представляет собой огромный резервуар инфицированных людей, у которых потенциально может развиться активное заболевание. Однако некоторые особенности эпидемиологии туберкулеза, ассоциированного с ВИЧ-1, требуют модификации концепции латентного периода 58. Во-первых, люди, инфицированные ВИЧ-1, чаще и быстрее прогрессируют до заболевания после заражения, чем часто цитируемые 5–10% жизни. временной риск 4, 59–61. Годовой риск развития активного туберкулеза у ВИЧ-1 инфицированных составляет до 30% 1.Во-вторых, в случаях рецидива ТБ стало ясно, что это часто представляет собой повторное инфицирование, а не эндогенную реактивацию: это особенно характерно для сред с высокой заболеваемостью 62, 63. В-третьих, наличие значительной распространенности бессимптомной ранней ВИЧ-инфекции. -1-ассоциированный ТБ, как указано выше, указывает на то, что размножение бактерий является признаком минимально симптоматического заболевания 21, 48, 49, 59.
Из исследований TST сделан вывод, что одна треть населения мира страдает латентной формой туберкулеза. Это представляет собой огромный резервуар инфицированных людей, у которых потенциально может развиться активное заболевание. Однако некоторые особенности эпидемиологии туберкулеза, ассоциированного с ВИЧ-1, требуют модификации концепции латентного периода 58. Во-первых, люди, инфицированные ВИЧ-1, чаще и быстрее прогрессируют до заболевания после заражения, чем часто цитируемые 5–10% жизни. временной риск 4, 59–61. Годовой риск развития активного туберкулеза у ВИЧ-1 инфицированных составляет до 30% 1.Во-вторых, в случаях рецидива ТБ стало ясно, что это часто представляет собой повторное инфицирование, а не эндогенную реактивацию: это особенно характерно для сред с высокой заболеваемостью 62, 63. В-третьих, наличие значительной распространенности бессимптомной ранней ВИЧ-инфекции. -1-ассоциированный ТБ, как указано выше, указывает на то, что размножение бактерий является признаком минимально симптоматического заболевания 21, 48, 49, 59. На самом деле это всегда предполагалось, потому что изониазид (INH) убивает размножающиеся бациллы.
На самом деле это всегда предполагалось, потому что изониазид (INH) убивает размножающиеся бациллы.
ДИАГНОСТИКА ЛАТЕРНОЙ ТБ У ЛЮДЕЙ, ИНФИЦИРОВАННЫХ ВИЧ-1
Несмотря на недостатки, ТКП остается наиболее проверенным методом определения латентной инфекции ТБ и прогнозирования риска прогрессирования и пользы от профилактической терапии изониазидом (IPT). Недостатки TST широко обсуждались: ложноположительные результаты возникают из-за того, что реагент на основе очищенного производного белка содержит много антигенов, присутствующих в бацилле Кальметта – Герена (БЦЖ) и непатогенных микобактериях, а ложноотрицательные результаты возникают в случае иммунодефицитных, ранних стадий первичного туберкулеза и при распространенном туберкулезе 64.Тест не может отличить активную инфекцию от скрытой инфекции. Прием и чтение требуют двух посещений клиники, и иногда реакция может быть шрамом.
Ранние исследования установили, что у ВИЧ-1 инфицированных людей чувствительность TST заметно снижается, особенно когда количество CD4 снижается 65–67. При сравнении аналогичных ВИЧ-1-инфицированных и неинфицированных людей в районе с высокой заболеваемостью в Южной Африке 52% инфицированных ВИЧ-1 имели реакцию> 5 мм, тогда как 86% неинфицированных имели реакцию> 5 мм.Соответствующие цифры для обрезки 10 мм составили 49% и 83% соответственно 68.
При сравнении аналогичных ВИЧ-1-инфицированных и неинфицированных людей в районе с высокой заболеваемостью в Южной Африке 52% инфицированных ВИЧ-1 имели реакцию> 5 мм, тогда как 86% неинфицированных имели реакцию> 5 мм.Соответствующие цифры для обрезки 10 мм составили 49% и 83% соответственно 68.
Признавая эти недостатки TST, за последние 10 лет было разработано и коммерциализировано in vitro IGRA в качестве потенциальной замены. IGRA зависят от in vitro рестимуляции лимфоцитов антигенами, которые либо удалены из генома всех штаммов БЦЖ (ранее секретируемый антигенный белок-мишень 6 кДа и белок фильтрата культуры-10 69, 70), либо кодируются эволюционно недавней вставкой профага в геном современного патогенного M.tuberculosis (TB7.7, кодируемый Rv2654c 71). Хотя требуется лаборатория, способная производить культивирование клеток и ELISA, тесты IGRA имеют операционные преимущества перед TST, поскольку они требуют одного посещения пациента и дают количественный результат, который может оставаться актуальным в течение некоторого времени, тогда как пропущенное считывание TST означает, что тест может быть только проведен. повторяется. IGRA имеет относительно низкую вариабельность между наблюдателями и, если одновременно не проводится TST 72, повторное тестирование не увеличивает ответ.Существует консенсус, что IGRA обладают более высокой специфичностью для диагностики инфекции ТБ у лиц, вакцинированных БЦЖ 73. Как и TST, они имеют ограниченную способность различать активное заболевание и латентную инфекцию.
повторяется. IGRA имеет относительно низкую вариабельность между наблюдателями и, если одновременно не проводится TST 72, повторное тестирование не увеличивает ответ.Существует консенсус, что IGRA обладают более высокой специфичностью для диагностики инфекции ТБ у лиц, вакцинированных БЦЖ 73. Как и TST, они имеют ограниченную способность различать активное заболевание и латентную инфекцию.
Потенциальные преимущества тестирования IGRA подтолкнули к оценке этих тестов у ВИЧ-1 инфицированных людей с тремя актуальными целями. Во-первых, чувствительность IGRA к выявлению туберкулезной инфекции при ВИЧ-1 меньше, чем у TST? Во-вторых, могут ли тесты IGRA лучше прогнозировать последующий активный туберкулез и, таким образом, лучше определять назначение профилактической терапии? В-третьих, могут ли тесты IGRA помочь в диагностике активного туберкулеза, ассоциированного с ВИЧ-1? Однако в отношении латентного ТБ этим целям мешают следующие факторы.Во-первых, не существует «золотого стандарта» для латентного ТБ, поэтому в исследованиях, как правило, используется чувствительность для выявления ТБ с подтвержденным посевом (см. Ниже) в качестве косвенного показателя. Это может привести к переоценке чувствительности, потому что экспериментально и на людях установлено, что существует взаимосвязь между количеством бацилл и периферическим ответом на белки ESAT-6 и CFP-10 74–78. Поскольку ВИЧ-1-инфицированные люди с латентным ТБ предположительно имеют относительно низкое количество бациллов и ослабленный иммунный ответ, следует ожидать более низкой частоты положительных результатов у лиц с сильной иммуносупрессией.Второй фактор также необходимо учитывать при интерпретации различных результатов по этому вопросу. Несмотря на то, что термин IGRA цепляет, он подразумевает, что тесты являются общими и взаимозаменяемыми, а это не так. Важно отметить, что лабораторной базой для теста T-Spot.TB на основе ELISpot является фиксированное количество мононуклеарных клеток периферической крови, тогда как в тестах QuantiFERON используется цельная кровь. Поскольку количество CD4 + T-клеток снижается, выделение мононуклеарных клеток периферической крови может иметь тенденцию частично компенсировать это снижение, тогда как абсолютное количество клеток CD4 (на которое полагаются оба теста), очевидно, будет уменьшаться в цельной крови 79, 80.
Ниже) в качестве косвенного показателя. Это может привести к переоценке чувствительности, потому что экспериментально и на людях установлено, что существует взаимосвязь между количеством бацилл и периферическим ответом на белки ESAT-6 и CFP-10 74–78. Поскольку ВИЧ-1-инфицированные люди с латентным ТБ предположительно имеют относительно низкое количество бациллов и ослабленный иммунный ответ, следует ожидать более низкой частоты положительных результатов у лиц с сильной иммуносупрессией.Второй фактор также необходимо учитывать при интерпретации различных результатов по этому вопросу. Несмотря на то, что термин IGRA цепляет, он подразумевает, что тесты являются общими и взаимозаменяемыми, а это не так. Важно отметить, что лабораторной базой для теста T-Spot.TB на основе ELISpot является фиксированное количество мононуклеарных клеток периферической крови, тогда как в тестах QuantiFERON используется цельная кровь. Поскольку количество CD4 + T-клеток снижается, выделение мононуклеарных клеток периферической крови может иметь тенденцию частично компенсировать это снижение, тогда как абсолютное количество клеток CD4 (на которое полагаются оба теста), очевидно, будет уменьшаться в цельной крови 79, 80.
Лишь небольшая часть исследований IGRA включала людей, инфицированных ВИЧ-1, у которых может быть латентный туберкулез. Дизайн исследований заметно разнороден, и очень немногие исследования охватывают латентную инфекцию в условиях высокой заболеваемости. Тест T-Spot.TB изучается реже, чем тесты QuantiFERON. Однако из существующих исследований можно сделать несколько выводов. Во-первых, обычно наблюдается, что частота неопределенных анализов (из-за отрицательного ответа в лунке или пробирке с положительным контролем) увеличивается по мере того, как количество CD4 снижается (81–86).В нескольких исследованиях, в которых проводились трехсторонние сравнения «лицом к лицу», данные противоречат друг другу относительно того, сильнее ли этот эффект с помощью тестов QuantiFERON 68, 85 или для T-Spot.TB 86, 87. Это, безусловно, Дело в том, что тест T-Spot.TB требует более сложных лабораторных исследований. Почти все исследования ВИЧ-1 инфицированных людей сообщают, что согласие между IGRA и TST иногда бывает плохим и редко лучше, чем удовлетворительное, со значениями каппа в диапазоне 0,3–0,5 68, 83–87. Это несоответствие может иметь прогностическое значение, но очень трудно оценить, что лучше всего подходит для прогнозирования последующего туберкулеза.Только в одном исследовании сообщается о прогностической ценности исходного положительного теста IGRA для последующего туберкулеза у ВИЧ-1 инфицированных людей. Aichelberg et al. Компания 81 провела тестирование QuantiFERON Gold-in tube на 830 ВИЧ-1 инфицированных, посещающих клинику в Австрии. 44 оказались положительными, из них у семи был распространенный туберкулез. У троих из оставшихся 37 (и ни у одного из них не было отрицательного результата) за время наблюдения развился бактериологически недоказанный туберкулез. Трудно избежать часто сделанного вывода о том, что потребуются дальнейшие исследования, особенно в условиях высокой заболеваемости, чтобы определить, могут ли эти тесты стать рутинной частью лечения ВИЧ-1 инфицированных лиц без признаков активной формы ТБ.
Это несоответствие может иметь прогностическое значение, но очень трудно оценить, что лучше всего подходит для прогнозирования последующего туберкулеза.Только в одном исследовании сообщается о прогностической ценности исходного положительного теста IGRA для последующего туберкулеза у ВИЧ-1 инфицированных людей. Aichelberg et al. Компания 81 провела тестирование QuantiFERON Gold-in tube на 830 ВИЧ-1 инфицированных, посещающих клинику в Австрии. 44 оказались положительными, из них у семи был распространенный туберкулез. У троих из оставшихся 37 (и ни у одного из них не было отрицательного результата) за время наблюдения развился бактериологически недоказанный туберкулез. Трудно избежать часто сделанного вывода о том, что потребуются дальнейшие исследования, особенно в условиях высокой заболеваемости, чтобы определить, могут ли эти тесты стать рутинной частью лечения ВИЧ-1 инфицированных лиц без признаков активной формы ТБ.
ДИАГНОСТИКА АКТИВНОГО ТБ
В диагностике ТБ за последние 10–15 лет произошли значительные инновации, и сейчас есть оптимизм в отношении возможности внедрения некоторых новых тестов, которые, как мы надеемся, приведут к лучшим результатам для здоровья. Необходимо проводить важное различие между тестами, применяемыми в национальных и региональных справочных лабораториях, и тестами, предназначенными для оказания медицинской помощи, что является наиболее сложным сценарием. Сравнительный анализ новых методов диагностики активного туберкулеза руководствуется золотым стандартом диагностики активного туберкулеза, которым является микробиологическая изоляция M.Туберкулез . Однако обнаружение кислотоустойчивых бацилл с помощью микроскопии остается единственным доступным лабораторным тестом для диагностики активного туберкулеза в большинстве стран с ограниченными ресурсами. Микроскопия мокроты недорога, высокоспецифична и позволяет выявлять наиболее заразных пациентов 88. Однако микроскопия мокроты нечувствительна: эта особенность усугубляется сочетанной инфекцией ВИЧ-1, поскольку увеличивается частота случаев отрицательного мазка и положительного посева (рис. 1) 64, 88, 103. Флуоресцентная микроскопия кажется более чувствительной, чем обычная микроскопия, и имеет аналогичную специфичность 104, но не так широко изучалась у ВИЧ-1-инфицированных людей.
Необходимо проводить важное различие между тестами, применяемыми в национальных и региональных справочных лабораториях, и тестами, предназначенными для оказания медицинской помощи, что является наиболее сложным сценарием. Сравнительный анализ новых методов диагностики активного туберкулеза руководствуется золотым стандартом диагностики активного туберкулеза, которым является микробиологическая изоляция M.Туберкулез . Однако обнаружение кислотоустойчивых бацилл с помощью микроскопии остается единственным доступным лабораторным тестом для диагностики активного туберкулеза в большинстве стран с ограниченными ресурсами. Микроскопия мокроты недорога, высокоспецифична и позволяет выявлять наиболее заразных пациентов 88. Однако микроскопия мокроты нечувствительна: эта особенность усугубляется сочетанной инфекцией ВИЧ-1, поскольку увеличивается частота случаев отрицательного мазка и положительного посева (рис. 1) 64, 88, 103. Флуоресцентная микроскопия кажется более чувствительной, чем обычная микроскопия, и имеет аналогичную специфичность 104, но не так широко изучалась у ВИЧ-1-инфицированных людей. Появление светодиодных флуоресцентных микроскопов, которые, похоже, не уступают по характеристикам более сложным устройствам на основе ртутных ламп, также является достижением 105. Индукция мокроты упоминается в медицинской исследовательской литературе с 1960-х годов как эффективный инструмент для диагностики туберкулеза. у пациентов с отрицательным мазком мокроты или у пациентов, не способных производить мокроту 106. Исследования на ВИЧ-1 инфицированных относительно немногочисленны. Hartung et al. 107 продемонстрировали, что индукция мокроты у пациентов с отрицательным мазком мокроты или у тех, кто не может откашливать, повысила их диагноз ТБ на 29%.Аналогичным образом Parry et al. 108 наблюдал 19% -ное увеличение диагнозов ТБ при оценке индукции мокроты в Малави.
Появление светодиодных флуоресцентных микроскопов, которые, похоже, не уступают по характеристикам более сложным устройствам на основе ртутных ламп, также является достижением 105. Индукция мокроты упоминается в медицинской исследовательской литературе с 1960-х годов как эффективный инструмент для диагностики туберкулеза. у пациентов с отрицательным мазком мокроты или у пациентов, не способных производить мокроту 106. Исследования на ВИЧ-1 инфицированных относительно немногочисленны. Hartung et al. 107 продемонстрировали, что индукция мокроты у пациентов с отрицательным мазком мокроты или у тех, кто не может откашливать, повысила их диагноз ТБ на 29%.Аналогичным образом Parry et al. 108 наблюдал 19% -ное увеличение диагнозов ТБ при оценке индукции мокроты в Малави.
Сравнение положительных результатов мазков у ВИЧ-1 инфицированных и неинфицированных ВИЧ-1 пациентов. □: ВИЧ-отрицательный, положительный мазок; ▓: ВИЧ-положительный, положительный мазок. # : в этих исследованиях нет ВИЧ-отрицательных групп сравнения.
# : в этих исследованиях нет ВИЧ-отрицательных групп сравнения.
При отсутствии положительного мазка рентгенограмма грудной клетки может играть важную роль в диагностике ВИЧ-1 пациентов с подозрением на ТБ.Есть несколько особенностей рентгенограммы грудной клетки, которые сильно указывают на туберкулез, но ни одна из них не является диагностической 17, 26, 38. Степень иммуносупрессии играет решающую роль в рентгенографической картине 8, 9. Лица с относительно хорошо сохранившимся иммунитетом (количество клеток CD4 > 200 клеток · мкл -1 ) могут иметь типичный взрослый рисунок с преобладанием верхней доли и кавитацией. У пациентов с более выраженной иммуносупрессией (количество CD4-клеток <200 клеток · мкл -1 ) рентгенологические признаки имеют тенденцию быть более атипичными с инфильтратами средней или нижней зоны, внутригрудной и средостенной лимфаденопатией 8, 9, 16, 27, 109 . Плевральный выпот может происходить независимо от иммунного статуса 16. Милиарный паттерн обычно возникает при более выраженной иммуносупрессии 8. Также хорошо описано, что ВИЧ-1 инфицированные пациенты с активным туберкулезом, подтвержденным посевом мокроты, могут иметь нормальные рентгенограммы грудной клетки 16, 19, 26.
Плевральный выпот может происходить независимо от иммунного статуса 16. Милиарный паттерн обычно возникает при более выраженной иммуносупрессии 8. Также хорошо описано, что ВИЧ-1 инфицированные пациенты с активным туберкулезом, подтвержденным посевом мокроты, могут иметь нормальные рентгенограммы грудной клетки 16, 19, 26.
В отсутствие каких-либо микробиологических данных о туберкулезе существуют руководства по диагностике 110. Расширенные определения случая хорошо себя зарекомендовали, но их следует сочетать с последующим наблюдением и объективной оценкой ответа на лечение 38.ВИЧ-1 инфицированные пациенты с туберкулезом с отрицательным мазком мокроты имеют более высокую смертность, чем пациенты с положительным мазком 9, 38, 111, 112. Поэтому важно, чтобы пациенты, которые не реагируют на лечение туберкулеза с отрицательным мазком мокроты, были направлены на дополнительное обследование. поскольку у них может быть лекарственно-устойчивое заболевание или альтернативный диагноз (таблица 1) 38.
Культивирование M. tuberculosis на твердой среде может быть пролонгировано. Жидкие питательные среды значительно сокращают время и усилия для получения положительной культуры 6, 26, 113, но нередко связаны с контаминацией (до 17%) 114.Это также связано с большими затратами и, следовательно, не всегда доступно во многих условиях с ограниченными ресурсами 64. Альтернативным более дешевым методом культивирования на основе жидкости является анализ чувствительности к лекарственным средствам (MODS) под микроскопом, в котором клубки микобактерий непосредственно визуализируются через и инвертированный микроскоп 115. Дополнительным преимуществом является возможность одновременного определения лекарственной устойчивости. Несколько последующих оценок MODS показали, что он эквивалентен или немного превосходит автоматизированную жидкую культуру для диагностики как легочного, так и внелегочного ТБ [116, 117].Однако коммерчески доступной формы теста не существует.
Имеющиеся в продаже и несколько тестов амплификации нуклеиновых кислот «на дому» (NAAT) обладают высокой специфичностью в отношении M. tuberculosis и высокой чувствительностью в мокроте с положительным мазком. Однако чувствительность при туберкулезе с отрицательным мазком мокроты и диссеминированном туберкулезе, как правило, была средней, что ограничивает их диагностическую роль [1118, 119]. Однако недавно сообщалось, что система Cepheid GeneXpert имеет чувствительность 71,7% в случаях с отрицательным мазком мокроты и положительным посевом 120 и находится в стадии тщательной оценки.Эта система имеет два эксплуатационных преимущества: простоту обработки мокроты и возможность одновременного выявления лекарственной устойчивости. Быстрое определение устойчивости к рифампицину также возможно на культурах или образцах с положительным мазком с высокой чувствительностью (~ 98%) и специфичностью (97%) с использованием линейных зондового анализа: два из которых коммерчески доступны 121. Точность для INH составляет более вариабельный, с меньшей чувствительностью (84,3%). Однако эти тесты требуют обширной лабораторной поддержки и инфраструктуры: создание ампликона вложенным NAAT, который впоследствии гибридизируется с мембраной, создает условия, при которых перекрестное загрязнение может быть проблематичным.
tuberculosis и высокой чувствительностью в мокроте с положительным мазком. Однако чувствительность при туберкулезе с отрицательным мазком мокроты и диссеминированном туберкулезе, как правило, была средней, что ограничивает их диагностическую роль [1118, 119]. Однако недавно сообщалось, что система Cepheid GeneXpert имеет чувствительность 71,7% в случаях с отрицательным мазком мокроты и положительным посевом 120 и находится в стадии тщательной оценки.Эта система имеет два эксплуатационных преимущества: простоту обработки мокроты и возможность одновременного выявления лекарственной устойчивости. Быстрое определение устойчивости к рифампицину также возможно на культурах или образцах с положительным мазком с высокой чувствительностью (~ 98%) и специфичностью (97%) с использованием линейных зондового анализа: два из которых коммерчески доступны 121. Точность для INH составляет более вариабельный, с меньшей чувствительностью (84,3%). Однако эти тесты требуют обширной лабораторной поддержки и инфраструктуры: создание ампликона вложенным NAAT, который впоследствии гибридизируется с мембраной, создает условия, при которых перекрестное загрязнение может быть проблематичным.
Обнадеживающий первоначальный отчет о 90% чувствительности RD1-специфичного ELISpot при активном ВИЧ-1-ассоциированном ТБ 122 вызвал ряд оценок коммерческих тестов. Наблюдается широкий диапазон чувствительности от 23% до 81% 74, 123–128. Неопределенные показатели увеличиваются по мере снижения числа CD4. Связь количественного количества пятен ELIS с CD4 увеличивает специфичность и чувствительность диагностики активного ТБ у ВИЧ-1 инфицированных 74, 129, 130. Однако общая специфичность остается низкой и составляет 62%, хотя можно утверждать, что обнаружение положительный результат IGRA у ВИЧ-1 инфицированного человека должен побуждать к рассмотрению возможности лечения латентной инфекции, даже если активное заболевание не обнаружено 74.
Коммерческое и домашнее серологическое тестирование продолжает изучаться, хотя консенсус состоит в том, что при достижении адекватной чувствительности это всегда происходит с потерей специфичности, и лишь немногие исследования включали пациентов, инфицированных ВИЧ-1 131, 132. В последнее время наблюдается интерес к обнаружение липоарабиноманнанового антигена в моче, особенно у ВИЧ-1 инфицированных людей, поскольку чувствительность теста имеет тенденцию улучшаться с прогрессом иммуносупрессии 22 и, следовательно, может служить потенциально полезным инструментом для проверки.
В последнее время наблюдается интерес к обнаружение липоарабиноманнанового антигена в моче, особенно у ВИЧ-1 инфицированных людей, поскольку чувствительность теста имеет тенденцию улучшаться с прогрессом иммуносупрессии 22 и, следовательно, может служить потенциально полезным инструментом для проверки.
ВЕДЕНИЕ ТБ У ЛЮДЕЙ, ИНФИЦИРОВАННЫХ ВИЧ-1
Туберкулезная терапия
Продолжительность и эффективность лечения туберкулеза
Оптимальная продолжительность и тип лечения ТБ у пациентов, коинфицированных ВИЧ-1, неизвестны, и для ответа на этот вопрос необходимы долгосрочные рандомизированные исследования. Некоторые исследования предполагают, что 6-месячный короткий курс лечения подходит для лечения ВИЧ-1 133–135, в то время как другие предлагают продлить его до 9 месяцев. Ретроспективный обзор из США показал отсутствие неудач лечения у ВИЧ-1-инфицированных пациентов, получавших 6-месячный стандартный режим на основе рифампицина, но частота рецидивов была в четыре раза выше у тех, кто лечился в течение 6 месяцев, по сравнению с теми, кто лечился дольше 136. Однако реинфекцию нельзя было отличить от рецидива, и набор данных был от небольшой группы пациентов, поскольку только 17% пациентов, инфицированных ВИЧ-1 (по сравнению с 37% неинфицированных / неизвестных ВИЧ-1), получили стандартный 6-месячный режим. Терапия под непосредственным наблюдением (ДОТ) была назначена только в 57% случаев, и не было формальной оценки приверженности пациентам, не получавшим ДОТ. Интересно, что пациенты, инфицированные ВИЧ-1, значительно чаще испытывали побочные реакции на лекарства и заболевали лекарственно-устойчивым туберкулезом, чем группа неинфицированных / неизвестных ВИЧ-1.Из этих данных можно сделать вывод, что при неоптимальном соблюдении режима лечения 6 месяцев терапии недостаточно.
Однако реинфекцию нельзя было отличить от рецидива, и набор данных был от небольшой группы пациентов, поскольку только 17% пациентов, инфицированных ВИЧ-1 (по сравнению с 37% неинфицированных / неизвестных ВИЧ-1), получили стандартный 6-месячный режим. Терапия под непосредственным наблюдением (ДОТ) была назначена только в 57% случаев, и не было формальной оценки приверженности пациентам, не получавшим ДОТ. Интересно, что пациенты, инфицированные ВИЧ-1, значительно чаще испытывали побочные реакции на лекарства и заболевали лекарственно-устойчивым туберкулезом, чем группа неинфицированных / неизвестных ВИЧ-1.Из этих данных можно сделать вывод, что при неоптимальном соблюдении режима лечения 6 месяцев терапии недостаточно.
Дальнейшее понимание получено из обзора шести исследований пациентов, инфицированных ВИЧ-1, и трех исследований пациентов без инфекции ВИЧ-1, получавших лечение в течение ≥6 месяцев. К сожалению, были различия в дизайне исследования, критериях отбора, месте заболевания ТБ, частоте и методе лечения, а также в определениях результатов 137. Хотя в некоторых исследованиях пациентов с коинфекцией частота рецидивов оказалась выше, другие исходы, такие как частота излечения и показатели успешного лечения были сопоставимы при использовании 6-месячных схем.В Бразилии частота рецидивов ТБ была высокой у лиц, инфицированных ВИЧ-1, но если было завершение начальной терапии ТБ, использование АРТ и последующее увеличение числа лимфоцитов CD4, то частота рецидивов была низкой, что позволяет предположить, что причиной возникновения инфекции могла быть реинфекция. рецидив 138. В целом, большинство исследований сходятся во мнении, что стандартное лечение туберкулеза следует назначать ВИЧ-1 инфицированным пациентам, когда это возможно 134, 135, 139, 140. 6-месячный режим лечения, включающий рифампицин и изониазид, следует назначать пациентам с лекарственной чувствительностью. ТБ (вне центральной нервной системы).Обычно это схема из четырех препаратов в течение 2 месяцев с последующим приемом INH и рифампицина в течение следующих 4 месяцев (всего не менее 182 доз INH и рифампицина и 56 доз пиразинамида и этамбутола).
Хотя в некоторых исследованиях пациентов с коинфекцией частота рецидивов оказалась выше, другие исходы, такие как частота излечения и показатели успешного лечения были сопоставимы при использовании 6-месячных схем.В Бразилии частота рецидивов ТБ была высокой у лиц, инфицированных ВИЧ-1, но если было завершение начальной терапии ТБ, использование АРТ и последующее увеличение числа лимфоцитов CD4, то частота рецидивов была низкой, что позволяет предположить, что причиной возникновения инфекции могла быть реинфекция. рецидив 138. В целом, большинство исследований сходятся во мнении, что стандартное лечение туберкулеза следует назначать ВИЧ-1 инфицированным пациентам, когда это возможно 134, 135, 139, 140. 6-месячный режим лечения, включающий рифампицин и изониазид, следует назначать пациентам с лекарственной чувствительностью. ТБ (вне центральной нервной системы).Обычно это схема из четырех препаратов в течение 2 месяцев с последующим приемом INH и рифампицина в течение следующих 4 месяцев (всего не менее 182 доз INH и рифампицина и 56 доз пиразинамида и этамбутола). По возможности следует проводить ежедневное лечение туберкулеза. В недавно опубликованном систематическом обзоре и метаанализе исследований лечения активного ТБ у пациентов с коинфекцией ВИЧ-1 было высказано предположение, что для оптимальных результатов лечения может потребоваться лечение рифамицином в течение ≥8 месяцев с начальным ежедневным приемом, но был сделан вывод о том, Для подтверждения этого требовались испытания 141.Данные о лекарственно-чувствительном туберкулезе, поражающем центральную нервную систему, подтверждают продолжительность лечения в течение 9–12 месяцев. Обычно он состоит из четырех препаратов в течение 2 месяцев, затем 7–10 месяцев изониазида и рифампицина. МЛУ- или ШЛУ-ТБ должны лечить практикующие врачи, имеющие опыт в таких случаях, и требует длительного лечения 142, 143.
По возможности следует проводить ежедневное лечение туберкулеза. В недавно опубликованном систематическом обзоре и метаанализе исследований лечения активного ТБ у пациентов с коинфекцией ВИЧ-1 было высказано предположение, что для оптимальных результатов лечения может потребоваться лечение рифамицином в течение ≥8 месяцев с начальным ежедневным приемом, но был сделан вывод о том, Для подтверждения этого требовались испытания 141.Данные о лекарственно-чувствительном туберкулезе, поражающем центральную нервную систему, подтверждают продолжительность лечения в течение 9–12 месяцев. Обычно он состоит из четырех препаратов в течение 2 месяцев, затем 7–10 месяцев изониазида и рифампицина. МЛУ- или ШЛУ-ТБ должны лечить практикующие врачи, имеющие опыт в таких случаях, и требует длительного лечения 142, 143.
ТЕРАПИЯ ПОД НАПРАВЛЕНИЕМ
DOT рекомендован Всемирной организацией здравоохранения для лечения ВИЧ-1 / ТБ, особенно при прерывистом дозировании. ДОТ / контролируемая терапия для АРТ применялась у некоторых пациентов, но АРТ необходимо назначать ежедневно 144. Не проводилось рандомизированных контролируемых испытаний или систематических обзоров полезности комбинированной АРТ / ТБ ДОТ в лечении сочетанной инфекции ВИЧ-1 / ТБ.
Не проводилось рандомизированных контролируемых испытаний или систематических обзоров полезности комбинированной АРТ / ТБ ДОТ в лечении сочетанной инфекции ВИЧ-1 / ТБ.
В некоторых случаях прерывистая терапия может проводиться три раза в неделю с модификацией дозы 133, 145, но она должна быть через DOT. Однако это вызвало беспокойство, так как в одном исследовании выявлен повышенный риск приобретенной устойчивости к рифамицину у ВИЧ-1-инфицированных пациентов, принимаемых три раза в неделю. Однако в этом исследовании, хотя DOT использовался для всех доз во время интенсивной фазы, только одна доза из трех в неделю контролировалась во время фазы продолжения 146.Две другие стратегии ДОТ, используемые у ВИЧ-1-отрицательных пациентов, были связаны с неприемлемо высокой частотой рецидивов и приобретенной резистентностью к рифампицину у ВИЧ-1-инфицированных пациентов, и их не следует использовать в этой популяции: это прием INH-рифапентина один раз в неделю в фаза продолжения и два раза в неделю INH-рифампицин или INH-рифабутин у пациентов с количеством CD4 <100 клеток · мкл -1 [139, 147-150]. В случае МЛУ-ТБ систематический обзор и метаанализ показали более высокий успех лечения, когда продолжительность лечения составляла не менее 18 месяцев и на протяжении всего курса лечения проводился ДОТ 143.
В случае МЛУ-ТБ систематический обзор и метаанализ показали более высокий успех лечения, когда продолжительность лечения составляла не менее 18 месяцев и на протяжении всего курса лечения проводился ДОТ 143.
РОЛЬ КОРТИКОСТЕРОИДОВ
У ВИЧ-1-инфицированных взрослых с туберкулезом легких или плевры кортикостероиды не улучшают выживаемость и не снижают рецидивов туберкулеза 151–153. Дополнительное исследование ВИЧ-1 инфицированных людей в рамках рандомизированного контролируемого исследования дексаметазона для лечения ТБМ во Вьетнаме показало тенденцию к увеличению выживаемости в группе дексаметазона 154. Поэтому большинство врачей назначают стероиды пациентам с туберкулезным менингитом и используют дексаметазон 12–16. мг · день -1 внутривенно, пока пациент не начнет принимать лекарства перорально.Альтернативой является преднизолон 1,5 мг · кг -1 · день -1 в течение 3 недель с постепенным снижением в течение следующих 3 недель 155. Рандомизированное контролируемое исследование дополнительного преднизолона у ВИЧ-1-инфицированных пациентов с экссудативным туберкулезным перикардитом продемонстрировало снижение по смертности среди пациентов, получавших преднизолон, несмотря на относительно небольшой размер выборки (n = 58) 153.
Рандомизированное контролируемое исследование дополнительного преднизолона у ВИЧ-1-инфицированных пациентов с экссудативным туберкулезным перикардитом продемонстрировало снижение по смертности среди пациентов, получавших преднизолон, несмотря на относительно небольшой размер выборки (n = 58) 153.
ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Лекарственное взаимодействие между терапией ВИЧ-1 и ТБ является обычным явлением, и механизм в основном заключается в индукции или ингибировании метаболического семейства ферментов в печени, цитохрома P450 (CYP450).Изоформа CYP3A4 особенно важна, поскольку это главный фермент, ответственный за метаболизм ингибиторов протеазы (ИП) и ненуклеозидного ингибитора обратной транскриптазы (ННИОТ). Среди наиболее мощных индукторов CYP3A4 156, 157 — семейство рифамицинов, а рифампицин (таблица 2) является наиболее мощным из известных индукторов CYP3A4, в меньшей степени рифабутин (таблица 3) 158. Рифампицин также индуцирует другие цитохромы, такие как CYP2C19 и CYP2D6 и увеличивает активность переносчика лекарств Р-гликопротеина, который способствует абсорбции, распределению и элиминации PI 159,160. Рифабутин, в отличие от рифампицина, также является субстратом фермента CYP3A4 156, поэтому ингибиторы CYP3A4 увеличивают концентрацию рифабутина, но не влияют на метаболизм рифампицина. Поскольку ИП ВИЧ-1 являются ингибиторами CYP3A4, концентрации рифабутина и его метаболитов в плазме могут увеличиваться и вызывать токсичность при использовании с ИП 161. Рифабутин успешно заменил рифампицин при лечении ТБ у ВИЧ-1-отрицательных пациентов 162, 163. Это может быть используется как альтернатива рифампицину, чтобы избежать лекарственного взаимодействия.Рифабутин продемонстрировал эффективность, аналогичную рифампицину, в одинарном слепом рандомизированном исследовании 50 ВИЧ-1-положительных пациентов в Уганде 164 и когорты из 25 пациентов в США 165. Однако отсутствуют долгосрочные данные о применении рифабутина в ВИЧ-1 инфицированные взрослые. Рифабутин стоит дорого, хотя вскоре может быть разработана его генерическая версия. Его токсичность включает угнетение костного мозга, увеит и артралгию.
Рифабутин, в отличие от рифампицина, также является субстратом фермента CYP3A4 156, поэтому ингибиторы CYP3A4 увеличивают концентрацию рифабутина, но не влияют на метаболизм рифампицина. Поскольку ИП ВИЧ-1 являются ингибиторами CYP3A4, концентрации рифабутина и его метаболитов в плазме могут увеличиваться и вызывать токсичность при использовании с ИП 161. Рифабутин успешно заменил рифампицин при лечении ТБ у ВИЧ-1-отрицательных пациентов 162, 163. Это может быть используется как альтернатива рифампицину, чтобы избежать лекарственного взаимодействия.Рифабутин продемонстрировал эффективность, аналогичную рифампицину, в одинарном слепом рандомизированном исследовании 50 ВИЧ-1-положительных пациентов в Уганде 164 и когорты из 25 пациентов в США 165. Однако отсутствуют долгосрочные данные о применении рифабутина в ВИЧ-1 инфицированные взрослые. Рифабутин стоит дорого, хотя вскоре может быть разработана его генерическая версия. Его токсичность включает угнетение костного мозга, увеит и артралгию.
Нуклеозидные / нуклеотидные ингибиторы обратной транскриптазы (НИОТ) в основном метаболизируются путем глюкуронизации и не имеют клинически значимого взаимодействия с рифамицинами.Данных по новым антиретровирусным препаратам немного. Новые препараты, такие как ингибиторы CCR5 маравирок и викривирок, метаболизируются CYP3A4 и, таким образом, взаимодействуют с рифамицинами, как и ингибитор интегразы элвитегравир. Ралтегравир метаболизируется UGT1A1, который индуцируется рифампицином, и в настоящее время проводятся исследования для выяснения этого взаимодействия.
РИФАМИЦИНЫ И NNRTIS
Рифампицин и эфавиренц
Нет единого мнения о том, какую дозу эфавиренца следует вводить с рифампицином.Несколько фармакокинетических исследований показали снижение уровня эфавиренца на 20-30% при приеме рифампицина 166, 167, и что в целом повышение дозы эфавиренца с 600 мг до 800 мг является эффективным и безопасным 166, 168. И наоборот, в стандартных когортных исследованиях. доза эфавиренца была назначена с рифампицином без снижения клинической эффективности 169–171. Крупное когортное исследование, проведенное в Южной Африке, не показало различий в показателях вирусологической супрессии при сравнении пациентов, получающих только АРТ, содержащую эфавиренз, и пациентов, получающих АРТ на основе эфавиренца и лечение туберкулеза на основе рифампицина одновременно.В этой когорте 172 применяли эфавиренц в дозе 600 мг в день независимо от веса 172. Напротив, группа наблюдателей, изучавшая фармакокинетические и клинические исходы и вес, предложила пациентам с массой тела> 60 кг назначать эфавиренц в дозе 800 мг 173 Одной из проблем является большая вариабельность уровней эфавиренца у разных пациентов 174, и это усугубляется тем фактом, что уровни и токсичность эфавиренца повышаются у лиц с полиморфизмом CYP2B6, который присутствует у 20% чернокожего населения по сравнению с 3% белых 175, 176 .Это может объяснить некоторую вариабельность и высокую частоту клинической токсичности в некоторых исследованиях 177.
И наоборот, в стандартных когортных исследованиях. доза эфавиренца была назначена с рифампицином без снижения клинической эффективности 169–171. Крупное когортное исследование, проведенное в Южной Африке, не показало различий в показателях вирусологической супрессии при сравнении пациентов, получающих только АРТ, содержащую эфавиренз, и пациентов, получающих АРТ на основе эфавиренца и лечение туберкулеза на основе рифампицина одновременно.В этой когорте 172 применяли эфавиренц в дозе 600 мг в день независимо от веса 172. Напротив, группа наблюдателей, изучавшая фармакокинетические и клинические исходы и вес, предложила пациентам с массой тела> 60 кг назначать эфавиренц в дозе 800 мг 173 Одной из проблем является большая вариабельность уровней эфавиренца у разных пациентов 174, и это усугубляется тем фактом, что уровни и токсичность эфавиренца повышаются у лиц с полиморфизмом CYP2B6, который присутствует у 20% чернокожего населения по сравнению с 3% белых 175, 176 .Это может объяснить некоторую вариабельность и высокую частоту клинической токсичности в некоторых исследованиях 177. На основании имеющихся данных стандартные дозы эфавиренца можно назначать пациентам с массой тела <60 кг, а пациентам с массой тела> 60 кг — увеличивать до 800 мг в день. можно рассмотреть, хотя в этом нет необходимости 159, 178. Мониторинг минимального уровня препарата, если он доступен, может быть проведен через 2 недели после начала эфавиренца для проверки адекватности.
На основании имеющихся данных стандартные дозы эфавиренца можно назначать пациентам с массой тела <60 кг, а пациентам с массой тела> 60 кг — увеличивать до 800 мг в день. можно рассмотреть, хотя в этом нет необходимости 159, 178. Мониторинг минимального уровня препарата, если он доступен, может быть проведен через 2 недели после начала эфавиренца для проверки адекватности.
Рифампицин и невирапин
Рифампицин и невирапин широко используются в странах с ограниченными ресурсами.Фармакокинетические данные показывают, что рифампицин 179–183 снижает уровень невирапина на 20–55%. Как и в случае с эфавиренцем, ведутся споры о том, оказывает ли это какое-либо клиническое воздействие. Исследования, проведенные в Южной Африке и Таиланде, показали, что уровни невирапина были значительно снижены рифампицином примерно у трети пациентов 182, 183. Одно исследование было направлено на решение этой проблемы с пациентами, которым назначали невирапин 200 мг в качестве вводной дозы каждые 12 часов (а не стандартная 200 мг в день), увеличиваясь до 300 мг каждые 12 часов через 2 недели (вместо стандартной 200 мг каждые 12 часов) 184. Фармакокинетика была улучшена в группе, получавшей высокие дозы, но наблюдалась неприемлемо высокая степень гиперчувствительности невирапина в течение раннего периода приема. Два исследования клинических исходов показали высокие показатели подавления вируса ВИЧ-1 при использовании стандартных доз невирапина и рифампицина 180, 185. Однако в большом исследовании с участием 1283 пациентов, начинающих АРТ на фоне рифампицина (209 человек получали невирапин и 1074 человека получали эфавиренц), Частота вирусологической неудачи была почти в три раза выше в группе невирапина по сравнению с группой эфавиренза или группой, не получавшей ТБ 172.Интересно отметить, что при поданализе тех пациентов, которые уже принимали невирапин, у которых развился туберкулез и затем началось лечение туберкулеза на основе рифампицина, показатели вирусологического подавления не были снижены 172. В целом, данные на сегодняшний день предполагают, что если рифампицин и ННИОТ должны быть тогда предпочтительнее эфавиренц.
Фармакокинетика была улучшена в группе, получавшей высокие дозы, но наблюдалась неприемлемо высокая степень гиперчувствительности невирапина в течение раннего периода приема. Два исследования клинических исходов показали высокие показатели подавления вируса ВИЧ-1 при использовании стандартных доз невирапина и рифампицина 180, 185. Однако в большом исследовании с участием 1283 пациентов, начинающих АРТ на фоне рифампицина (209 человек получали невирапин и 1074 человека получали эфавиренц), Частота вирусологической неудачи была почти в три раза выше в группе невирапина по сравнению с группой эфавиренза или группой, не получавшей ТБ 172.Интересно отметить, что при поданализе тех пациентов, которые уже принимали невирапин, у которых развился туберкулез и затем началось лечение туберкулеза на основе рифампицина, показатели вирусологического подавления не были снижены 172. В целом, данные на сегодняшний день предполагают, что если рифампицин и ННИОТ должны быть тогда предпочтительнее эфавиренц.
Рифампицин и этравирин или рилпивирин
По этравирину данных нет, и, насколько нам известно, исследования не планируются. Из-за фармакокинетических свойств их нельзя назначать одновременно.Рифампицин снижает концентрацию рилпивирина в плазме до 90%, поэтому эти препараты также не следует применять вместе 186.
РИФАБУТИН И ННИОТ
Эфавиренц уменьшает площадь под кривой зависимости концентрации в плазме от времени (AUC) рифабутина на 38%, поэтому дозу рифабутина следует увеличить до 450 мг в день. Одновременное назначение невирапина приводит к незначительным изменениям фармакокинетики невирапина, и, исходя из ограниченных данных, рифабутин и невирапин, вероятно, можно назначать вместе без корректировки любой из их доз.Рифабутин и этравирин можно назначать одновременно без коррекции дозы. Рифабутин снижает уровень рилпивирина в плазме на 50%, поэтому дозу рилпивирина следует удвоить 186.
Рифамицины и PI, усиленный ритонавиром
Большинству пациентов назначают ИП с низкой дозой ритонавира (100 мг или 200 мг в день), чтобы воспользоваться свойствами ритонавира ингибировать фермент CYP3A4.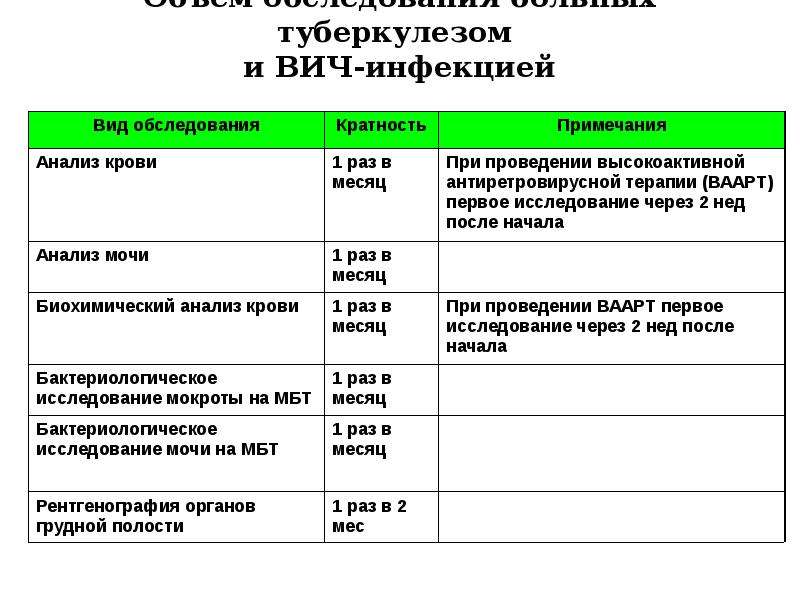 Ритонавир повышает концентрацию других ИП, облегчая дозирование. Это свойство контрастирует с индуцирующей активностью рифампицина, которую можно «нейтрализовать» только введением больших доз ритонавира 400 мг b.я бы.
Ритонавир повышает концентрацию других ИП, облегчая дозирование. Это свойство контрастирует с индуцирующей активностью рифампицина, которую можно «нейтрализовать» только введением больших доз ритонавира 400 мг b.я бы.
ЛОПИНАВИР / РИТОНАВИР
Стандартная доза ритонавира, используемая в обычной дозе комбинированных таблеток лопинавира / ритонавира, недостаточна для компенсации индуцирующего эффекта рифампицина на метаболизм лопинавира 187. Одна из стратегий состоит в том, чтобы назначать лопинавир / ритонавир с повышенной дозой ритонавира. В одном исследовании, когда доза ритонавира была увеличена до 400 мг дважды в день, минимальные концентрации лопинавира были адекватными у девяти из 10 субъектов. Однако наблюдались высокие показатели повышения уровня трансаминаз, изменений липидов и желудочно-кишечной токсичности 187.Фармакокинетическое исследование такой стратегии на здоровых добровольцах было прекращено досрочно из-за высоких показателей резкого увеличения печеночных ферментов / трансаминаз 188. Другой стратегией является удвоение дозы лопинавира / ритонавира, что также преодолевает эффект индукции рифампицина 187.
Другой стратегией является удвоение дозы лопинавира / ритонавира, что также преодолевает эффект индукции рифампицина 187.
ПРОЧЕЕ PI, УСИЛЕННЫЙ РИТОНАВИРОМ
Саквинавир, атазанавир и типранавир имеют неблагоприятную фармакокинетику с рифампицином и не должны применяться вместе. Взаимодействие между дарунавиром и рифампицином не исследовалось, но, исходя из фармакокинетических свойств, его не следует назначать одновременно с рифампицином 189–196.
РИФАБУТИН И ИП
Ритонавир, усиленный ИП
При использовании низких доз ИП, усиленных ритонавиром, с рифабутином возникает сложное лекарственное взаимодействие. Рифабутин индуцирует метаболизм ИП, но этой индукции противодействуют ингибирующие эффекты ритонавира, которые также ингибируют метаболизм рифабутина. Следовательно, доза ИП, усиленного ритонавиром, остается неизменной, но дозу рифабутина следует снизить до 150 мг три раза в неделю. Нет данных о клинических исходах ни для ВИЧ-1, ни для туберкулеза при использовании этой стратегии, и там, где это возможно, следует измерить уровни препарата ИП. Недавнее фармакокинетическое исследование вызвало опасения относительно текущих рекомендаций по дозировке рифабутина при использовании с лопинавиром / ритонавиром из-за субтерапевтических концентраций рифабутина у большинства пациентов. Авторы этого исследования предложили мониторинг терапевтических препаратов 197. Если врачи рассматривают возможность измерения уровней рифабутина, это должно включать определение активного метаболита, 25-0-дезацетил-рифабутина.
Недавнее фармакокинетическое исследование вызвало опасения относительно текущих рекомендаций по дозировке рифабутина при использовании с лопинавиром / ритонавиром из-за субтерапевтических концентраций рифабутина у большинства пациентов. Авторы этого исследования предложили мониторинг терапевтических препаратов 197. Если врачи рассматривают возможность измерения уровней рифабутина, это должно включать определение активного метаболита, 25-0-дезацетил-рифабутина.
PI И РИФАМИЦИНЫ: ЧТО ДЕЛАТЬ?
Комбинации ИП / ритонавир, как правило, не назначаются с рифампицином, поэтому либо схему АРТ следует изменить на схему, содержащую эфавиренц, если возможно, либо вместо рифампицина следует использовать рифабутин.В условиях ограниченных ресурсов, где рифабутин недоступен, с рифампицином использовалось дополнительное усиление лопинавира ритонавиром. Это достигается либо добавлением высоких доз ритонавира (дополнительно 300 мг каждые 12 ч) к комбинации лопинавир / ритонавир, либо удвоением дозы лопинавира / ритонавира, чтобы преодолеть индукцию рифампицином. В исследованиях здоровых добровольцев и пациентов при использовании таких стратегий сообщалось о высокой частоте печеночных явлений и желудочно-кишечной непереносимости, и пациенты должны тщательно контролироваться на предмет развития желтухи или гепатита 188,198.Четверные нуклеозиды также возможны в качестве АРТ. Выбор любой схемы АРТ зависит от исходного уровня и последующего тестирования на резистентность, а также от истории воздействия лекарств в случае вирусологической неудачи.
В исследованиях здоровых добровольцев и пациентов при использовании таких стратегий сообщалось о высокой частоте печеночных явлений и желудочно-кишечной непереносимости, и пациенты должны тщательно контролироваться на предмет развития желтухи или гепатита 188,198.Четверные нуклеозиды также возможны в качестве АРТ. Выбор любой схемы АРТ зависит от исходного уровня и последующего тестирования на резистентность, а также от истории воздействия лекарств в случае вирусологической неудачи.
РИФАМИЦИНЫ И НИОТ
При назначении НИОТ с рифампицином фармакокинетические взаимодействия не оказывают значительного клинического воздействия. Схемы тройных НИОТ теоретически так же привлекательны, как АРТ, поскольку они не взаимодействуют с лечением ТБ и использовались в обсервационных исследованиях в Африке 199–201, но, как было показано в рандомизированном исследовании 202, вирусологически уступают АРТ, содержащим ННИОТ.Четырехкратные схемы НИОТ (чаще всего абакавир, ламивудин, зидовудин и тенофовир) также использовались у взрослых, получающих лечение от ТБ 203.
РИФАМИЦИНЫ И ИНГИБИТОРЫ ИНТЕГРАЗЫ
Ралтегравир метаболизируется путем глюкуронизации UGT1A1. Рифампицин является индуктором этого фермента и снижает уровень препарата ралтегравир 204. Поскольку противовирусная активность ралтегравира может зависеть от его AUC, фармакокинетические данные показывают, что это сохраняется, если доза ралтегравира удваивается при введении с рифампицином.Согласно имеющимся на сегодняшний день данным, можно использовать обычные дозы ралтегравира и рифабутина. Эльвитегравир метаболизируется изоферментом CYP3A4, и его не следует назначать с рифампицином.
РИФАМИЦИНЫ И CCR5-АНТАГОНИСТЫ ИЛИ ЭНФУРВИРТИД
Поскольку маравирок метаболизируется изоферментом CYP3A4, дозу маравирока следует удвоить до 600 мг. два раза в день. при введении с рифампицином 205. Теоретически маравирок можно вводить в стандартных дозах с рифабутином. Между рифамицином и энфувиртидом 206 нет значительного взаимодействия.
НЕРИФАМИЦИНОВЫЕ РЕЖИМЫ
ТБ, связанный с ВИЧ-1, иногда можно лечить с помощью схем, не содержащих рифамицин, но они обладают меньшей эффективностью, с высокой частотой рецидивов 207, 208. В обзоре межлекарственных взаимодействий между препаратами, используемыми в схемах без рифамицина, и антиретровирусными препаратами описывается потенциальное взаимодействие этих препаратов второго ряда с антиретровирусными препаратами 209.
В обзоре межлекарственных взаимодействий между препаратами, используемыми в схемах без рифамицина, и антиретровирусными препаратами описывается потенциальное взаимодействие этих препаратов второго ряда с антиретровирусными препаратами 209.
ТОКСИЧНОСТЬ КОМБИНИРОВАННОЙ АРТ И ТБ ТЕРАПИИ
Неблагоприятные реакции на лекарства распространены среди пациентов с туберкулезом, связанным с ВИЧ-1, особенно если пациенты также принимают АРТ, при этом частыми побочными эффектами являются сыпь, лихорадка, гепатит и периферическая невропатия (таблица 4).Может быть сложно определить ответственный препарат, особенно если пациенту одновременно назначаются препараты для лечения или профилактики оппортунистических инфекций, такие как ко-тримоксазол, и лечение было начато одновременно. Сообщалось о высоких показателях побочных реакций, требующих изменения терапии, у ВИЧ-1-инфицированных пациентов 210, 211. Высокие показатели прекращения терапии ТБ или ВИЧ-1 наблюдаются 212, 213, и повторное введение лекарств может быть длительным и трудным. Это может косвенно увеличить заболеваемость и смертность из-за отсрочки эффективного лечения ТБ и ВИЧ-1.
Это может косвенно увеличить заболеваемость и смертность из-за отсрочки эффективного лечения ТБ и ВИЧ-1.
ГЕПАТОТОКСИЧНОСТЬ
Гепатотоксичность вызывается многими лекарствами, используемыми для лечения ВИЧ-1, такими как ко-тримоксазол, азолы и макролиды. Не все реакции вызваны препаратами против ВИЧ-1 или противотуберкулезными препаратами. Пациенты с хроническим заболеванием печени имеют более высокий уровень токсичности и нуждаются в более частом мониторинге функциональных тестов печени. Хронические гепатиты B и C часто встречаются у людей, инфицированных ВИЧ-1.Острое повреждение печени или гепатотоксичность, связанное с лекарственными препаратами, определяется как: сывороточная аспартатаминотрансфераза (АСТ) или аланинаминотрансфераза (АЛТ) более чем в три раза превышает верхний предел нормы при наличии симптомов, или уровень АСТ или АЛТ в сыворотке более чем в пять раз превышает верхняя граница нормы при отсутствии симптомов.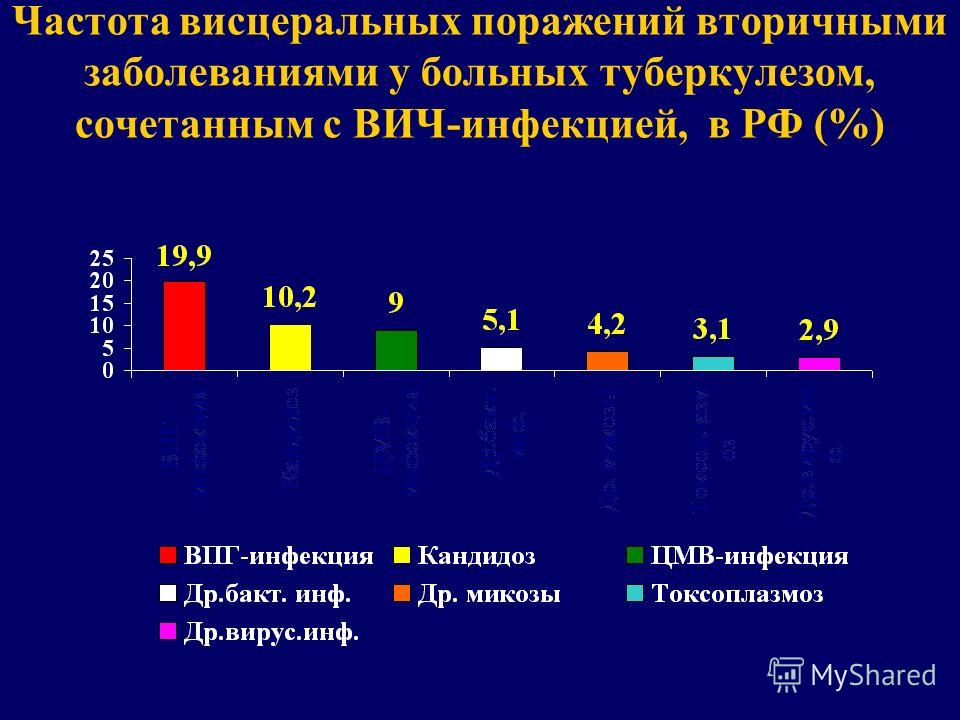 Гепатотоксичность из-за INH среди населения в целом увеличивается с возрастом и более вероятна при чрезмерном употреблении алкоголя, коинфекции гепатита C и у лиц, также принимающих рифампицин.
Гепатотоксичность из-за INH среди населения в целом увеличивается с возрастом и более вероятна при чрезмерном употреблении алкоголя, коинфекции гепатита C и у лиц, также принимающих рифампицин.
ВЕДЕНИЕ ГЕПАТИТА
Следует немедленно прекратить прием всех потенциально гепатотоксичных препаратов, включая изониазид, рифампицин, пиразинамид, АРТ и ко-тримоксазол, следует направить серологическое исследование на гепатиты A, B и C и определить воздействие других гепатотоксинов, включая алкоголь.Если разрешение гепатита продолжается, то может потребоваться лечение ТБ двумя или более противотуберкулезными препаратами без значительного риска гепатотоксичности, такими как этамбутол, стрептомицин, амикацин / канамицин, капреомицин или фторхинолон; но не моксифлоксацин, так как он может вызвать тяжелый гепатит. Как только АСТ упадет до уровня менее чем в два раза выше верхнего предела нормы и симптомы значительно улучшатся, можно будет возобновить прием противотуберкулезных препаратов первого ряда. Многие врачи используют режим повторного введения на основе общепринятой практики, но они не исследовались в клинических испытаниях.Если нельзя возобновить прием препаратов или первоначальная реакция была опасной для жизни, следует использовать альтернативную схему лечения ТБ. Повторное введение противовирусных препаратов должно осуществляться по полному режиму, поскольку введение лекарств одно за другим может привести к вирусологической неудаче. При повторном введении АРТ можно использовать менее гепатотоксичную схему АРТ.
Многие врачи используют режим повторного введения на основе общепринятой практики, но они не исследовались в клинических испытаниях.Если нельзя возобновить прием препаратов или первоначальная реакция была опасной для жизни, следует использовать альтернативную схему лечения ТБ. Повторное введение противовирусных препаратов должно осуществляться по полному режиму, поскольку введение лекарств одно за другим может привести к вирусологической неудаче. При повторном введении АРТ можно использовать менее гепатотоксичную схему АРТ.
ПЕРИФЕРИЧЕСКАЯ НЕВРОПАТИЯ
Аналоги нуклеозидов диданозин и ставудин вызывают периферическую невропатию: токсичность, которая может быть аддитивной, когда INH используется со ставудином 214, 215.Таким образом, ставудин нежелателен при одновременном применении INH, хотя эта комбинация по необходимости широко используется. Пациентов, у которых развивается туберкулез, когда они уже принимают ставудин, следует переключить на альтернативные антиретровирусные препараты, такие как тенофовир или зидовудин, если таковые имеются. Все ВИЧ-1-инфицированные пациенты, получающие лечение от ТБ, должны получать дополнительный пиридоксин для предотвращения нейропатии.
Все ВИЧ-1-инфицированные пациенты, получающие лечение от ТБ, должны получать дополнительный пиридоксин для предотвращения нейропатии.
РАШ
Сыпь обычно бывает легкой или средней степени тяжести и обычно возникает в первые 2 месяца лечения.Легкие высыпания без поражения слизистых оболочек можно лечить симптоматически, но при более распространенных или обостряющихся высыпаниях, а также при системных симптомах или изъязвлениях слизистой оболочки необходимо прекратить прием препарата. Во многих случаях, когда сыпь рассосалась, можно осторожно повторно ввести лекарство. Имеется мало перспективных данных, которые позволили бы решить проблему. Тяжелые кожные реакции на противотуберкулезную терапию следует повторно осматривать под руководством специалиста и стремиться повторно вводить одно лекарство за другим с постепенно увеличивающимися дозами, чтобы способствовать десенсибилизации 216.Однако не рекомендуется повторно вводить ННИОТ после синдрома Стивенса – Джонсона, приписываемого ННИОТ.
RENAL
Тенофовир и аминогликозиды, используемые для лечения туберкулеза (канамицин, амикацин и стрептомицин), потенциально нефротоксичны 217. Все эти препараты преимущественно вызывают токсичность на уровне проксимальных почечных канальцев 218, и вполне вероятно, что одновременное назначение двух препаратов, имеющих общий такое же токсическое действие может увеличить риск нефротоксичности.Поэтому по возможности следует избегать комбинации тенофовира с аминогликозидами. У пациентов, получающих аминогликозиды в интенсивной фазе лечения МЛУ-ТБ, это важная часть их лечения, и в этот период следует использовать антиретровирусную терапию, альтернативную тенофовиру.
КОГДА НАЧАТЬ АРТ
Руководящие принципы Всемирной организации здравоохранения 2010 года рекомендуют АРТ всем ВИЧ-1-инфицированным пациентам с активным туберкулезом, независимо от количества клеток CD4. Однако оптимальное время для начала АРТ у пациентов с ВИЧ-1 / ТБ до конца не изучено, и сейчас проводится несколько испытаний, чтобы ответить на этот вопрос 219. Риск прогрессирования ВИЧ-1 должен быть сбалансирован с опасностями начала АРТ у пациентов, получающих противотуберкулезную терапию, которые включают токсичность, побочные эффекты, воспалительный синдром восстановления иммунитета (ВСВИ) и лекарственные взаимодействия. АРТ и противотуберкулезные препараты могут иметь сходные пути метаболизма и выведения, а обширные лекарственные взаимодействия также могут привести к субтерапевтическим уровням одного или обоих препаратов в плазме. Перекрывающаяся токсичность может привести к прерыванию схем лечения ТБ или ВИЧ-1 с последующей микробиологической или вирусологической неудачей.Смерть может быть вызвана туберкулезом, особенно если он произошел на ранней стадии, тогда как поздняя смерть у лиц с коинфекцией обычно происходит из-за прогрессирования заболевания ВИЧ-1 53, 96, 220.
Риск прогрессирования ВИЧ-1 должен быть сбалансирован с опасностями начала АРТ у пациентов, получающих противотуберкулезную терапию, которые включают токсичность, побочные эффекты, воспалительный синдром восстановления иммунитета (ВСВИ) и лекарственные взаимодействия. АРТ и противотуберкулезные препараты могут иметь сходные пути метаболизма и выведения, а обширные лекарственные взаимодействия также могут привести к субтерапевтическим уровням одного или обоих препаратов в плазме. Перекрывающаяся токсичность может привести к прерыванию схем лечения ТБ или ВИЧ-1 с последующей микробиологической или вирусологической неудачей.Смерть может быть вызвана туберкулезом, особенно если он произошел на ранней стадии, тогда как поздняя смерть у лиц с коинфекцией обычно происходит из-за прогрессирования заболевания ВИЧ-1 53, 96, 220.
Недавнее исследование, проведенное в Южной Африке, показало явное преимущество в отношении смертности среди ВИЧ-1 / ТБ, начавших АРТ во время лечения ТБ, по сравнению с откладыванием АРТ до завершения лечения ТБ. Было 5,4 смертей на 100 человеко-лет в группе интегрированного лечения и 12,1 на 100 человеко-лет в группе последовательного лечения (HR в группе интегрированной терапии 0.44, р = 0,003). В исследование были включены пациенты, инфицированные ВИЧ-1, с числом CD4 <500 клеток · мкл -1 . Последовательная группа исследования была остановлена комитетом по мониторингу безопасности данных, и всем пациентам было рекомендовано интегрированное АРТ. TB-IRIS чаще встречался в группе комплексного лечения, но события TB-IRIS не требовали изменения схемы АРТ и не вызывали летальных исходов, а нежелательные явления 3 и 4 степени (не-IRIS) были одинаковыми в обеих группах [221]. Другое южноафриканское исследование людей с низким уровнем CD4, начинающих АРТ рано, также показало, что частота ВСВИ высока, а смертность низка 222.Рандомизированное исследование, недавно завершенное в Камбодже, показало улучшение показателей смертности у пациентов с туберкулезом, у которых низкое число CD4 и которые начали АРТ рано.
Было 5,4 смертей на 100 человеко-лет в группе интегрированного лечения и 12,1 на 100 человеко-лет в группе последовательного лечения (HR в группе интегрированной терапии 0.44, р = 0,003). В исследование были включены пациенты, инфицированные ВИЧ-1, с числом CD4 <500 клеток · мкл -1 . Последовательная группа исследования была остановлена комитетом по мониторингу безопасности данных, и всем пациентам было рекомендовано интегрированное АРТ. TB-IRIS чаще встречался в группе комплексного лечения, но события TB-IRIS не требовали изменения схемы АРТ и не вызывали летальных исходов, а нежелательные явления 3 и 4 степени (не-IRIS) были одинаковыми в обеих группах [221]. Другое южноафриканское исследование людей с низким уровнем CD4, начинающих АРТ рано, также показало, что частота ВСВИ высока, а смертность низка 222.Рандомизированное исследование, недавно завершенное в Камбодже, показало улучшение показателей смертности у пациентов с туберкулезом, у которых низкое число CD4 и которые начали АРТ рано. Пациенты были рандомизированы для начала АРТ через 2 недели после начала лечения туберкулеза или через 8 недель. Уровень смертности составил 8,25 (95% ДИ 6,4–10,7) в группе раннего лечения и 13,77 (95% ДИ 11,2–16,9) в группе позднего лечения после 712 человеко-лет наблюдения. Это было статистически значимым (p = 0,02) 223. Напротив, рандомизированное исследование пациентов с коинфекцией ВИЧ-1 во Вьетнаме, которые в основном были мужчинами-потребителями наркотиков с клиническим диагнозом туберкулезный менингит, сравнивалось рано (в тот же день, что и лечение туберкулеза) по сравнению с отсроченными АРТ (через 2 месяца после начала лечения ТБ).Он не показал значительных различий в исходах, таких как смертность через 12 месяцев или события СПИДа. Было значительно увеличено количество нежелательных явлений в группе начала АРТ 224.
Пациенты были рандомизированы для начала АРТ через 2 недели после начала лечения туберкулеза или через 8 недель. Уровень смертности составил 8,25 (95% ДИ 6,4–10,7) в группе раннего лечения и 13,77 (95% ДИ 11,2–16,9) в группе позднего лечения после 712 человеко-лет наблюдения. Это было статистически значимым (p = 0,02) 223. Напротив, рандомизированное исследование пациентов с коинфекцией ВИЧ-1 во Вьетнаме, которые в основном были мужчинами-потребителями наркотиков с клиническим диагнозом туберкулезный менингит, сравнивалось рано (в тот же день, что и лечение туберкулеза) по сравнению с отсроченными АРТ (через 2 месяца после начала лечения ТБ).Он не показал значительных различий в исходах, таких как смертность через 12 месяцев или события СПИДа. Было значительно увеличено количество нежелательных явлений в группе начала АРТ 224.
Пациенты с сохраненным числом CD4 (> 350 клеток · мкл -1 ) имеют более низкий риск прогрессирования ВИЧ-1 или смерти во время лечения ТБ, в зависимости от их возраста и вирусной нагрузки.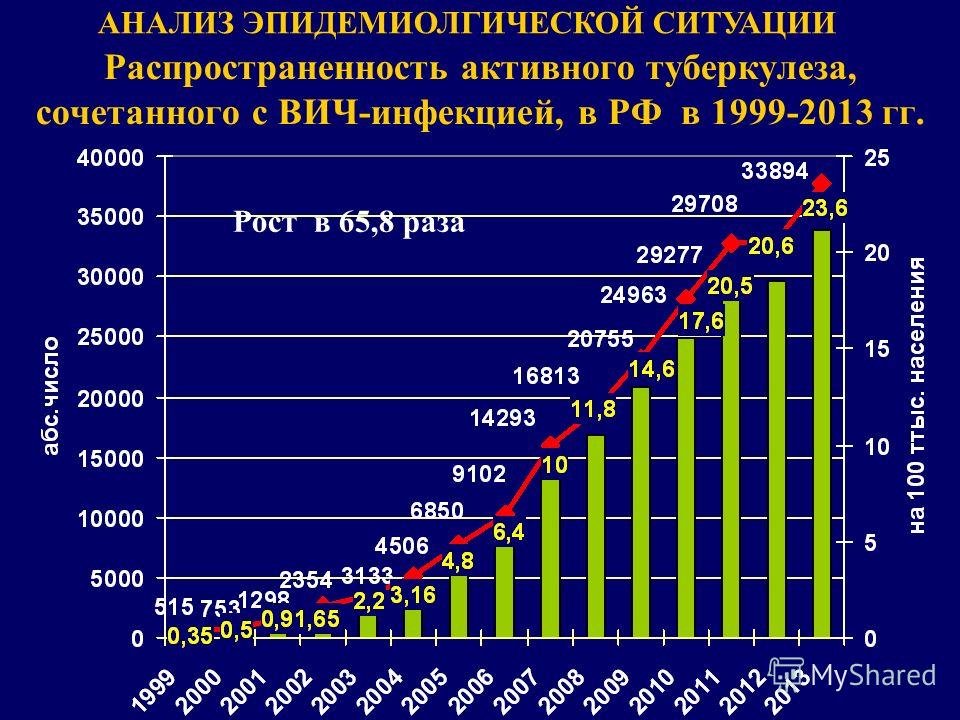 В этой группе АРТ можно отложить до завершения краткосрочного курса лечения туберкулеза при условии, что будет проводиться как клинический мониторинг, так и мониторинг числа CD4.Это может предотвратить токсичность и лекарственные взаимодействия. Однако у большинства пациентов с ТБ наблюдается низкий уровень CD4, часто <100 клеток · мкл -1 . АРТ улучшает выживаемость у этих пациентов, и большинство из них посоветовали бы начать АРТ как можно скорее 225, 226. Некоторые врачи предпочитают подождать до 2 недель, прежде чем начинать АРТ после начала лечения больных туберкулезом, чтобы можно было диагностировать и лечить любое раннее заболевание. токсичность и проблемы с соблюдением режима лечения. Хотя некоторые группы не обнаружили преимущества раннего начала АРТ 227, 228, другие показали, что раннее лечение связано со снижением смертности и скорости прогрессирования 212.
В этой группе АРТ можно отложить до завершения краткосрочного курса лечения туберкулеза при условии, что будет проводиться как клинический мониторинг, так и мониторинг числа CD4.Это может предотвратить токсичность и лекарственные взаимодействия. Однако у большинства пациентов с ТБ наблюдается низкий уровень CD4, часто <100 клеток · мкл -1 . АРТ улучшает выживаемость у этих пациентов, и большинство из них посоветовали бы начать АРТ как можно скорее 225, 226. Некоторые врачи предпочитают подождать до 2 недель, прежде чем начинать АРТ после начала лечения больных туберкулезом, чтобы можно было диагностировать и лечить любое раннее заболевание. токсичность и проблемы с соблюдением режима лечения. Хотя некоторые группы не обнаружили преимущества раннего начала АРТ 227, 228, другие показали, что раннее лечение связано со снижением смертности и скорости прогрессирования 212.
Воспалительный синдром, связанный с туберкулезом, ИММУННОЕ ВОССТАНОВЛЕНИЕ
После начала АРТ репликация ВИЧ-1 значительно снижается, и вирусная нагрузка быстро падает. Это приводит к увеличению количества CD4 T-лимфоцитов и улучшению иммунной функции. Когда АРТ начинают у пациентов со значительной иммуносупрессией в ранний период восстановления иммунной системы, у подгруппы может развиться ВСВИ, также называемое заболеванием восстановления иммунитета 229. ВСВИ проявляется клиническим ухудшением и особенностями воспаления из-за дисрегулируемых иммунных ответов, направленных на антигены условно-патогенных инфекций. , леченные или необработанные, присутствуют до начала АРТ.ВСВИ описывается в связи с широким спектром оппортунистических инфекций, но форма, о которой чаще всего сообщается и представляет наибольшую проблему для клиницистов во всем мире, — это ВСВИ, связанной с ТБ. TB-IRIS рецензировался несколькими авторами 230, 231.
Это приводит к увеличению количества CD4 T-лимфоцитов и улучшению иммунной функции. Когда АРТ начинают у пациентов со значительной иммуносупрессией в ранний период восстановления иммунной системы, у подгруппы может развиться ВСВИ, также называемое заболеванием восстановления иммунитета 229. ВСВИ проявляется клиническим ухудшением и особенностями воспаления из-за дисрегулируемых иммунных ответов, направленных на антигены условно-патогенных инфекций. , леченные или необработанные, присутствуют до начала АРТ.ВСВИ описывается в связи с широким спектром оппортунистических инфекций, но форма, о которой чаще всего сообщается и представляет наибольшую проблему для клиницистов во всем мире, — это ВСВИ, связанной с ТБ. TB-IRIS рецензировался несколькими авторами 230, 231.
TB-IRIS может быть представлен в одной из двух форм. Парадоксальный ТБ-ВСВИ возникает у пациентов, у которых до начала АРТ диагностирована активная форма ТБ, которые обычно улучшают лечение ТБ, а затем в начале АРТ развиваются иммуноопосредованные парадоксальные реакции с новыми или повторяющимися клиническими и / или радиологическими проявлениями ТБ. Менее четко определено разоблачение ТБ-ВСВИ, которое встречается у подгруппы пациентов с диагнозом активного ТБ, получающих АРТ (АРТ-ассоциированный ТБ), и у которых проявляются необычно ускоренные или воспалительные проявления ТБ в течение первых 3 месяцев АРТ 231.
Менее четко определено разоблачение ТБ-ВСВИ, которое встречается у подгруппы пациентов с диагнозом активного ТБ, получающих АРТ (АРТ-ассоциированный ТБ), и у которых проявляются необычно ускоренные или воспалительные проявления ТБ в течение первых 3 месяцев АРТ 231.
ПАРАДОКСИЧЕСКИЙ ТБ-ИРИС
Парадоксальный ТБ-ВСВИ встречается у 8–43% пациентов, начинающих АРТ на фоне лечения ТБ 231. Большинство случаев парадоксального ТБ-ВСВИ развивается в течение первых 4 недель АРТ 222, 232–235. Общими признаками являются повторение симптомов туберкулеза, лихорадка, лимфаденит, увеличение серозных выделений, новые или рецидивирующие инфильтраты на рентгенограмме грудной клетки и подкожные или глубокие тканевые абсцессы 236, 237.Могут быть задействованы несколько систем органов. У пациентов может наблюдаться высокая температура, стойкая тахикардия и потеря веса. Печень может быть поражена холестатическим гепатитом из-за TB-IRIS, проявляясь болезненной гепатомегалией и холестатическим нарушением функции печени 222, 237. Это трудно отличить от лекарственного поражения печени. Неврологические особенности, включая новый или рецидивирующий туберкулезный менингит или увеличивающиеся туберкулемы, были зарегистрированы у 12% пациентов с парадоксальным ТБ-ВСВИ и могут привести к смерти или инвалидности 238.
Это трудно отличить от лекарственного поражения печени. Неврологические особенности, включая новый или рецидивирующий туберкулезный менингит или увеличивающиеся туберкулемы, были зарегистрированы у 12% пациентов с парадоксальным ТБ-ВСВИ и могут привести к смерти или инвалидности 238.
Основными факторами риска парадоксального ТБ-ВСВИ являются диссеминированный ТБ, низкое количество CD4 и более короткий интервал от начала лечения ТБ до начала АРТ 222, 233–235, 239–241. Считается, что патогенным механизмом является воспалительная реакция на антигены микобактерий, все еще присутствующие в тканях, несмотря на лечение ТБ. Продолжительность парадоксального ТБ-ВСВИ обычно составляет 2–3 месяца 240 241, но зарегистрированы случаи длительностью> 1 года 231 241.
Не существует диагностического теста на парадоксальный ТБ-ВСВИ.Диагноз предполагают следующие признаки: улучшение лечения туберкулеза до начала АРТ, ухудшение с воспалительными признаками туберкулеза, тесная временная связь с началом АРТ и исключение альтернативных объяснений ухудшения во время диагностического обследования. Альтернативные диагнозы, которые необходимо рассмотреть, будут зависеть от конкретного случая и включать: другие оппортунистические или бактериальные инфекции, злокачественные новообразования, лекарственно-устойчивый ТБ, несоблюдение или нарушение всасывания противотуберкулезных препаратов и реакцию на лекарства.В исследовании, проведенном в Южной Африке, наиболее частым диагнозом, обнаруживаемым во время обследования, был лекарственно-устойчивый туберкулез. Недиагностированная устойчивость к рифампицину присутствовала у девяти из 100 подозреваемых в ТБ-ВСВИ 236. Тест на лекарственную чувствительность, предпочтительно с помощью экспресс-теста, следует проводить у всех парадоксальных подозреваемых в ТБ-ВСВИ.
Альтернативные диагнозы, которые необходимо рассмотреть, будут зависеть от конкретного случая и включать: другие оппортунистические или бактериальные инфекции, злокачественные новообразования, лекарственно-устойчивый ТБ, несоблюдение или нарушение всасывания противотуберкулезных препаратов и реакцию на лекарства.В исследовании, проведенном в Южной Африке, наиболее частым диагнозом, обнаруживаемым во время обследования, был лекарственно-устойчивый туберкулез. Недиагностированная устойчивость к рифампицину присутствовала у девяти из 100 подозреваемых в ТБ-ВСВИ 236. Тест на лекарственную чувствительность, предпочтительно с помощью экспресс-теста, следует проводить у всех парадоксальных подозреваемых в ТБ-ВСВИ.
В некоторых случаях диагноз прост, например, у пациента с доказанным туберкулезным лимфаденитом, отвечающего на лечение туберкулеза, который испытывает периодические ночные поты и увеличение того же лимфатического узла после начала АРТ.В других случаях может существовать значительная диагностическая неопределенность. Это особенно актуально в условиях ограниченных ресурсов, где первоначальный диагноз туберкулеза часто не подтверждается микробиологически, а диагностические возможности для поиска альтернативных диагнозов и лекарственной устойчивости ограничены. В таких ситуациях может быть неясно, связано ли ухудшение с неправильным диагнозом ТБ или ТБ-ВСВИ.
Это особенно актуально в условиях ограниченных ресурсов, где первоначальный диагноз туберкулеза часто не подтверждается микробиологически, а диагностические возможности для поиска альтернативных диагнозов и лекарственной устойчивости ограничены. В таких ситуациях может быть неясно, связано ли ухудшение с неправильным диагнозом ТБ или ТБ-ВСВИ.
Согласованное определение клинического случая парадоксального ТБ-ВСВИ опубликовано Международной сетью по изучению ВСВИ, ассоциированного с ВИЧ-1 (таблица 5) 231.Это определение случая было разработано для содействия стандартизации результатов исследований в различных условиях, но оно также может иметь практическое применение для врачей, поскольку обеспечивает систематический подход к диагностике парадоксального ТБ-ВСВИ. Это определение случая не включает критерии вирусной нагрузки или CD4, потому что эти тесты часто недоступны в условиях ограниченных ресурсов. Две исследовательские группы независимо друг от друга проверили это определение случая 237, 242.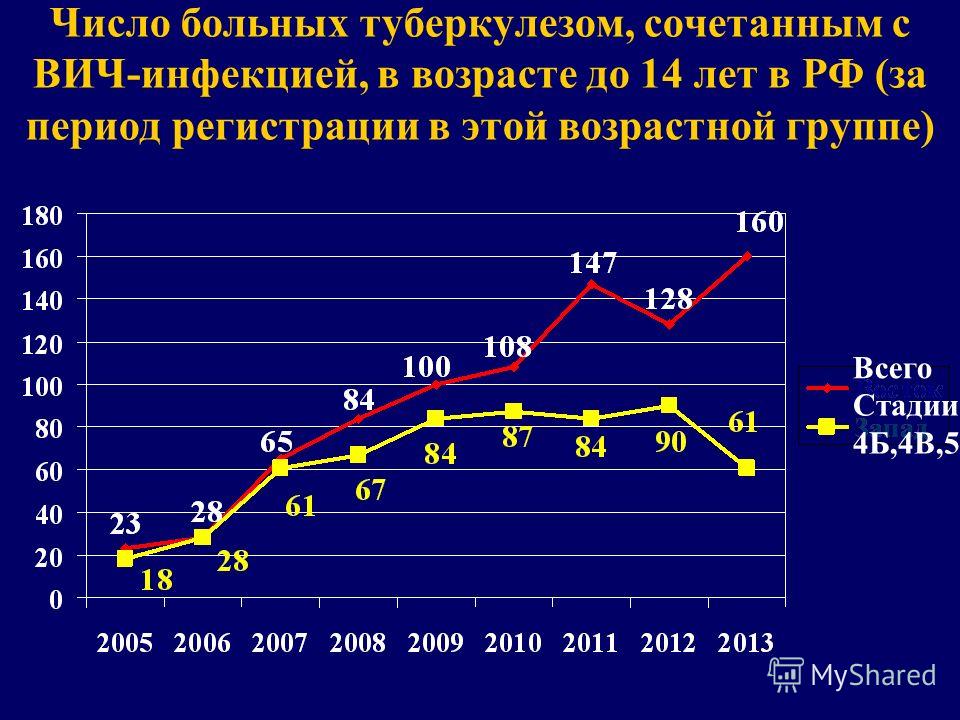 Консенсусное определение клинического случая, по-видимому, работает так же, как определение случая, которое включает критерии вирусной нагрузки и количества клеток CD4, что важно, особенно в условиях ограниченных ресурсов, где эти переменные часто являются не определено на момент презентации с TB-IRIS 237.
Консенсусное определение клинического случая, по-видимому, работает так же, как определение случая, которое включает критерии вирусной нагрузки и количества клеток CD4, что важно, особенно в условиях ограниченных ресурсов, где эти переменные часто являются не определено на момент презентации с TB-IRIS 237.
В легких случаях может потребоваться только симптоматическая терапия. Аспирация больших флюктуирующих лимфатических узлов или абсцессов мягких тканей может облегчить симптомы 241. Очень важно оптимизировать лечение ТБ, особенно в случаях с лекарственно-устойчивым ТБ. Кортикостероиды и нестероидные противовоспалительные препараты — наиболее часто используемые дополнительные методы лечения.В рандомизированном плацебо-контролируемом исследовании преднизона для лечения не опасного для жизни парадоксального ТБ-ВСВИ был проведен 4-недельный курс преднизона (1,5 мг · кг -1 · день -1 в течение 2 недель с последующим 0,75 мг · кг ( -1 · день -1 в течение 2 недель) значительно снизили комбинированную первичную конечную точку количества дней госпитализации и количества выполненных амбулаторных терапевтических процедур. Также наблюдалось более быстрое улучшение симптомов в группе преднизона 243. Кортикостероиды у ВИЧ-1-инфицированных связаны с риском саркомы Капоши, реактивации вируса герпеса, других инфекций и метаболических побочных эффектов 152, 244, 245 и должны быть только используется, когда диагноз парадоксального ТБ-ВСВИ определен и альтернативные диагнозы исключены.
Также наблюдалось более быстрое улучшение симптомов в группе преднизона 243. Кортикостероиды у ВИЧ-1-инфицированных связаны с риском саркомы Капоши, реактивации вируса герпеса, других инфекций и метаболических побочных эффектов 152, 244, 245 и должны быть только используется, когда диагноз парадоксального ТБ-ВСВИ определен и альтернативные диагнозы исключены.
В большинстве случаев АРТ следует продолжать. Прерывание АРТ может быть рассмотрено при угрожающем жизни ТБ-ВСВИ, особенно при тяжелом неврологическом поражении. Были предложены другие иммуномодулирующие препараты, включая талидомид, антагонисты лейкотриенов и ингибиторы фактора некроза опухолей-α, но существуют только отдельные сообщения об их эффективности 230.
НЕЗАКАЗЫВАЮЩИЙ TB-IRIS
Высокие показатели заболеваемости ТБ (5,6–23 случая ТБ на 100 человек в год) в первые 3 месяца АРТ были зарегистрированы в программах АРТ в развивающихся странах 246, 247.Туберкулез является важной причиной высокой смертности, наблюдаемой на ранних этапах АРТ в этих условиях 248.
Было предложено, чтобы подмножество случаев активного ТБ, диагностированного на АРТ, представляло собой разоблачающий TB-IRIS 231, 248. Это пациенты, у которых наблюдаются повышенные воспалительные проявления ТБ в течение первых 3 месяцев АРТ. Предполагается, что у таких пациентов до начала АРТ был недиагностированный или субклинический туберкулез. Предполагается, что сочетание высокой микобактериальной нагрузки организма и быстрого восстановления иммунной системы способствует развитию демаскирующего TB-IRIS 249.Немногочисленные случаи, о которых сообщается в литературе, включают пациентов с тяжелым легочным туберкулезом с быстрым началом 231, 249, 250, одному из которых потребовалась искусственная вентиляция легких из-за респираторного дистресс-синдрома взрослых, связанного с милиарным туберкулезом 250, осложненного неврологического поражения 251, 252 и пиомиозита 253 . Более высокая смертность среди тех, кому поставлен диагноз ТБ в первые 3 месяца АРТ (27% смертности) по сравнению с другими пациентами со СПИДом и ТБ (8% смертность), была зарегистрирована в Гаити 254. Этому, возможно, способствовало разоблачение ТБ. ИРИС.
Этому, возможно, способствовало разоблачение ТБ. ИРИС.
Клиницисты должны проверять симптомы ТБ до начала АРТ, обследовать тех, у кого есть симптомы, и знать, что у некоторых пациентов с тяжелой иммуносупрессией может быть субклинический активный ТБ 248. У пациентов в эндемичных по ТБ условиях или у иммигрантов из этих регионов, состояние которых ухудшается после начала АРТ, Следует строго рассмотреть диагноз демаскирующего ТБ-ВСВИ. Случаи демаскированного ТБ-ВСВИ лечат стандартным лечением ТБ. Роль кортикостероидов в выявлении TB-IRIS не определена.
ПРОФИЛАКТИЧЕСКАЯ ТЕРАПИЯ ПРОТИВ ТБ У ЛЮДЕЙ, ИНФИЦИРОВАННЫХ ВИЧ-1
Профилактическая терапия против ТБ включает лечение лиц с риском развития активного ТБ (лиц с латентной инфекцией M. tuberculosis ) одним или несколькими противотуберкулезными препаратами с целью искоренения инфекции M. tuberculosis до возникновения заболевания. Фактические данные указывают на то, что лечение латентной инфекции ТБ снижает риск активного ТБ у всех инфицированных ВИЧ-1; Однако есть две оговорки. Во-первых, польза наблюдается только у тех, кто имеет положительный результат ТКП (> 5 мм) и с отношением риска 0,38 по сравнению с теми, у кого туберкулиновая кожная проба отрицательна, а отношение риска составляет 0,89 255. Во-вторых, польза непродолжительна. жили в условиях высокого бремени ТБ. Напротив, ПЛИ очень эффективна в снижении риска ТБ в странах с низкой заболеваемостью ТБ 256.
Во-первых, польза наблюдается только у тех, кто имеет положительный результат ТКП (> 5 мм) и с отношением риска 0,38 по сравнению с теми, у кого туберкулиновая кожная проба отрицательна, а отношение риска составляет 0,89 255. Во-вторых, польза непродолжительна. жили в условиях высокого бремени ТБ. Напротив, ПЛИ очень эффективна в снижении риска ТБ в странах с низкой заболеваемостью ТБ 256.
Чтобы начать профилактическую терапию ВИЧ-1 инфицированного человека, необходимо исключить активный туберкулез.Это может вызвать трудности, особенно у людей с развитой иммуносупрессией в регионах с высокой распространенностью ВИЧ-1 и заболеваемостью туберкулезом. Скрининг на активный туберкулез включает скрининг симптомов, микробиологический скрининг, радиологический скрининг или комбинацию этих тестов, и, как указано выше, все они могут иметь пониженную чувствительность у пациентов с распространенным ВИЧ-1. Результативность более интенсивного выявления случаев заболевания в условиях ограниченных ресурсов предсказуемо связана с распространенностью ВИЧ-1 в целевой группе населения, местной заболеваемостью ТБ и стратегией скрининга. При скрининге только популяций, инфицированных ВИЧ-1, были обнаружены существенно более высокие результаты, когда все люди прошли микробиологический скрининг (анализ мокроты) независимо от симптомов, что соответствует значительной части ВИЧ-1 инфицированных пациентов с бессимптомным активным ТБ 19–21, 257. Следовательно, протоколы скрининга могут нуждаться в индивидуальной настройке для различных условий в зависимости от местной и национальной распространенности ВИЧ-1 и ТБ, а также имеющихся лабораторных и лечебных ресурсов.
При скрининге только популяций, инфицированных ВИЧ-1, были обнаружены существенно более высокие результаты, когда все люди прошли микробиологический скрининг (анализ мокроты) независимо от симптомов, что соответствует значительной части ВИЧ-1 инфицированных пациентов с бессимптомным активным ТБ 19–21, 257. Следовательно, протоколы скрининга могут нуждаться в индивидуальной настройке для различных условий в зависимости от местной и национальной распространенности ВИЧ-1 и ТБ, а также имеющихся лабораторных и лечебных ресурсов.
В настоящее время рекомендованное лечение латентного ТБ у ВИЧ-1-инфицированных — это 6–9 месяцев монотерапии изониазидом.Также было обнаружено, что эффективными являются несколько более коротких комбинаций противотуберкулезных препаратов. Эффективность одинакова для всех схем, но риск прекращения лечения из-за побочных эффектов значительно выше при краткосрочных комбинациях терапии по сравнению с монотерапией изониазидом 255. У пациентов, не инфицированных ВИЧ-1, защитный эффект профилактической терапии ТБ сохраняется в течение длительного времени. 258. У ВИЧ-1 инфицированных этого не наблюдалось. Несколько исследований, проведенных в странах с тяжелым бременем ТБ, показали довольно быстрое ослабление защитного эффекта после прекращения профилактического лечения ТБ.В одном исследовании защитный эффект исчез через 6 месяцев, что свидетельствует о необходимости длительного лечения ВИЧ-1 инфицированным людям 259–261. В недавнем крупном когортном исследовании в Ботсване (2000 пациентов, инфицированных ВИЧ-1) сравнивались две группы профилактического лечения ТБ. Одна группа получала 6 месяцев монотерапии изониазидом, затем плацебо, а вторая группа получала 3 года непрерывной монотерапии изониазидом. Исследование показало значительное снижение заболеваемости туберкулезом в течение 36 месяцев в группе непрерывного приема INH по сравнению с группой 6 месяцев.Защитный эффект для 6-месячной группы уменьшился через 200 дней после прекращения приема INH. Преимущество INH наблюдалось только у пациентов с положительным результатом TST, хотя пациенты с отрицательным результатом TST имели высокий риск развития туберкулеза 262.
258. У ВИЧ-1 инфицированных этого не наблюдалось. Несколько исследований, проведенных в странах с тяжелым бременем ТБ, показали довольно быстрое ослабление защитного эффекта после прекращения профилактического лечения ТБ.В одном исследовании защитный эффект исчез через 6 месяцев, что свидетельствует о необходимости длительного лечения ВИЧ-1 инфицированным людям 259–261. В недавнем крупном когортном исследовании в Ботсване (2000 пациентов, инфицированных ВИЧ-1) сравнивались две группы профилактического лечения ТБ. Одна группа получала 6 месяцев монотерапии изониазидом, затем плацебо, а вторая группа получала 3 года непрерывной монотерапии изониазидом. Исследование показало значительное снижение заболеваемости туберкулезом в течение 36 месяцев в группе непрерывного приема INH по сравнению с группой 6 месяцев.Защитный эффект для 6-месячной группы уменьшился через 200 дней после прекращения приема INH. Преимущество INH наблюдалось только у пациентов с положительным результатом TST, хотя пациенты с отрицательным результатом TST имели высокий риск развития туберкулеза 262.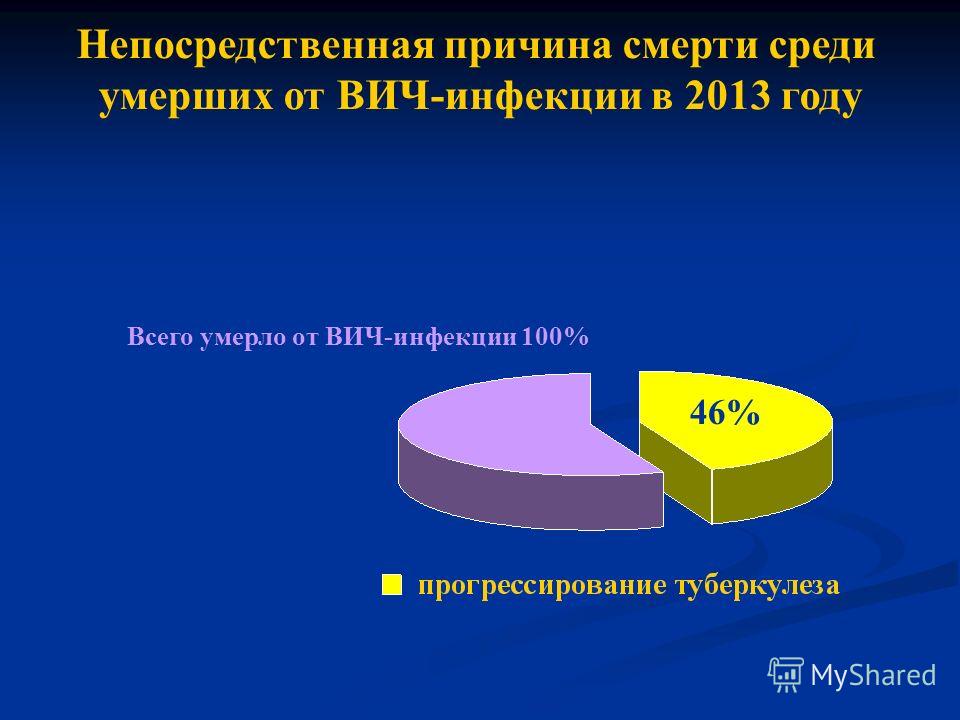
Эти данные позволяют предположить, что даже если ТКП имеет низкую чувствительность для выявления латентной инфекции ТБ у ВИЧ-1 инфицированных, она по-прежнему играет важную роль в выявлении тех людей, инфицированных ВИЧ-1, которые получают пользу от длительного профилактического лечения ТБ. Также предполагается, что те, у кого положительный результат ТКП, должны получать профилактическую терапию дольше, чем рекомендуемые в настоящее время 6 месяцев.Кратковременная защита, индуцированная ИПТ, наблюдаемая у ВИЧ-1 инфицированных, может быть интерпретирована как указание на то, что инфекционное давление в условиях испытаний выше, чем в исследованиях Вефиля 258, и, таким образом, повторное инфицирование может быть важным фактором. Альтернативное объяснение может заключаться в том, что для эффективности ИПТ необходим остаточный иммунный ответ на туберкулез (что проявляется положительным тестом TST).
В районах с низкой заболеваемостью туберкулезом всех ВИЧ-1 инфицированных следует обследовать на латентную туберкулезную инфекцию с помощью TST. ПЛИ следует предлагать, если тест положительный или если известно, что люди заразились туберкулезом. Рекомендуется 9 месяцев ИПТ с монотерапией изониазидом.
ПЛИ следует предлагать, если тест положительный или если известно, что люди заразились туберкулезом. Рекомендуется 9 месяцев ИПТ с монотерапией изониазидом.
В районах с высокой заболеваемостью туберкулезом все люди, инфицированные ВИЧ-1, должны пройти скрининг на латентную туберкулезную инфекцию с помощью ТКП, а лицам с положительным результатом теста должна быть предложена ПТИ. Долгосрочная ИПТ может быть наиболее эффективной, но систематическая оценка не проводилась. Также см. Таблицы 6 и 7 для получения сводного заявления и рекомендаций.
Благодарности
Благодарим Р.Lehloenya и S. Marais, которые консультировали по частям рукописи.
Сноски
Предыдущие статьи из этой серии: № 1: . Erkens CGM, Kamphorst M, Abubakar I, et al. Контактное расследование по поводу туберкулеза в странах с низкой распространенностью: европейский консенсус. Eur Respir J 2010; 36: 925–949. No. 2: Solovic I, Sester M, Gomez-Reino JJ, et al.
 Риск туберкулеза, связанный с терапией антагонистами фактора некроза опухоли: утверждение консенсуса TBNET. Eur Respir J 2010; 36: 1185–1206.
Риск туберкулеза, связанный с терапией антагонистами фактора некроза опухоли: утверждение консенсуса TBNET. Eur Respir J 2010; 36: 1185–1206.Заявление о поддержке
R.J. Уилкинсон и Г. Мейнтьес поддерживаются Wellcome Trust (ссылки 084323, 081667 и 088316). К. Шутц и Г. Мейнтьес прошли курс обучения исследованиям в области туберкулеза в Южной Африке (SATBAT), который финансировался Международным центром Фогарти и Национальным институтом здравоохранения (NIH / FIC 1U2RTW007373-01A1 и U2RTW007370 ICOHRTA). Дополнительную поддержку оказали Совет по медицинским исследованиям Великобритании и Южной Африки, а также Европейский Союз (Sante / 2006 / 105–061).
Заявление о заинтересованности
Не заявлено.
- Получено 14 июля 2010 г.
- Принято 4 октября 2010 г.

Влияние ВИЧ-инфекции на туберкулез
Туберкулез был признан с незапамятных времен и в 19 веке был одним из ведущих причины заболеваемости и смертности в Европе и США. Некоторые из множества названий, которые были даны различным клиническим формам туберкулеза, перечислены в таблице 1.Начиная со второй половины XIX века заболеваемость значительно снизилась в промышленно развитых странах, а к началу 1980-х годов было широко распространено мнение, что болезнь практически побеждена. Это благодушное отношение было поколеблено в начале 1990-х годов резким ростом заболеваемости туберкулезом в Нью-Йорке. Теперь очевидно, что туберкулез, который еще далеко не побежден, является одной из самых распространенных инфекционных причин человеческих страданий и смерти во всем мире.Действительно, сегодня в мире больше случаев туберкулеза, чем когда-либо в истории человечества. Из-за неумолимого распространения туберкулеза во всем мире Всемирная организация здравоохранения (ВОЗ) в 1993 году сделала беспрецедентный шаг, объявив туберкулез глобальной чрезвычайной ситуацией. 1
1
Исторические названия туберкулеза
Глобальное бремя туберкулеза
Глобальное бремя туберкулеза обобщено в таблице 2. Ежегодно это заболевание заболевает от семи до восьми миллионов человек.От туберкулеза ежегодно умирает около трех миллионов человек. Заболевание является причиной 7% всех смертей среди взрослых и 25% смертей среди взрослых, которые можно предотвратить.2 В настоящее время среди детей это важная причина заболеваемости и смертности.3 Заболеваемость и распространенность этого заболевания продолжают расти в развивающихся странах, в то время как во многих развитых странах, включая США и Великобританию, наблюдалась обратная тенденция к снижению, которая наблюдалась с конца 19 века.
Таблица 2Расчетное глобальное бремя туберкулеза (Всемирная организация здравоохранения, 1998 г.)
Этиология туберкулеза
Большинство случаев туберкулеза человека вызывается туберкулезной палочкой человека, Mycobacterium tuberculosis , но в странах, где туберкулез крупного рогатого скота все еще встречается, туберкулез человека также вызывается M. bovis .Кроме того, некоторые случаи, особенно в экваториальной Африке, вызваны довольно разнородной группой штаммов, получившей название M africanum . Хотя они носят разные названия видов, на самом деле они являются членами одного вида, который часто называют комплексом M. tuberculosis . Заражение обычно происходит при вдыхании небольших капелек аэрозоля от кашля, около 5 мкм в диаметре, содержащих туберкулезные палочки. Заражение, вызываемое вирусом M bovis , также происходит при употреблении инфицированного молока, при этом первичные поражения возникают в глотке или кишечнике.В редких случаях заражение происходит в результате травматической инокуляции бацилл на коже, особенно у мясников и других лиц, занимающихся тушами туберкулезных животных.
bovis .Кроме того, некоторые случаи, особенно в экваториальной Африке, вызваны довольно разнородной группой штаммов, получившей название M africanum . Хотя они носят разные названия видов, на самом деле они являются членами одного вида, который часто называют комплексом M. tuberculosis . Заражение обычно происходит при вдыхании небольших капелек аэрозоля от кашля, около 5 мкм в диаметре, содержащих туберкулезные палочки. Заражение, вызываемое вирусом M bovis , также происходит при употреблении инфицированного молока, при этом первичные поражения возникают в глотке или кишечнике.В редких случаях заражение происходит в результате травматической инокуляции бацилл на коже, особенно у мясников и других лиц, занимающихся тушами туберкулезных животных.
Факторы, определяющие предрасположенность к туберкулезу
Не у всех, кто инфицирован туберкулезной палочкой, развивается клинически очевидное заболевание. В целом, при отсутствии очевидных предрасполагающих факторов, около 5% инфицированных заболевают первичным туберкулезом в течение трех лет после инфицирования, а еще у 5% развивается послеродовой туберкулез в любой последующий период их жизни. 5 Многие факторы предрасполагают к развитию туберкулеза, и основные из них перечислены в таблице 3. Вопрос о том, является ли устойчивость к туберкулезу генетически обусловленной, вызвал серьезные споры. В то время как у мышей были выделены различные гены, определяющие устойчивость, их отношение к ситуации с человеком четко не установлено. Точно так же неясно, является ли снижение заболеваемости в развитых странах за последнее столетие главным образом естественным отбором или улучшением социальных условий.
5 Многие факторы предрасполагают к развитию туберкулеза, и основные из них перечислены в таблице 3. Вопрос о том, является ли устойчивость к туберкулезу генетически обусловленной, вызвал серьезные споры. В то время как у мышей были выделены различные гены, определяющие устойчивость, их отношение к ситуации с человеком четко не установлено. Точно так же неясно, является ли снижение заболеваемости в развитых странах за последнее столетие главным образом естественным отбором или улучшением социальных условий.
Факторы, определяющие предрасположенность к туберкулезу
Факторы окружающей среды также могут влиять на предрасположенность к прогрессированию туберкулеза. Так, например, было высказано предположение, что воздействие микобактерий из окружающей среды может, в зависимости от характера воздействия, оказывать положительное или отрицательное влияние на соответствующие иммунные реакции.6 Возраст также влияет на восприимчивость: пожилые и очень молодые выглядят больше восприимчивы, тогда как дети в возрасте от 5 до 15 лет кажутся относительно невосприимчивыми к развитию туберкулеза — «группа золотого возраста». Эти возрастные вариации защиты могут быть связаны с гормональной регуляцией иммунных ответов.
Эти возрастные вариации защиты могут быть связаны с гормональной регуляцией иммунных ответов.
Воздействие пандемии ВИЧ / СПИДа на глобальное бремя туберкулеза
Помимо перечисленных выше факторов, иммуносупрессия любого типа является предрасполагающим фактором для развития туберкулеза. С начала 80-х годов прошлого века ВИЧ-инфекция превратилась в самый важный из предрасполагающих факторов8. У лиц, коинфицированных туберкулезной палочкой и ВИЧ, общий годовой риск развития активного туберкулеза повышается примерно с 0.От 4% до 8%, то есть в 20 раз больше риска9. Однако риск зависит от степени иммуносупрессии — риск развития туберкулеза у пациента со СПИДом в 170 раз выше, чем у человека без иммунодепрессии. По этим причинам инфицирование ВИЧ и M tuberculosis было названо «проклятым дуэтом» 10.
По состоянию на конец 1998 года, по оценкам, более 33 миллионов человек были инфицированы ВИЧ11, и их региональное распределение показано в таблице 4. Большинство инфицированных были в возрасте от 15 до 49 лет и, как показано в таблице 4, более 1 года. % этой возрастной группы ВИЧ-инфицированы.Если предположить, что треть из них коинфицированы туберкулезной палочкой и что у 8% из них ежегодно развивается активный туберкулез, то в 1999 г. может быть почти один миллион случаев туберкулеза, связанного с ВИЧ, что составляет около 10% ожидаемых новых случаев туберкулеза. в том году. Было подсчитано, что туберкулез станет причиной 30% ожидаемых 2,5 миллиона смертей, связанных со СПИДом, в 1999 г.11
% этой возрастной группы ВИЧ-инфицированы.Если предположить, что треть из них коинфицированы туберкулезной палочкой и что у 8% из них ежегодно развивается активный туберкулез, то в 1999 г. может быть почти один миллион случаев туберкулеза, связанного с ВИЧ, что составляет около 10% ожидаемых новых случаев туберкулеза. в том году. Было подсчитано, что туберкулез станет причиной 30% ожидаемых 2,5 миллиона смертей, связанных со СПИДом, в 1999 г.11
Глобальное бремя ВИЧ / СПИДа, декабрь 1998 г.
В дополнение к высокому риску развития реактивационного туберкулеза, ВИЧ-положительные люди могут быть инфицированы или повторно инфицированы туберкулезной палочкой и подвергаются очень высокому риску развития активного туберкулеза.12 Риск такого заражения и повторного инфицирования туберкулезом зависит от количества случаев заражения в сообществе и, следовательно, является низким в регионах с низкой распространенностью туберкулеза.13 Точный риск развития туберкулеза после контакта ВИЧ-инфицированного человека с источником Случай неизвестен из-за трудности различения недавней инфекции и реактивации. Большинство задокументированных случаев связаны с контактом пациентов с источниками во время госпитализации по поводу заболевания, связанного со СПИДом. Эти пациенты, как следствие, имеют глубокую иммуносупрессию, и их шанс прогрессировать до явного туберкулеза после заражения приближается к 100%.Более того, клиническое течение болезни «сокращается» до нескольких месяцев, а не лет или десятилетий.10 Такое воздействие в больницах и других учреждениях стало причиной ряда взрывоопасных миниэпидемий, сначала в Нью-Йорке, а затем в Европе. .14
Большинство задокументированных случаев связаны с контактом пациентов с источниками во время госпитализации по поводу заболевания, связанного со СПИДом. Эти пациенты, как следствие, имеют глубокую иммуносупрессию, и их шанс прогрессировать до явного туберкулеза после заражения приближается к 100%.Более того, клиническое течение болезни «сокращается» до нескольких месяцев, а не лет или десятилетий.10 Такое воздействие в больницах и других учреждениях стало причиной ряда взрывоопасных миниэпидемий, сначала в Нью-Йорке, а затем в Европе. .14
Распространенность и распространение туберкулеза, связанного с ВИЧ
Бремя туберкулеза, связанного с ВИЧ, распределяется неравномерно, поскольку оно определяется общей распространенностью инфекции туберкулезной палочкой и ВИЧ в сообществе, а также социальными факторами, которые способствуют перекрестному распространению этих двух инфекций.В США туберкулез, связанный с ВИЧ, в значительной степени ограничен социально-экономически неблагополучными общинами в Нью-Йорке и других крупных городах15. Это было появление миниэпидемий туберкулеза, связанного с ВИЧ, в Нью-Йорке в начале 1990-х гг., И беспокойство, вызванное в целом населения, что привело к всплеску интереса и беспокойства по поводу этого состояния. В Великобритании туберкулез, связанный с ВИЧ, хотя и не является серьезной проблемой, становится все более распространенным как среди иммигрантов, так и среди коренного населения.Поэтому туберкулезные клиники поощряются к увеличению использования тестирования на ВИЧ16, и клиники, специализирующиеся на ВИЧ, всегда должны держать туберкулез в списке дифференциальных диагнозов в любом трудном клиническом случае.
Это было появление миниэпидемий туберкулеза, связанного с ВИЧ, в Нью-Йорке в начале 1990-х гг., И беспокойство, вызванное в целом населения, что привело к всплеску интереса и беспокойства по поводу этого состояния. В Великобритании туберкулез, связанный с ВИЧ, хотя и не является серьезной проблемой, становится все более распространенным как среди иммигрантов, так и среди коренного населения.Поэтому туберкулезные клиники поощряются к увеличению использования тестирования на ВИЧ16, и клиники, специализирующиеся на ВИЧ, всегда должны держать туберкулез в списке дифференциальных диагнозов в любом трудном клиническом случае.
С глобальной точки зрения, регион, наиболее пострадавший в конце тысячелетия, — это Африка к югу от Сахары, где произошло 83% всех смертей, связанных со СПИДом.17-19 Однако заболеваемость ВИЧ-инфекцией быстро растет в Азии, где большой процент населения, инфицированного туберкулезной палочкой, жив.17 В странах Африки к югу от Сахары особенно страдают страны Восточной и Центральной Африки, где примерно каждый пятый взрослый инфицирован ВИЧ. 11 В этих странах ВИЧ в основном передается гетеросексуальным путем, и женщины заражаются так же часто, как и мужчины. В Замбии, по крайней мере, каждая четвертая беременная женщина является ВИЧ-серопозитивной20, и, поскольку около 50% также инфицированы туберкулезной палочкой, каждая восьмая, вероятно, будет коинфицирована. Недавнее исследование, проведенное в Замбии, показывает, что туберкулез, связанный с ВИЧ, является после малярии самой важной неакушерской причиной материнской смертности.21 Растущее число случаев туберкулеза среди африканских детей связано с ВИЧ. В Замбии уровень распространенности ВИЧ среди детей, госпитализированных с туберкулезом, вырос с 18% до 67% за восьмилетний период до 1995 г., в то время как за тот же период уровень распространенности ВИЧ оставался на постоянном уровне 10% у детей, госпитализированных для хирургического вмешательства. условия.22
11 В этих странах ВИЧ в основном передается гетеросексуальным путем, и женщины заражаются так же часто, как и мужчины. В Замбии, по крайней мере, каждая четвертая беременная женщина является ВИЧ-серопозитивной20, и, поскольку около 50% также инфицированы туберкулезной палочкой, каждая восьмая, вероятно, будет коинфицирована. Недавнее исследование, проведенное в Замбии, показывает, что туберкулез, связанный с ВИЧ, является после малярии самой важной неакушерской причиной материнской смертности.21 Растущее число случаев туберкулеза среди африканских детей связано с ВИЧ. В Замбии уровень распространенности ВИЧ среди детей, госпитализированных с туберкулезом, вырос с 18% до 67% за восьмилетний период до 1995 г., в то время как за тот же период уровень распространенности ВИЧ оставался на постоянном уровне 10% у детей, госпитализированных для хирургического вмешательства. условия.22
Патология туберкулеза при ВИЧ-инфекции
Легкие ВИЧ-положительных пациентов, умирающих от туберкулеза, характеризуются фиброзными и кальцинированными туберкулезными поражениями, перемежающимися с более новыми активными поражениями, содержащими туберкулезные палочки. 23 Последнее может быть связано либо с реактивацией старых поражений, либо с повторным инфицированием. Точная природа иммунодефицита, который приводит к повышенному риску туберкулеза у ВИЧ-положительных пациентов, не установлена, и описан ряд патологических характеристик. У пациентов с относительно интактной иммунной функцией и относительно высоким числом CD4 + наблюдаются классические казеозные гранулемы, характеризующиеся зрелыми эпителиоидными клетками и гигантскими клетками Лангханса, но с небольшим количеством видимых бацилл или без них.По мере увеличения иммунного дефекта и снижения количества CD4 + -клеток встречаются более диффузные поражения с обильным некрозом тканей, мало или совсем отсутствуют зрелые эпителиоидные клетки и многочисленные туберкулезные палочки.
25 Фибротические реакции, ответственные за блокирование очагов активного заболевания, уменьшаются у более анергических пациентов, что способствует локальному распространению и широкому распространению болезни. Также снижается образование кариеса, также являющегося результатом активного, хотя и несоответствующего иммунного ответа.
23 Последнее может быть связано либо с реактивацией старых поражений, либо с повторным инфицированием. Точная природа иммунодефицита, который приводит к повышенному риску туберкулеза у ВИЧ-положительных пациентов, не установлена, и описан ряд патологических характеристик. У пациентов с относительно интактной иммунной функцией и относительно высоким числом CD4 + наблюдаются классические казеозные гранулемы, характеризующиеся зрелыми эпителиоидными клетками и гигантскими клетками Лангханса, но с небольшим количеством видимых бацилл или без них.По мере увеличения иммунного дефекта и снижения количества CD4 + -клеток встречаются более диффузные поражения с обильным некрозом тканей, мало или совсем отсутствуют зрелые эпителиоидные клетки и многочисленные туберкулезные палочки.
25 Фибротические реакции, ответственные за блокирование очагов активного заболевания, уменьшаются у более анергических пациентов, что способствует локальному распространению и широкому распространению болезни. Также снижается образование кариеса, также являющегося результатом активного, хотя и несоответствующего иммунного ответа.
Клинические особенности туберкулеза, связанного с ВИЧ
Диагностика туберкулеза никогда не была простой, так как существует очень широкий спектр клинических признаков. Появление туберкулеза, связанного с ВИЧ, с множеством необычных проявлений, значительно усугубило диагностические трудности. Повышенная клиническая осведомленность остается основой диагностики. Туберкулез может развиться в любой момент в ходе ВИЧ-инфекции и, таким образом, может возникать на ранних этапах развития ВИЧ-инфекции, часто до того, как произойдет какое-либо значительное снижение количества CD4 + Т-клеток или появятся другие клинические состояния, указывающие на ВИЧ-инфекцию или СПИД.
Природа, проявления, клинические и радиологические особенности туберкулеза зависят от степени иммуносупрессии. У людей с относительно хорошим иммунитетом и количеством CD4 + клеток, а также с низкой вирусной нагрузкой проявления и симптомы туберкулеза по существу аналогичны таковым у ВИЧ-отрицательных людей. По мере снижения иммунокомпетентности увеличивается частота атипичных проявлений туберкулеза, и диагностические трудности возникают из-за довольно неспецифических признаков, которые можно спутать с признаками других инфекций, связанных с ВИЧ.3
26
27 Эти атипичные формы туберкулеза включают быстрое прогрессирование клинического заболевания после заражения и высокую долю внелегочного, множественного и широко распространенного туберкулеза. Клинические признаки туберкулеза, связанного с ВИЧ и не связанного с ним, сравниваются в таблице 5.
По мере снижения иммунокомпетентности увеличивается частота атипичных проявлений туберкулеза, и диагностические трудности возникают из-за довольно неспецифических признаков, которые можно спутать с признаками других инфекций, связанных с ВИЧ.3
26
27 Эти атипичные формы туберкулеза включают быстрое прогрессирование клинического заболевания после заражения и высокую долю внелегочного, множественного и широко распространенного туберкулеза. Клинические признаки туберкулеза, связанного с ВИЧ и не связанного с ним, сравниваются в таблице 5.
Сравнение клинических особенностей туберкулеза у ВИЧ-инфицированных и неинфицированных пациентов
Наиболее частыми внелегочными проявлениями туберкулеза являются: (а) асимметричная лимфаденопатия, (б) перикардит, (в) плеврит и (г) кости и кожа.По неясным причинам поражение центральной нервной и мочеполовой систем в Африке встречается нечасто по сравнению с промышленно развитыми странами28. Более общее распространение болезни может привести к множеству мелких повреждений по всему телу.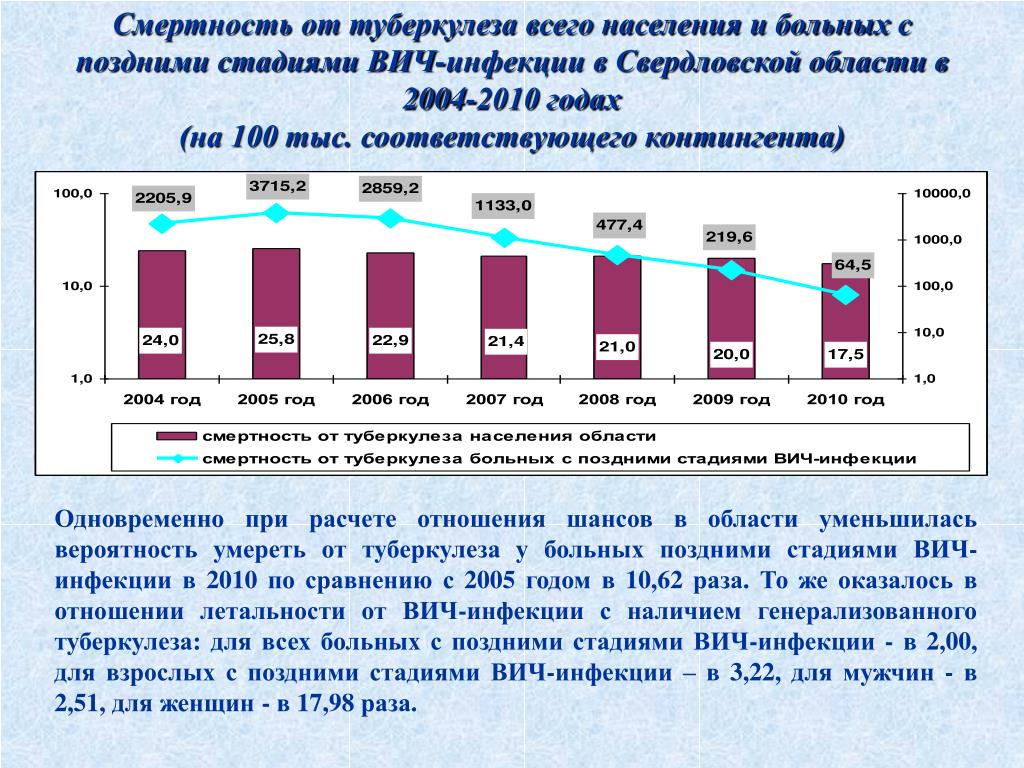 Это состояние, называемое криптогенным диссеминированным туберкулезом, может быть очень трудно диагностировать в течение жизни. Поэтому многие неожиданные случаи диагностируются при вскрытии трупа и представляют серьезный риск для патолога. Туберкулиновые тесты могут быть отрицательными, особенно у пациентов с более тяжелой иммуносупрессией, хотя степень уплотнения не имеет тесной связи с количеством CD4 + лимфоцитов и, таким образом, является независимым маркером иммунной компетентности.29 Посев крови положительный у от трети до половины пациентов с диссеминированным туберкулезом, связанным с ВИЧ.30
Это состояние, называемое криптогенным диссеминированным туберкулезом, может быть очень трудно диагностировать в течение жизни. Поэтому многие неожиданные случаи диагностируются при вскрытии трупа и представляют серьезный риск для патолога. Туберкулиновые тесты могут быть отрицательными, особенно у пациентов с более тяжелой иммуносупрессией, хотя степень уплотнения не имеет тесной связи с количеством CD4 + лимфоцитов и, таким образом, является независимым маркером иммунной компетентности.29 Посев крови положительный у от трети до половины пациентов с диссеминированным туберкулезом, связанным с ВИЧ.30
У значительной части африканских пациентов, больных СПИДом, развивается тяжелая форма истощения, поэтому местные жители называют ее «болезнью похудания». Многие такие пациенты страдают хронической диареей, и, таким образом, считалось, что это состояние вызвано энтеропатией, но в одном исследовании, проведенном в Африке, почти половина пациентов со СПИДом умерла от «болезни тонкости», и почти половина из них, как было обнаружено, имели диссеминированный туберкулез при вскрытии. чуть более четверти из тех, кто умирает без таких потерь.31 год
чуть более четверти из тех, кто умирает без таких потерь.31 год
Детский туберкулез, связанный с ВИЧ
Клинические различия в заболевании у ВИЧ-положительных и ВИЧ-отрицательных детей не так разительны, как у взрослых.22 В Африке большая часть обращений в педиатрические клиники и госпитализаций связана с легочными заболеваниями, и отличить туберкулез от других причин всегда непросто. обычно основывается на клинических характеристиках, туберкулиновом тесте и истории контакта с источником. Лабораторные исследования часто бесполезны, поскольку очаги поражения обычно закрыты, а мокрота, даже если ее можно получить, почти всегда отрицательна на кислотоустойчивые бациллы при микроскопии.Даже при наличии самых современных диагностических средств диагноз может быть подтвержден посевом только примерно в половине случаев.32 Положительные культуры могут быть получены из необычных мест: в исследовании, проведенном в Южной Африке, шесть из 14 ВИЧ-инфицированных детей с положительным посевом туберкулеза имели оторею, а мазки из уха были источником положительных культур в трех таких случаях.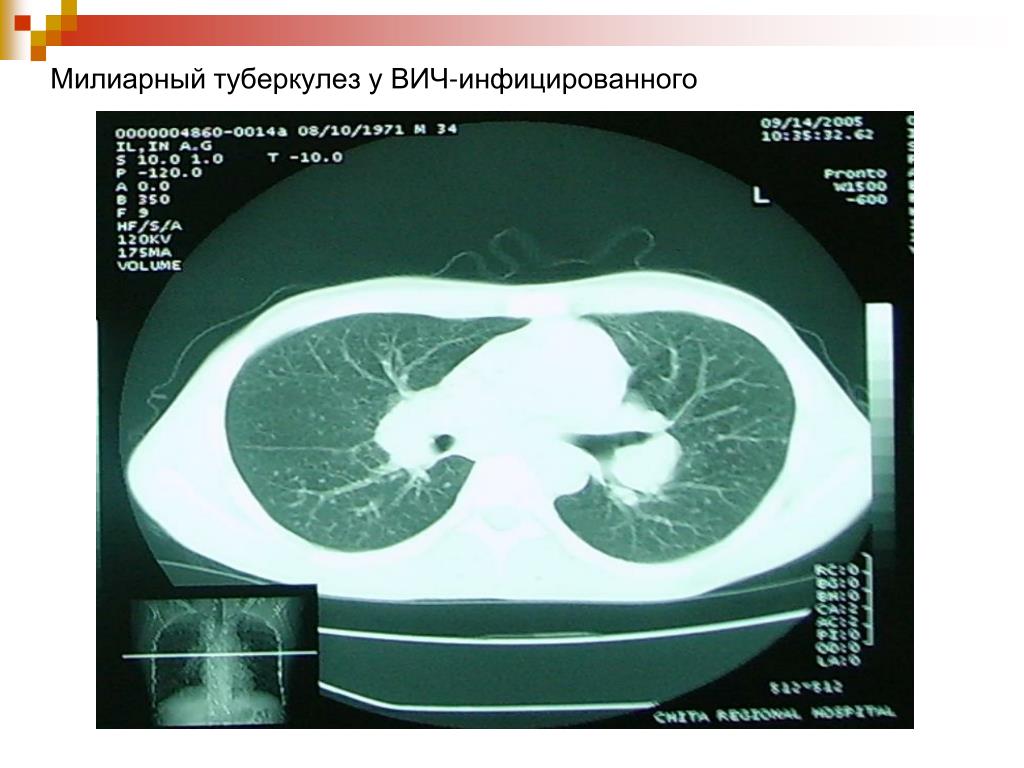 33
33
Дополнительные диагностические трудности возникают у ВИЧ-положительных детей, поскольку общие диагностические критерии, такие как хронический кашель, потеря веса и неспособность развиваться, также могут быть результатом других легочных инфекций, связанных с ВИЧ, таких как Pneumocystis carinii пневмония и болезнь, вызванная окружающей средой. микобактерии, особенно члены комплекса M avium .34 Точно так же радиологические характеристики этих других инфекций могут быть неотличимы от таковых для туберкулеза. Таким образом, в развивающихся странах часто ставят неправильный диагноз, что затрудняет оценку масштабов проблемы туберкулеза, связанного с ВИЧ, у детей. Представление об истинном риске туберкулеза у ВИЧ-инфицированных детей может быть получено из исследований аутопсии. Одно из таких исследований в Западной Африке показало низкий риск35, но вскрытие туберкулеза, проведенное у ВИЧ-положительных детей в Булавайо, Зимбабве, позволило установить диагноз туберкулеза у шести из 122 детей (5%). 36 В Замбии в настоящее время проводится крупное вскрытие трупа детей, умирающих от респираторных заболеваний.
36 В Замбии в настоящее время проводится крупное вскрытие трупа детей, умирающих от респираторных заболеваний.
Диагностика туберкулеза
Ввиду проблем, возникающих при клинической диагностике туберкулеза, огромные усилия были приложены к разработке быстрых и чувствительных диагностических тестов, но возникли серьезные проблемы. Традиционно диагноз ставился путем микроскопической демонстрации кислотоустойчивых бацилл в биологических образцах и культивирования туберкулезных бацилл in vitro.Ни один из подходов не является полностью удовлетворительным, и в последнее время внимание было обращено на молекулярные методы диагностики.
МИКРОСКОПИЯ
В основном это применяется к мокроте, но другие образцы включают жидкость бронхоальвеолярного лаважа, смывы желудка, мазки из гортани, спинномозговую жидкость, плевральные, перикардиальные и перитонеальные выпоты, аспираты тонкоигольных лимфатических узлов, аспираты костного мозга и биопсии тканей. В идеале следует исследовать три образца мокроты, собранные в последовательные дни, но, особенно в странах с ограниченными ресурсами, это способствует несоблюдению требований и перегружает лабораторию. 4 У детей мокрота выделяется редко: только 5% случаев детского туберкулеза легких имеют положительный результат мазка. Желудочный аспират с большей вероятностью будет положительным, но мазок из гортани причиняет беспокойство ребенку, подвергает оператора риску инфицирования и дает низкую диагностическую ценность.
4 У детей мокрота выделяется редко: только 5% случаев детского туберкулеза легких имеют положительный результат мазка. Желудочный аспират с большей вероятностью будет положительным, но мазок из гортани причиняет беспокойство ребенку, подвергает оператора риску инфицирования и дает низкую диагностическую ценность.
Микроскопия мокроты выполняется быстро, что позволяет поставить предположительный диагноз при первом визите пациента в клинику, но она нечувствительна, так как в 1 мл мокроты должно быть не менее 5000 организмов, чтобы сделать их обнаружение вероятным.Микроскопия не позволяет отличить туберкулезные микобактерии от микобактерий окружающей среды, но это не является серьезной проблемой в регионах, где распространен туберкулез. Как упоминалось выше, пациенты с туберкулезом, связанным с ВИЧ, особенно пациенты с более выраженной иммуносупрессией и без образования полостей, с большей вероятностью будут иметь отрицательный результат по мокроте, чем пациенты с типичным кавитирующим пост-первичным заболеванием.
КУЛЬТУРА
Выделение M tuberculosis в культуре, облегчая идентификацию на уровне видов, позволяет поставить окончательный диагноз.Традиционный метод инокуляции твердой среды, такой как среда Левенштейна-Йенсена на основе яиц, является чувствительным, но медленным, так как рост может быть незаметен до трех или более недель инкубации. Более быстрые результаты достигаются при использовании коммерчески доступных систем культивирования, основанных на высвобождении радиоактивно меченного диоксида углерода (CO 2 ) или изменении цвета или флуоресценции красителей из-за высвобождения CO 2 или потребления кислорода. 4
СЕРОЛОГИЧЕСКИЕ ИСПЫТАНИЯ
Были предприняты многочисленные попытки разработать серологические тесты на туберкулез, и некоторые из них коммерчески доступны, но возникли серьезные проблемы специфичности и чувствительности.Из-за ослабленного иммунного ответа чувствительность еще ниже у пациентов с туберкулезом, связанным с ВИЧ37.
МОЛЕКУЛЯРНЫЕ МЕТОДЫ
Ввиду проблем, возникающих при использовании традиционных микробиологических методов, применение методов амплификации нуклеиновых кислот (ДНК и РНК) — полимеразной цепной реакции (ПЦР) и лигазной цепной реакции (LCR) — является предметом интенсивной исследовательской деятельности. В результате на рынке имеется ряд наборов для быстрого, чувствительного и специфического тестирования.38 Проблемы возникают в результате присутствия ингибирующих веществ в некоторых клинических образцах, которые снижают чувствительность, особенно в образцах мокроты с отрицательным мазком мокроты, и необъяснимого появления нескольких «ложноположительных» результатов4. Другой проблемой является перекрестное заражение, хотя это минимизируется закрытыми изотермическими системами, основанными на амплификации специфической информационной РНК, которая имеет короткий период полураспада.
Молекулярные методы также позволяют быстро идентифицировать микобактерии, отличные от M tuberculosis , и определять устойчивость к рифампицину путем обнаружения мутаций в гене RpoB , ответственного за устойчивость.39
Еще одним применением молекулярной технологии является «снятие отпечатков пальцев» с изолятов или продуктов ПЦР M tuberculosis . Такие методы использовались для исследования миниэпидемий туберкулеза, связанного с ВИЧ, и для различения реактивации старых поражений и недавней инфекции. Таким образом, было показано, что, особенно среди ВИЧ-положительных людей, повторное инфицирование происходит гораздо чаще, чем предполагалось ранее40. В настоящее время стоимость ядерной технологии, а не технические проблемы, препятствует ее использованию в странах с ограниченными ресурсами.
РАДИОГРАФИЯ НАГРУДНИКА
Рентгенологические проявления туберкулеза легких как у ВИЧ-отрицательных, так и у положительных, очень изменчивы, но в большей степени у последних.41 42 Классические проявления туберкулеза на рентгенограммах грудной клетки наблюдаются примерно у одной трети ВИЧ-инфицированных пациентов, в то время как у других наблюдается целый ряд нетипичных проявлений. Радиологические исследования взрослых заирских и замбийских пациентов с ВИЧ-ассоциированным туберкулезом показывают значительно повышенную частоту лимфаденопатии, плевральных выпотов, паренхиматозных изменений, консолидации и милиарного заболевания, но значительно меньшее количество полостных заболеваний и ателектазов.42 Внутригрудная лимфаденопатия, редко встречающаяся у взрослых, не инфицированных ВИЧ и страдающих послеродовым туберкулезом, выявляется у 25–50% у ВИЧ-инфицированных взрослых с туберкулезом легких. 43 Факторы, определяющие рентгенологические проявления туберкулеза у ВИЧ-инфицированных пациентов, недостаточно изучены. Вопреки предыдущему мнению, способность образовывать полости и фиброзные изменения, по-видимому, не связаны напрямую с количеством клеток CD4 +. Возникновение атипичных радиологических проявлений туберкулеза легких, связанного с ВИЧ, имеет значение для точного диагноза заболевания, и поэтому требуется высокая степень клинического подозрения.
Лечение туберкулеза, связанного с ВИЧ
Стандартная противотуберкулезная схема, рекомендованная ВОЗ, представляет собой шестимесячный курс рифампицина и изониазида с добавлением пиразинамида вместе с этамбутолом (или стрептомицином) в течение первых двух месяцев лечения. Ежедневный прием пиридоксина (витамина B6) для предотвращения невропатии, вызванной изониазидом, в настоящее время является обычным делом.
Противотуберкулезные схемы, основанные на лекарствах, отличных от рифампицина, или использование рифампицина только в течение первых двух месяцев использовались на том основании, что они дешевле.Разница в стоимости сейчас не так велика, и с точки зрения частоты рецидивов и продолжительности лечения схемы на основе рифампицина в конечном итоге намного более рентабельны.
Схемы на основе тиацетазона, хотя и дешевые, вызывают неприемлемо высокую частоту тяжелых токсических реакций у ВИЧ-инфицированных, и от них следует повсеместно отказаться.
При использовании короткого курса лечения на основе рифампицина разница в частоте рецидивов между ВИЧ-инфицированными и неинфицированными пациентами практически отсутствует.Таким образом, при отсутствии лекарственной устойчивости рекомендуется стандартный короткий курс, описанный выше.44 Тем не менее, некоторые врачи продолжают лечение в течение девяти месяцев, чтобы еще больше снизить риск рецидива.45 46 К сожалению, как указано ниже, многие пациенты умирают от других осложнений, связанных с ВИЧ, во время или после завершения противотуберкулезного лечения. В одном исследовании продление лечения на основе рифампицина с шести до 12 месяцев снизило частоту рецидивов, но не улучшило выживаемость.47
Кроме того, из-за ряда человеческих факторов, включая негативное восприятие болезни, ее лечения и исхода, а также стигматизирующий характер диагноза, ВИЧ-положительные пациенты в некоторых регионах реже, чем серонегативные пациенты, завершают лечение.48 Таким образом, важно принять стратегии терапии под непосредственным наблюдением (DOT), чтобы гарантировать завершение лечения.44 Эта стратегия может также помочь ограничить появление лекарственно-устойчивого туберкулеза, но в некоторых африканских странах даже создание национальной системы лечения туберкулеза программы, использующие стратегии, основанные на ДОТ, не могут остановить нарастающую волну туберкулеза. В Ботсване, например, заболеваемость туберкулезом выросла на 120% в период с 1989 по 1996 год, что соответствует показателю распространенности ВИЧ-инфекции, несмотря на десятилетие применения таких стратегий и низкую распространенность лекарственной устойчивости.49
Побочные эффекты противотуберкулезной химиотерапии
Побочные эффекты противотуберкулезных препаратов первого ряда проявляются как у ВИЧ-инфицированных, так и у неинфицированных пациентов, поэтому за пациентом следует тщательно наблюдать. Побочные эффекты противотуберкулезных препаратов сравнительно чаще встречаются у ВИЧ-инфицированных больных туберкулезом, и в нескольких исследованиях наблюдались очень тяжелые и даже фатальные реакции. Наиболее серьезные проблемы возникают с тиацетазоном, особенно кожные реакции, включая эксфолиативный дерматит и часто смертельный синдром Стивенса-Джонсона.В одном исследовании взрослых из Кении токсичность тиацетазона была в 18 раз более частой у ВИЧ-положительных, чем у ВИЧ-отрицательных пациентов, и риск был напрямую связан со степенью иммуносупрессии, что свидетельствует об иммунологической основе50. фатальные реакции на тиацетазон и подчеркнули преимущества схем без тиацетазона.51 Соответственно, как упоминалось выше, схемы, содержащие тиацетазон, больше не должны использоваться.
Противотуберкулезные лекарственные взаимодействия
Описан ряд взаимодействий между противотуберкулезными агентами и другими лекарствами.52 Большинство взаимодействий связано с рифампицином из-за его способности индуцировать ферменты цитохрома CYP450 в печени, которые влияют на метаболизм многих других препаратов (таблица 6). Помимо воздействия на метаболизм противогрибковых и других лекарств, которые могут потребоваться ВИЧ-инфицированным пациентам, могут происходить серьезные взаимодействия между рифампицином и антиретровирусными препаратами (ингибиторами протеазы и ненуклеозидными ингибиторами обратной транскриптазы). Рекомендуемая практика заключалась в прекращении антиретровирусного лечения, чтобы можно было использовать рифампицин для лечения туберкулеза, но в настоящее время рекомендуется заменить рифампицин рифабутином, гораздо менее мощным индуктором ферментов цитохрома, и начать или продолжить прием антиретровирусных препаратов.46 Даже если рифабутин заменяет рифампицин, следует проявлять осторожность при использовании ингибитора протеазы саквинавира и ненуклеозидных ингибиторов обратной транскриптазы, поскольку рифабутин снижает их уровни, что создает риск селекции устойчивых к лекарствам вирусов. одновременное назначение антиретровирусных препаратов и противотуберкулезной химиотерапии является временным обострением симптомов и признаков туберкулеза — так называемых парадоксальных реакций53. Они, которые приписывают реакциям гиперчувствительности к антигену, выделяемому убитыми химиотерапией бактериями, проявляются в виде лихорадки. увеличение пораженных лимфатических узлов и ухудшение рентгенологического состояния.Они иногда встречаются у ВИЧ-серонегативных пациентов, но их частота выше у ВИЧ-серопозитивных пациентов, особенно у тех, кто принимает антиретровирусные препараты, вероятно, в результате улучшения иммунной реакции. Эти реакции не указывают на неэффективность лечения и обычно проходят спонтанно. Лечение не следует изменять, но при тяжелых парадоксальных реакциях могут потребоваться короткие курсы стероидов.46
Таблица 6Лекарственные взаимодействия с рифампицином 6-150
Смертность среди больных туберкулезом, связанным с ВИЧ
Имеются убедительные доказательства того, что ВИЧ-серопозитивные пациенты с туберкулезом подвергаются более высокому риску смерти, чем их ВИЧ-серонегативные коллеги во время или после лечения туберкулеза, причем смерть обычно вызвана осложнениями ВИЧ-инфекции, а не самим туберкулезом.54 55 Исследование, проведенное в Малави, показало, что у первых в 2,5 раза выше вероятность умереть во время лечения, причем половина смертей приходится на первый месяц лечения56. Риск смерти для пациентов с отрицательным мазком мокроты и внелегочным туберкулезом был соответственно в 3,9 и 2,6 раза выше. чем у пациентов с положительным результатом мокроты, вероятно, поскольку первые имеют тенденцию быть связаны с более глубокой иммуносупрессией. Риск смерти связан с используемым режимом лечения туберкулеза. В Уганде риск смерти в течение года после начала лечения был на 60% выше у пациентов, получавших стрептомицин, тиацетазон и изониазид, чем у пациентов, получавших схемы на основе рифампицина.57 Это может быть связано с профилактикой других оппортунистических инфекций, связанных со СПИДом, за счет широкого антимикробного действия рифампицина. Тем не менее, важно диагностировать и лечить другие оппортунистические инфекции, возникающие во время курса противотуберкулезного лечения44.
Причина высокой смертности, связанной с возникновением туберкулеза, связанного с ВИЧ, даже при интенсивном лечении, не ясна. Это может быть результатом плохо изученного синергизма между двумя инфекциями, который ускоряет снижение иммунной компетентности, а также значительно увеличивает вирусную нагрузку.58 Этот синергетический эффект может быть связан с индукцией репликации ВИЧ цитокинами, включая фактор некроза опухоли-α, индуцированной туберкулезным процессом. Кроме того, туберкулез per se связан со снижением количества лимфоцитов CD4 +, которое может быть добавлено к количеству лимфоцитов, вызванному ВИЧ-инфекцией. Ввиду пагубного воздействия туберкулеза на течение ВИЧ-инфекции все формы туберкулеза классифицируются как состояния, определяющие СПИД.59
Туберкулез с лекарственной устойчивостью
Еще одним осложняющим фактором является появление лекарственно-устойчивого туберкулеза.Многие из случаев этих вспышек, о которых сообщалось в Нью-Йорке, имели множественную лекарственную устойчивость, которая, по определению, резистентна к рифампицину и изониазиду с устойчивостью к другим лекарствам или без них.60 Это было результатом плохой медицинской помощи, ранее полученной пациентами, которые были в основном из социально-экономически неблагополучных слоев общества. ВИЧ-инфекция как таковая не является предрасполагающим фактором для развития множественной лекарственной устойчивости, и во многих других частях мира такой связи не наблюдается.61 62 Тесты на лекарственную чувствительность часто невозможны в развивающихся странах, но их, безусловно, следует проводить в промышленно развитых странах44.
Инфекционный контроль в медицинских учреждениях
Поскольку несколько миниэпидемий туберкулеза, связанного с ВИЧ, включая формы с множественной лекарственной устойчивостью, возникли после контакта с источниками инфекции в больницах и клиниках, очень важны четко определенные стратегии предотвращения передачи туберкулеза в таких учреждениях, включая изоляцию известных и подозреваемых инфекционных пациентов. .63
Профилактика туберкулеза у лиц с коинфекцией
Ввиду очень высокого риска развития активного туберкулеза у человека с коинфекцией и неблагоприятного воздействия этого заболевания на иммунный статус и выживаемость пациента, существует очень хороший теоретический аргумент в пользу проведения профилактического лечения для тех, кто находится в риск. На практике возникают серьезные проблемы при диагностике двойного заражения, исключении активного туберкулеза и обеспечении соблюдения режима лечения без ущерба для доверия или усиления стигмы.63 64
В первоначальных исследованиях было обнаружено, что 12-месячный курс изониазида снижает заболеваемость туберкулезом у лиц с коинфекцией.65 66 Впоследствии было показано, что эффективны и более короткие комбинированные схемы. Они включают трехмесячный курс рифамицина (рифампицин или рифабутин) плюс изониазид и двухмесячный курс рифамицина плюс пиразинамид.46 67-69 Исследование, проведенное в Замбии, показало, что двухмесячные комбинированные схемы или шесть месяцев изониазида, вводимого дважды в неделю, снизили заболеваемость туберкулезом примерно на 40% по сравнению с группой плацебо, хотя общая смертность от всех причин не снизилась. .70 Профилактика была более эффективной у пациентов с относительно ограниченной иммуносупрессией (положительные туберкулиновые тесты, высокое количество лимфоцитов и высокие концентрации гемоглобина). К 18 месяцам заболеваемость туберкулезом у тех, кто получал профилактику, была такой же, как в группе плацебо; вероятно, из-за повторного заражения и, таким образом, указывает на необходимость рассмотреть возможность повторных курсов или, возможно, пожизненного профилактического лечения.
ВИЧ-инфекция и туберкулез крупного рогатого скота
Туберкулез, вызываемый вирусом M bovis передается от крупного рогатого скота к человеку, а иногда и от человека к крупному рогатому скоту, но доказательства передачи от человека к человеку являются слабыми и анекдотичными.71 Это привело к концепции, никогда официально не подтвержденной, что M bovis менее вирулентен для человека, чем M tuberculosis . Однако были сообщения о высокой заболеваемости туберкулезом, связанным с ВИЧ, из-за M bovis среди мексиканцев, прибывающих в США72, а также сообщение о миниэпидемии, вызванной контактом в отделении СПИДа с пациентом, тесно инфицированным туберкулезной палочкой. похожий на M bovis .14 В случае подтверждения повышенная восприимчивость ВИЧ-инфицированных к этой форме туберкулеза может создать серьезную проблему для здоровья человека в регионах, включая многие африканские страны, где распространенность ВИЧ-инфекции высока и где наблюдается туберкулез крупного рогатого скота. не искоренен.73
Вакцинация БЦЖ ВИЧ-инфицированных
Существует риск того, что вакцинация бациллой Кальметта-Герена (БЦЖ), живой аттенуированной вакциной, вызовет инфекционные осложнения у ВИЧ-положительных лиц.74 Наблюдается небольшое увеличение частоты побочных эффектов БЦЖ у ВИЧ-инфицированных детей. женщины, но большинство таких эффектов незначительны.75 В одном исследовании осложнения возникли у девяти из 68 ВИЧ-инфицированных детей через 3–35 месяцев после вакцинации БЦЖ новорожденных. Регионарная лимфаденопатия с образованием свищей или без них возникла у семи, а системное заболевание — у двух.76 Соответственно, необходимо учитывать безопасность вакцинации БЦЖ в регионах с высокой распространенностью ВИЧ-инфекции. ВОЗ сообщила, что, хотя лицам, заведомо инфицированным ВИЧ, никогда не следует делать БЦЖ, плановую иммунизацию младенцев, тем не менее, следует продолжать в районах с высокой заболеваемостью туберкулезом и ВИЧ-инфекцией.77 В Великобритании рекомендуется младенцам, рожденным от известных матерей. или с подозрением на ВИЧ-положительный статус, которым не следует получать БЦЖ, если впоследствии не будет выявлено отрицательное отношение к ВИЧ.78
Выводы
Возникновение пандемии ВИЧ за последние два десятилетия оказало разрушительное воздействие на туберкулез во всем мире, но главным образом в странах Африки к югу от Сахары. В 1999 г. около 10% всех случаев туберкулеза будут связаны с ВИЧ, а в Африке этот показатель превысит 20%. Кроме того, 30% из ожидаемых 2,5 миллиона смертей, связанных со СПИДом, в 1999 году будут вызваны туберкулезом. Ожидается, что в ближайшее десятилетие проблема также станет серьезной в Азии. Многие африканские страны сообщают, что их медицинские учреждения перегружены дополнительным бременем туберкулеза, связанного с ВИЧ, и поэтому необходимы срочные меры, чтобы остановить эту эпидемию, прежде чем она станет полностью неуправляемой с разрушительными человеческими и экономическими последствиями, которые будут ощущаться во всем мире.
Практикующий врач должен помнить о трудностях диагностики, связанных с разнообразными клиническими проявлениями туберкулеза и особенно высокой частотой атипичных проявлений у ВИЧ-положительных пациентов, а также с проблемами лечения. Поскольку заболеваемость туберкулезом, особенно случаями, связанными с ВИЧ, продолжает расти во всем мире, врачи и патологи должны держать туберкулез в списке дифференциальных диагнозов в любом проблемном клиническом случае.
Вопросы с несколькими вариантами ответов
Q1. Верны следующие утверждения:
(A) У пациентов с сочетанной инфекцией туберкулеза и ВИЧ общий годовой риск развития активного туберкулеза возрастает в среднем вдвое.
(B) В Африке к югу от Сахары мужчин в два раза больше, чем женщин, инфицированных ВИЧ.
(C) В Замбии ВИЧ — вторая по распространенности причина неакушерской материнской смертности.
(D) У больных СПИДом с активным туберкулезом легких преимущественно наблюдаются кавитирующие гранулематозные поражения легких.
(E) Смертность, связанная с туберкулезом, одинакова у пациентов с ВИЧ и людей без ВИЧ.
Q2. У пациентов с диссеминированным туберкулезом, коинфекцией ВИЧ:
(A) Туберкулиновые кожные пробы могут быть отрицательными.
(B) Посев крови на микобактерии редко бывает положительным.
(C) Перикардит — частое внелегочное проявление.
(D) Неизменно наблюдается поражение центральной нервной системы.
(E) Пациенты менее склонны к потере веса, чем пациенты с туберкулезом, не связанным с ВИЧ.
Q3. Что касается лечения туберкулеза у ВИЧ-инфицированных пациентов, то верно следующее:
(A) Добавление пиридоксина к схемам лечения туберкулеза предотвращает нейропатию, вызванную этамбутолом.
(B) Продление противотуберкулезного лечения с шести до 12 месяцев приводит к снижению частоты рецидивов и повышению выживаемости.
(C) Рифампицин взаимодействует с антиретровирусными препаратами, ингибируя фермент цитохрома CYP450, тем самым снижая уровни антиретровирусных препаратов.
(D) Текущие рекомендации гласят, что антиретровирусные препараты следует продолжать, пока пациент лечится от туберкулеза.
(E) ВИЧ-положительные пациенты с туберкулезом испытывают больше реакций гиперчувствительности, чем ВИЧ-отрицательные пациенты с туберкулезом.
Q4. Верны следующие утверждения относительно туберкулеза:
(A) ВИЧ-положительные пациенты с большей вероятностью будут «положительными по мазку», чем ВИЧ-отрицательные пациенты.
(B) Выявление кислотоустойчивых бацилл под микроскопом позволяет поставить диагноз туберкулеза.
(C) Дети, больные туберкулезом, реже получают положительный мазок, чем взрослые.
(D) Устойчивость к рифампицину можно надежно предсказать, используя молекулярные методы для обнаружения мутаций в гене RpoB .
(E) Серология используется для диагностики туберкулеза у ВИЧ-положительных пациентов.
Q5. Какие из утверждений верны:
(A) Mycobacterium bovis — признанная причина первичного туберкулеза легких.
(B) Особому риску туберкулеза подвержены люди в возрасте от 5 до 15 лет.
(C) ВИЧ-инфицированные пациенты, однажды инфицированные туберкулезом, подвергаются высокому риску повторного заражения, а также реактивации.
(D) Ожидается, что туберкулез станет причиной 30% ожидаемых смертей, связанных со СПИДом в 1999 году.
(E) Младенцам, инфицированным ВИЧ, безопасно делать вакцинацию БЦЖ.
Q6. В 1999 году какой процент из ожидаемых 2,5 миллиона смертей, связанных со СПИДом, по оценкам, будет вызван туберкулезом?
(А) 10%
(В) 30%
(К) 50%
(Г) 70%
(E) 90%
Q7.Общий годовой риск развития активной туберкулезной инфекции у лиц, коинфицированных туберкулезной палочкой и ВИЧ, по сравнению с людьми, не инфицированными ВИЧ, увеличивается примерно на:
(А) 10 раз
(В) 20 раз
(К) 30 раз
(D) 40 раз
(E) 50 раз
Q8. В настоящее время регион, наиболее пострадавший от сочетанной инфекции ВИЧ и туберкулеза («проклятый дуэт»):
(A) Юго-Восточная Азия
(B) Северная Африка
(C) Африка к югу от Сахары
(D) США
(E) Европа
Q9.Какое из следующих утверждений неверно?
(A) Стандартная рекомендованная ВОЗ противотуберкулезная терапия составляет шесть месяцев рифампицином, изониазидом, пиразинамидом и этамбутолом / стрептомицином.
(B) ВИЧ-положительные пациенты с меньшей вероятностью, чем пациенты, не инфицированные ВИЧ, завершат курс противотуберкулезного лечения.
(C) Побочные эффекты противотуберкулезного лечения сравнительно чаще встречаются у ВИЧ-инфицированных пациентов с туберкулезом.
(D) Ингибиторы протеазы и рифампицин взаимодействуют редко.
(E) Туберкулез с лекарственной устойчивостью по определению устойчив к изониазиду и рифампицину.
Ответов на вопросы с несколькими вариантами ответов:
Q1:
(A) Неверно. Риск намного больше — оказаться примерно в 20 раз больше.
(B) Неверно. Среди полов примерно одинаковая распространенность, причем гетеросексуальный секс является наиболее распространенным способом передачи.
(C) Верно. Самая распространенная — малярия.
(D) Неверно. У ВИЧ-инфицированных пациентов с активным туберкулезом легких наблюдаются некротизирующие, а не гранулематозные поражения легких, которые не отделены фиброзными изменениями, как при туберкулезе у пациентов, не инфицированных ВИЧ.Это делает пациента более предрасположенным к местной инвазии и распространению болезни по всему телу (криптогенный диссеминированный туберкулез).
(E) Неверно. Смертность выше у людей с ВИЧ.
Q2:
(A) Верно. Хотя степень уплотнения не связана с количеством CD4.
(B) Неверно. От одной трети до половины случаев будет положительным посев крови.
(C) Верно. Перикардит — второе по распространенности внелегочное проявление после асимметричной лимфаденопатии.
(D) Неверно. Поражение центральной нервной системы у африканских пациентов с ВИЧ и диссеминированным туберкулезом встречается довольно редко.
(E) Неверно. Считается, что тяжелое истощение у ВИЧ-инфицированных африканцев, известное как «болезнь стройности», связано с туберкулезом.
Q3:
(A) Неверно. Невропатия — это побочный эффект, наблюдаемый при приеме изониазида, а не этамбутола.
(B) Неверно. Увеличение продолжительности курса лечения не влияет на выживаемость ВИЧ-инфицированных пациентов с активным туберкулезом.
(C) Неверно. Рифампицин является индуктором фермента, а не ингибитором.
(D) Верно.
(E) Верно.
4 квартал:
(A) Неверно. У ВИЧ-инфицированных пациентов с активным туберкулезом меньше шансов получить положительный результат мазка мокроты.
(B) Неверно. Различие между туберкулезом и другими видами микобактерий (например, M avium intracellulare ) невозможно надежно провести с помощью микроскопии. Золотым стандартом остается культура организма. Также можно использовать молекулярные методы.
(C) Верно.
(D) Верно.
(E) Неверно. Серологии не хватает как специфичности, так и чувствительности, особенно у ВИЧ-положительных пациентов.
Q5:
(A) Неверно. M bovis вызывает первичную инфекцию в глотке или кишечнике (при употреблении инфицированного молока), а не в легких. Хотя сообщалось об отдельных институциональных вспышках среди ВИЧ-инфицированных, нет убедительных доказательств того, что распространение произошло через первичную инфекцию легких.
(B) Неверно.У лиц этой возрастной группы есть относительная защита от заражения туберкулезом — «группа золотого века».
(C) Верно.
(D) Верно.
(E) Неверно. При использовании этой живой аттенуированной вакцины возрастает частота инфекционных осложнений.
Q6:
(B) Верно 30% (оценки ВОЗ).
Q7:
(B) Верно 20 раз.
Q8:
(C) Верно. Хотя затронуты многие регионы, страны Африки к югу от Сахары, похоже, несут на себе основную тяжесть проклятого дуэта туберкулеза и ВИЧ.
Q9:
(D) Верно. Рифампицин индуцирует ферменты в системе цитохрома P -450 и приводит к взаимодействию между этими лекарственными средствами.
Эпидемиологическое исследование туберкулеза и ВИЧ-инфекции в …: СПИД
Цель
В Танзании за последние 6 лет зарегистрированные случаи туберкулеза (ТБ) почти удвоились, причем пропорционально гораздо большее увеличение числа случаев с отрицательным мазком и внелегочными случаями по сравнению с случаями с положительным мазком.В то же время ВИЧ-инфекция получила широкое распространение по всей стране. Это исследование было предпринято с целью изучить связь туберкулеза и ВИЧ и определить влияние ВИЧ на нынешние и будущие случаи туберкулеза в Танзании.
Методы
План обследования предусматривал тестирование на ВИЧ репрезентативной общенациональной выборки, составляющей примерно одну шестую всех новых и рецидивов, зарегистрированных в период с января 1991 г. по декабрь 1993 г., с привязкой к демографическим, клиническим и бактериологическим данным по этим случаям.Для сравнения использовались данные эпиднадзора за ВИЧ.
Результаты
Всего было протестировано 6928 случаев ТБ из всех 20 материковых регионов страны. Общая распространенность ВИЧ-инфекции составила 32%. Как приблизительные, так и скорректированные отношения шансов (OR) для ВИЧ-инфекции были выше у женщин, в возрасте 25–44 лет, городских жителей, случаев заболевания с отрицательным мазком мокроты и внелегочного заболевания, а также у лиц с шрамом от вакцинации против бациллы Кальметта-Герена (БЦЖ). Относительный риск ВИЧ-инфекции с поправкой на возраст и пол у больных ТБ по сравнению с донорами крови в тех же регионах составил 7.1 (95% доверительный интервал, 6,6–7,5) и был значительно выше среди лиц в возрасте 25–34 лет. Из 3360 пациентов с результатами бактериологического посева 46% оказались положительными на Mycobacterium tuberculosis. Тесты на лекарственную чувствительность были выполнены на 1164 изолятах с общим уровнем лекарственной устойчивости 6,2%. Показатели исходной резистентности были низкими как у ВИЧ-положительных (4%), так и у ВИЧ-отрицательных (5,8%) пациентов. Показатели приобретенной устойчивости были выше (19% в целом) и существенно не менялись в зависимости от серологического статуса ВИЧ.Первоначальная комбинированная устойчивость как к изониазиду, так и к рифампицину была редкой (0,4%), как и монорезистентность к рифампицину (0,3%).
Выводы
Более высокий OR для женщин и молодых людей отражает более высокие уровни ВИЧ-инфекции в этих группах населения. Обнаружение того факта, что у случаев рецидива с положительным мазком вероятность заражения ВИЧ-инфекцией не выше, чем у новых случаев с положительным мазком, позволяет предположить, что режим лечения новых случаев ВИЧ-ассоциированного ТБ эффективен. Низкие показатели как начальной, так и приобретенной лекарственной устойчивости у ВИЧ-положительных пациентов являются еще одним свидетельством адекватности лечения.Более высокий относительный риск заражения ВИЧ среди пациентов в возрасте 25–34 лет предполагает увеличение числа случаев передачи ТБ, связанных с ВИЧ. Наконец, по оценкам, примерно две трети увеличения заболеваемости туберкулезом с положительным мазком мокроты в стране могут быть напрямую связаны с ВИЧ-инфекцией.
Пространственные модели сочетанной инфекции туберкулеза и ВИЧ в Эфиопии
Аннотация
Фон
Туберкулез (ТБ) и вирус иммунодефицита человека (ВИЧ) являются основными причинами смертности от инфекционных заболеваний в Эфиопии, но мало что известно об их пространственном распределении по стране.Целью этого исследования было изучить пространственные закономерности сочетанной инфекции ТБ и ВИЧ в Эфиопии на районном уровне.
Методы
Мы провели экологическое исследование с использованием данных о ТБ и ВИЧ, полученных из всех регионов Эфиопии через национальную информационную систему управления здравоохранением (HMIS), в период с июня 2015 года по июнь 2017 года. Пространственная кластеризация оценивалась с использованием статистики Морана I и статистики Getis-Ord. Модели пространственной биномиальной регрессии были построены отдельно для распространенности ТБ среди людей, живущих с ВИЧ, и для распространенности ВИЧ среди пациентов с ТБ, с пространственными компонентами и без них с использованием байесовского подхода.
Результаты
Всего в анализ были включены 1 830 880 больных ВИЧ и 192 359 больных ТБ. Распространенность ВИЧ среди больных туберкулезом составила 7,34%; горячие точки наблюдались в районах, расположенных в регионах Амхара, Афар и Гамбела, а холодные точки наблюдались в регионах Оромия и Южных Наций, национальностей и народов (SNNP). Распространенность ТБ среди людей, живущих с ВИЧ, колебалась от 0,7% в регионе Оромия до 14,5% в регионе Афар. Горячие точки распространения туберкулеза среди людей, живущих с ВИЧ, наблюдались в округах, расположенных в регионах Гамбела, Афар, Сомали и Оромия; тогда как точки холода наблюдались в районах, расположенных в регионах Амхара и Тыграй.Факторами экологического уровня, связанными с распространенностью ТБ среди людей, живущих с ВИЧ, были низкий индекс благосостояния (OR: 1,49; 95% CrI: 1,05, 2,05), низкий уровень грамотности взрослого населения (OR: 0,67; 95% CrI: 0,46, 0,94). ) и расстояние до международной границы (OR: 0,61; 95% CrI: 0,40, 0,91). Факторами, связанными с распространенностью ВИЧ среди больных ТБ, были ограниченный доступ к медицинской помощи (OR: 0,76; 95% CrI: 0,59, 0,95), низкий индекс благосостояния (OR: 1,31; 95% CrI: 1,01, 1,67) и низкий уровень взрослого населения. уровень грамотности (OR: 1,37; 95% CrI: 1.03, 1,78).
Заключение
Наше исследование предоставляет доказательства географической кластеризации сочетанной инфекции ТБ / ВИЧ в Эфиопии. Доступность здравоохранения, близость к международным границам и демографические факторы, такие как низкий индекс благосостояния и грамотность взрослого населения, в значительной степени были связаны с распространенностью сочетанной инфекции ТБ / ВИЧ.
Образец цитирования: Alene KA, Viney K, Moore HC, Wagaw M, Clements ACA (2019) Пространственные модели сочетанной инфекции туберкулеза и ВИЧ в Эфиопии.PLoS ONE 14 (12): e0226127. https://doi.org/10.1371/journal.pone.0226127
Редактор: HASNAIN SEYED EHTESHAM, Jamia Hamdard, INDIA
Поступила: 7 октября 2019 г .; Одобрена: 20 ноября 2019 г .; Опубликовано: 5 декабря 2019 г.
Авторские права: © 2019 Alene et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Автор (ы) не получил специального финансирования для этой работы.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Туберкулез (ТБ) и вирус иммунодефицита человека (ВИЧ) являются первой и второй по значимости причиной смерти от инфекционных заболеваний во всем мире, соответственно.Синергия между туберкулезом и ВИЧ-инфекцией сильна. В то время как туберкулез является основной причиной смерти среди людей, живущих с ВИЧ [1], ВИЧ-инфекция является наиболее важным фактором риска развития активного ТБ [2, 3]. Сочетанная инфекция туберкулеза и ВИЧ представляет собой серьезную проблему общественного здравоохранения для глобальных усилий по достижению целей ликвидации обоих заболеваний. По оценкам, в 2017 году во всем мире насчитывалось 36 миллионов человек, живущих с ВИЧ, причем примерно одна треть из них были коинфицированы туберкулезом [4].Наибольшее бремя сочетанной инфекции ТБ / ВИЧ зарегистрировано в странах Африки к югу от Сахары [4].
Эфиопия — одна из 30 стран с высоким бременем ТБ и ВИЧ в мире [5–7], где заболеваемость ВИЧ составляет 0,17 случая на 1000 населения и 1,64 случая на 1000 населения [8–10]. Исследования, проведенные в Эфиопии, показали, что люди с коинфекцией ТБ / ВИЧ имеют больший риск психосоциальных проблем, низкого качества жизни и более плохого физического здоровья, чем ВИЧ-инфицированные люди без активной формы ТБ [11–13]. Было обнаружено, что распространенность сочетанной инфекции ТБ / ВИЧ широко варьируется в Эфиопии [14, 15] и других странах [16–18], частично из-за различий в доступе к медицинской помощи и других социально-демографических факторов, таких как индекс благосостояния и уровень грамотности.
Хотя несколько небольших исследований сообщили об эпидемиологии сочетанной инфекции ТБ / ВИЧ во многих частях Эфиопии [19, 20], насколько нам известно, отчетов о пространственном распределении сочетанной инфекции ТБ и ВИЧ в национальном масштабе нет. Выявление областей, в которых сконцентрировано бремя сочетанной инфекции ТБ / ВИЧ, может помочь выявить группы населения с повышенным риском сочетанной инфекции, а для успешных программ эпиднадзора и оптимального распределения ресурсов требуется знание областей с высоким и низким уровнем бремени [21], включая определение области, в которых необходимо укрепить существующие программы сотрудничества и интегрированные услуги по борьбе с ТБ и ВИЧ.Таким образом, это исследование было направлено на оценку пространственного распределения сочетанной инфекции ТБ / ВИЧ в Эфиопии на районном уровне и изучение факторов экологического уровня, связанных с распространенностью ТБ среди людей, живущих с ВИЧ, и распространенностью ВИЧ среди больных ТБ.
Методы
Дизайн исследования и постановка
Экологическое исследование было проведено в Эфиопии. В нашем исследовании оценивалась распространенность сочетанной инфекции ТБ / ВИЧ на районном уровне с использованием национальных данных уведомления о случаях ТБ / ВИЧ, представленных с июня 2015 года по июнь 2017 года.Район является третьим административным уровнем в Эфиопии. Районы состоят из хорошо определенного населения в четко очерченной административно-географической зоне. Районы содержат сети пунктов первичной медико-санитарной помощи, таких как медицинские центры, медицинские пункты и районные больницы. Данные, связанные со здоровьем, собираются на районном уровне и передаются в Зональный департамент здравоохранения, Региональное бюро здравоохранения, а затем в Федеральное министерство здравоохранения. И туберкулез, и ВИЧ являются болезнями, подлежащими регистрации в Эфиопии.Об этих заболеваниях районное управление здравоохранения сообщает в Федеральное министерство здравоохранения через Информационную систему управления здравоохранением (HMIS) ежеквартально [22, 23]. Данные включают количество: больных туберкулезом, включенных в национальную программу борьбы с туберкулезом, больных туберкулезом, прошедших тестирование на ВИЧ, больных туберкулезом с положительными результатами тестирования; ВИЧ-положительные клиенты, получившие помощь в связи с ВИЧ в течение отчетного периода; ВИЧ-положительные клиенты, прошедшие обследование на туберкулез во время визита; и ВИЧ-положительные клиенты с активной формой ТБ.Диагностика и лечение туберкулеза и ВИЧ интегрированы и предоставляются бесплатно в Эфиопии по всей стране.
Переменные данных
Зависимой переменной в этом исследовании было количество случаев сочетанной инфекции ТБ и ВИЧ в двух исследуемых популяциях: люди, живущие с ВИЧ, и пациенты с ТБ. Это было определено как распространенность ТБ среди людей, живущих с ВИЧ, и распространенность ВИЧ среди больных ТБ. Отдельные данные об инфекционном статусе туберкулеза и ВИЧ для всего населения или репрезентативной выборки отсутствовали, что исключало использование единой (полиномиальной) модели, включающей все возможные комбинации моно- и сочетанных инфекций ТБ и ВИЧ.
В исследование были включены все лица с коинфекцией ТБ / ВИЧ, поступившие в национальную HMIS в течение периода исследования. Участники исследования, чей текущий адрес проживания не был зарегистрирован или неизвестен, были исключены из анализа, поскольку их данные не могли быть привязаны к районному уровню. Независимыми переменными были социально-экономические факторы (такие как низкий индекс благосостояния, среднее количество человек в комнате, уровень безработицы и уровень грамотности взрослого населения), поведенческие факторы (такие как жевание чата и употребление алкоголя), плохой доступ к медицинскому обслуживанию ( я.е. сложность получения совета или лечения из-за отсутствия денег или расстояния до медицинского учреждения), расстояние до международной границы (т.е. расстояние по прямой до ближайшей международной границы) и климатические факторы (такие как средняя температура, осадки и засушливость). Таблица, показывающая сводку независимых переменных, их источники данных и единицы измерения, представлена в качестве дополнительной информации (таблица S1). Эти независимые переменные были извлечены из Обзора демографии и здоровья Эфиопии (EDHS 2011 и EDHS 2016), Атласа плотности населения Эфиопии и пространственных данных EDHS.Переменные были выбраны априори из-за их вероятной связи с распространенностью сочетанной инфекции ВИЧ / ТБ.
Шейп-файл Polygon административных границ Эфиопии на районном уровне был получен с веб-сайта Open Africa (https://africaopendata.org/group/ethiopia). Наборы данных о ТБ и ВИЧ и ковариаты исследования были объединены с полигонами районного уровня с использованием программного обеспечения географической информационной системы (ГИС) ArcGIS (ESRI, Redlands, CA) [24].
Анализ данных
Проведены описательная статистика и геопространственный анализ.Распространенность ТБ среди людей, живущих с ВИЧ, рассчитывалась как число больных ТБ с положительным результатом теста на ВИЧ в районе, деленное на общее количество клиентов, охваченных лечением ВИЧ и прошедших скрининг на ТБ во время посещения в том же районе. Аналогичным образом, распространенность ВИЧ среди больных ТБ рассчитывалась как число больных ТБ с положительным результатом теста на ВИЧ в районе, деленное на общее количество пациентов с ТБ, прошедших тестирование на ВИЧ.
Пространственный анализ
Пространственная автокорреляция (основанная на расположении объектов и значениях атрибутов) распространенности коинфекции была измерена с использованием статистики Global Moran’s I, чтобы оценить общую картину и тенденцию данных.Локальная пространственная кластеризация была исследована с использованием статистики Getis-Ord. Первоначальный кандидатный набор демографических, поведенческих, климатических и экологических ковариат был рассмотрен для включения в пространственные модели для исследования факторов экологического уровня, связанных с кластеризацией распространенности сочетанной инфекции ТБ и ВИЧ. Выбор переменных производился с использованием одномерных регрессионных моделей с фиксированными эффектами, и все переменные с P <0,2 были отобраны для включения в окончательные многомерные модели. Переменные также проверялись на наличие мультиколлинеарности, и те переменные с коэффициентом инфляции дисперсии более шести были исключены из окончательной пространственной модели.Остатки окончательных моделей проверялись на наличие пространственной автокорреляции.
Модели пространственной биномиальной регрессии были построены отдельно для распространенности ТБ среди людей, живущих с ВИЧ, и распространенности ВИЧ среди пациентов с ТБ в WinBUGS версии 1.4 (MRC Biostatistics Unit, Кембридж, и Имперский колледж Лондона, Великобритания). Модели были разработаны с пространственными компонентами и без них с использованием байесовского подхода.
Мы построили модели с пространственно структурированными и неструктурированными случайными эффектами.Мы предположили, что наблюдаемая распространенность ТБ среди людей, живущих с ВИЧ (r) в зоне (i), имела биномиальное распределение с общим числом пациентов с ТБ, прошедших тестирование на ВИЧ в зоне (ni), и смоделированной распространенностью ТБ среди люди, живущие с ВИЧ, в зоне (pi): ri ~ биномиальное (ni, pi). Для этой модели pi был задан следующим образом: logit ( p i ) = α + ∑ N β m * X n, i + U i + V i , где α — точка пересечения; ∑ N β м * X n, i — это матрица м независимых переменных, специфичных для зоны X (т.е.е. доля населения с низким индексом благосостояния, употреблением алкоголя, плохим доступом к здравоохранению, уровнем грамотности взрослого населения и расстоянием до международной границы), измеренная в каждой зоне i, умноженная на их коэффициенты (β). U i — неструктурированные случайные эффекты; и V i представляют собой пространственно структурированные случайные эффекты, смоделированные с использованием подхода условной авторегрессии (CAR). Компонент CAR был определен с использованием матрицы смежности для определения пространственных отношений между зонами.Матрица смежности для каждой зоны была сгенерирована с помощью ArcGIS на основе определения ферзя, при этом две области считаются соседями, если они имеют общую границу или вершину. Вес 1 присваивался, если две зоны были соседними, и 0 — в противном случае. Апостериорные параметры оценивали с помощью моделирования байесовской цепи Маркова методом Монте-Карло (MCMC). Неинформативные априорные значения использовались для α (равномерный априор с границами –∞ и + ∞) и коэффициентов (нормальный априорный со средним значением = 0 и точностью 1 × 10–6).Приоритетам точности неструктурированных и пространственно структурированных случайных эффектов были даны неинформативные гамма-распределения с параметрами формы и масштаба, установленными на уровне 0,001. Статистический критерий отклонения информации (DIC) был рассчитан для выбора наиболее подходящей модели (считается, что модели с более низкой статистикой DIC показывают лучший компромисс между соответствием модели и экономией). Сходимость значений параметров наблюдалась при визуальном изучении истории и графиков плотности модельных цепочек.Сходимость моделей была успешно достигнута после 400 000 итераций. Модели были запущены для следующих 100 000 итераций, а апостериорные значения были сохранены после 500 000 итераций. С помощью этих процедур и шагов были построены аналогичные, но отдельные модели распространенности ВИЧ среди больных ТБ. Модели также были разработаны для каждого результата, за исключением неструктурированных или структурированных случайных эффектов.
Допуск по этике
Это исследование было одобрено Комитетом по этике исследований на людях Австралийского национального университета (номер протокола 2016/218), а от Министерства здравоохранения Эфиопии было получено письмо с одобрением.Поскольку в этом исследовании использовались агрегированные данные на районном уровне, информированное согласие участников не было получено.
Результаты
В это исследование были включены в общей сложности 1830 880 пациентов с ВИЧ и 192 359 больных туберкулезом, зарегистрированные в национальной HMIS с июня 2015 по июнь 2017 года. Эти данные охватили все зоны и регионы Эфиопии, за исключением 23 районов, по которым не было данных о туберкулезе или ВИЧ. Из общего числа 1 830 880 ВИЧ-положительных клиентов, получивших помощь в связи с ВИЧ в Эфиопии в течение периода исследования, 1 685 303 (92%) прошли скрининг на ТБ.Более высокая доля клиентов, включенных в программу лечения ВИЧ и прошедших скрининг на ТБ в течение периода исследования, составляли женщины (61,6%; n = 1 128 917), чем мужчины (38,4%; n = 70 1963), тогда как более высокая доля пациентов с ТБ, включенных в программу под непосредственным наблюдением. Краткий курс терапии (DOTS), прошедшие тестирование на ВИЧ, были мужчинами (54,8%; n = 105 387), чем женщинами (45,2%; n = 86 972). В таблице 1 представлено общее количество больных ТБ и ВИЧ в Эфиопии с разбивкой по полу. Общая распространенность ТБ среди людей, живущих с ВИЧ, составила 0.84%; и сильно различались по полу, при этом распространенность туберкулеза среди мужчин (1,2%) выше, чем среди женщин (0,64%). Распространенность ВИЧ среди больных туберкулезом составила 7,34% и была несколько ниже (7,09%) у мужчин, чем у женщин (7,72%). Самый высокий уровень распространенности ТБ среди людей, живущих с ВИЧ, был зарегистрирован в регионах Сомали (14,5%), Гамбела (9,6%) и Афар (8,5%) (таблица 2; рис. 1). Самый высокий уровень распространенности ВИЧ среди больных ТБ был зарегистрирован в Аддис-Абебе (22,5%), а самый низкий — в Южных странах, национальностях и народах (SNNP) (3.8%) и Оромия (4,8%) (Таблица 2; Рис. 2). Распространенность ТБ среди людей, живущих с ВИЧ, и распространенность ВИЧ среди пациентов с ТБ на уровне страны, региона и зоны представлены в дополнительных таблицах (таблица S2).
Пространственная кластеризация сочетанной инфекции ТБ / ВИЧ
Имеются данные о пространственной кластеризации коинфекции ТБ / ВИЧ с глобальным I Морана = 0,13 (значение p <0,001) для распространенности ТБ среди людей, живущих с ВИЧ, и 0,17 (значение p <0,001) для распространенности ВИЧ среди больных туберкулезом.Статистика Getis-Ord показала, что распространенность ВИЧ среди больных туберкулезом в Эфиопии была сосредоточена в районах, расположенных в регионе Амхара, а распространенность ВИЧ среди больных туберкулезом в том же регионе относительно высока. Горячие точки распространения туберкулеза среди людей, живущих с ВИЧ, наблюдались в округах, расположенных в регионах Гамбела, Афар, Сомали и Оромия; тогда как «холодные точки» наблюдались в районах, расположенных в регионах Амхара и Тыграй (рис. 3). Что касается распространенности ВИЧ среди больных туберкулезом, горячие точки наблюдались в районах, расположенных в регионах Амхара, Афар и Гамбела, а холодные точки наблюдались в регионах Оромия и SNNP (рис. 4).
Факторы, связанные с пространственной кластеризацией коинфекции ТБ / ВИЧ
В таблице 3 показаны одномерные модели, соответствующие как распространенности ТБ среди людей, живущих с ВИЧ, так и распространенности ВИЧ среди больных ТБ. Для обоих исходов наиболее подходящей моделью была модель с пространственно структурированными случайными эффектами, но без пространственно неструктурированных случайных эффектов. В наиболее подходящей модели распространенности ТБ среди людей, живущих с ВИЧ, индекс низкого благосостояния (отношение шансов (ОШ): 1.49; 95% CrI: 1,05, 2,05), низкий уровень грамотности взрослого населения (OR: 0,67; 95% CrI: 0,46, 0,94) и близость (расстояние) к международным границам (OR: 0,61; 95% CrI: 0,40, 0,91). связанные с туберкулезом (таблица 4). Когда модель была адаптирована с учетом распространенности ВИЧ среди больных ТБ, плохого доступа к медицинскому обслуживанию (OR: 0,76; 95% CrI: 0,59, 0,95), низкого индекса благосостояния (OR: 1,31; 95% CrI: 1,01, 1,67) и низкий уровень грамотности взрослого населения (OR: 1,37; 95% CrI: 1,03, 1,78) были в значительной степени связаны с распространенностью ВИЧ (Таблица 4).Когда остатки окончательной модели были исследованы на пространственную автокорреляцию, после включения в модель социально-экономических переменных и переменных доступа к здравоохранению была очевидна пространственная автокорреляция (глобальный индекс Морана = 0,09; p-значение = 0,04), что указывает на то, что ковариаты не смогли полностью объяснить пространственную кластеризацию сочетанных инфекций ТБ / ВИЧ. Карты, показывающие остатки структурированных случайных эффектов для распространенности ВИЧ среди больных ТБ и распространенности ТБ среди людей, живущих с ВИЧ, представлены на дополнительных рисунках (рис. S1 и рис. S2).
Таблица 4. Байесовская модель логистической регрессии для ассоциации ковариат экологического уровня и пространственно структурированного и неструктурированного случайного эффекта с распространенностью ТБ среди пациентов с ВИЧ и распространенностью ВИЧ среди пациентов с ТБ в Эфиопии, 2015–2017 гг.
https://doi.org/10.1371/journal.pone.0226127.t004
Обсуждение
Сочетанная инфекция туберкулеза и ВИЧ — серьезная проблема общественного здравоохранения в Эфиопии. В настоящем исследовании изучается пространственное распределение сочетанной инфекции ТБ / ВИЧ во всей Эфиопии на районном уровне путем сопоставления двух отдельных моделей распространенности ТБ среди людей, живущих с ВИЧ, и распространенности ВИЧ среди больных ТБ.Это исследование показало, что пространственная кластеризация сочетанной инфекции ВИЧ / ТБ в Эфиопии связана с плохим доступом к медицинскому обслуживанию, удаленностью от международных границ и социально-экономическими факторами.
Распространенность туберкулеза среди людей, живущих с ВИЧ, сильно различалась между районами и зонами в Эфиопии, достигая 35,9% в специальной зоне Итанг и всего 0,1% в специальной зоне Бурджи. Пространственная неоднородность распространенности ТБ среди людей, живущих с ВИЧ, была в значительной степени связана с лежащей в основе вариабельностью социально-экономических переменных на уровне региона, таких как низкий индекс благосостояния, низкий уровень грамотности взрослого населения и близость к международной границе.Наблюдаемая связь между распространенностью ТБ и социально-экономическими факторами уже описана в существующей литературе [25–27]. Ранее сообщалось о высокой распространенности ТБ среди людей с низким квинтилем благосостояния и низким уровнем образования в нескольких странах, таких как Южная Африка [28], Кения [29], Китай [30] и Бразилия [31].
Интересным открытием нашего исследования была связь между распространенностью ТБ среди людей с ВИЧ и расстоянием до международной границы; В частности, сообщалось о более высокой распространенности туберкулеза в районах, прилегающих к международной границе, по сравнению с районами, расположенными далеко от международной границы.Карта в нашем локальном пространственном кластерном анализе также показала аналогичный вывод, в котором горячие точки расположены в регионах Гамбела, Сомали, Афар и Оромия недалеко от границ Эфиопии-Судана, Эфиопии-Эритреи и Эфиопии-Кении. Эти районы характеризуются большим количеством мигрантов и плохим доступом к медицинским услугам. Наши предыдущие исследования, проведенные на северо-западе Эфиопии для оценки пространственной кластеризации детского туберкулеза и МЛУ-ТБ среди населения в целом, также выявили аналогичные горячие точки вблизи границ Эфиопия-Судан и Эфиопия-Эритрея [32, 33].Эти результаты свидетельствуют о том, что в этих удаленных районах срочно необходимы эффективные меры общественного здравоохранения для контроля передачи туберкулеза в приграничных регионах.
Наше исследование также показало, что общая распространенность ВИЧ-инфекции среди больных ТБ составила 7,4%; и хотя этот показатель значительно превышает национальный показатель распространенности ВИЧ среди населения в целом (0,9%) [34], он соответствует оценкам ВОЗ распространенности ВИЧ среди больных ТБ в Эфиопии (7%) [7]. В предыдущих исследованиях постоянно сообщалось о высокой распространенности ВИЧ среди больных ТБ [35, 36].Недавний систематический обзор и метаанализ, проведенные в странах Африки к югу от Сахары, показали высокую распространенность (31,8%) ВИЧ среди больных туберкулезом с постепенным снижением распространенности с 33,7% в период до 2000 г. до 25,7% в период после 2010 г. [37].
Наше исследование также выявило широкие различия в распространенности ВИЧ среди больных туберкулезом на субнациональном уровне: от 0,8% в зоне Восточного Харарге до 57,1% в зоне Либень. Горячая точка распространения ВИЧ среди больных туберкулезом наблюдалась в районах, расположенных в регионах Амхара, Афар и Гамбела.Это указывает на то, что общая распространенность ВИЧ по стране может маскировать локальную пространственную неоднородность эпидемии ВИЧ, и это подчеркивает кластерную модель передачи ВИЧ на районном уровне внутри страны. Предыдущие исследования также выявили пространственную кластеризацию распространенности ВИЧ среди больных ТБ на местном уровне [38, 39]. Такие результаты показывают, что бремя ВИЧ-инфекции среди больных туберкулезом следует контролировать на субнациональном уровне, чтобы эффективно использовать стратегии профилактики и укреплять комплексные услуги.Это особенно важно в такой стране, как Эфиопия, где бремя ВИЧ и туберкулеза велико.
Пространственная кластеризация распространенности ВИЧ среди больных ТБ была в значительной степени связана с доступом к медицинской помощи и социально-экономическими факторами, такими как низкий индекс благосостояния и низкий уровень грамотности взрослого населения. Этот результат согласуется с предыдущими исследованиями, проведенными в Африке к югу от Сахары, где высокая распространенность ВИЧ-инфекции была зарегистрирована в районах с низким социально-экономическим индексом [40, 41]. Отрицательная связь между плохим доступом к медицинской помощи и распространенностью ВИЧ среди больных ТБ, вероятно, связана с доступом к диагностическим учреждениям.Хотя консультирование и тестирование на ВИЧ предоставляются в Эфиопии во всех больницах и медицинских центрах, их охват недостаточен в сельских и отдаленных районах [42]. Это говорит о том, что определение географических районов с низким индексом благосостояния и предоставление адекватных медицинских услуг будет иметь жизненно важное значение для улучшения местных программ выявления, профилактики и контроля ВИЧ.
Наблюдаемая пространственная кластеризация сочетанной инфекции ТБ и ВИЧ в Эфиопии в целом предполагает, что, хотя оценки на уровне страны важны для международного сравнения, они могут скрывать важные локальные географические различия в распространенности как ТБ, так и ВИЧ.Это указывает на то, что туберкулез и ВИЧ плохо контролируются в некоторых районах. Если не будут разработаны и внедрены эффективные меры вмешательства, эти районы могут продолжать оставаться источником передачи туберкулеза и ВИЧ и создавать оперативные проблемы для разработки и реализации совместных мероприятий по борьбе с ТБ-ВИЧ. Таким образом, лучшее понимание субнациональных вариаций сочетанной инфекции ТБ / ВИЧ поможет расширить масштабы рекомендованных ВОЗ совместных мероприятий по борьбе с ТБ / ВИЧ для устранения воздействия сочетанной инфекции ТБ / ВИЧ и для достижения национальных и глобальных целей. [31].
Наш анализ имел большой размер выборки и широкий географический охват по всей Эфиопии. Однако у него есть некоторые ограничения. Во-первых, исследование проводилось на основе регулярно собираемых данных, которые доступны в национальной ИСУЗ. Эти данные могут не отражать точные национальные данные, поскольку недостаточное выявление и неполная отчетность о случаях заболевания является потенциальным ограничением данных. Во-вторых, поскольку единицей пространственного анализа были районы, мы не смогли оценить мелкомасштабные пространственные вариации распространенности ВИЧ и ТБ на уровне сообществ.Однако мы считаем, что наши результаты обеспечивают полезную оперативную основу для планирования и установления приоритетов, поскольку районы в Эфиопии являются наиболее важным административным уровнем, на котором местные ресурсы распределяются для каждого сектора. В-третьих, было бы более значимым, если бы мы оценили пространственное распределение ТБ, ВИЧ и сочетанной инфекции ТБ / ВИЧ, используя полиномиальную модель с общим населением в качестве знаменателя. Полиномиальными исходами будут отсутствие инфекции, моноинфекции ВИЧ, моноинфекции ТБ и сочетанной инфекции ВИЧ / ТБ.Однако мы не смогли этого сделать из-за отсутствия данных скрининга на уровне популяции; наша когорта была ограничена лицами, прошедшими вторичный скрининг после получения положительного диагноза на ТБ или ВИЧ. Наконец, хотя мы использовали несколько наборов данных экологического уровня, некоторые важные ковариаты, такие как паттерны лекарственной устойчивости, не были включены в анализ. Эти данные не были доступны в ИСУЗ, и при дальнейшем анализе следует рассмотреть возможность их включения, когда они станут доступны.
Заключение
Наше исследование предоставляет доказательства географической кластеризации коинфекции ТБ / ВИЧ в Эфиопии и определяет приоритетные регионы, зоны и районы, в которых необходимо усилить совместные мероприятия по ТБ / ВИЧ для достижения большего воздействия с минимальными дополнительными инвестициями.
Ссылки
- 1. Брухфельд Дж., Коррейя-Невес М., Келлениус Г. Туберкулез и коинфекция ВИЧ. Перспективы Колд-Спринг-Харбор в медицине. 2015; 5 (7): a017871. pmid: 25722472
- 2. Павловски А., Янссон М., Скёльд М., Роттенберг М.Э., Келлениус Г. Коинфекция туберкулеза и ВИЧ. Патогены PLoS. 2012; 8 (2): e1002464. pmid: 22363214
- 3. Alene KA, Viney K, McBryde ES, Gray DJ, Melku M, Clements ACA. Факторы риска туберкулеза с множественной лекарственной устойчивостью на северо-западе Эфиопии: исследование случай-контроль.Transbound Emerg Dis. 2019; 66 (4): 1611–8. pmid: 30924283
- 4. ВИЧ / СПИД JUNPo. Данные ЮНЭЙДС за 2017 г. Женева: Швейцария: ЮНЭЙДС 2017 г. 2018 г.
- 5. Kyu HH, Maddison ER, Генри NJ, Ledesma JR, Wiens KE, Reiner R Jr и др. Глобальное, региональное и национальное бремя туберкулеза, 1990–2016 гг .: результаты исследования «Глобальное бремя болезней, травм и факторов риска», 2016 г. Ланцетные инфекционные болезни. 2018; 18 (12): 1329–49. pmid: 30507459
- 6. Кю Х. Х., Мэддисон Э. Р., Генри Нью-Джерси, Мамфорд Дж. Э., Барбер Р., Шилдс С. и др.Глобальное бремя туберкулеза: результаты исследования Global Burden of Disease Study 2015. The Lancet Infectious Diseases. 2018; 18 (3): 261–84. pmid: 29223583
- 7. ВОЗ. Глобальный доклад о туберкулезе, 2018 г. Женева: Всемирная организация здравоохранения; 2018.
- 8. ВОЗ. Использование ВОЗ списков стран с высоким бременем туберкулеза в период после 2015 г. Женева: Всемирная организация здравоохранения, 2015.
- 9. ВОЗ. Глобальный доклад о туберкулезе 2018 г. Всемирная организация здравоохранения.Женева: 2018.
- 10. ЮНЭЙДС. Данные ЮНЭЙДС за 2018 г. Женева, Швейцария: Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу (ЮНЭЙДС), 2018 г.
- 11. Дерибью А., Тесфайе М., Хайльмайкл Ю., Негуссу Н., Даба С., Воги А. и др. Сочетанная инфекция туберкулеза и ВИЧ: влияние на качество жизни. Здоровье и качество жизни. 2009; 7 (1): 105.
- 12. Дерибью А., Тесфай М., Хайльмайкл Й., Аперс Л., Абебе Г., Дюшато Л. и др. Общие психические расстройства у пациентов с коинфекцией ТБ / ВИЧ в Эфиопии.BMC инфекционные болезни. 2010; 10 (1): 201.
- 13. Alene KA, Clements ACA, McBryde ES, Jaramillo E, Lonnroth K, Shaweno D и др. Расстройства психического здоровья, социальные стрессоры и качество жизни, связанное со здоровьем, у пациентов с туберкулезом с множественной лекарственной устойчивостью: систематический обзор и метаанализ. Журнал инфекции. 2018; 77 (5): 357–67. pmid: 30036607
- 14. Belay M, Bjune G, Abebe F. Распространенность туберкулеза, ВИЧ и сочетанной инфекции ТБ-ВИЧ среди лиц с подозрением на туберкулез легких в преимущественно скотоводческом районе на северо-востоке Эфиопии.Действия в области глобального здравоохранения. 2015; 8 (1): 27949.
- 15. Fite RO, Chichiabellu TY, Demissie BW, Hanfore LK. Туберкулез и ВИЧ-инфекция и сопутствующие факторы среди ВИЧ-реактивных пациентов в Эфиопии. Журнал сестринского дела и акушерства. 2019; 6 (1): 15.
- 16. Атуринде А., Фарнаги М., Пилешё П., Мансуриан А. Пространственный анализ совместной кластеризации ВИЧ-ТБ в Уганде. BMC инфекционные болезни. 2019; 19 (1): 612. pmid: 31299907
- 17. Вэй В, Вэй-Шэн З., Ахан А, Ци Ю, Вэй-Вэнь З., Мин-Цинь Ч.Характеристики эпидемии ТБ и эпидемии сочетанной инфекции ТБ / ВИЧ: ретроспективное исследование 2007–2013 гг. В Урумчи, провинция Синьцзян, Китай. PloS один. 2016; 11 (10): e0164947. pmid: 27768740
- 18. Отиенде В., Ачиа Т., Мвамби Х. Байесовское моделирование пространственно-временных моделей риска сочетанной инфекции ТБ-ВИЧ в Кении. BMC инфекционные болезни. 2019; 19 (1): 902. pmid: 31660883
- 19. Alene KA, Nega A, Taye BW. Заболеваемость и предикторы туберкулеза среди взрослых людей, живущих с вирусом иммунодефицита человека, в специализированной больнице Университета Гондэра, Северо-Западная Эфиопия.BMC инфекционные болезни. 2013; 13 (1): 292.
- 20. Аялав С.Г., Алене К.А., Адане А.А. Заболеваемость и предикторы туберкулеза среди ВИЧ-положительных детей в специализированной больнице Университета Гондэра, северо-запад Эфиопии: ретроспективное последующее исследование. Уведомления о международных научных исследованиях. 2015; 2015.
- 21. Куадрос Д.Ф., Ли Дж., Бранскум А.Дж., Акуллиан А., Цзя П., Мзирай Э.Н. и др. Составление карты пространственной изменчивости ВИЧ-инфекции в Африке к югу от Сахары: эффективная информация для локальной профилактики и контроля ВИЧ.Научные отчеты. 2017; 7 (1): 9093. pmid: 28831171
- 22. Тадесс К., Гебейох Э., Тадессе Г. Оценка внедрения информационной системы управления здравоохранением в специализированной больнице Айдер, Мекелле, Эфиопия. Int J Intell Inf Syst. 2014; 3 (4): 34.
- 23. Белай Х., Азим Т., Кассахун Х. Оценка эффективности информационной системы управления здравоохранением (HMIS) в SNNPR, Эфиопия. Оценка меры. 2013.
- 24. ESRI. ArcGIS Desktop: Выпуск 10.3.1 В: Институт СОЭ, редактор. 2015.
- 25. Alene KA, Clements AC. Пространственная кластеризация зарегистрированных случаев туберкулеза в Эфиопии: общенациональное исследование. PLoS One. 2019; 14 (8): e0221027. pmid: 31398220
- 26. Alene KA, Viney K, Gray DJ, McBryde ES, Wagnew M, Clements AC. Картирование результатов лечения туберкулеза в Эфиопии. BMC инфекционные болезни. 2019; 19 (1): 474. pmid: 31138129
- 27. Шавено Д., Кармакар М., Ален К.А., Рагоннет Р., Клементс А.С., Трауэр Дж. М. и др.Методы пространственного анализа эпидемиологии туберкулеза: систематический обзор. BMC медицина. 2018; 16 (1): 193. pmid: 30333043
- 28. Ван Ри А., Бейерс Н., Ги Р., Куннеке М., Зитсман Л., Дональд П. Детский туберкулез среди городского населения в Южной Африке: бремя и фактор риска. Архивы болезней в детстве. 1999. 80 (5): 433–7. pmid: 10208948
- 29. Йонге С., Отиено М., Шарма Р., Омедо Р. Факторы риска передачи инфекции туберкулеза в Момбасе, Кения: эпидемиологическое описательное исследование.2016.
- 30. Ван Х, Инь С., Ли Й, Ван В., Ду М, Го В. и др. Пространственно-временная эпидемиология и факторы, связанные с распространенностью туберкулеза в северном Китае, 2010–2014 гг. BMC инфекционные болезни. 2019; 19 (1): 365. pmid: 31039734
- 31. Харлинг Джи, Кастро МС. Пространственный анализ социальных и экономических детерминант туберкулеза в Бразилии. Здоровье и место. 2014; 25: 56–67.
- 32. Alene KA, Viney K, McBryde ES, Clements AC.Пространственно-временная передача и социально-климатические факторы, связанные с детским туберкулезом на северо-западе Эфиопии. Геопространственное здоровье. 2017.
- 33. Alene KA, Viney K, McBryde ES, Clements AC. Пространственные модели туберкулеза с множественной лекарственной устойчивостью и взаимосвязь с социально-экономическими, демографическими и бытовыми факторами на северо-западе Эфиопии. PloS один. 2017; 12 (2): e0171800. pmid: 28182726
- 34. Международный CSAEaI. Обзор демографии и здравоохранения Эфиопии, 2016 г.Эфиопия, Аддис-Абеба 2016.
- 35. Райзада Н., Чаухан Л.С., Кхера А., Сохей Дж., Варес Д.Ф., Саху С. и др. Распространенность ВИЧ-инфекции среди больных туберкулезом в Индии, 2006–2007 гг. PLoS One. 2008; 3 (8): e2970. pmid: 18714335
- 36. Чанда-Капата П., Капата Н., Клинкенберг Э., Гробуш М.П., Кобеленс Ф. Распространенность ВИЧ среди взрослых с легочным туберкулезом на популяционном уровне в Замбии. BMC инфекционные болезни. 2017; 17 (1): 236. pmid: 28356081
- 37. Гелав Я., Уильямс Г., Магальяйнс Р. Дж. С., Гилкс К. Ф., Ассефа Ю.Распространенность ВИЧ среди больных туберкулезом в Африке к югу от Сахары: систематический обзор и метаанализ. СПИД и поведение. 2019: 1–15.
- 38. Куадрос Д.Ф., Авад С.Ф., Абу-Раддад Л.Дж. Картирование кластеров ВИЧ: стратегия выявления групп высокого риска инфицирования ВИЧ в Африке к югу от Сахары. Международный журнал географии здоровья. 2013; 12 (1): 28.
- 39. Ганбарнежад А., Рустазаде А., Ализаде А., Аббастабар Х., Назарнежад М., Мохсени С. Пространственное распределение сочетанной инфекции ТБ и ВИЧ на юге Ирана.АЙЕР. 2015; 4: 177–83.
- 40. Маоре Н.К., Кируи Н.К., Киреки О, Огуту О, Овино М., Огаро Т. и др. Пространственное и временное распределение зарегистрированных случаев туберкулеза в округе Найроби, Кения, с 2012 по 2016 год. Восточноафриканский медицинский журнал. 2017; 94 (10): 28–40.
- 41. Сифуна П., Оума С., Атиэли Х., Овуот Дж., Оньянго Д., Андагалу Б. и др. Пространственная эпидемиология туберкулеза в округах Кисуму и Сиая с высоким бременем туберкулеза, Западная Кения, 2012–2015 гг. Международный журнал туберкулеза и болезней легких.2019; 23 (3): 363–70. pmid: 30871668
- 42. Дерибью А., Биаджилин С., Берхану Д., Дефар А., Дерибе К., Текле Е. и др. Возможности медицинских учреждений для диагностики и лечения ВИЧ / СПИДа в Эфиопии. BMC исследования служб здравоохранения. 2018; 18 (1): 535. pmid: 29996821
% PDF-1.7 % 108 0 объект > endobj xref 108 85 0000000016 00000 н. 0000002778 00000 н. 0000002953 00000 н. 0000003495 00000 н. 0000003627 00000 н. 0000003760 00000 н. 0000004069 00000 н. 0000004490 00000 н. 0000004688 00000 н. 0000005030 00000 н. 0000005246 00000 н. 0000005283 00000 п. 0000005538 00000 п 0000005652 00000 п. 0000005764 00000 н. 0000006086 00000 н. 0000006468 00000 н. 0000006715 00000 н. 0000007051 00000 н. 0000007300 00000 н. 0000007327 00000 н. 0000008096 00000 н. 0000009577 00000 н. 0000009714 00000 н. 0000009741 00000 н. 0000010297 00000 п. 0000011528 00000 п. 0000012818 00000 п. 0000013797 00000 п. 0000014714 00000 п. 0000015745 00000 п. 0000016785 00000 п. 0000017894 00000 п. 0000020544 00000 п. 0000020614 00000 п. 0000020728 00000 п. 0000050975 00000 п. 0000051238 00000 п. 0000052041 00000 п. 0000052111 00000 п. 0000052220 00000 п. 0000057020 00000 п. 0000057544 00000 п. 0000077989 00000 п. 0000080645 00000 п. 0000081013 00000 п. 0000100501 00000 н. 0000100756 00000 н. 0000104331 00000 п. 0000121530 00000 н. 0000121799 00000 н. 0000143546 00000 н. 0000143616 00000 н. 0000143701 00000 н. 0000146356 00000 н. 0000146620 00000 н. 0000146782 00000 н. 0000146809 00000 н. 0000147118 00000 н. 0000147203 00000 н. 0000147667 00000 н. 0000148036 00000 н. 0000148415 00000 н. 0000148759 00000 н. 0000149119 00000 п. 0000167187 00000 н. 0000167436 00000 н. 0000167794 00000 н. 0000168137 00000 н. 0000168509 00000 н. 0000168889 00000 н. 0000169710 00000 н. 0000169737 00000 н. 0000170119 00000 п. 0000170256 00000 н. 0000170283 00000 н. 0000170710 00000 н. 0000170842 00000 н. 0000171259 00000 н. 0000171765 00000 н. 0000172167 00000 н. 0000172568 00000 н. 0000172865 00000 н. 0000173041 00000 н. 0000001996 00000 н. трейлер ] / Назад 613760 >> startxref 0 %% EOF 192 0 объект > поток hb«b`f`g`Pfb @
Тенденции и факторы, связанные с ВИЧ-инфекцией среди больных туберкулезом в эпоху антиретровирусной терапии: ретроспективное исследование в Англии, Уэльсе и Северной Ирландии | BMC Medicine
В этом ретроспективном исследовании зарегистрированных случаев ТБ в Англии, Уэльсе и Северной Ирландии мы сообщаем о существенном снижении как числа, так и доли случаев ТБ с ВИЧ с 2005 и 2004 годов соответственно, особенно среди женщин.ВИЧ-инфекция была наиболее распространена среди чернокожих африканцев, родившихся в странах с высоким уровнем распространения ВИЧ. Злоупотребление наркотиками было единственным социальным фактором риска, независимо связанным с ВИЧ-инфекцией.
Значение наших выводов
Доля случаев ТБ, диагностированных через более 91 дня после постановки диагноза ВИЧ, выросла в течение периода исследования, тогда как доля случаев, диагностированных до постановки диагноза ВИЧ, снизилась. Вероятно, это результат более частого тестирования на ВИЧ, более ранних диагнозов ВИЧ и более здорового населения ЛЖВ благодаря началу антиретровирусной терапии (АРТ) [19].
BHIVA и Национальный институт здравоохранения и передового опыта (NICE) рекомендуют тестирование на ВИЧ для всех пациентов с диагнозом ТБ с 2011 года [11, 20]. В период с 2011 по 2015 год более 90% больных туберкулезом с ранее неизвестным ВИЧ-статусом прошли тестирование на ВИЧ [1]. Однако у значительной части пациентов (38,5% в 2014 г.) одновременно были диагностированы туберкулез и ВИЧ. Регулярное тестирование новых больных туберкулезом на ВИЧ не дает возможности предотвратить заболевание туберкулезом, и эти случаи туберкулеза можно было бы предотвратить, если бы ВИЧ был диагностирован ранее, и пациенты раньше начали АРТ или прошли лечение от ЛТИ.В 2008 году BHIVA представила специальные рекомендации, рекомендующие больше тестирования на ВИЧ среди населения с высоким риском инфицирования, и увеличила порог числа CD4, при котором они рекомендуют ЛЖВ начать АРТ. Это отражается в увеличении среднего числа CD4, представляющих более здоровую популяцию ЛЖВ [19], что способствует наблюдаемому снижению инфекций. С 2015 года руководство BHIVA рекомендует АРТ для всех ЛЖВ независимо от их числа CD4, что должно еще больше снизить заболеваемость ТБ у ЛЖВ. Необходимо больше тестирования на ВИЧ среди населения, подверженного риску туберкулеза, чтобы диагностировать ВИЧ раньше, чтобы ЛЖВ, у которых ранее не диагностировали диагноз, могли начать АРТ и предотвратить прогрессирование ЛТИ в активную болезнь.
В настоящее время большинство случаев заражения ТБ-ВИЧ происходит у людей, которые уже были инфицированы ВИЧ и впоследствии заболели туберкулезом. Это имеет важное значение для стратегий профилактики туберкулеза. Сосредоточения внимания на тестировании на ВИЧ и начале АРТ недостаточно для профилактики туберкулеза у ЛЖВ, а усиление тестирования и лечения ЛТБИ может еще больше снизить ТБ-ВИЧ. Наши данные показывают, что у чернокожих африканцев по-прежнему высокие показатели ВИЧ-ассоциированного ТБ, и что рекомендации BHIVA, рекомендующие скрининг на ЛТБИ в этой популяции ЛЖВ, остаются актуальными.
Частично снижение уровня ВИЧ-инфекции можно отнести к изменению моделей миграции, что привело к уменьшению числа случаев туберкулеза у чернокожих африканцев из стран с высоким уровнем распространенности ВИЧ и к увеличению числа лиц из азиатских стран с низким уровнем распространенности ВИЧ [5]. Хотя наибольшее снижение заболеваемости ВИЧ-инфекцией произошло среди чернокожих африканских больных туберкулезом, они остаются группой риска. ВИЧ-инфекция была выше среди женщин с туберкулезом, чем среди мужчин. Это отражает гендерное соотношение гетеросексуальных ЛЖВ в Великобритании, где ВИЧ-инфицированных женщин больше, чем мужчин, особенно среди чернокожих африканцев [2].Вероятно, это связано с более высоким уровнем диагностики у женщин [2] из-за дородового тестирования на ВИЧ; таким образом, снижение отражает как изменения в этнической принадлежности больных туберкулезом, так и более здоровую когорту женщин с ВИЧ. ВИЧ-инфекция снизилась у больных туберкулезом в возрасте 15–44 лет, но не у пожилых людей. Это может быть связано со старением когорты ЛЖВ и более высокой частотой поздней диагностики ВИЧ у пожилых пациентов, что увеличивает риск ТБ [2].
ВИЧ-инфекция чаще встречалась у больных туберкулезом с любым социальным фактором риска (злоупотребление наркотиками и алкоголем, тюремное заключение и бездомность), чем у больных туберкулезом, и в целом даже чаще среди больных туберкулезом с множеством социальных факторов риска.Однако после поправки на другие социальные факторы риска в многофакторной модели только злоупотребление наркотиками оставалось связанным с большей вероятностью заражения ВИЧ; вероятно, это результат заражения ВИЧ в результате употребления инъекционных наркотиков. Поскольку заболеваемость ТБ среди ЛЖВ, употребляющих инъекционные наркотики, сравнима с заболеваемостью чернокожих африканцев из стран с высоким бременем ТБ [10], мы предполагаем, что скрининг на ЛТБИ и профилактическое лечение ТБ у ЛЖВ с социальными факторами риска, в частности, злоупотреблением наркотиками, могут снизить заболеваемость туберкулезом в этой стране. численность населения.
Мы обнаружили гораздо большую долю сочетанной ВИЧ-инфекции среди пациентов с милиарным и менингеальным туберкулезом, чем легочный туберкулез, и меньшую долю среди пациентов с другими внелегочными заболеваниями. Это согласуется с периодом исследования и с предыдущей работой [21], вероятно, потому, что внелегочный ТБ распространен у больных ТБ с индийского субконтинента [21], где распространенность ВИЧ низкая. Наши результаты согласуются с другими исследованиями, в которых сообщается о более высокой распространенности коинфекции ВИЧ среди случаев милиарного [22] и менингеального [23] ТБ и более низкой распространенности ВИЧ среди других форм внелегочного ТБ.Недавняя работа в Великобритании показала, что пациенты с тяжелым внелегочным туберкулезом имеют худшие результаты, чем пациенты с легочным туберкулезом, тогда как пациенты с другим внелегочным туберкулезом обычно имеют лучшие результаты [1]. Неясно, связано ли это исключительно с тяжелой формой заболевания или на этих пациентов может повлиять более высокая частота коинфекции ВИЧ (и соответствующая клиническая сложность). Тем не менее, поскольку диагностика внелегочного ТБ часто затруднена, повышение осведомленности о симптомах внелегочного ТБ среди ЛЖВ и групп населения с высокими показателями недиагностированного ВИЧ может позволить более раннюю диагностику внелегочного ТБ.
Сильные стороны и ограничения
Это исследование извлекает выгоду из 15-летнего уведомления о случаях заболевания в надежных национальных программах эпиднадзора, представляющих всесторонний охват случаев ТБ в Англии, Уэльсе и Северной Ирландии. Однако есть некоторые ограничения. Набор данных эпиднадзора за ВИЧ не содержит информации, позволяющей установить личность (PII), что означает необходимость привязки записи к данным о ТБ. Адаптированный нами вероятностный алгоритм имеет очень высокую чувствительность (97,1%) и специфичность (100.0%), даже если PII, например номера и адреса NHS, недоступны [14]. Чтобы уменьшить систематическую ошибку, мы адаптировали алгоритм, устранив необходимость субъективного ручного анализа пограничных совпадений, заменив этот шаг детерминированным связыванием записей [15]. Алгоритм связывания записей использовал этническую принадлежность, год и страну рождения для связи случаев, и, хотя полнота этих переменных была высокой (таблица 1), случаи, в которых эти переменные отсутствовали (в любом наборе данных), были связаны с меньшей вероятностью. Поэтому возможно, что мы недооценили распространенность ТБ-ВИЧ, если не смогли связать некоторые записи из-за отсутствия данных.Мы провели анализ чувствительности, исключив более слабые совпадения между записями о ТБ и ВИЧ, чтобы оценить, различались ли факторы риска для пациентов, относительно ВИЧ-статуса которых мы были менее уверены. Они дали последовательные результаты, предполагающие, что алгоритм сопоставления не повлиял на наши выводы. Надежные и высококачественные национальные базы данных по эпиднадзору за болезнями необходимы для мониторинга прогресса в достижении целей устойчивого развития ВОЗ. Системы эпиднадзора за туберкулезом и ВИЧ в Великобритании имеют очень высокое качество, но включение статуса ВИЧ в систему эпиднадзора за туберкулезом или возможность связать два набора данных с использованием уникальных идентификаторов пациентов будет полезным для будущих исследований.
По большинству переменных практически отсутствовали данные; однако у 19% пациентов с 2010 по 2014 г. отсутствовали данные о некоторых социальных факторах риска. Эти пациенты, скорее всего, были женщинами или жителями Индийского субконтинента; обе группы имели низкий уровень социальных факторов риска [1]. Следовательно, любое смещение в наших результатах будет в сторону нуля, что недооценивает связь между туберкулезом и социальными факторами риска.
Нам удалось идентифицировать только инфицированных людей с диагностированным ВИЧ, и, по оценкам, в 2015 году не диагностировали 13% ВИЧ-инфекций [2].Однако 94% людей, у которых в 2015 г. был диагностирован туберкулез, прошли тестирование на ВИЧ или уже знали о своем ВИЧ-статусе [1], и поэтому можно ожидать очень низкой распространенности недиагностированного ВИЧ в этой группе населения. До 2011 года, когда тестирование больных туберкулезом на ВИЧ стало обычным делом, среди пациентов могло быть больше недиагностированного ВИЧ; однако с тех пор большинство этих пациентов обратились за помощью и были связаны в нашем наборе данных. Поскольку это было ретроспективное обсервационное исследование случаев ТБ, мы не смогли установить причинно-следственную связь между ВИЧ-инфекцией и заболеванием ТБ, но вполне вероятно, что ВИЧ-инфекция предшествует заболеванию ТБ.Наше исследование демонстрирует постоянный риск заражения ВИЧ среди пациентов с туберкулезом, подтверждая руководство по универсальному тестированию на ВИЧ для всех пациентов с диагнозом туберкулез и выделяя группы, которым следует уделять первоочередное внимание при проведении мероприятий, улучшающих охват тестирования.
Границы | Синдемия ВИЧ-ассоциированного туберкулеза: растущая клиническая проблема во всем мире
Введение
Коинфекция Mycobacterium tuberculosis (MTB) у пациентов, предварительно инфицированных вирусом иммунодефицита человека (ВИЧ) и / или с синдромом полномасштабного приобретенного иммунодефицита (СПИД), представляет собой назревающую пандемию (1–3).В связи с более широким признанием заболеваемости и смертности, связанных с этой коинфекцией, Всемирная организация здравоохранения (ВОЗ) рекомендует агрессивные подходы к скринингу на MTB во время первичных посещений, связанных со скринингом и лечением ВИЧ (2). Хотя такое состояние коинфекции является серьезной проблемой общественного здравоохранения в условиях ограниченных ресурсов с высоким бременем обеих болезней, например, в странах Африки и Азии (1, 4, 5), оно все чаще признается в условиях развитых стран. страны, в том числе США (U.С.) (6–9). По оценкам ВОЗ, 1,5 миллиона случаев смерти от туберкулеза (ТБ) примерно у 70% ВИЧ-отрицательных и 30% ВИЧ-положительных людей, что делает МТБ второй ведущей причиной смерти от инфекционного заболевания и ведущей причиной смерти в условиях СПИДа во всем мире ( 10). В этом обзоре представлены ключевые клинические аспекты коинфекции ВИЧ-MTB, включая необычные проявления, диагностические вопросы и стратегии лечения, и подчеркивается постоянная необходимость в повышении бдительности для более точного выявления случаев.
Согласно рекомендациям ВОЗ, все клиенты, посещающие центры тестирования на ВИЧ, и люди, живущие с ВИЧ (ЛЖВ), посещающие центры антиретровирусной терапии (АРТ), должны проходить клинический скрининг на симптомы ТБ при каждом амбулаторном обращении (2). Хотя показатели начала АРТ у ВИЧ-положительных пациентов с ТБ улучшаются, летальность по-прежнему высока по сравнению с ВИЧ-отрицательными пациентами с ТБ (2). Основным объяснением этого различия может быть задержка бактериологического выявления ВИЧ-ассоциированного ТБ, включение в АРТ или немедленное начало АРТ (2).
Различные группы населения создают групповые проблемы в ответ на обнаружение и лечение. К этим группам населения относятся педиатрические пациенты, дородовые ВИЧ-инфицированные пациенты, водители грузовиков, работницы секс-бизнеса и мужчины, практикующие секс с мужчинами, беженцев и перемещенных лиц (2). Другие проблемы существуют в переполненных местах, таких как шахты, тюрьмы, приюты для бездомных и центры опиоидной заместительной терапии (2). Социальные проблемы, в том числе бедность, превращаются в ткань клинического течения коинфекции ВИЧ-MTB (2).В этом обзоре мы делаем упор на раннее выявление за счет эффективного проведения тестирования на ВИЧ и консультирования по инициативе провайдера у больных ТБ, а также на более интенсивном выявлении случаев ТБ среди ЛЖВ и начале быстрого лечения для минимизации заболеваемости и смертности (2).
Демографические факторы, связанные с
Mycobacterium tuberculosis Коинфекция у пациентов с ВИЧПол, возраст, социально-экономический статус, семейное положение и уровень образования — это факторы, которые влияют на вероятность коинфекции ВИЧ-MTB.Сообщается, что мужской пол положительно коррелирует с инфекцией MTB в соотношении 2: 1 (11). Коинфекция ВИЧ-MTB чаще встречается у взрослых в возрасте от 33 до 45 лет (2). Одинокий статус, низкий социально-экономический статус и низкий уровень дохода, а также отсутствие образования связаны с неблагоприятными условиями жизни. Плохая санитария и плохой доступ к медицинскому обслуживанию отрицательно влияют на исходы, что может объяснить более высокую заболеваемость и смертность в этой группе пациентов (2).
Здесь важно указать некоторые исключения.Например, коинфекцией могут болеть молодые люди. Особо высокому риску может подвергаться педиатрическое население, особенно те, кто заразился вертикальной передачей инфекции (12). Интересно отметить, что в некоторых географических регионах, таких как приграничные районы Пакистана и Афганистана, заболеваемость среди женщин выше, чем среди мужчин (13). Согласно Глобальному отчету ВОЗ о туберкулезе за 2013 год, Афганистан является страной с высоким бременем туберкулеза с соотношением мужчин и женщин по туберкулезу 0,5, так что в отличие от многих других стран афганские женщины с большей вероятностью заражаются туберкулезом, чем мужчины.Предполагаемая частота коинфекций ВИЧ-ТБ в этой группе относительно низкая (1 на 100 000) и сконцентрирована в основном среди потребителей инъекционных наркотиков (по данным Всемирного банка). Если бы у афганских женщин-беженцев была более высокая частота коинфекции ВИЧ-MTB, наблюдения, вероятно, были бы связаны с более высокой заболеваемостью туберкулезом у афганских женщин или с небольшим размером выборки коинфекции ВИЧ-MTB в лагере беженцев. Кроме того, состояния с ослабленным иммунитетом, такие как состояния, получающие лечение противоопухолевым фактором некроза, кортикостероиды, диализ, трансплантацию органов или гематологическую трансплантацию, или состояния с силикозом, могут быть более предрасположены к коинфекции ВИЧ-МТБ из-за активации латентной инфекции ТБ (14).
Патогенез
Mycobacterium tuberculosis — Коинфекция ВИЧДетали иммунного ответа на ТБ, ВИЧ и коинфекцию описаны в недавних обзорах (1, 15). Важно отметить, что MTB возникает у пациентов с ВИЧ раньше, чем другие оппортунистические инфекции (OI), из-за повышенной чувствительности MTB-специфических CD4 + T-клеток к ВИЧ-инфекции (16). Мы представляем иммунный патогенез в зависимости от интенсивности клинических проявлений туберкулеза с уже существующей ВИЧ-инфекцией.
Инфекция туберкулеза является результатом взаимодействия между вирулентностью бактерий и резистентностью хозяина (17, 18). Инфекция начинается при вдыхании капель воздуха, содержащих примерно 1–200 бацилл, от человека с активным заболеванием MTB (легочные) (18). Бациллы быстро фагоцитируются резидентными макрофагами в альвеолах. Это вызывает воспалительный каскад, за которым следует развитие гранулемы. Кроме того, клеточный иммунитет через активацию CD4-Т-лимфоцитов важен для предотвращения ускорения и реактивации заболевания MTB (1, 15, 17, 18).
С другой стороны, ВИЧ, передающийся в основном через генитальные жидкости, кровь и слизистые оболочки, взаимодействует с различными клетками организма и имеет тенденцию избегать иммунного ответа хозяина против него, что приводит к полномасштабному заболеванию СПИДом (19). Прогрессирование ВИЧ-инфекции является результатом сочетания истощения CD4 + Т-лимфоцитов и хронического состояния иммунной инактивации. Подавление CD4 + Т-клеток и нарушение активности макрофагов при ВИЧ / СПИДе приводит к подавлению иммунного ответа организма на инфекции, такие как MTB. Микобактерии содержатся внутри гранулем; однако их нарушение приводит к росту бактерий MTB и их системному распространению во многие органы (1, 15). MTB оказывает негативное влияние на иммунный ответ организма на ВИЧ, регулируя иммунный ответ хозяина путем активации Т-клеток. Исследования показали, что MTB усиливает репликацию вируса ВИЧ за счет увеличения экспрессии рецепторов (например, CXCR4), что способствует росту вируса (15, 19). Иммунный ответ отвечает за интенсивность туберкулезной инфекции у ВИЧ-инфицированного хозяина, а также за милиарные и внелегочные проявления и связанную с ними диагностическую дилемму (1, 15, 20, 21).
Исследования, направленные на получение прямых доказательств прогрессирования заболевания, были ограничены из-за экономических причин оценки вирусной нагрузки ВИЧ, особенно в странах, где частота / распространенность коинфекции ВИЧ-MTB высока, но имеет недостаток, связанный с ограниченностью ресурсов (22). Как уже отмечалось, влияние MTB на прогрессирование ВИЧ-инфекции в первую очередь связано с повышением вирусной нагрузки ВИЧ-1, включая развитие новых ОИ (22–28). Интересно, что было обнаружено, что туберкулез оказывает существенное влияние на снижение выживаемости у субъектов с более сохраненным иммунологическим статусом (т.е., количество клеток CD4> 200 клеток / мкл) (27, 28). Повышенная продукция ВИЧ-1 была продемонстрирована в локальных участках инфекции MTB, например, в жидкости бронхоальвеолярного лаважа (БАЛ) от пораженного туберкулеза, по сравнению с неинфицированными легкими пациентов с коинфекцией ВИЧ-1 / туберкулез (29). Клиническим проявлением туберкулеза, которое особенно наблюдается у ВИЧ-1-инфицированных пациентов, является туберкулез плевры, часто встречающийся у африканских пациентов с коинфекцией (30, 31). Эти участки активной инфекции MTB действуют как очаги репликации ВИЧ и эволюции квазивидов, независимо от системной активности ВИЧ-1, и могут быть ответственны за распространение инфекции MTB у хозяев, инфицированных ВИЧ-1.
Mycobacterium tuberculosis повреждает альвеолярный эпителий во время первой фазы внелегочного распространения. Сообщалось о молекулярных механизмах этого цитолиза. Например, гепарин-связывающий гемагглютинин-адгезин (HBHA) способствует связыванию MTB с сульфатированными гликоконъюгатами на эпителиальных клетках. Два генных продукта гена MTB RD1, ранняя секреторная антигенная мишень 6 кДа (ESAT-6) и белок фильтрата культуры 10 кД (CFP-10), были причинно связаны с лизисом клеток и внелегочным распространением микобактерий (32).Перенос микобактерий в региональные лимфатические узлы, хотя и важен для развития защитного Т-клеточного иммунного ответа, является первым внелегочным местом миграции MTB. Затем бактерии, распространяющиеся через кровоток и лимфатические сосуды, приводят к внелегочному туберкулезу (EPTB). Гранулемы легких от пациентов с коинфекцией MTB / ВИЧ-1 высвобождают более низкие уровни in situ продукции TNF (33). Кроме того, хозяева с коинфекцией MTB – ВИЧ-1 имеют низкие уровни циркулирующего лектина, связывающего маннозу (34).Сложные взаимодействия, которые происходят между Т-клетками хозяина, Treg, продукцией цитокинов и общими нарушениями Th2-ответов, предрасполагают к внелегочным инфекциям у хозяев с коинфекцией ВИЧ (35, 36). Несколько первичных иммунодефицитов, включая менделевскую восприимчивость к микобактериальным инфекциям, увеличивают общий риск EPTB (37). Эти аспекты заслуживают подробного изучения в будущем.
Скрининг на
Mycobacterium tuberculosis –ВИЧ-коинфекцияВсемирная организация здравоохранения сформулировала политику в отношении совместных мероприятий по БТБ / ВИЧ с главной целью снижения двойного бремени БТ и ВИЧ (2).ВОЗ рекомендует проводить скрининг на MTB среди ВИЧ-инфицированных пациентов во время постановки диагноза и до начала АРТ. Скрининг на MTB также следует распространить на домашних контактов с ВИЧ-положительными пациентами (2). Инструмент скрининга использует алгоритм, основанный на клинических симптомах, который заключается в отсутствии или наличии текущего кашля, лихорадки, потери веса или ночного потоотделения во время первоначального обращения и при каждом посещении поликлиники. Этот инструмент можно использовать для выявления пациентов, которым требуется дополнительная медицинская помощь, и тех, кто нуждается в химиопрофилактике MTB, направленной на предотвращение активного туберкулеза (а не в профилактике инфекции туберкулеза per se ).
Диагностика
Mycobacterium tuberculosis Инфекция у пациентов с коинфекцией ВИЧОсобого внимания заслуживают высокая степень клинического подозрения и необходимость получения целенаправленного и подробного анамнеза. Многочисленные заболевания могут имитировать проявления туберкулеза, но туберкулез должен быть выше по сравнению с легочными проявлениями и ВИЧ-ассоциированными заболеваниями грудной клетки (7, 38). Рекомендуется первоначальный скрининг с помощью туберкулиновой кожной пробы (TST) или тестов высвобождения гамма-интерферона (IGRA).ТКП, на которую может повлиять вакцинация против бациллы Кальметта – Герена (БЦЖ), и / или IGRA, на которую не влияет вакцинация БЦЖ, обычно используются в качестве методов скрининга на ТБ у бессимптомных лиц, не инфицированных ВИЧ, в странах с низкой распространенностью ТБ. Однако можно отметить, что эти тесты имеют «низкую специфичность» (TST) или «имеют ложноположительные и ложноотрицательные результаты» (IGRA) и имеют низкую диагностическую ценность в эндемичных по туберкулезу районах, особенно при коинфекции ВИЧ. Когда есть высокая степень клинического подозрения или пневматических представлений, стандартный диагноз ТБ у пациентов с симптомами обычно не TST или IGRA, а скорее достигается с помощью микроскопии мазка мокроты.Это недорого, быстро и легко выполняется в полевых условиях, но имеет более низкую чувствительность при коинфекции MTB – ВИЧ. Преимущество мазка мокроты заключается в том, что он используется для посева на MTB и тестирования лекарственной чувствительности. Поскольку коинфекция снижает чувствительность микроскопии, некоторые современные диагностические методы более чувствительны, чем обычная микроскопия мазка мокроты, при обнаружении MTB у ВИЧ-инфицированных. Обнаружение MTB на основе роста в культурах и молекулярных методах, таких как тестирование амплификации нуклеиновых кислот (NAAT), оказалось более чувствительным и позволяет характеризовать штамм и проводить тесты на лекарственную чувствительность (39, 40).
В 2013 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США одобрило тест GeneXpert MTB / RIF (Cepheid Inc., Саннивейл, Калифорния, США), диагностическую платформу на основе NAAT. ВОЗ одобрила использование этого теста в качестве первоначального теста для диагностики ТБ у ЛЖВ или у тех, у кого есть подозрение на ТБ с множественной лекарственной устойчивостью (МЛУ-ТБ), и с тех пор он широко используется (41–44). Стоимость теста, несмотря на субсидию, во многих эндемичных по ТБ странах была препятствием для использования в качестве диагностического инструмента первой линии.
Кроме того, низкие пороговые значения должны соблюдаться при выполнении стандартных рентгеновских снимков грудной клетки и компьютерной томографии для диагностического подозрения на милиарный туберкулез и выявления поражений при внелегочных проявлениях (38). Плеоморфные проявления радиографических проявлений коинфекции ВИЧ-МТБ показаны на Рисунке 1.
Рис. 1. Рентгенографические признаки туберкулеза при ВИЧ. (A) Правосторонняя внутригрудная лимфаденопатия и бронхиальные отметины при первичном туберкулезном проявлении легких у ВИЧ-инфицированного молодого взрослого (B) Консолидация левой нижней доли из-за инфекции Streptococcus pneumonia при ранее существовавшем туберкулезе и коинфекциях ВИЧ (Ci, ii) Радиологический вид IRIS .Рентген грудной клетки, показывающий рентгенологическое прогрессирование небольшого поражения левой доли до обширной консолидации у больного туберкулезом через несколько недель после начала антиретровирусной терапии (АРТ). Все рентгеновские снимки получены с разрешения Chou et al. (38).
Важное предостережение при диагностике MTB связано с контекстом латентного ТБ. Низкая специфичность TST и проблемы ложноположительных и ложноотрицательных результатов с помощью анализа IGRA [QuantiIFERON ® -TB Gold In-Tube (QFT-G-IT) (Cellestis Ltd.), Carnegie, VIC, Australia) или T-SPOT ® TB assay (Oxford Immunotec Inc., Мальборо, Массачусетс, США)] создают серьезные проблемы для пациентов с коинфекцией ВИЧ. Критические аспекты и неудовлетворенные потребности в диагностике латентного ТБ были недавно рассмотрены (39). Из-за очень высокого риска активации латентного ТБ при коинфекции ВИЧ эти когорты (пациенты с ослабленным иммунитетом, иммигранты из стран с высоким бременем болезней, бездомные, заключенные, потребители запрещенных наркотиков, медицинские работники, заботящиеся о группах высокого риска, и взрослые, контактирующие с ними). больных туберкулезом) нуждаются в тщательном выявлении и оценке, чтобы их можно было рассмотреть для последующего наблюдения, профилактического лечения и незамедлительного начала лечения при обнаружении активных поражений.
Клиническое ведение
Mycobacterium tuberculosis –коинфекция ВИЧЗадержка в диагностике MTB у ВИЧ-инфицированных пациентов и неадекватное начальное лечение могут привести к туберкулезу с множественной лекарственной устойчивостью (МЛУ-ТБ). МЛУ-ТБ вызывает растущую озабоченность не только из-за большей продолжительности лечения, но и из-за связанного с ним повышенного риска передачи между контактами и повышенного уровня смертности среди пациентов с коинфекцией ВИЧ (45).
При лечении коинфекции ВИЧ-MTB необходимо учитывать корректировку продолжительности, дозировки и частоты приема противотуберкулезных препаратов, а также оптимальное время начала лечения высокоактивной антиретровирусной терапией (ВААРТ).Стандартный режим лечения туберкулеза состоит из изониазида (INH), рифамицина (рифампицин-RIF или рифабутин-RFB), пиразинамида (PZA) и этамбутола (EMB) в течение 2 месяцев с последующим приемом INH плюс рифамицин в течение 4–7 месяцев. (46). Лечение активной туберкулезной инфекции является приоритетом из-за риска передачи туберкулеза другим людям. Однако, когда количество CD4 + Т-лимфоцитов чрезвычайно низкое (<50 клеток / мм 3 ), следует составить соответствующий план лечения, в котором необходимо быстрое начало ВААРТ.Рандомизированные контролируемые исследования, такие как SAPiT (47), CAMELIA (48) и STRIDE (49), предложили и предоставили доказательства для немедленного начала АРТ в течение 2 недель после начала антимикобактериальной терапии.
Существует несколько дискуссий об идеальном времени начала ВААРТ и одновременного приема противотуберкулезных препаратов. Преимущества раннего назначения ВААРТ включают более высокие показатели излечения, снижение риска рецидива, снижение риска инфицирования другими ВИЧ-ассоциированными ОИ и более низкие показатели смертности.С другой стороны, к недостаткам относятся потенциальные лекарственные взаимодействия ВААРТ с рифампицином, что ограничивает совместное введение выбранных ингибиторов протеазы (ИП), кумулятивную токсичность, терапевтическую неудачу и риск воспалительного синдрома восстановления иммунитета (ВСВИ), которые влияют на длительный период времени. краткосрочное соблюдение режима ВААРТ у пациентов, инфицированных МТБ (50). Кроме того, несоблюдение режима приема таблеток, побочные эффекты лекарств, доступность центров лечения ВИЧ и туберкулеза, опасения стигматизации, стоимость медицинского обслуживания и отсутствие надлежащего санитарного просвещения также являются серьезными проблемами, которые необходимо решать для успешного лечения. Пациенты с МТБ (51).В целом, приоритет должен заключаться в предоставлении этим пациентам терапии под непосредственным наблюдением (DOT), чтобы обеспечить соблюдение режима лечения и успех лечения (10). Два недавно опубликованных исследования вновь подчеркнули важность раннего начала АРТ. Исследование TEMPRANO, проведенное в Кот-д’Ивуаре, показало, что раннее начало АРТ у субъектов с числом CD4 + клеток ≥500 клеток / мм 3 было связано со снижением риска смерти или тяжелого заболевания, связанного с ВИЧ, на 44%, чем при начале АРТ в соответствии с преобладающие критерии ВОЗ (52).Кроме того, пациенты, получавшие профилактику изониазидом, имели на 35% меньший риск смерти или тяжелого заболевания, связанного с ВИЧ, чем пациенты, которые ее не получали. В исследовании START с участием 215 центров в 35 странах риск смерти, серьезного события, связанного со СПИДом, или серьезного события, не связанного со СПИДом, был на 57% меньше среди субъектов, получавших раннее лечение, чем среди пациентов, получавших лечение, когда количество клеток CD4 + снизилась до 350 кл / мм 3 (53). В обоих исследованиях снижение заболеваемости туберкулезом после ранней, а не отсроченной АРТ было наиболее значительным фактором общего положительного эффекта.Раннее начало АРТ обладает дополнительными преимуществами в плане снижения риска передачи ВИЧ и HSV2 половым путем (54). Однако проблемы общественного здравоохранения, связанные с затратами и мотивацией глобального здравоохранения к внедрению этих последних основанных на фактических данных рекомендаций, остаются серьезной проблемой, которую необходимо преодолеть (54).
У определенных пациентов, таких как ВИЧ-инфицированные беременные женщины с активным туберкулезом, рекомендуется как можно раньше начинать АРТ, как для здоровья матери, так и для предотвращения перинатальной передачи ВИЧ (55).Выбор АРТ должен основываться на эффективности и безопасности во время беременности и учитывать возможные лекарственные взаимодействия между антиретровирусными препаратами и рифамицином (50). Сообщалось, что у ВИЧ-инфицированных пациентов с латентной туберкулезной инфекцией (ЛТИ) профилактическая терапия изониазидом (ПЛИ) снижает реактивацию латентной инфекции ТБ как в промышленно развитых, так и в развивающихся странах (56).
Осложнения, возникающие при терапии коинфекции ВИЧ – MTB
Воспалительный синдром восстановления иммунной системы
Преходящее обострение респираторных признаков и симптомов, несмотря на снижение вирусной нагрузки и / или радиологическое ухудшение, может развиваться у пациентов с коинфекцией ВИЧ-MTB, которые получают лечение противотуберкулезными препаратами одновременно с ВААРТ (19).IRIS имеет диморфное представление: разоблачительное и парадоксальное (57, 58). Восстановление иммунной компетентности путем введения АРТ приводит к гипериммунному ответу хозяина на туберкулезные бациллы и / или антигены. Разоблачение ВСВИ проявляется активным туберкулезом вскоре после начала АРТ. Парадоксальный ВСВИ означает ухудшение симптомов ТБ после начала АРТ у пациентов, получающих лечение ТБ. Противовоспалительные препараты и стероиды являются основой терапии ВСВИ. Прекращение ВААРТ в большинстве случаев не требуется.Отсрочка начала АРТ на 2–8 недель может снизить частоту и тяжесть ВСВИ. Однако это возможное преимущество отсроченного АРТ необходимо сопоставить с потенциальной пользой более раннего АРТ для улучшения иммунной функции и предотвращения прогрессирования заболевания и смертности от ВИЧ. Важно отметить, что восстановление иммунитета с помощью АРТ может привести к разоблачению ЛТБИ (т. Е. Преобразованию ранее отрицательного TST в положительный TST или положительный IGRA для MTB-специфических белков) (44). Положительный результат IGRA, аналогичный положительному результату TST, свидетельствует о ЛТИ при отсутствии признаков активного ТБ.Поскольку лечение ЛТИ показано при отсутствии признаков активного туберкулеза, такая ситуация должна быть клинически признана, особенно в группах высокого риска.
Противотуберкулезные и антиретровирусные лекарственные средства взаимодействия
Рифамицины являются мощными индукторами фермента цитохрома P (CYP) 450 в печени. Они связаны со значительными взаимодействиями со всеми ИП, некоторыми ненуклеозидными ингибиторами обратной транскриптазы (ННИОТ), маравироком (MVC) и ралтегравиром (RAL) (50, 58–61), что приводит к усилению клиренса лекарственного средства и значительному снижению циркулирующих антибиотиков. -ретровирусные препараты.Однако хорошие вирусологические, иммунологические и клинические результаты могут быть достигнуты при использовании стандартных доз эфавиренца (EFV) и невирапина (NVP) в сочетании с рифампицином (61). Субоптимальное подавление ВИЧ или неоптимальный ответ на лечение ТБ должны вызывать немедленную оценку приверженности к лечению, субтерапевтических уровней препаратов (с учетом мониторинга терапевтических препаратов) и приобретенной лекарственной устойчивости.
Другие известные побочные эффекты
Гепатотоксичность потенциально возникает при совместном применении антиретровирусных и антимикобактериальных агентов; Таким образом, следует осуществлять постоянный мониторинг функции печени.Симптомы боли в животе, желтухи, потери аппетита, лихорадки и тошноты заслуживают неотложного клинического внимания (39). Кроме того, многим из этих пациентов может потребоваться дополнительное лечение, например, при лекарственной зависимости или коинфекции ВГС, что представляет дополнительный риск сопутствующих заболеваний печени (62). С другой стороны, периферическая невропатия может возникать при введении INH, диданозина (ddI) или ставудина (d4T) или может быть проявлением нативной ВИЧ-инфекции per se . Всем пациентам, получающим INH, следует назначать дополнительный пиридоксин для уменьшения периферической нейропатии (61).Другие сосуществующие медицинские и поведенческие состояния, такие как курение табака, алкоголизм, недоедание и сахарный диабет, могут значительно повлиять на ведение болезни и результаты (63).
Заключение
Коинфекция ВИЧ является важным фактором смертности от ТБ не только во многих странах, в основном в странах Африки к югу от Сахары, но также и в развитых странах, таких как США. Сегодня уход за больными ТБ и борьба с распространением ТБ затруднены. появлением МЛУ-ТБ.Глобализация и миграция из эндемичных зон продолжают оставаться основной силой в глобальном распространении этой коинфекции. ВИЧ-инфицированные пациенты с активным туберкулезом должны получать поддержку в лечении, включая консультирование по вопросам соблюдения режима лечения и DOT, в соответствии с их потребностями. В заключение, коинфекция MTB и ВИЧ остается диагностической и терапевтической проблемой во всем мире.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
2. Всемирная организация здравоохранения. Global Tuberculosis Report . Женева: Всемирная организация здравоохранения (2013).
Google Scholar
3. Montales MT, Beebe A, Chaudhury A., Patil N. Mycobacterium tuberculosis Инфекция у ВИЧ-инфицированного пациента. Respir Med Case Rep (2015) 16 : 160–2. DOI: 10.1016 / j.rmcr.2015.10.006
CrossRef Полный текст | Google Scholar
4.Эфсен А.М., Шульце А., Пост Ф., Пантелеев А., Фуррер Н., Миллер Р. и др. Основные проблемы в клиническом ведении пациентов с коинфекцией ТБ / ВИЧ в Восточной Европе по сравнению с Западной Европой и Латинской Америкой. J Int AIDS Soc (2014) 17 (4 Приложение 3): 19505. DOI: 10.7448 / IAS.17.4.19505
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Sester M, van Leth F, Bruchfeld J, Bumbacea D, Cirillo DM, Dilektasli AG и др.TBNET. Оценка риска туберкулеза у пациентов с ослабленным иммунитетом. Исследование TBNET. Am J Respir Crit Care Med (2014) 190 (10): 1168–76. DOI: 10.1164 / rccm.201405-0967OC
CrossRef Полный текст | Google Scholar
6. Hotez PJ. Здоровье из голубого мрамора и «три большие болезни»: ВИЧ / СПИД, туберкулез и малярия. Микробы заражают (2015) 17 (8): 539–41. DOI: 10.1016 / j.micinf.2015.05.004
CrossRef Полный текст | Google Scholar
7.Хаббаз РФ, Мозли Р.Р., Штайнер Р.Дж., Левитт А.М., Белл Б.П. Проблемы инфекционных заболеваний в США. Ланцет (2014) 384 (9937): 53–63. DOI: 10.1016 / S0140-6736 (14) 60890-4
CrossRef Полный текст | Google Scholar
8. Патил Н., Марко А., Саба Х, Самант Р., Мукаса Л. ТБ или нет; не упускайте очевидное. J Ark Med Soc (2014) 111 (6): 112–4.
Google Scholar
9.Берзкалнс А., Бейтс Дж., Йе В., Мукаса Л., Франс А.М., Патил Н. и др. Путь к ликвидации туберкулеза ( Mycobacterium tuberculosis ) в Арканзасе; повторное обследование групп риска. PLoS One (2014) 9 (3): e
. DOI: 10.1371 / journal.pone.00
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Корбетт Э.Л., Ватт С.Дж., Уокер Н., Махер Д., Уильямс Б.Г., Равильоне М.С. и др. Растущее бремя туберкулеза: глобальные тенденции и взаимодействие с эпидемией ВИЧ. Arch Intern Med (2003) 163 : 1009–21. DOI: 10.1001 / archinte.163.9.1009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Холмс Ч., Хауслер Х., Нанн П. Обзор половых различий в эпидемиологии туберкулеза. Int J Tuberc Lung Dis (1998) 2 (2): 96–104.
PubMed Аннотация | Google Scholar
12.Вентурини Э., Туркова А., Чиаппини Э., Галли Л., де Мартино М., Торн С. Коинфекция туберкулеза и ВИЧ у детей. BMC Infect Dis (2014) 14 (Дополнение 1): S5. DOI: 10.1186 / 1471-2334-14-S1-S5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ричелди Л., Лози М., Д’Амико Р., Луппи М., Феррари А., Муссини С. и др. Проведение тестов на латентный туберкулез в различных группах пациентов с ослабленным иммунитетом. Сундук (2009) 136 (1): 198–204. DOI: 10.1378 / сундук.08-2575
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Шанкар Е.М., Виньеш Р., Эллегард Р., Баратан М., Чонг Ю.К., Бадор М.К. и др. Сопутствующая инфекция ВИЧ- Mycobacterium tuberculosis : «модель опасной пары» патогенеза заболевания. Pathog Dis (2014) 70 (2): 110–8. DOI: 10.1111 / 2049-632X.12108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Гельдмахер К., Нгвеньяма Н., Шуэц А., Петровас С., Райтер К., Херегрейв Э. Дж. И др. Предпочтительное инфицирование и истощение Mycobacterium tuberculosis -специфических CD4 Т-клеток после заражения ВИЧ-1. J Exp Med (2010) 207 (13): 2869–81. DOI: 10.1084 / jem.20100090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Купер А. Клеточные иммунные ответы при туберкулезе. Анну Рев Иммунол (2009) 27 : 393–422.DOI: 10.1146 / annurev.immunol.021908.132703
CrossRef Полный текст | Google Scholar
21. Дидрих К., Флинн Дж. ВИЧ-1/ Mycobacterium tuberculosis Иммунология коинфекций: как ВИЧ-1 обостряет туберкулез? Infect Immun (2011) 79 (4): 1407–17. DOI: 10.1128 / IAI.01126-10
CrossRef Полный текст | Google Scholar
22. Djoba Siawaya JF, Ruhwald M, Eugen-Olsen J, Walzl G.Коррелирует с прогрессированием заболевания и прогнозом при сопутствующей инфекции ВИЧ / ТБ. Int J Infect Dis (2007) 11 (4): 289–99. DOI: 10.1016 / j.ijid.2007.02.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Волдей Д., Хайлу Б., Гирма М., Хайлу Е., Сандерс Е., Фонтанет А.Л. Низкое количество CD4 + Т-клеток и высокая вирусная нагрузка ВИЧ предшествуют развитию туберкулеза в когорте ВИЧ-положительных эфиопов. Ethiop Med J (2003) 41 (Дополнение 1): 67–73.
Google Scholar
24. Каплан Дж. Э., Хэнсон Д. Л., Джонс Дж. Л., Дворкин М. С.; Спектр исследователей проекта по ВИЧ-инфекции среди взрослых и подростков. Вирусная нагрузка как независимый фактор риска оппортунистических инфекций у ВИЧ-инфицированных взрослых и подростков. AIDS (2001) 15 (14): 1831–6. DOI: 10.1097 / 00002030-200109280-00012
CrossRef Полный текст | Google Scholar
25.Суинделлс С., Эванс С., Закин Р., Голдман М., Хаубрих Р., Филлер С.Г. и др. Прогностическое значение вирусной нагрузки ВИЧ-1 для риска оппортунистической инфекции. J Acquir Immune Defic Syndr (2002) 30 (2): 154–8. DOI: 10.1097 / 00042560-200206010-00003
CrossRef Полный текст | Google Scholar
27. Whalen C, Horsburgh CR, Hom D, Lahart C, Simberkoff M, Ellner J. Ускоренное течение инфекции вируса иммунодефицита человека после туберкулеза. Am J Respir Crit Care Med (1995) 151 (1): 129–35. DOI: 10.1164 / ajrccm.151.1.7812542
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Голетти Д., Вайсман Д., Джексон Р. В., Грэм Н. М., Влахов Д., Кляйн Р. С. и др. Влияние Mycobacterium tuberculosis на репликацию ВИЧ. Роль иммунной активации. J Immunol (1996) 157 (3): 1271–8.
PubMed Аннотация | Google Scholar
29.Nakata K, Rom WN, Honda Y, Condos R, Kanegasaki S, Cao Y и др. Mycobacterium tuberculosis усиливает репликацию вируса иммунодефицита человека-1 в легких. Am J Respir Crit Care Med (1997) 155 (3): 996–1003. DOI: 10.1164 / ajrccm.155.3.38
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Toossi Z, Johnson JL, Kanost RA, Wu M, Luzze H, Peters P, et al. Повышенная репликация ВИЧ1 в сайтах инфекции Mycobacterium tuberculosis : потенциальные механизмы активации вируса. J Acquir Immune Defic Syndr (2001) 28 (1): 1–8. DOI: 10.1097 / 00042560-200109010-00001
CrossRef Полный текст | Google Scholar
32. Кришнан Н., Робертсон Б.Д., Туэйтс Г. Механизмы и последствия внелегочного распространения Mycobacterium tuberculosis . Туберкулез (Edinb) (2010) 90 (6): 361–6. DOI: 10.1016 / j.tube.2010.08.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.de Noronha AL, Báfica A, Nogueira L, Barral A, Barral-Netto M. Гранулемы легких от Mycobacterium tuberculosis / ВИЧ-1 пациентов с коинфекцией демонстрируют снижение продукции TNF in situ. Патол Рес Прак (2008) 204 : 155. DOI: 10.1016 / j.prp.2007.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Гарред П., Рихтер С., Андерсен А.Б., Мадсен Х.О., Мтони И., Свейгаард А. и др. Маннан-связывающий лектин в эпидемиях ВИЧ и туберкулеза к югу от Сахары. Scand J Immunol (1997) 46 (2): 204–8. DOI: 10.1046 / j.1365-3083.1997.d01-111.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Чжан М., Гонг Дж., Айер Д.В., Джонс Б.Э., Модлин Р.Л., Барнс П.Ф. Т-клеточные цитокиновые ответы у людей с туберкулезом и инфекцией вируса иммунодефицита человека. J Clin Invest (1994) 94 : 2435–42. DOI: 10.1172 / JCI117611
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36.Беррингтон WR, Хоун TR. Mycobacterium tuberculosis , макрофаги и врожденный иммунный ответ: имеет ли значение общие различия? Immunol Rev (2007) 219 : 167–86. DOI: 10.1111 / j.1600-065X.2007.00545.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Чоу С.Х., Прабху С.Дж., Кротерс К., Стерн Э.Д., Годвин Д.Д., Пипаватх С.Н. Заболевания грудной клетки, связанные с ВИЧ-инфекцией в эпоху антиретровирусной терапии: клинические и визуальные данные. Радиография (2014) 34 (4): 895–911. DOI: 10.1148 / rg.344130115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Getahun H, Matteelli A, Chaisson RE, Raviglione M. Скрытая инфекция Mycobacterium tuberculosis . N Engl J Med (2015) 372 (22): 2127–35. DOI: 10.1056 / NEJMra1405427
CrossRef Полный текст | Google Scholar
41.Кауль К. Молекулярное обнаружение Mycobacterium tuberculosis: влияние на лечение пациентов. Clin Chem (2001) 47 (8): 1553–8.
PubMed Аннотация | Google Scholar
42. Патил Н., Саба Х., Марко А., Самант Р., Мукаса Л. Первоначальный опыт использования анализа GeneXpertMTB / RIF в программе борьбы с туберкулезом в Арканзасе. Aust Med J (2014) 7 (5): 203–7. DOI: 10.4066 / AMJ.2014.1905
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Патил Н., Монталес М.Т., Миттадодла П., Мукаса Л.Н., Бхаскар Н., Бейтс Дж. Х. и др. Реинфекция туберкулеза у беременной с муковисцидозом. Respir Med Case Rep (2015) 16 : 57–9. DOI: 10.1016 / j.rmcr.2015.04.002
CrossRef Полный текст | Google Scholar
44. Патил Н., Марко А., Монталес М. Т., Бхаскар Н., Миттадодла П., Мукаса Л. Н.. Туберкулез легких у больного муковисцидозом. North Am J Med Sci (2015) 7 : 233–5.DOI: 10.4103 / 1947-2714.157494
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Дин А.С., Зигнол М., Фальзон Д., Гетахун Х., Флойд К. ВИЧ и туберкулез с множественной лекарственной устойчивостью: перекрывающиеся эпидемии. Eur Respir J (2014) 44 (1): 251–4. DOI: 10.1183 / 036.00205413
CrossRef Полный текст | Google Scholar
46. Курран А., Фалько В., Пахисса А., Рибера Э.Ведение туберкулеза у ВИЧ-инфицированных. AIDS Rev (2012) 14 (4): 231–46.
PubMed Аннотация | Google Scholar
47. Найду А., Найду К., Йенде-Зума Н., Генгия Т. Н., Падаятчи Н., Грей А. Л. и др. Изменения в схемах приема антиретровирусных препаратов при интегрированном лечении ТБ-ВИЧ: результаты исследования SAPiT. Антивир Тер (2014) 19 (2): 161–9. DOI: 10.3851 / IMP2701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Боранд Л., Фенг П., Саман М., Ленг С., Чеа П., Саради Эй С. и др. [Сочетанная инфекция туберкулеза и ВИЧ: клиническое испытание под координацией Института Пастера в Камбодже]. Med Sci (Париж) (2013) 29 (10): 908–11. DOI: 10.1051 / medsci / 201320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Crump JA, Wu X, Kendall MA, Ive PD, Kumwenda JJ, Grinsztejn B, et al. Предикторы и исходы бактериемии Mycobacterium tuberculosis среди пациентов с ВИЧ и коинфекцией туберкулеза, включенных в исследование ACTG A5221 STRIDE. BMC Infect Dis (2015) 15 (1): 12. DOI: 10.1186 / s12879-014-0735-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Гавлир Д.В., Карриер Дж.С. CROI 2015: осложнения ВИЧ-инфекции и антиретровирусной терапии. Топ Антивир Мед (2015) 23 (1): 56–65.
PubMed Аннотация | Google Scholar
51. Биби А., Сиворт Б., Патил Н.Нефротоксичность, вызванная рифампицином, у больного туберкулезом. J Clin Tuberc Другой Mycobact Dis (2015) 1 : 13–5. DOI: 10.1016 / j.jctube.2015.09.001
CrossRef Полный текст | Google Scholar
52. Исследовательская группа TEMPRANO ANRS 12136; Данел С., Мох Р., Габиллард Д., Бадье А., Ле Карру Дж. И др. Испытание ранних антиретровирусных препаратов и профилактической терапии изониазидом в Африке. N Engl J Med (2015) 373 (9): 808–22.DOI: 10.1056 / NEJMoa1507198
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Исследовательская группа INSIGHT START; Лундгрен Дж. Д., Бабикер А. Г., Гордин Ф., Эмери С., Грунд Б. и др. Начало антиретровирусной терапии при ранней бессимптомной ВИЧ-инфекции. N Engl J Med (2015) 373 (9): 795–807. DOI: 10.1056 / NEJMoa1506816
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54.Абдул Карим СС. Преодоление препятствий на пути глобального внедрения ранней антиретровирусной терапии. N Engl J Med (2015) 373 (9): 875–6. DOI: 10.1056 / NEJMe1508527
CrossRef Полный текст | Google Scholar
55. van Lettow M, Bedell R, Mayuni I., Mateyu G, Landes M, Chan AK, et al. На пути к искоренению передачи ВИЧ от матери ребенку: применение различных моделей оказания помощи для начала пожизненной антиретровирусной терапии для беременных женщин в Малави (Вариант B +). J Int AIDS Soc (2014) 17 : 18994. DOI: 10.7448 / IAS.17.1.18994
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Ayele HT, Mourik MS, Debray TP, Bonten MJ. Профилактическая терапия изониазидом для профилактики туберкулеза у ВИЧ-инфицированных взрослых: систематический обзор и метаанализ рандомизированных исследований. PLoS One (2015) 10 (11): e0142290. DOI: 10.1371 / journal.pone.0142290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57.Барбер Д.Л., Андраде Б.Б., Серети И., Шер А. Воспалительный синдром восстановления иммунитета: проблемы с иммунитетом, когда его не было. Nat Rev Microbiol (2012) 10 (2): 150–6. DOI: 10.1038 / nrmicro2712
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Эль-Садр WM, Tsiouris SJ. ВИЧ-ассоциированный туберкулез: проблемы диагностики и лечения. Semin Respir Crit Care Med (2008) 29 (5): 525–31.DOI: 10.1055 / с-0028-1085703
CrossRef Полный текст | Google Scholar
59. Regazzi M, Carvalho AC, Villani P, Matteelli A. Оптимизация лечения пациентов, коинфицированных ВИЧ и Mycobacterium tuberculosis : акцент на лекарственные взаимодействия с рифамицинами. Clin Pharmacokinet (2014) 53 (6): 489–507. DOI: 10.1007 / s40262-014-0144-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60.Абдул Карим С.С., Найду К., Гроблер А., Падаятчи Н., Бакстер С., Грей А.Л. и др. Интеграция антиретровирусной терапии с лечением туберкулеза. N Engl J Med (2011) 365 (16): 1492–501. DOI: 10.1056 / NEJMoa1014181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Гетахун Х., Баддели А., Равильоне М. Управление туберкулезом у людей, употребляющих и употребляющих запрещенные наркотики. Bull World Health Organ (2013) 91 (2): 154–6.DOI: 10.2471 / BLT.13.117267
CrossRef Полный текст | Google Scholar
63. Бейтс М., Марэ Б.Дж., Зумла А. Коморбидность туберкулеза с инфекционными и неинфекционными заболеваниями. Cold Spring Harb Perspect Med (2015) 5 (11): a017889. DOI: 10.
