Вирус гриппа: подробности личной жизни
: 10 Дек 2009 , Вирус гриппа: подробности личной жизни , том 29, №5
Возможность наблюдать и изучать множество самых разных микроорганизмов появилась благодаря изобретению микроскопа: это революционное событие неизмеримо расширило границы мира живых существ. Развитие технического прогресса и появление электронной микроскопии сделало доступным наблюдение и изучение «интимных» подробностей жизни самых мелких и поразительных организмов – вирусов. Наш сегодняшний «герой» – вирус гриппа, ежегодно убивающий на Земле до полумиллиона человек. Оказывается, его поразительная устойчивость к различным терапевтическим воздействиям связана с тем, что основные фазы цикла воспроизводства этого вируса проходят в самом защищенном месте зараженной клетки – ее ядре
Электронная микроскопия является единственным методом прямой визуализации
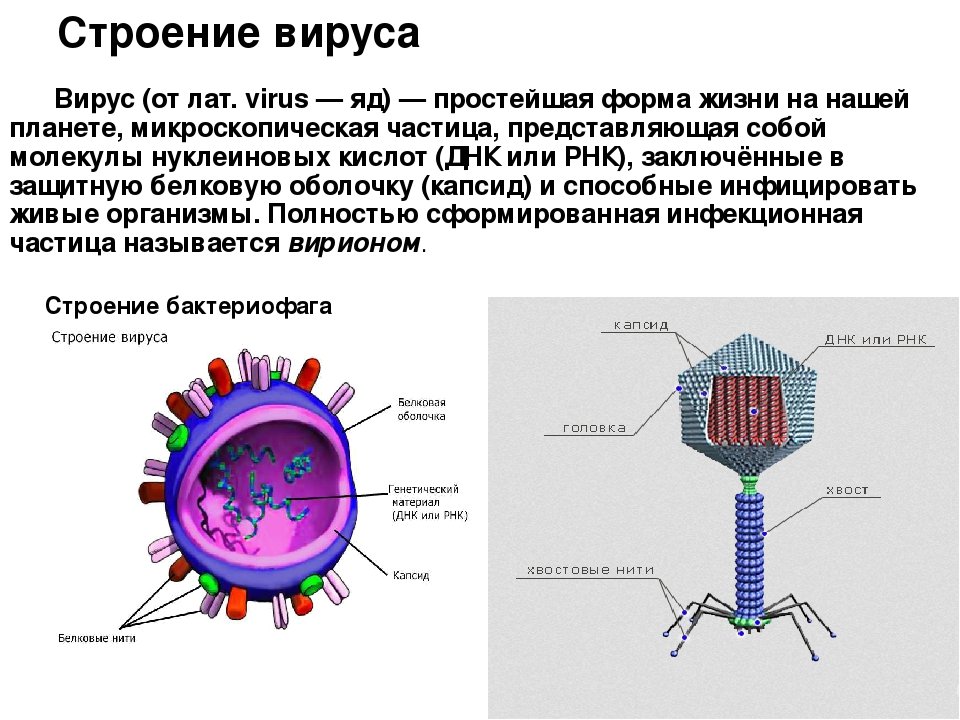
 Очевидно, что столь малые размеры жестко ограничивают набор структурных компонентов организма: вирусы, по сути, представляют собой наследственный материал (ДНК или РНК), упакованный в белковый «чехол» разной степени сложности. Такая частица (вирион) в воде, воздухе или на поверхности предметов ведет себя как неживое образование, поэтому споры о том, являются ли вирусы «живыми», до сих пор не утихают.
Очевидно, что столь малые размеры жестко ограничивают набор структурных компонентов организма: вирусы, по сути, представляют собой наследственный материал (ДНК или РНК), упакованный в белковый «чехол» разной степени сложности. Такая частица (вирион) в воде, воздухе или на поверхности предметов ведет себя как неживое образование, поэтому споры о том, являются ли вирусы «живыми», до сих пор не утихают.Как только вирион встречается с подходящей клеткой, включается сложнейшая программа воспроизводства вируса, программа паразитизма на генетическом уровне. Проникнув в клетку, вирус «переключает» работу ее макромолекулярных систем на синтез вирусных молекул. Вирус эксплуатирует все без исключения клеточные структуры, которые обеспечивают не только синтез вирусных белков и нуклеиновых кислот, но и формирование вирусного потомства. Зараженная клетка помимо воспроизводства обеспечивает паразиту еще и надежную защиту.
Единственной возможностью остановить развитие инфекции в организме является уничтожение зараженных клеток, с чем может справиться сам организм, и что является чрезвычайно сложной задачей для разработчиков противовирусных препаратов.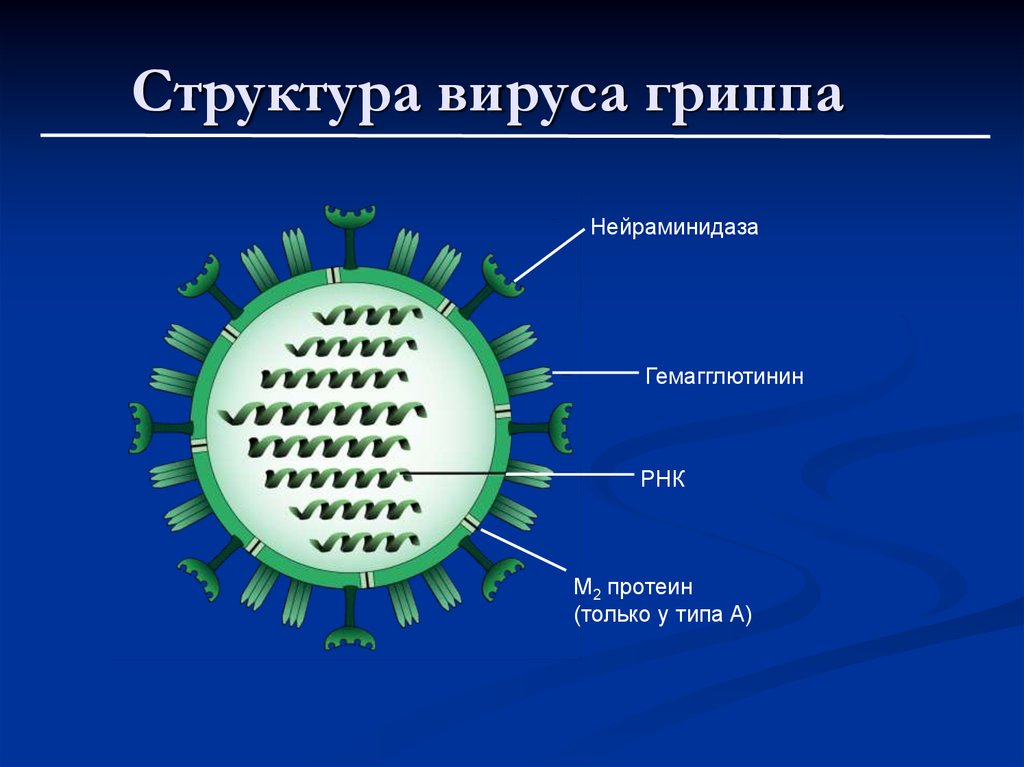
Вирус гриппа, как и многие другие вирусы, проникает в клетку различными способами, механизмы которых до конца не изучены. И все же с помощью электронной микроскопии мы можем «воочию» увидеть многие «интимные» подробности жизни вируса в зараженной клетке.
«Анфас и в профиль»
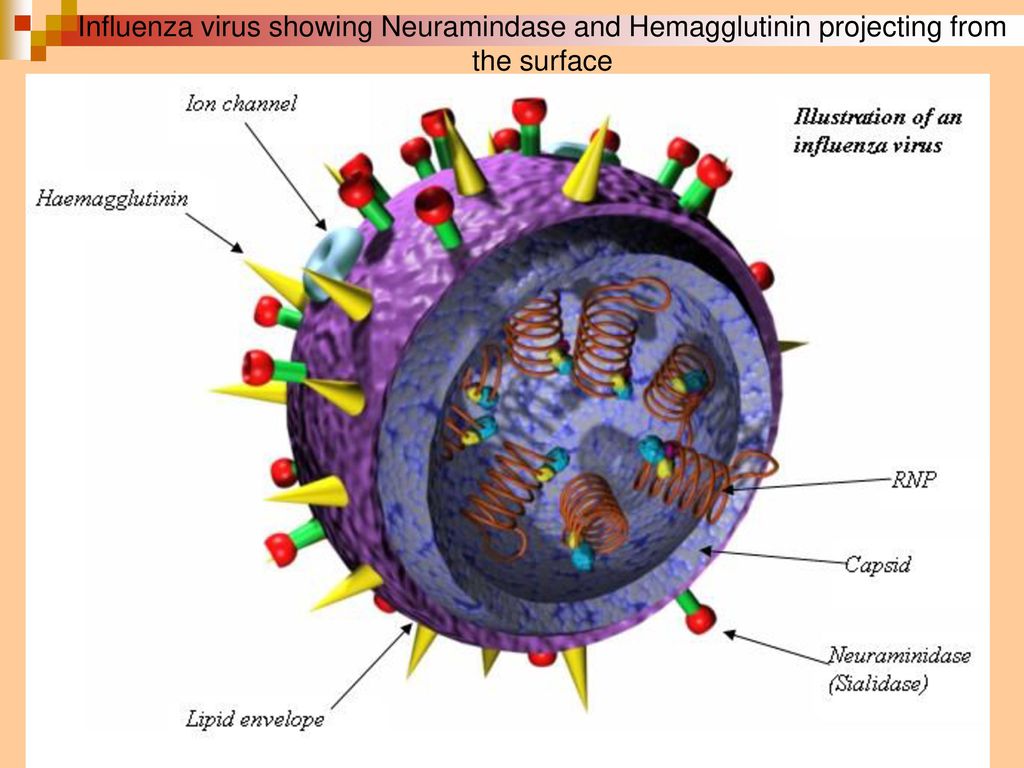
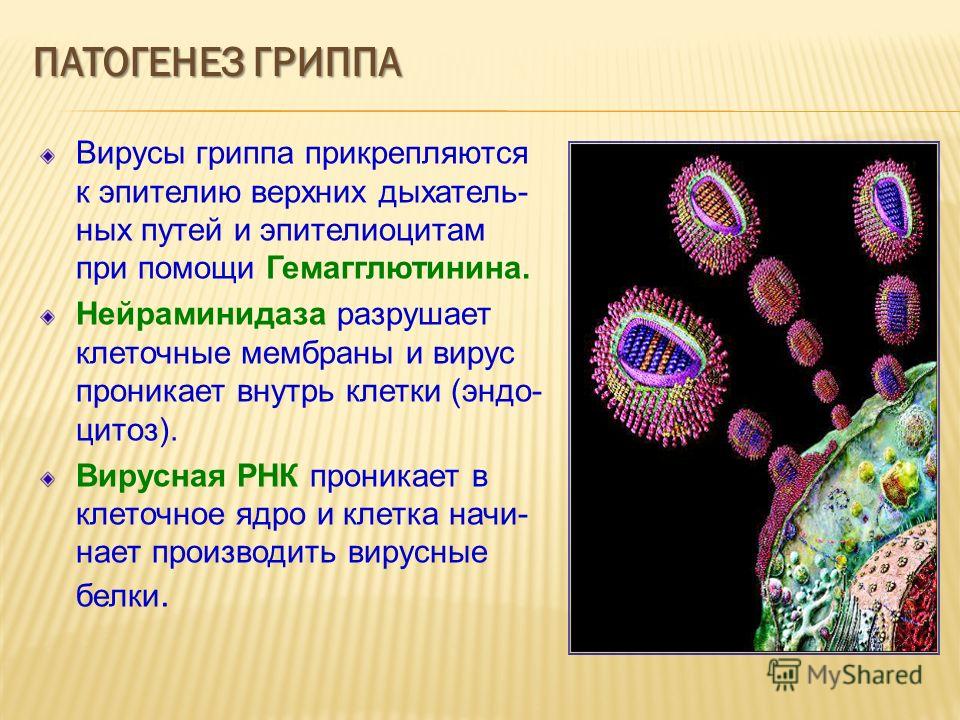
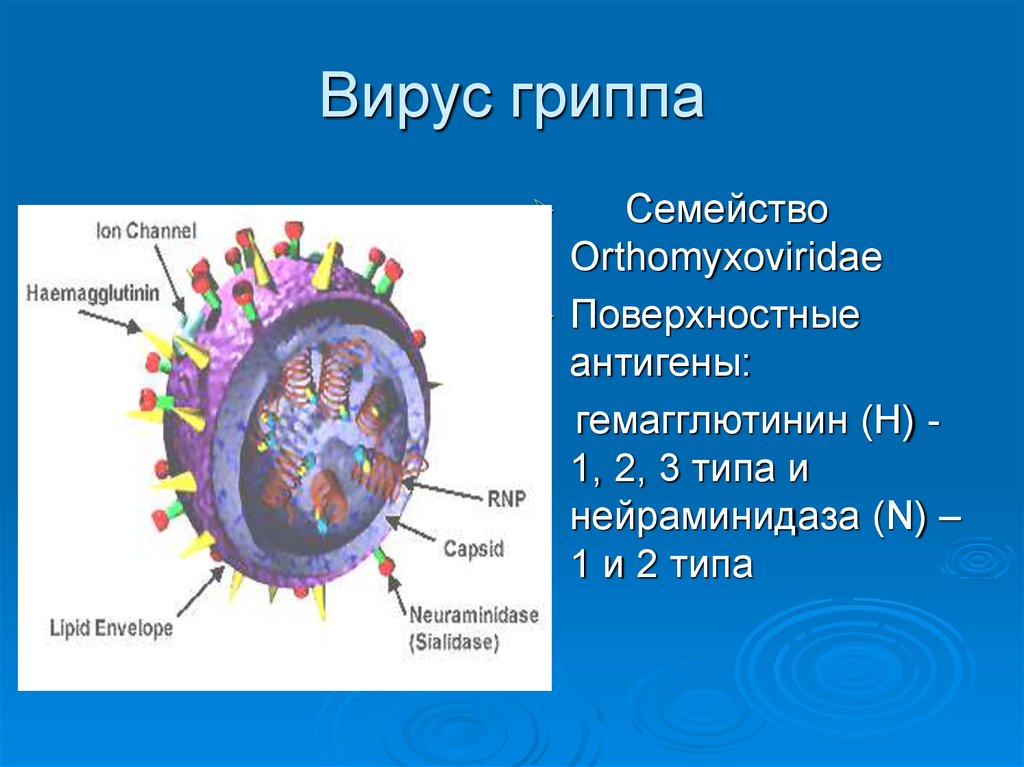
Внешне вирус гриппа выглядит как пузырек или вытянутая палочка. Под мембранной оболочкой скрывается необычный РНК-геном, состоящий из восьми отдельных частей. Поверхность щетинится шипиками, представляющими собой наружные части встроенных в мембрану белков – гемагглютинина и нейраминидазы.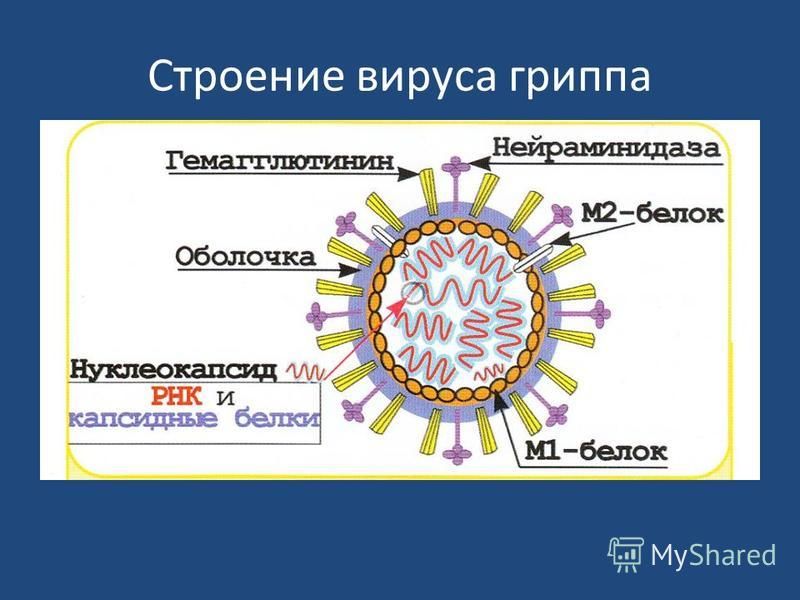 Именно молекулы этих двух гликопротеинов ответственны за связывание вирусной частицы с рецепторами клетки-хозяина.
Именно молекулы этих двух гликопротеинов ответственны за связывание вирусной частицы с рецепторами клетки-хозяина.
В соответствии с «классическими» представлениями, верхняя часть молекулы вирусного гемагглютинина связывается с гликопротеинами и гликолипидами плазматической мембраны клетки, а именно – с остатками сиаловых кислот, находящихся обычно на концах боковых цепей этих молекул.
Интересно, что вирусы гриппа человека присоединяются к сиаловым кислотам, содержащим альфа-2,6-галактозную связь, тогда как вирусы гриппа птиц – к кислотам с альфа-2,3-галактозной связью (высокая специфичность связывания обусловлена наличием в определенном месте молекулы вирусного гемагглютинина аминокислот лейцина или глутамина). В клетках трахеи свиньи присутствуют сиаловые кислоты обоих типов, поэтому свиньи могут быть инфицированы как вирусами гриппа птиц, так и человека. Этот факт служит основанием считать свинью своего рода «сосудом Пандоры», где образуются новые, опасные для человека разновидности вируса гриппа.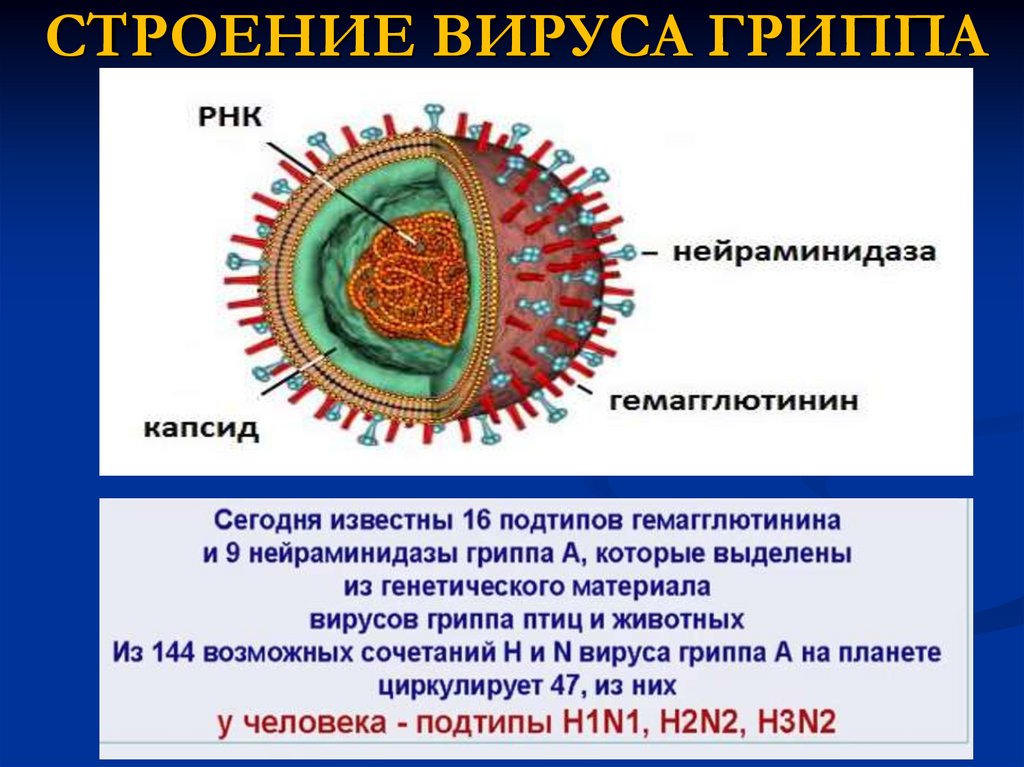
Опасные связи
Итак, первый шаг сделан: вирус связался с клеточными рецепторами. В месте связывания образуется углубление плазматической мембраны, края которого затем смыкаются, и вирус оказывается в полости так называемого эндоцитозного пузырька. Вообще эндоцитоз является процессом, обычным для клеток высших организмов, которые с помощью этого механизма поглощают крупные молекулы. Вирус, таким образом, эксплуатирует транспортную систему клетки, причем делает это «на законных основаниях»: «билетом» служит сам факт связывания с клеточными рецепторами.
Первым сортировочным узлом эндоцитозного транспортного потока является эндосома – мембранный пузырь с выростами и мелкими пузырьками внутри. Несмотря на свою видимую простоту, эндосома осуществляет в клетке сложные логистические функции: она «опознает» и сортирует попавшие в нее макромолекулы, направляя их по тому или иному метаболическому пути. Однако вирусу это совершенно не нужно – он сам «знает», что делать дальше.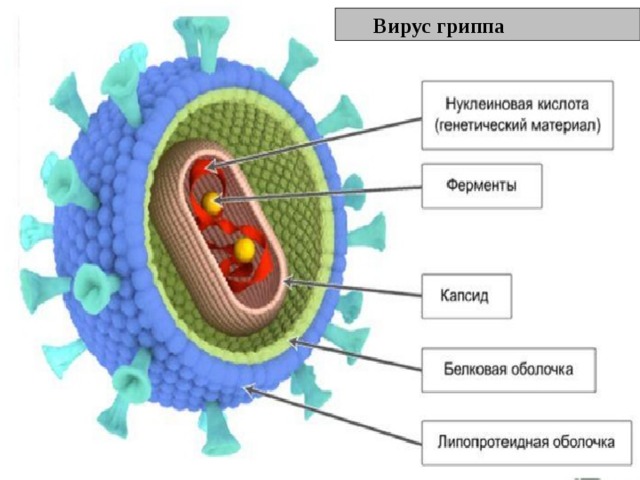 Пользуясь тем, что внутри эндосомы среда кислая, вирусная оболочка плотно «прижимается» к мембране эндосомы и сливается с ней. В результате вирусная РНК попадает в цитоплазму – всего через полчаса после того, как вирус связался с поверхностью клетки. Кстати, препараты группы ремантадина воздействуют именно на стадию «раздевания» вируса гриппа, блокируя слияние вирусной оболочки с мембраной эндосом.
Пользуясь тем, что внутри эндосомы среда кислая, вирусная оболочка плотно «прижимается» к мембране эндосомы и сливается с ней. В результате вирусная РНК попадает в цитоплазму – всего через полчаса после того, как вирус связался с поверхностью клетки. Кстати, препараты группы ремантадина воздействуют именно на стадию «раздевания» вируса гриппа, блокируя слияние вирусной оболочки с мембраной эндосом.
Добавим, что на стадии проникновения в клетку вирус гриппа использует еще и разные пути эндоцитоза, что повышает воздействие инфекции и позволяет с большей вероятностью избежать атаки иммунной системой.
Под надежной «крышей»
Вирусный геном проник в цитоплазму, теперь ему предстоит путь к месту его репликации (размножения) – прямиком в ядро клетки. Репликация в клеточном ядре – редкое явление среди вирусов с РНК-геномом. И хотя ядро – самое защищенное место в клетке, и каким-то образом вирус гриппа научился использовать самую надежную «крышу».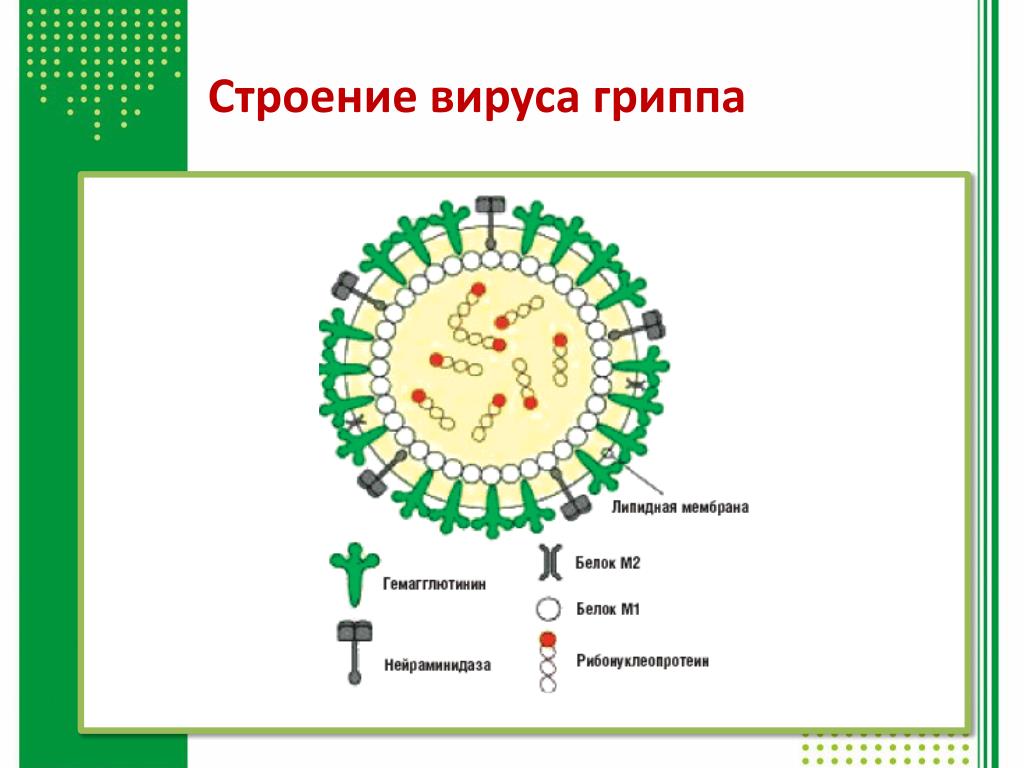
Попасть туда непросто: клеточное ядро надежно изолировано от окружающей цитоплазмы, и все транспортируемые молекулы проходят строгую «проверку документов» у входа в ядерные поры. В качестве «пропуска» вирусу служит закодированная в его геноме особая сигнальная последовательность нуклеотидов, идентичная клеточной.
И вот РНК вируса уже в ядре, под надежной защитой. Здесь следует отметить еще одну интересную особенность нашего «героя»: его РНК имеет так называемую негативную полярность и не способна сама по себе служить матрицей для синтеза дочерней вирусной РНК (будущего вирусного генома) и мРНК (матрицы для синтеза вирусных белков).
Поэтому в ядре зараженной клетки на матрице вирусной (–)РНК сначала образуются две формы с положительной полярностью (+)РНК. Первая – комплементарная вирусная (+)РНК, которая впоследствии служит шаблонном для синтеза дочерней (–)РНК. Вторая – информационная вирусная (+)РНК, которая после сложной цепи превращений с участием клеточных ферментов транспортируется в цитоплазму клетки для будущего синтеза вирусных белков.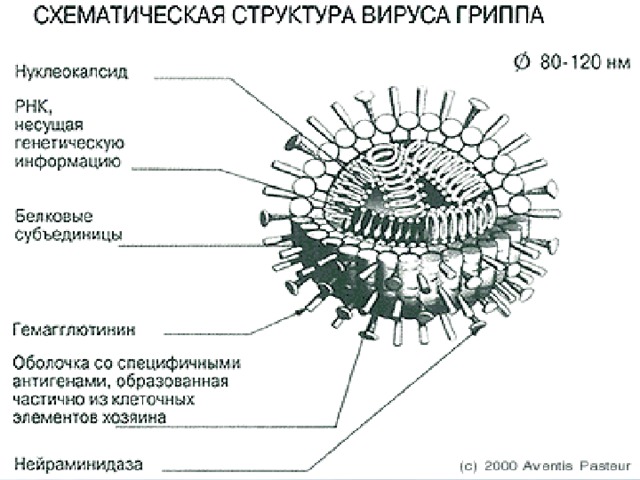 Разумеется, все эти перемещения также обеспечиваются транспортными системами клетки.
Разумеется, все эти перемещения также обеспечиваются транспортными системами клетки.
Вот теперь все основные детали для конвейера по производству миллионов вирусных клонов готовы.
Клеточная фабрика
В соответствии с законами клетки синтез мембранных белков будущих вирусов происходит на цепочках рибосом (клеточных белковых «фабрик»), закрепленных на шероховатой эндоплазматической сети – транспортной внутриклеточной системе, состоящей из полостей и канальцев. Вирусные белковые заготовки затем переносятся еще в одну клеточную органеллу – аппарат Гольджи – где они, как и собственные белки клетки, подвергаются гликозилированию – присоединению определенных углеводных остатков.
Готовые молекулы мембранных вирусных белков гемагглютинина и нейраминидазы объединяются и в таком виде транспортируются к внешней границе клетки специальными транспортными пузырьками, которые обеспечивают включение вирусных молекул в особые участки плазматической мембраны – липидные рафты (кавеолы).
Остальные вирусные белки, предназначенные для формирования комплексов с наследственным материалом будущего вирусного потомства (–)РНК, синтезируются на свободных полирибосомах клетки, как и положено всем немембранным белкам. Нужно сказать, что в этом смысле вирус гриппа даже «терпит» некоторые неудобства – ведь белки накапливаются в цитоплазме, а сама (–)РНК – в ядре. Поэтому вирусные белки вновь прибегают к помощи клеточной транспортной системы и проникают в ядро, где объединяются с вирусной (–)РНК, формируя рибонуклеопротеиновые частицы (РНП). Последние можно увидеть с помощью электронного микроскопа: РНП представляют собой палочки с «петельками» на концах.
Таким образом, в ядре зараженной клетки образовалось множество копий вирусного генома; на мембране клетки «заготовлены» будущие шипики вирусных мембранных белков – осталось собрать вместе эти детали нашего конструктора. Следующий шаг – экспорт частиц РНП из ядра в цитоплазму и далее, к плазматической мембране клетки (механизмы этого процесса еще не изучены до конца).
На сборочном конвейере
Наступает финальный этап вирусной репродукции – формирование новых вирионов. Для того чтобы это произошло, необходимо, чтобы вирусный геном – все восемь частиц РНП, а также остальные вирусные белки, встретились в строго определенном месте.
Место встречи уже «назначено» – это липидные рафты, участки мембраны, в которые включены молекулы гемагглютинина и нейраминидазы, и которые послужат для вируса платформами для сборки и почкования. Удивительно, как частицы РНП «находят» дорогу к месту почкования будущего вируса: в последние годы появляется все больше доказательств наличия у каждого сегмента вирусного генома специфичных «упаковочных сигналов».
Итак, частицы РНП – главный компонент новых вирионов – доставлены к плазматической мембране и готовы к упаковке. Благодаря действию комплекса факторов плазматическая мембрана в участке сборки вирусной частицы искривляется – начинается почкование вириона. На поверхности клетки появляются выпячивания, которые затем отделяются от клетки, и вот уже «свежеиспеченные» вирусные частицы выходят в межклеточное пространство. Чтобы они не связались вновь с «родительской» клеткой, предусмотрен специальный механизм – нейраминидаза нового вируса как метелкой отщепляет рецепторы с поверхности клетки. Действие препаратов
На поверхности клетки появляются выпячивания, которые затем отделяются от клетки, и вот уже «свежеиспеченные» вирусные частицы выходят в межклеточное пространство. Чтобы они не связались вновь с «родительской» клеткой, предусмотрен специальный механизм – нейраминидаза нового вируса как метелкой отщепляет рецепторы с поверхности клетки. Действие препаратов
Каждая зараженная клетка вырабатывает огромное число вирусных частиц, причем далеко не все из них жизнеспособны – на «сборочном конвейере» всегда возникают перебои, а производство «комплектующих» не сбалансировано. Да и сама клетка не всегда в состоянии обеспечить работу своих синтетических и транспортных систем на должном уровне. Именно поэтому вирус гриппа, как и все другие вирусы, наиболее эффективно размножается в «здоровых» клетках, что хорошо известно вирусологам, работающим с клеточными культурами.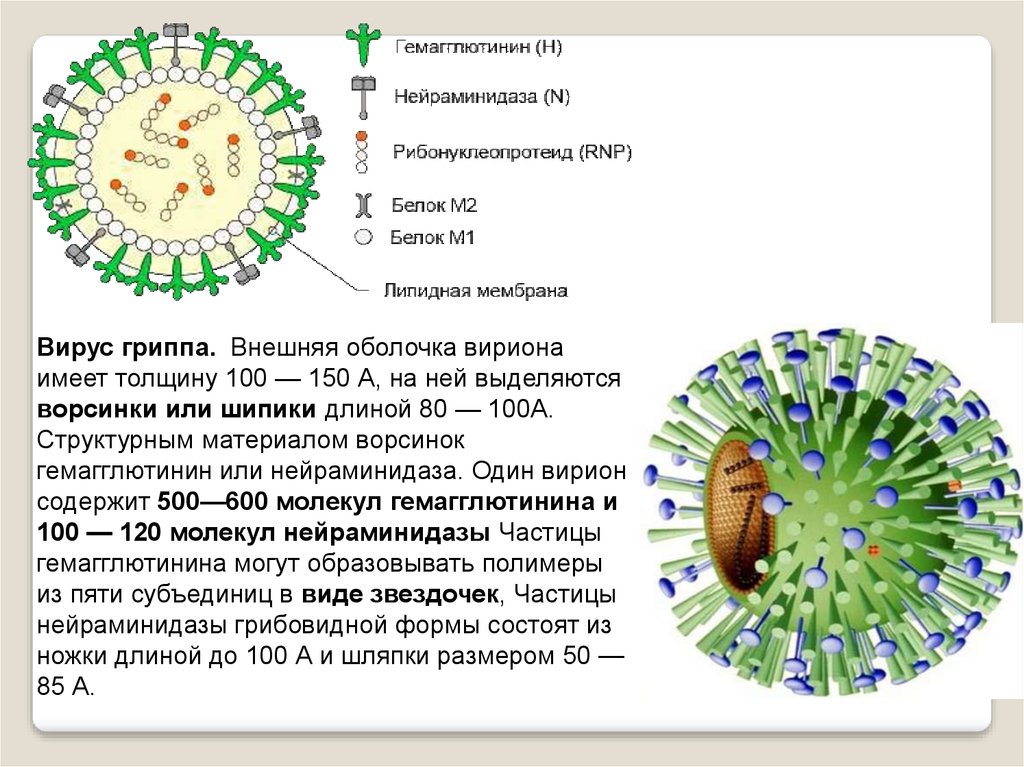
В организме вирусное потомство оказывается в слое слизи, покрывающей внутреннюю поверхность носоглотки, и человек, чихая и кашляя, распространяет вирус с капельками слизи. Клетки, естественно, пытаются защититься от агрессора, включая механизмы интерференции и апоптоза, однако эта защита, как правило, запаздывает, и паразит успевает размножиться и заразить новые клетки. Поэтому так важно применять препараты интерферона в первые сутки (а лучше – в первые часы заболевания), чтобы предотвратить массовое заражение клеток и остановить развитие заболевания.
Нужна ли вакцинация против гриппа?
Вирус гриппа имеет «особые отношения» с иммунной системой человека, отраженные в так называемом «феномене первичного антигенного греха» (парадокс Бёркита), открытого более 50 лет назад (Francis et al., 1953) и вновь подтвержденного в последние годы. Это явление аналогично «импритингу», известному из этологии (науки о поведении животных) – образованию чрезвычайно устойчивых следов в психике после однократного переживания (например, запечатлевание образа матери у детенышей).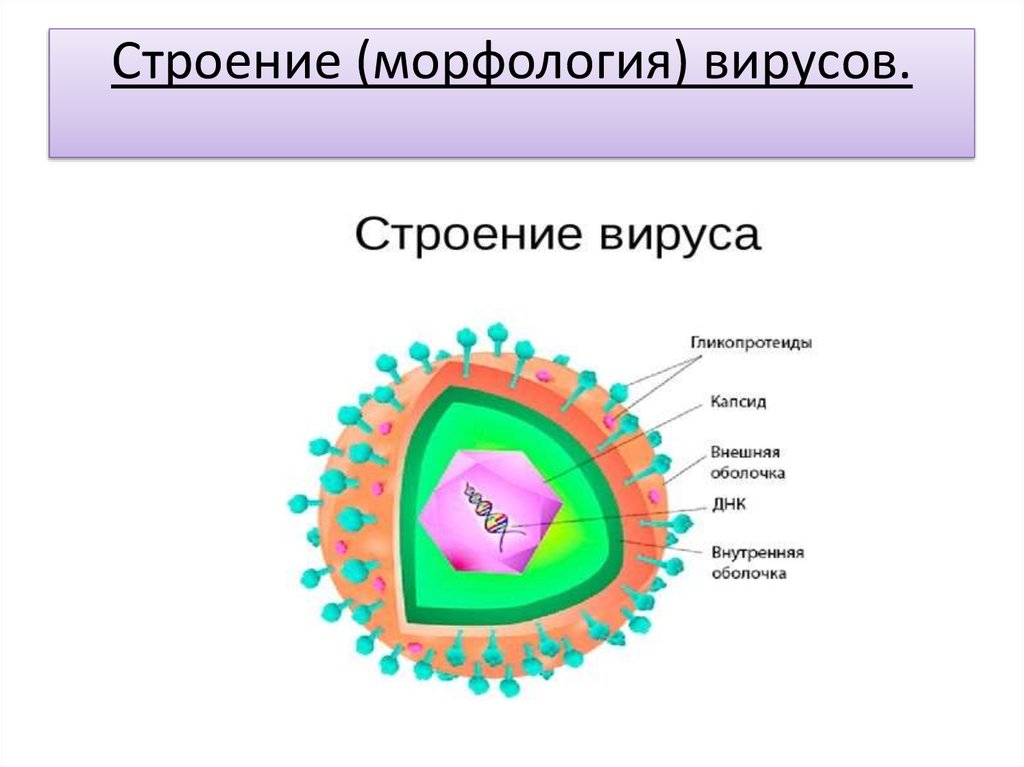
Дело в том, что при заражении любым вариантом вируса гриппа (или при введении вакцины) наша иммунная система всегда будет вырабатывать защитные антитела не конкретно к этому вирусу, а к тому, который встретился ей когда-то впервые. И если вновь встреченный вирус не будет тождествен «запечатленному», эти антитела не только не защитят организм от инфекции, но могут резко осложнить ее течение. Это ставит принципиальный вопрос о целесообразности вакцинации против гриппа
Познакомившись со сложным взаимодействием вируса гриппа с отдельной клеткой, поражаешься той виртуозности, с которой этот паразит эксплуатирует клеточные системы.
Если же перейти на уровень организма, то здесь взаимодействие вируса с хозяином определяется множеством дополнительных факторов, которые могут привести, а могут и не привести к заболеванию. Главный из этих факторов – реакция иммунной системы, и споры о том, надо ли стимулировать эту реакцию вакцинацией, не только не утихают, но становятся со временем все более острыми.
Сегодня о вирусе гриппа и его биологических свойствах известно много, однако грипп до сих пор остается болезнью, которая «проходит за неделю при лечении, и за 7 дней – без него». Такая устойчивость этого заболевания, очевидно, обусловлена почти полной невозможностью терапевтически «вмешаться» в цикл воспроизводства вируса гриппа, столь надежно укрытого в самом «сердце» зараженной клетки.
Литература
Compans R.W., Dimmock N.J. An electron microscopic study of single-cycle infection of chick embryo fibroblasts by influenza virus// Virology. 1969. V. 39. P. 499—515.
Harris A., Cardone G., Winkler D.C. et al. Influenza virus pleiomorphy characterized by cryoelectron tomography //PNAS. 2006. V. 103. P. 19123—19127.
Kim J.H., Skountzou I, Compans R, Jacob J. Original antigenic sin responses to influenza viruses// J. Immunol. 2009. V. 183. P. 294—301.
Leser G. P., Lamb R.A. Influenza virus assembly and budding in raft-derived microdomains: a quantitative analysis of the surface distribution of HA, NA and M2 proteins// Virology. 2005. V. 342. P. 215—227.
P., Lamb R.A. Influenza virus assembly and budding in raft-derived microdomains: a quantitative analysis of the surface distribution of HA, NA and M2 proteins// Virology. 2005. V. 342. P. 215—227.
Matrosovich M., Matrosovich T., Uhlendorff J. et al. Avian-virus-like receptor specificity of the hemagglutinin impedes influenza virus replication in cultures of human airway epithelium// Virology. 2007. V. 361. P. 384—390.
Morris S.J., Nightingalea K., Smithb H. et al. Influenza A virus-induced apoptosis is a multifactorial process: Exploiting reverse genetics to elucidate the role of influenza A virus proteins in virus-induced apoptosis// Virology. 2005. V. 335. P. 198—211.
Noda T., Sagara H., Yen A. et al. Architecture of ribonucleoprotein complexes in influenza A virus particles// Nature. 2006. V. 439. P. 490—492.
В публикации использованы фотографии автора.
Автор выражает благодарность Ю. Спицыной и О. Таранову (ИХБФМ СО РАН) за помощь в обработке фотографий
: 10 Дек 2009 , Вирус гриппа: подробности личной жизни , том 29, №5
Грипп
Грипп- Вопросы здравоохранения »
- A
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Щ
- Ъ
- Ы
- Ь
- Э
- Ю
- Я
- Популярные темы
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- Данные и статистика »
- Информационный бюллетень
- Факты наглядно
- Публикации
- Найти страну »
- А
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- Й
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Щ
- Ъ
- Ы
- Ь
- Э
- Ю
- Я
- ВОЗ в странах »
- Репортажи
- Регионы »
- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- Центр СМИ
- Пресс-релизы
- Заявления
- Сообщения для медиа
- Комментарии
- Репортажи
- Онлайновые вопросы и ответы
- События
- Фоторепортажи
- Вопросы и ответы
- Последние сведения
- Чрезвычайные ситуации »
- Новости »
- Новости о вспышках болезней
- Данные ВОЗ »
- Приборные панели »
- Приборная панель мониторинга COVID-19
- Основные моменты »
- Информация о ВОЗ »
- Генеральный директор
- Информация о ВОЗ
- Деятельность ВОЗ
- Где работает ВОЗ
- Руководящие органы »
- Всемирная ассамблея здравоохранения
- Исполнительный комитет
- Главная страница/
- Центр СМИ/
- Информационные бюллетени/
- Подробнее/
- Грипп
ВОЗ/T. Pietrasik
Pietrasik
© Фото
Сезонный грипп — это острая респираторная инфекция, вызываемая вирусами гриппа, которые циркулируют во всем мире.
Патоген
Существует 4 типа вирусов сезонного гриппа – типы A, B, C и D. Вирусы гриппа A и B циркулируют и вызывают сезонные эпидемии болезни.
Вирусы гриппа А подразделяются на подтипы в соответствии с комбинациями гемагглютинина (HA) и нейраминидазы (NA), белков на поверхности вируса. В настоящее время среди людей циркулируют вирусы гриппа подтипов A(h2N1) и A(h4N2). A(h2N1) также обозначается как A(h2N1)pdm09, поскольку он вызвал пандемию 2009 г. и впоследствии сменил вирус сезонного гриппа A(h2N1), циркулировавший до 2009 года. Известно, что пандемии вызывали только вирусы гриппа типа А.
Вирусы гриппа В не подразделяются на подтипы, но могут подразделяться на линии. В настоящее время циркулирующие вирусы гриппа типа В принадлежат к линиям В/Ямагата и В/Виктория.
Вирус гриппа С выявляется реже и обычно приводит к легким
инфекциям. Поэтому он не представляет проблемы для общественного
здравоохранения.
Поэтому он не представляет проблемы для общественного
здравоохранения.
Вирусы группы D, в основном, инфицируют крупный рогатый скот. По имеющимся данным, они не инфицируют людей и не вызывают у них заболеваний.
Признаки и симптомы
Для сезонного гриппа характерно внезапное появление высокой температуры, кашель (обычно сухой), головная боль, мышечные боли и боли в суставах, тяжелое недомогание, боль в горле и насморк. Кашель может быть тяжелым и длиться 2 недели и более. У большинства людей температура нормализуется и симптомы проходят в течение недели без какой-либо медицинской помощи. Но грипп может приводить к развитию тяжелой болезни и к смерти, особенно у людей из групп высокого риска (см. ниже).
Болезнь может протекать как в легкой, так и в тяжелой форме и даже заканчиваться смертельным исходом. Случаи госпитализации и смерти происходят, в основном, в группах высокого риска. По оценкам, ежегодные эпидемии гриппа приводят к 3-5 миллионам случаев тяжелой болезни и к 290 000 – 650 000 случаев смерти от респираторных заболеваний.
В промышленно развитых странах большинство случаев смерти, связанных с гриппом, происходят среди людей в возрасте 65 лет и старше (1). Эпидемии могут приводить к высоким уровням отсутствия на работе/в школе и к потерям производительности. Во время пиковых периодов заболеваемости клиники и больницы могут быть переполнены.
Последствия эпидемий сезонного гриппа в развивающихся странах недостаточно известны, но по результатам научных исследований 99% случаев смерти детей в возрасте до 5 лет с инфекциями нижних дыхательных путей, связанных с гриппом, происходят в развивающихся странах (2).
Эпидемиология
Люди болеют гриппом в любом возрасте, но есть группы населения, подверженные повышенному риску.
- Повышенному риску развития тяжелой болезни или осложнений в результате инфицирования подвергаются беременные женщины, дети в возрасте до 59 месяцев, пожилые люди, люди с хроническими нарушениями здоровья (такими как хронические болезни сердца, легких и почек, нарушения метаболизма, нарушения неврологического развития, болезни печени и крови) и люди с ослабленным иммунитетом (в результате ВИЧ/СПИДа, химиотерапии или лечения стероидами, а также в связи со злокачественными новообразованиями).

- Работники здравоохранения подвергаются высокому риску инфицирования вирусом гриппа во время контактов с пациентами и могут способствовать дальнейшей передаче инфекции, особенно людям из групп риска.
Передача инфекции сезонного гриппа происходит легко и быстро, особенно в местах большого скопления людей, включая школы и интернаты. При кашле или чихании инфицированного человека мелкие капли, содержащие вирус (инфекционные капли), попадают в воздух и могут распространяться на расстояние до одного метра и инфицировать людей, находящихся поблизости, которые вдыхают их. Инфекция может также передаваться через руки, загрязненные вирусами гриппа. Для предотвращения передачи инфекции при кашле необходимо прикрывать рот и нос салфеткой и регулярно мыть руки.
В районах с умеренным климатом сезонные эпидемии происходят, в основном, в зимнее время года, тогда как в тропических районах вирусы гриппа циркулируют круглый год, приводя к менее регулярным эпидемиям. Сезонные эпидемии и бремя болезни
Сезонные эпидемии и бремя болезни
Период времени с момента инфицирования до развития болезни, известный как инкубационный период, длится около 2 дней, но может варьироваться от 1 до 4 дней.
Диагностика
В большинстве случаев грипп человека клинически диагностируется. Однако в периоды низкой активности вирусов гриппа и при отсутствии эпидемий инфекция, вызванная другими респираторными вирусами, такими как риновирус, респираторный синцитиальный вирус, вирус парагриппа и аденовирус, может также протекать как гриппоподобное заболевание, что затрудняет клинически дифференцировать грипп от других патогенов.
Для постановки окончательного диагноза необходимо собрать надлежащие респираторные образцы и выполнить лабораторный диагностический тест. Первым важнейшим шагом для лабораторного выявления вирусных инфекций гриппа является надлежащий сбор, хранение и транспортировка респираторных образцов. Обычно лабораторное подтверждение вирусов гриппа в выделениях из горла, носа и носоглотки или в аспиратах или смывах из трахеи осуществляется путем прямого выявления антигенов, изоляции вирусов или выявления специфичной для гриппа РНК методом полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР). Имеется целый ряд руководств по лабораторным методикам, опубликованных и обновленных ВОЗ (3).
Имеется целый ряд руководств по лабораторным методикам, опубликованных и обновленных ВОЗ (3).
В клиниках для выявления гриппа применяются диагностические экспресс-тесты, но по сравнению с методами ОТ-ПЦР они имеют низкую чувствительность, и надежность их результатов в значительной мере зависит от условий, в которых они используются.
Лечение
Пациенты, не входящие в группы повышенного риска, должны получать симптоматическое лечение. При наличии симптомов им рекомендуется оставаться дома с тем, чтобы минимизировать риск инфицирования других людей в сообществе. Лечение направлено на смягчение симптомов гриппа, таких как высокая температура. Пациенты должны следить за своим состоянием и в случае его ухудшения обращаться за медицинской помощью. Если известно, что пациентам угрожает высокий риск развития тяжелой болезни или осложнений (см. выше), они, помимо симптоматического лечения, должны как можно скорее получать противовирусные препараты.
Пациенты с тяжелым или прогрессирующим клиническим заболеванием, связанным с предполагаемой или подтвержденной вирусной инфекцией гриппа (например, с клиническими синдромами пневмонии, сепсиса или обострения сопутствующих хронических заболеваний), должны как можно скорее получать противовирусные препараты.
- Для получения максимального терапевтического эффекта следует как можно скорее (в идеале, в течение 48 часов после появления симптомов) назначать ингибиторы нейраминидазы (например, озельтамивир). Для пациентов на более поздней стадии болезни следует также предусматривать прием лекарственных препаратов.
- Лечение рекомендуется проводить не менее 5 дней, но можно продлевать до получения удовлетворительных клинических результатов.
- Использование кортикостероидов следует предусматривать только при наличии других показаний (таких как астма и другие конкретные нарушения здоровья), поскольку оно связано с более длительным выведением вирусов из организма и ослаблением иммунитета, что приводит к бактериальной или грибковой суперинфекции.
- Все циркулирующие в настоящее время вирусы гриппа устойчивы к противовирусным препаратам класса адамантанов (таким как амантадин и римантадин), поэтому эти препараты не рекомендуется применять в качестве монотерапии.

ГСЭГО ВОЗ ведет мониторинг за устойчивостью к противовирусным препаратам среди циркулирующих вирусов гриппа с тем, чтобы своевременно предоставлять руководящие указания в отношении применения противовирусных препаратов для клинического ведения и потенциальной химиопрофилактики.
Профилактика
Наиболее эффективным способом профилактики болезни является вакцинация. Вот уже более 60 лет имеются и используются безопасные и эффективные вакцины. Через некоторое время после вакцинации иммунитет ослабевает, поэтому для защиты от гриппа рекомендуется ежегодная вакцинация. Наиболее широко в мире используются инъекционные инактивированные противогриппозные вакцины.
Среди здоровых взрослых людей противогриппозная вакцина обеспечивает защиту даже в том случае, если циркулирующие вирусы не соответствуют в точности вакцинным вирусам. Однако для пожилых людей вакцинация против гриппа может быть менее эффективной с точки зрения предотвращения болезни, но ослабляет ее тяжесть и уменьшает вероятность развития осложнений и смертельного исхода.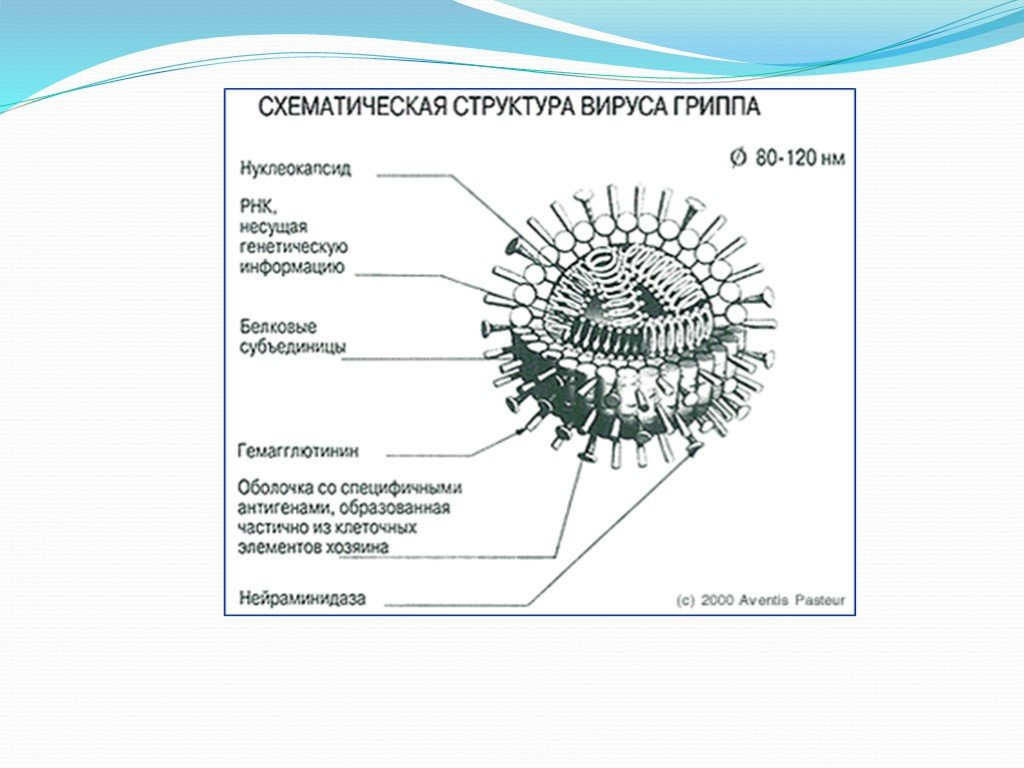 Вакцинация особенно важна для людей, подвергающихся высокому риску развития осложнений, а также для людей, живущих с людьми из группы высокого риска или осуществляющих уход за ними.
Вакцинация особенно важна для людей, подвергающихся высокому риску развития осложнений, а также для людей, живущих с людьми из группы высокого риска или осуществляющих уход за ними.
ВОЗ рекомендует ежегодную вакцинацию для следующих групп населения:
- беременные женщины на любом сроке беременности
- дети в возрасте от 6 месяцев до 5 лет
- пожилые люди (старше 65 лет)
- люди с хроническими нарушениями здоровья
- работники здравоохранения.
Эффективность противогриппозной вакцины зависит от того, насколько циркулирующие вирусы совпадают с вирусами, содержащимися в вакцине. Из-за постоянно изменяющейся природы вирусов гриппа Глобальная система эпиднадзора за гриппом и ответных мер ВОЗ (ГСЭГО) – система национальных центров по гриппу и сотрудничающих центров ВОЗ во всем мире – осуществляет непрерывный мониторинг за вирусами гриппа, циркулирующими среди людей, и дважды в год обновляет состав противогриппозных вакцин.
На протяжении многих лет ВОЗ обновляет свои рекомендации в отношении состава вакцины (трехвалентной), нацеленной на 3 наиболее представленных циркулирующих типа вируса (два подтипа вируса гриппа А и один подтип вируса гриппа В).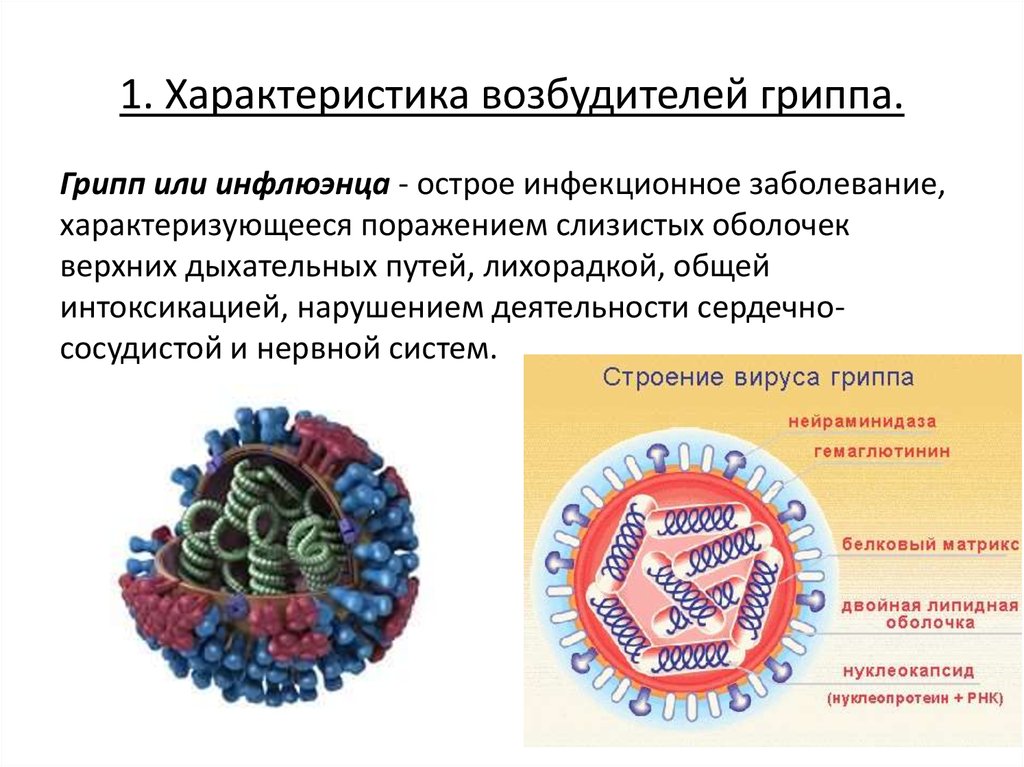 Начиная с сезона гриппа 2013-2014 г. в северном полушарии для содействия разработке четырехвалентной вакцины рекомендуется вводить четвертый компонент. Четырехвалентные вакцины в дополнение к вирусам, входящим в состав трехвалентной вакцины, включают второй вирус гриппа типа В, и ожидается, что они обеспечат более широкую защиту против инфекций, вызванных вирусом гриппа типа В. Многие инактивированные и рекомбинантные противогриппозные вакцины доступны в инъекционной форме. Живая аттенуированная противогриппозная вакцина доступна в форме назального спрея.
Начиная с сезона гриппа 2013-2014 г. в северном полушарии для содействия разработке четырехвалентной вакцины рекомендуется вводить четвертый компонент. Четырехвалентные вакцины в дополнение к вирусам, входящим в состав трехвалентной вакцины, включают второй вирус гриппа типа В, и ожидается, что они обеспечат более широкую защиту против инфекций, вызванных вирусом гриппа типа В. Многие инактивированные и рекомбинантные противогриппозные вакцины доступны в инъекционной форме. Живая аттенуированная противогриппозная вакцина доступна в форме назального спрея.
Предэкспозиционная и постэкспозиционная профилактика с помощью противовирусных препаратов возможна, но ее эффективность зависит от ряда факторов, таких как индивидуальные особенности, тип воздействия и риск, связанный с воздействием.
Помимо вакцинации и противовирусного лечения мероприятия общественного здравоохранения включают меры индивидуальной защиты, такие как:
- регулярное мытье и надлежащее высушивание рук;
- надлежащая респираторная гигиена – прикрытие рта и носа при кашле и чихании салфетками с их последующим надлежащим удалением;
- своевременная самоизоляция людей, почувствовавших себя нездоровыми, с высокой температурой и другими симптомами гриппа;
- предотвращение тесных контактов с больными людьми;
- предотвращение прикасаний к глазам, носу и рту.
Деятельность ВОЗ
ВОЗ через систему ГСЭГО ВОЗ и в сотрудничестве с другими партнерами проводит мониторинг за активностью гриппа в глобальных масштабах, дает рекомендации по составам вакцины против сезонного гриппа дважды в год для северного и южного полушарий, помогает странам с тропическим и субтропическим климатом в выборе вакцинных препаратов (для северного и южного полушарий) и принятии решений в отношении времени проведения кампаний вакцинации и оказывает поддержку государствам-членам в разработке стратегий профилактики и контроля.
ВОЗ работает в целях усиления национального, регионального и глобального потенциала для принятия мер в связи с гриппом (включая диагностику, мониторинг чувствительности к противовирусным препаратам, эпиднадзор за болезнью и реагирование на вспышки болезни), расширения охвата вакцинацией в группах населения высокого риска и обеспечения готовности к следующей пандемии гриппа.
(1) Estimates of US influenza-associated deaths made using four different methods.
Thompson WW, Weintraub E, Dhankhar P, Cheng OY, Brammer L, Meltzer MI, et al. Influenza Other Respi Viruses. 2009;3:37-49
(2) Global burden of respiratory infections due to seasonal influenza in young children: a systematic review and meta-analysis.
Nair H, Abdullah Brooks W, Katz M et al. Lancet 2011; 378: 1917–3
(3) WHO recommended surveillance standards, Second edition.
Видеоролик
изображений вирусов гриппа | CDC
Изображения, связанные с H7N9, см. в разделе Изображения птичьего гриппа A H7N9.
- Вирус гриппа связывается с клеткой респираторного тракта
- Графическое изображение родового вируса гриппа
На этом изображении показаны самые начальные стадии инфекции гриппа. Большинство экспертов считают, что вирусы гриппа распространяются в основном через мелкие капли, содержащие вирус гриппа. Эти капли выбрасываются в воздух, когда люди, инфицированные гриппом, кашляют, чихают или разговаривают.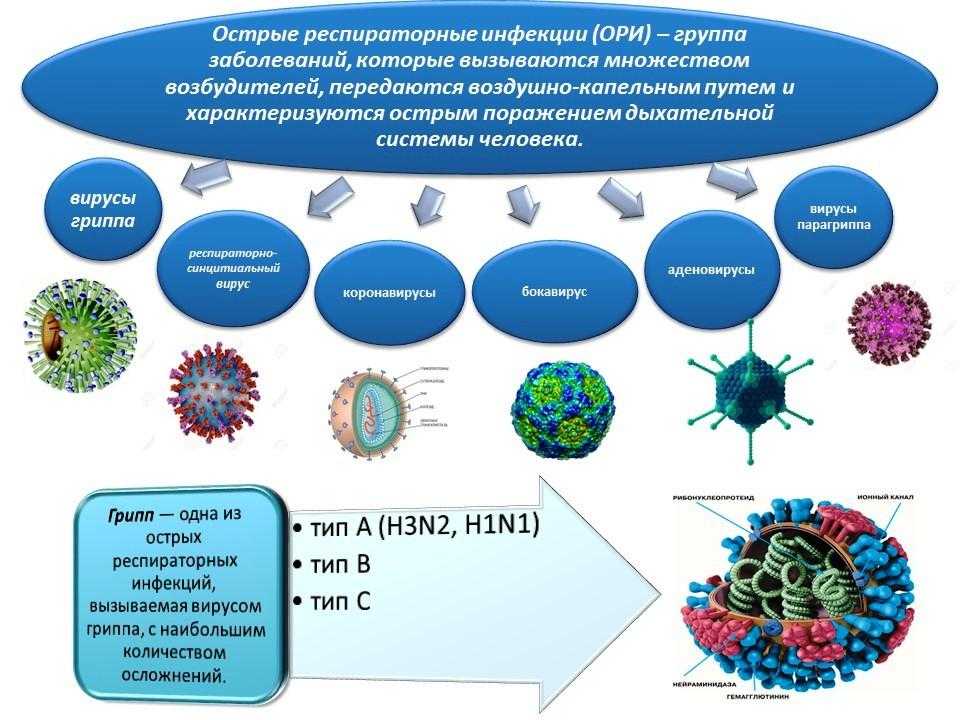 Оказавшись в воздухе, эти маленькие инфекционные капельки могут попасть в рот или нос людей, находящихся поблизости. На этом изображении показано, что происходит после того, как эти вирусы гриппа попадают в организм человека. Вирусы прикрепляются к клеткам носовых ходов и горла (то есть дыхательных путей). Затем поверхностные белки гемагглютинина (HA) вируса гриппа связываются с рецепторами сиаловой кислоты на поверхности клеток дыхательных путей человека. Структура поверхностных белков HA вируса гриппа разработана таким образом, чтобы соответствовать рецепторам сиаловой кислоты в клетке человека, подобно ключу к замку. Как только ключ входит в замок, вирус гриппа может проникнуть в клетку и заразить ее. Это знаменует собой начало заражения гриппом.
Оказавшись в воздухе, эти маленькие инфекционные капельки могут попасть в рот или нос людей, находящихся поблизости. На этом изображении показано, что происходит после того, как эти вирусы гриппа попадают в организм человека. Вирусы прикрепляются к клеткам носовых ходов и горла (то есть дыхательных путей). Затем поверхностные белки гемагглютинина (HA) вируса гриппа связываются с рецепторами сиаловой кислоты на поверхности клеток дыхательных путей человека. Структура поверхностных белков HA вируса гриппа разработана таким образом, чтобы соответствовать рецепторам сиаловой кислоты в клетке человека, подобно ключу к замку. Как только ключ входит в замок, вирус гриппа может проникнуть в клетку и заразить ее. Это знаменует собой начало заражения гриппом.
Изображение с метками и полным текстом
Загрузить изображение изображение значка [JPG, 1,6 МБ]
Изображение без меток или текста [JPG, 1,3 МБ]
Загрузить изображение изображение значка [JPG, 1,3 МБ]
Изображение с метками только [JPG, 1,4 МБ]
Загрузить изображение image icon[JPG, 1,4 МБ]
К началу страницы
Графическое представление родового вируса гриппа
Эти изображения обеспечивают трехмерное графическое представление биологии и структуры родового вируса вируса гриппа и не специфичны для 2009 г.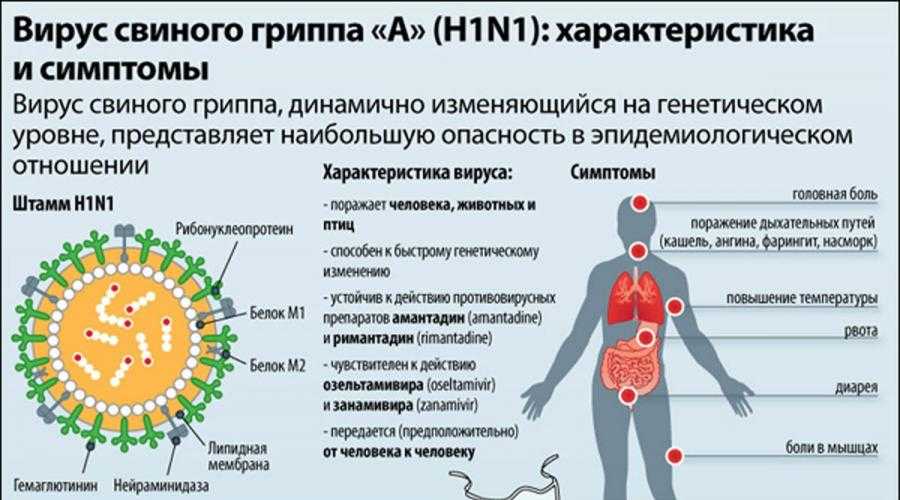 вирус h2N1. Доступно для скачивания в разрешении 72 dpi.
вирус h2N1. Доступно для скачивания в разрешении 72 dpi.
Доступны следующие цвета фона — Опубликовано 26 марта 2010 г.
Черный:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Синий:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Фиолетовый:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Прозрачный:
Значок большого изображения | Значок среднего изображения | Маленькая иконка
К началу страницы
Доступны следующие цвета фона — Опубликовано 25 ноября 2009 г.
Черный:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Синий:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Фиолетовый:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Прозрачный:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
К началу страницы
Доступны следующие цвета фона — Опубликовано 26 марта 2010 г.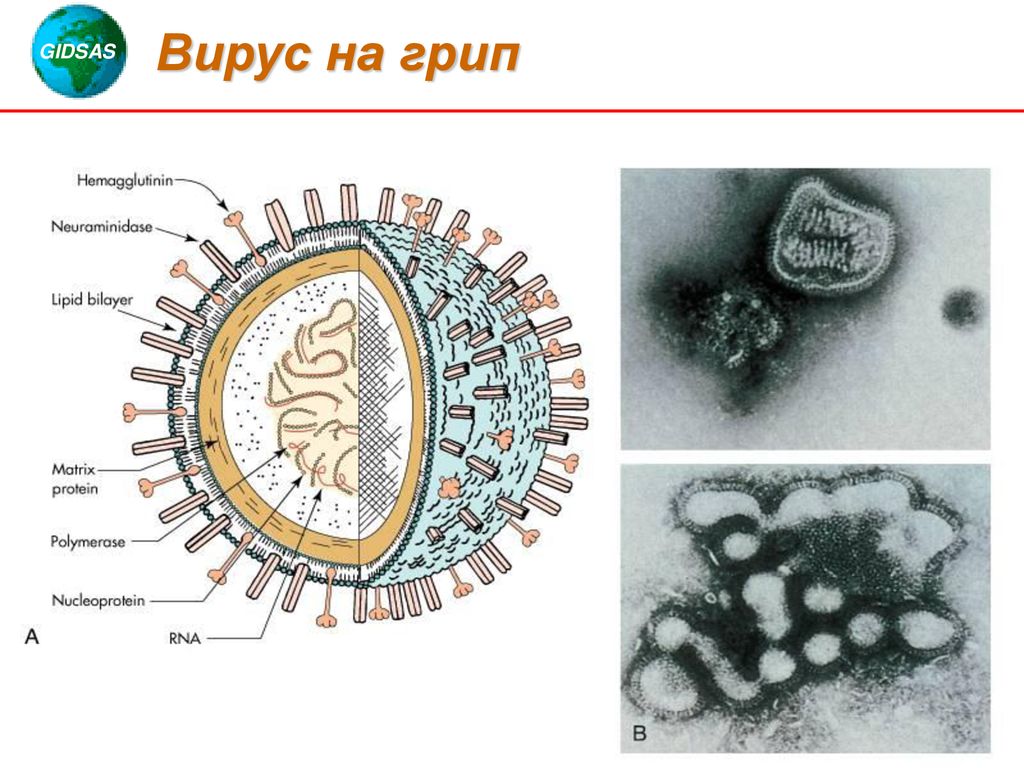
Черный:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Синий:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Прозрачный:
Значок большого изображения | Значок среднего изображения | Значок Smallimage
К началу страницы
Доступны следующие цвета фона — Опубликовано 25 ноября 2009 г.
Черный:
Значок Largeimage | Значок среднего изображения | Маленькая иконка
Синий:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Прозрачный:
Значок большого изображения | Значок среднего изображения | Значок Smallimage
К началу страницы
Доступны следующие цвета фона — Опубликовано 26 марта 2010 г.
Черный:
Значок Largeimage | Значок среднего изображения | Значок маленького изображения
Синий:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Фиолетовый:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Прозрачный:
Значок большого изображения | Значок среднего изображения | Значок Smallimage
К началу страницы
Доступны следующие цвета фона — Опубликовано 25 ноября 2009 г.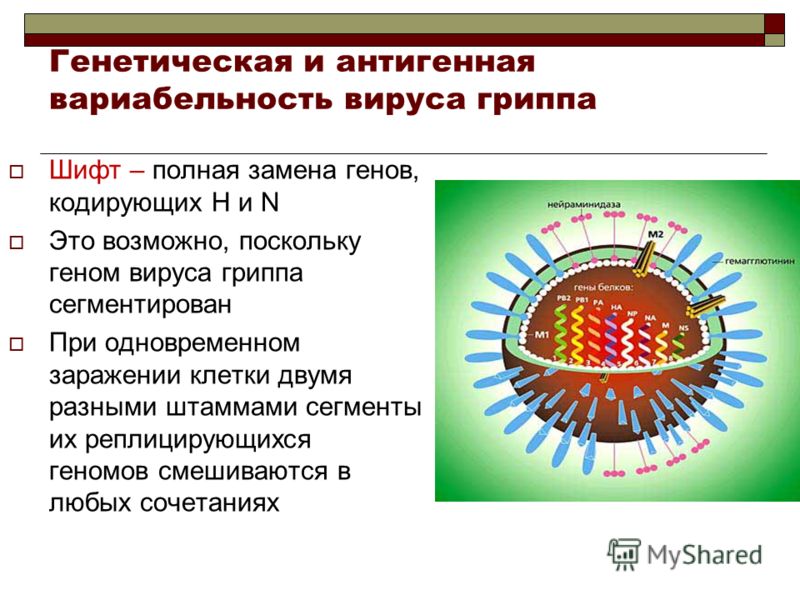
Черный:
Значок Largeimage | Значок среднего изображения | Значок маленького изображения
Синий:
Значок большого изображения | Значок среднего изображения | Значок маленького изображения
Фиолетовый:
Значок большого изображения | Значок среднего изображения | Маленькая иконка
Прозрачный:
Значок большого изображения | Значок среднего изображения | Значок Smallimage
К началу страницы
Доступен на белом фоне — Опубликовано 19 мая 2014 г.
Белый:
Значок Largeimage | Значок среднего изображения | Smallimage icon
На приведенном выше изображении показаны различные особенности вируса гриппа, включая поверхностные белки гемагглютинин (HA) и нейраминидазу (NA). После заражения гриппом или получения противогриппозной вакцины иммунная система организма вырабатывает антитела, которые распознают и связываются с «антигенными участками», представляющими собой области, обнаруженные на поверхностных белках вируса гриппа.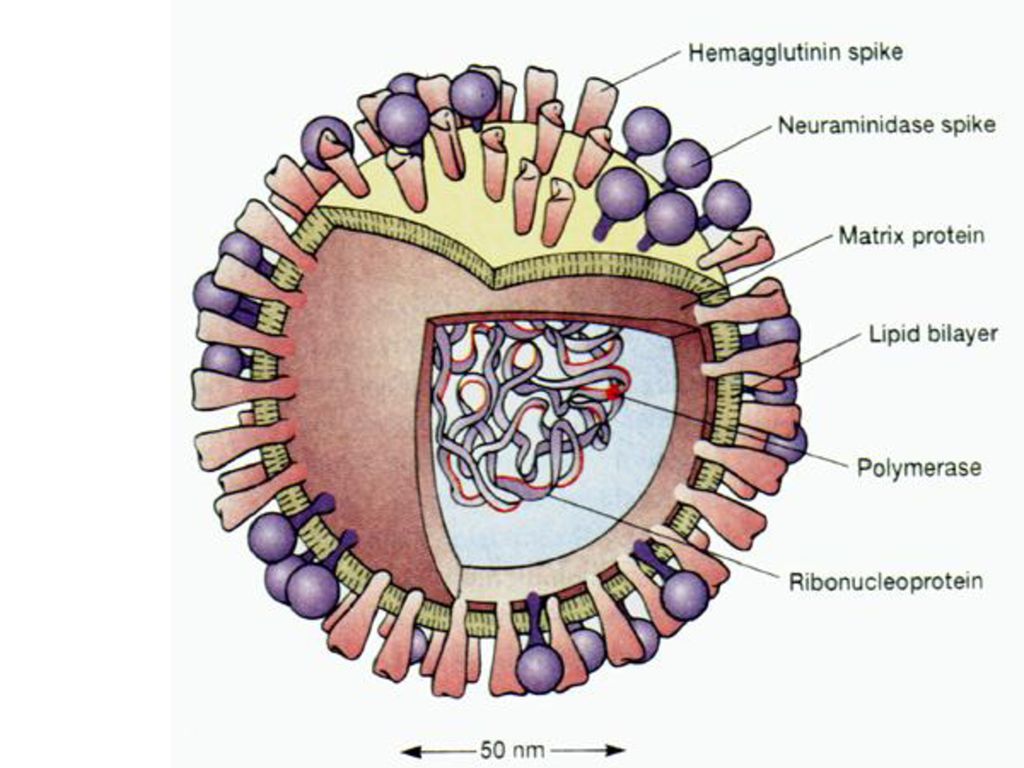 Связываясь с этими антигенными участками, антитела нейтрализуют вирусы гриппа, что предотвращает их дальнейшее заражение.
Связываясь с этими антигенными участками, антитела нейтрализуют вирусы гриппа, что предотвращает их дальнейшее заражение.
К началу страницы
Доступно на белом фоне с подписями — Опубликовано 4 июня 2014 г.
Белый:
Значок большого изображения | Значок среднего изображения | Smallimage icon
На приведенном выше изображении показаны различные особенности вируса гриппа, включая поверхностные белки гемагглютинин (HA) и нейраминидазу (NA). После заражения гриппом или получения противогриппозной вакцины иммунная система организма вырабатывает антитела, которые распознают и связываются с «антигенными участками», представляющими собой области, обнаруженные на поверхностных белках вируса гриппа. Связываясь с этими антигенными участками, антитела нейтрализуют вирусы гриппа, что предотвращает их дальнейшее заражение.
К началу страницы
Значок большого изображения | Значок среднего изображения | Smallimage icon
Компьютерная трехмерная визуализация целого вируса гриппа (гриппа) в полупрозрачном синем цвете на чистом фоне. Поверхностные белки вируса гемагглютинин (HA) и нейраминидаза (NA) отображаются полупрозрачным синим цветом, выступающим из поверхности вируса. HA представляет собой тример (состоящий из трех субъединиц), а NA представляет собой тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер).
Поверхностные белки вируса гемагглютинин (HA) и нейраминидаза (NA) отображаются полупрозрачным синим цветом, выступающим из поверхности вируса. HA представляет собой тример (состоящий из трех субъединиц), а NA представляет собой тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер).
Значок большого изображения | Значок среднего изображения | Smallimage icon
Компьютерная трехмерная визуализация всего вируса гриппа (гриппа) в полупрозрачном синем цвете на темно-синем фоне. Поверхностные белки вируса гемагглютинин (HA) и нейраминидаза (NA) отображаются полупрозрачным синим цветом, выступающим из поверхности вируса. HA — это тример (состоящий из трех субъединиц), а NA — тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер)
Значок большого изображения | Значок среднего изображения | Smallimage icon
Компьютерная трехмерная визуализация целого вируса гриппа со светло-серой поверхностной мембраной на прозрачном фоне.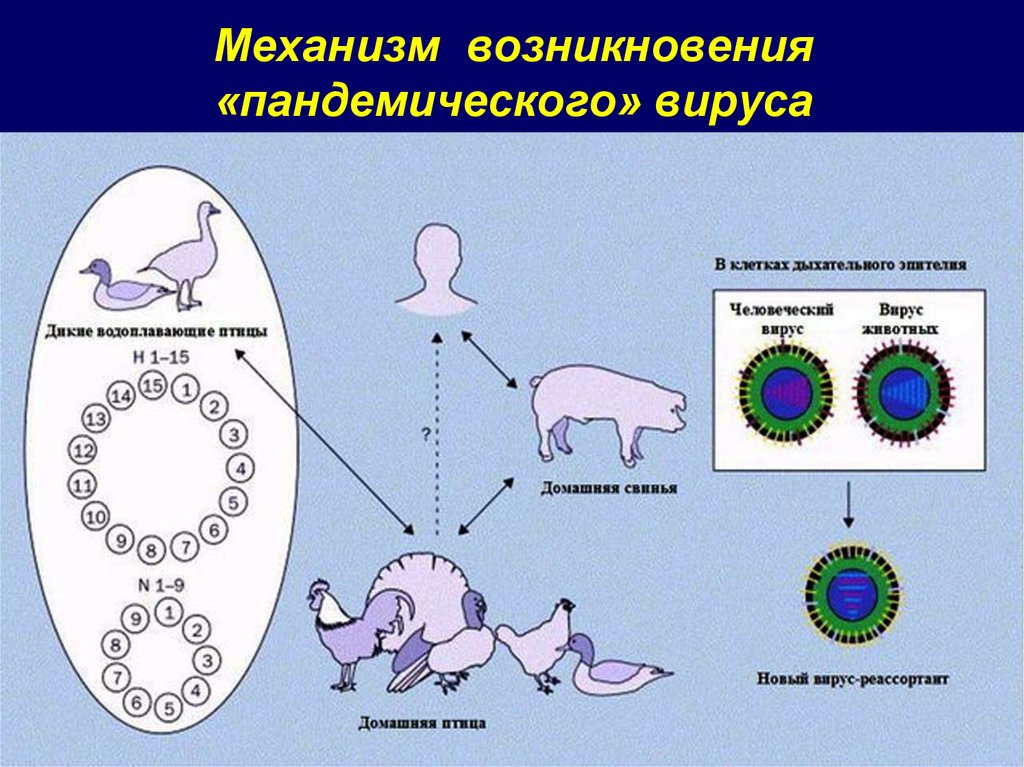 Поверхностные белки вируса — гемагглютинин (HA) и нейраминидаза (NA) — показаны светло- и темно-синим цветом соответственно. HA представляет собой тример (состоит из трех субъединиц), а NA представляет собой тетрамер (состоит из четырех субъединиц, а его головная часть напоминает четырехлистный клевер)
Поверхностные белки вируса — гемагглютинин (HA) и нейраминидаза (NA) — показаны светло- и темно-синим цветом соответственно. HA представляет собой тример (состоит из трех субъединиц), а NA представляет собой тетрамер (состоит из четырех субъединиц, а его головная часть напоминает четырехлистный клевер)
Значок большого изображения | Значок среднего изображения | Smallimage icon
Компьютерная трехмерная визуализация целого вируса гриппа со светло-серой поверхностной мембраной на черном фоне. Поверхностные белки вируса — гемагглютинин (HA) и нейраминидаза (NA) — показаны светло- и темно-синим цветом соответственно. HA — это тример (состоящий из трех субъединиц), а NA — тетрамер (состоящий из четырех субъединиц, головная часть которого напоминает четырехлистный клевер)
Largeimage icon | Значок среднего изображения | Маленькая иконка
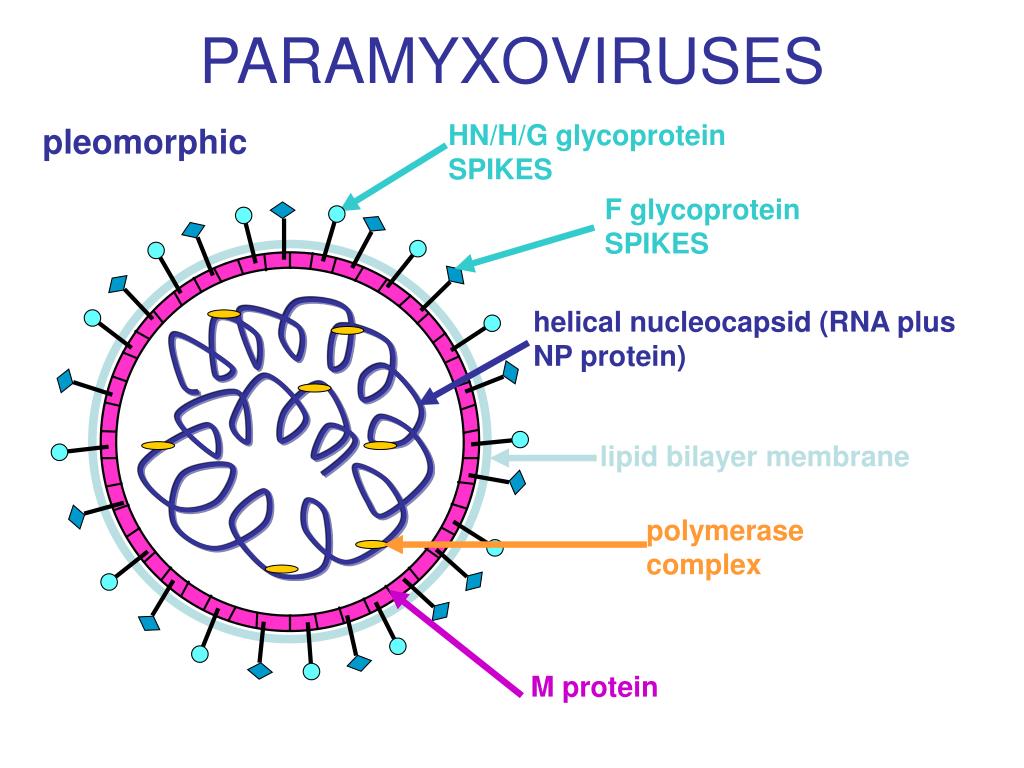
Компьютерная трехмерная визуализация наполовину разрезанного вируса гриппа (гриппа) с серой поверхностной мембраной на прозрачном фоне.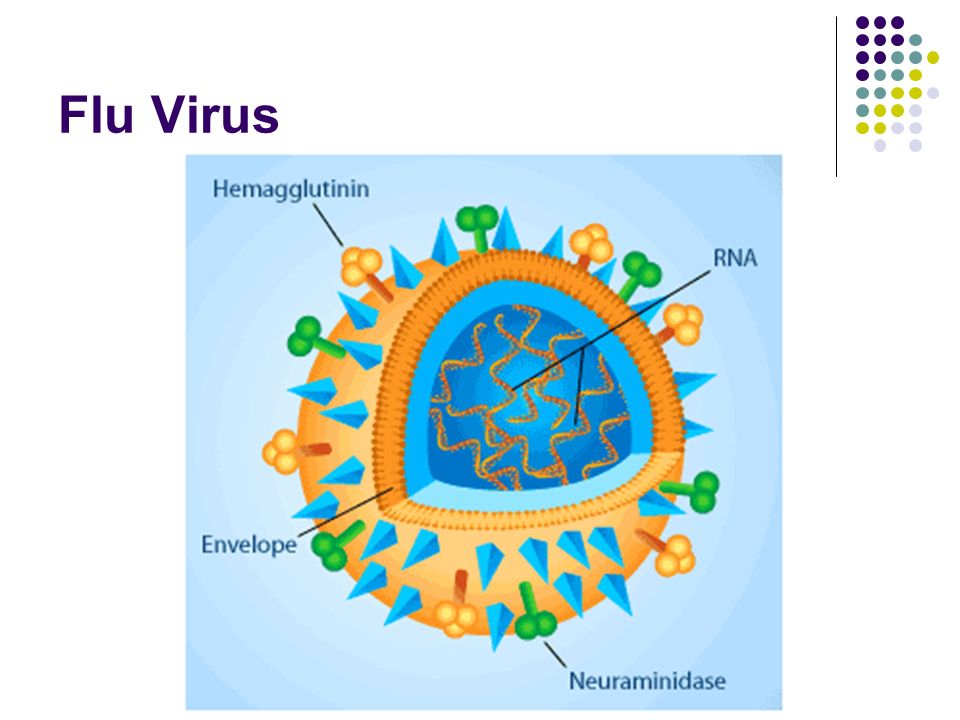 Поверхностные белки вируса — гемагглютинин (HA) и нейраминидаза (NA) — показаны светло- и темно-синим цветом соответственно. Внутри вируса показаны его рибонуклеопротеины (РНП) со спиральными структурами и полимеразным комплексом с тремя луковицами на концах. РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M).
Поверхностные белки вируса — гемагглютинин (HA) и нейраминидаза (NA) — показаны светло- и темно-синим цветом соответственно. Внутри вируса показаны его рибонуклеопротеины (РНП) со спиральными структурами и полимеразным комплексом с тремя луковицами на концах. РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M).
Значок большого изображения | Значок среднего изображения | Smallimage icon
Компьютерная трехмерная визуализация наполовину разрезанного вируса гриппа с серой поверхностной мембраной на черном фоне. Поверхностные белки вируса — гемагглютинин (HA) и нейраминидаза (NA) — показаны светло- и темно-синим цветом соответственно. HA представляет собой тример (состоящий из трех субъединиц), а NA представляет собой тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер).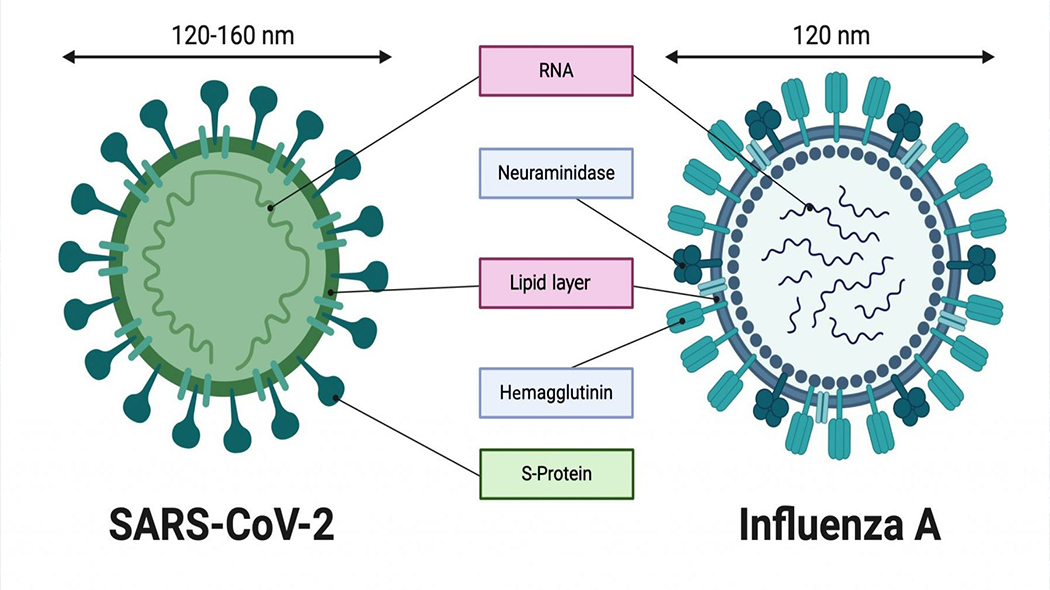 Внутри вируса показаны его рибонуклеопротеины (РНП) со спиральными структурами и полимеразным комплексом с тремя луковицами на концах. РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M).
Внутри вируса показаны его рибонуклеопротеины (РНП) со спиральными структурами и полимеразным комплексом с тремя луковицами на концах. РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M).
Значок большого изображения | Значок среднего изображения | Smallimage icon
Компьютерная трехмерная визуализация всего вируса гриппа (гриппа) в полупрозрачном синем цвете на чистом фоне. На внутренней стороне вируса его рибонуклеопротеины (РНП) показаны белым цветом со спиральными структурами и полимеразным комплексом с тремя луковицами на концах. РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M).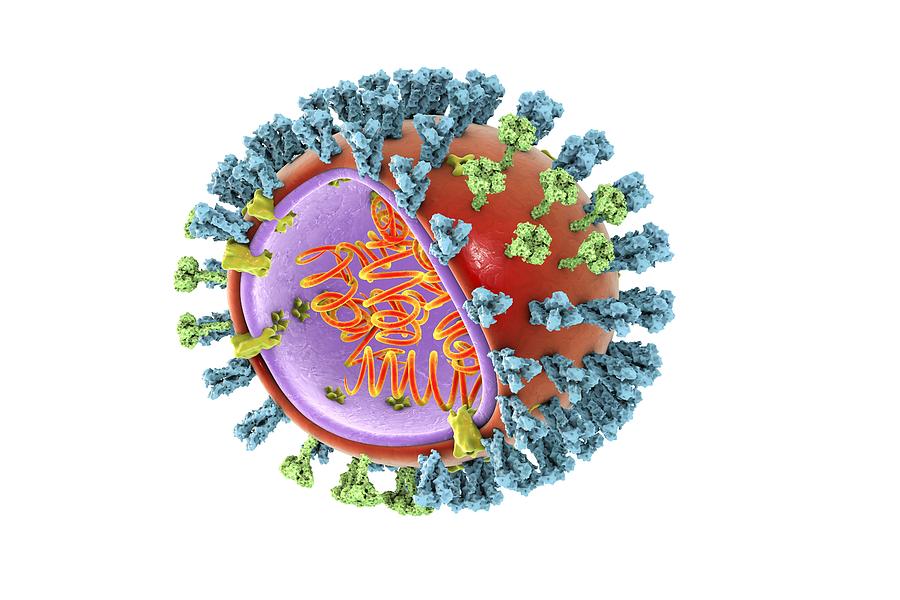
Значок большого изображения | Значок среднего изображения | Smallimage icon
Созданный компьютером 3D-рендеринг целого вируса гриппа (гриппа) в полупрозрачном синем цвете на черном фоне. На внутренней стороне вируса его рибонуклеопротеины (РНП) показаны белым цветом со спиральными структурами и полимеразным комплексом с тремя луковицами на концах. РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M).
Значок большого изображения | Значок среднего изображения | Smallimage icon
Компьютерная трехмерная визуализация всего вируса гриппа (гриппа) в полупрозрачном синем цвете на чистом фоне. Прозрачная область в центре изображения позволяет зрителю заглянуть внутрь вируса гриппа, чтобы увидеть его рибонуклеопротеины (РНП). RNPS показаны белым цветом с их спиральными структурами и полимеразным комплексом с тремя луковицами на концах.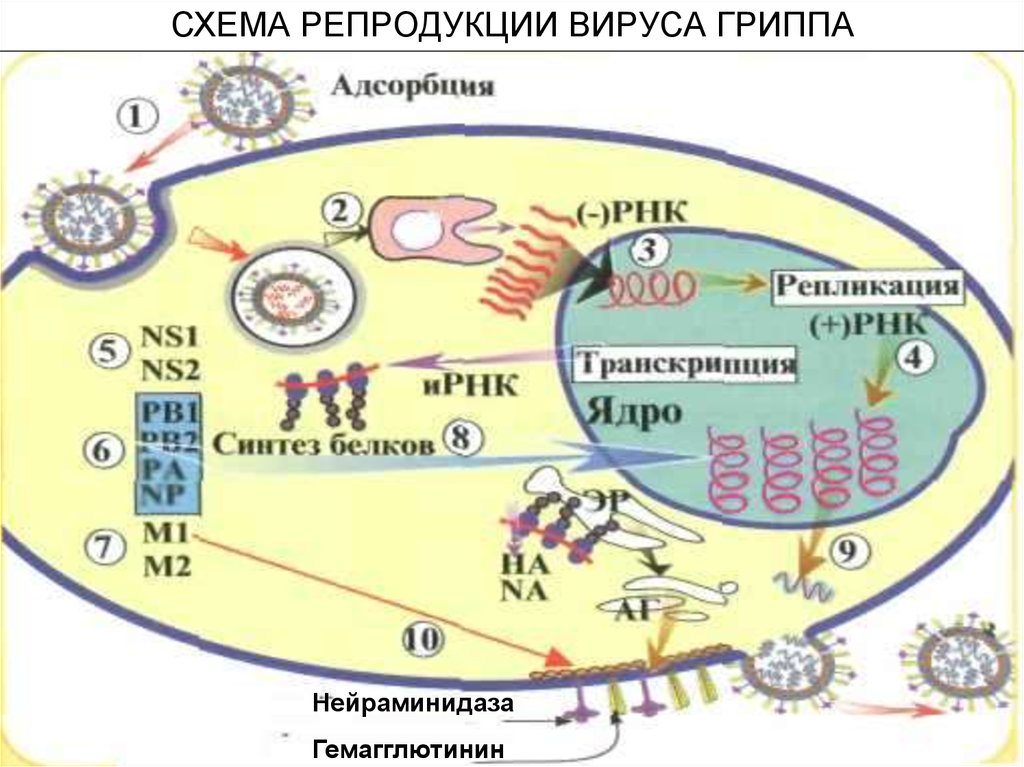 РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M). Поверхностные белки вируса гемагглютинин (HA) и нейраминидаза (NA) отображаются полупрозрачным синим цветом, выступающим из поверхности вируса. HA — это тример (состоящий из трех субъединиц), а NA — тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер)
РНП вируса гриппа состоит как из РНК, так и из белка. Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M). Поверхностные белки вируса гемагглютинин (HA) и нейраминидаза (NA) отображаются полупрозрачным синим цветом, выступающим из поверхности вируса. HA — это тример (состоящий из трех субъединиц), а NA — тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер)
Значок большого изображения | Значок среднего изображения | Smallimage icon
Созданный компьютером 3D-рендеринг целого вируса гриппа (гриппа) в полупрозрачном синем цвете на черном фоне. Прозрачная область в центре изображения позволяет зрителю заглянуть внутрь вируса гриппа, чтобы увидеть его рибонуклеопротеины (РНП). RNPS показаны белым цветом с их спиральными структурами и полимеразным комплексом с тремя луковицами на концах. РНП вируса гриппа состоит как из РНК, так и из белка.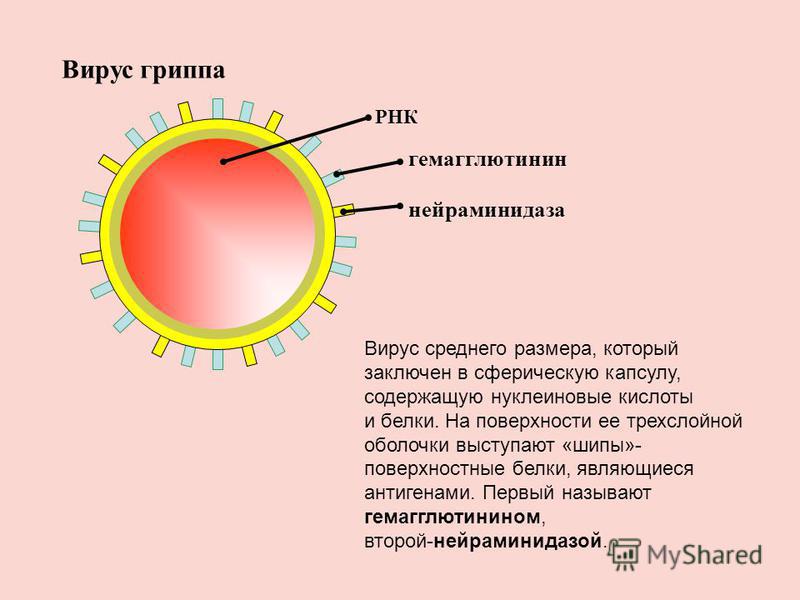 Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M). Поверхностные белки вируса гемагглютинин (HA) и нейраминидаза (NA) отображаются полупрозрачным синим цветом, выступающим из поверхности вируса. HA — это тример (состоящий из трех субъединиц), а NA — тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер)
Каждый вирус гриппа имеет восемь сегментов RNP, которые соответствуют восьми общим генным сегментам вируса. Три из этих сегментов RNP кодируют поверхностные белки вируса (т. е. белки HA, NA и M). Поверхностные белки вируса гемагглютинин (HA) и нейраминидаза (NA) отображаются полупрозрачным синим цветом, выступающим из поверхности вируса. HA — это тример (состоящий из трех субъединиц), а NA — тетрамер (состоящий из четырех субъединиц, а его головная часть напоминает четырехлистный клевер)
БИОЛОГИЯ ВИРУСОВ ГРИППА
1. Palese P, Shaw ML. Ортомиксовирусы: вирусы и их репликация. В: Knipe DM, Howley PM, редакторы. Вирусология Филдса. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2007. [Google Scholar]
2. Zebedee SL, Lamb RA. Белок М2 вируса гриппа А: ограничение роста вируса моноклональными антителами и обнаружение М2 в вирионах. Дж Вирол. 1988 г., август; 62 (8): 2762–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Chen W, Calvo PA, Malide D, Gibbs J, Schubert U, Bacik I, et al.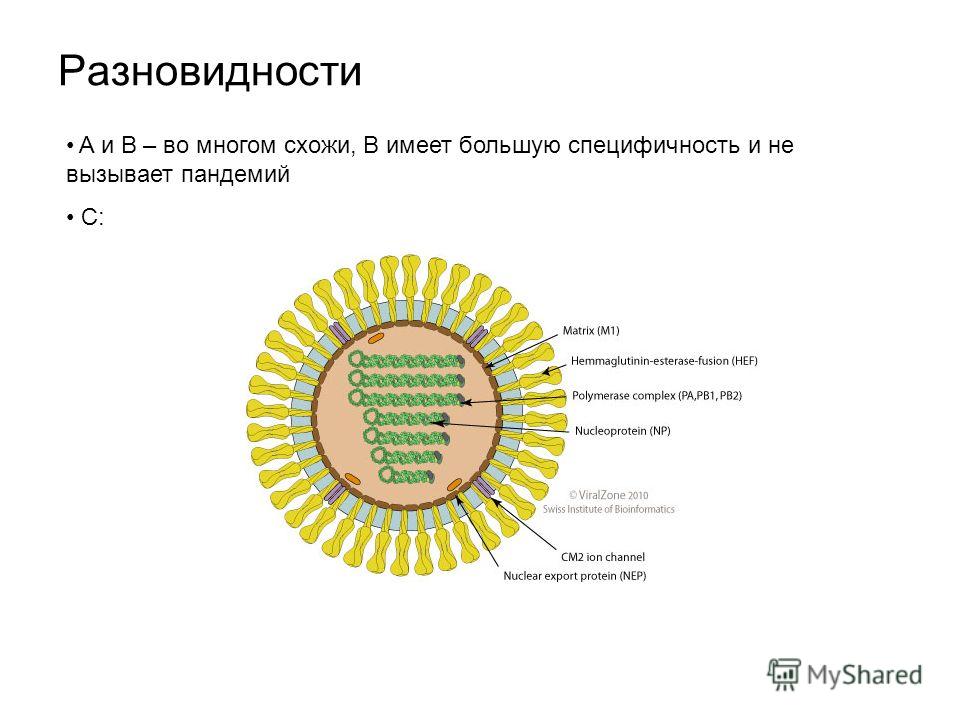 Новый митохондриальный белок вируса гриппа А, вызывающий гибель клеток. Нат Мед. 2001 г., декабрь; 7 (12): 1306–12. [PubMed] [Академия Google]
Новый митохондриальный белок вируса гриппа А, вызывающий гибель клеток. Нат Мед. 2001 г., декабрь; 7 (12): 1306–12. [PubMed] [Академия Google]
4. Hatta M, Kawaoka Y. Белок NB вируса гриппа B не является необходимым для репликации вируса in vitro. Дж Вирол. 2003 г., май; 77 (10): 6050–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Lamb RA, Lai CJ, Choppin PW. Последовательности мРНК, полученные из сегмента геномной РНК 7 вируса гриппа: коллинеарные и прерванные мРНК кодируют перекрывающиеся белки. Proc Natl Acad Sci U S A. 1981 Jul; 78 (7): 4170–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Briedis DJ, Lamb RA, Choppin PW. Последовательность сегмента 7 РНК генома вируса гриппа B: частичная гомология аминокислот между мембранными белками (M1) вирусов гриппа A и B и сохранение второй открытой рамки считывания. Вирусология. 1982 30 января; 116 (2): 581–588. [PubMed] [Google Scholar]
7. Horvath CM, Williams MA, Lamb RA. Эукариотическая сопряженная трансляция тандемных цистронов: идентификация полипептида BM2 вируса гриппа B.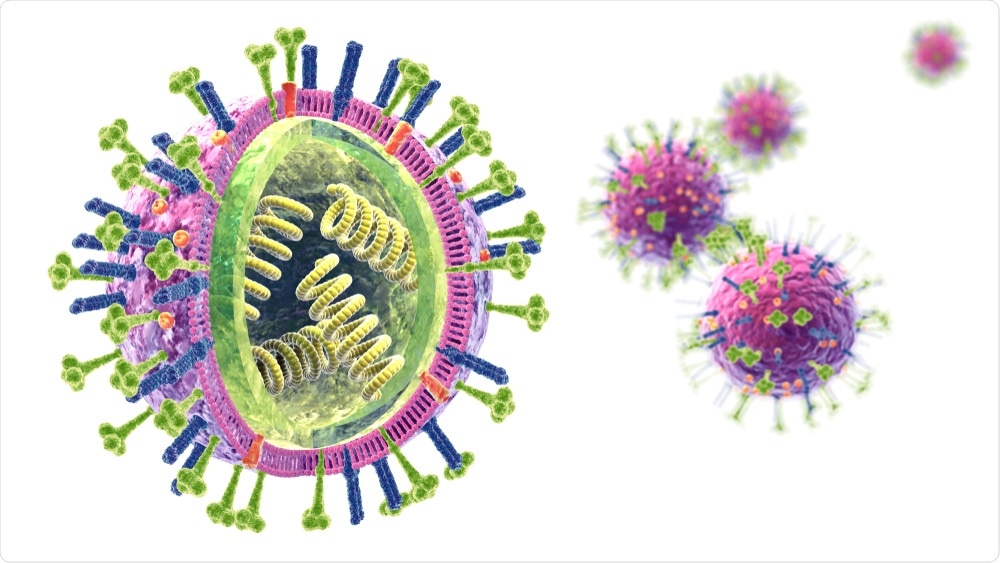 EMBO J. 1990 авг.; 9 (8): 2639–47. [Статья бесплатно PMC] [PubMed] [Google Scholar]
EMBO J. 1990 авг.; 9 (8): 2639–47. [Статья бесплатно PMC] [PubMed] [Google Scholar]
8. Dauber B, Heins G, Wolff T. Неструктурный белок NS1 вируса гриппа B необходим для эффективного роста вируса и противодействует индукции бета-интерферона. Дж Вирол. 2004 г., февраль; 78 (4): 1865–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Гарсия-Састре А. Ингибирование интерферон-опосредованного противовирусного ответа вирусами гриппа А и другими РНК-вирусами с отрицательной цепью. Вирусология. 2001 г., 20 января; 279 (2): 375–84. [PubMed] [Google Scholar]
10. Кохс Г., Гарсия-Састре А., Мартинес-Собридо Л. Множественные антиинтерфероновые действия белка NS1 вируса гриппа А. Дж Вирол. 2007 г., июль; 81 (13): 7011–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Briedis DJ, Lamb RA. Геном вируса гриппа B: последовательности и структурная организация сегмента 8 РНК и мРНК, кодирующих белки NS1 и NS2. Дж Вирол. 1982 апреля; 42 (1): 186–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Lamb RA, Choppin PW, Chanock RM, Lai CJ. Картирование двух перекрывающихся генов полипептидов NS1 и NS2 на 8-м сегменте РНК генома вируса гриппа. Proc Natl Acad Sci U S A. 1980 Apr; 77 (4): 1857–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Lamb RA, Choppin PW, Chanock RM, Lai CJ. Картирование двух перекрывающихся генов полипептидов NS1 и NS2 на 8-м сегменте РНК генома вируса гриппа. Proc Natl Acad Sci U S A. 1980 Apr; 77 (4): 1857–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Baudin F, Bach C, Cusack S, Ruigrok RW. Структура РНП вируса гриппа. I. Нуклеопротеин вируса гриппа плавит вторичную структуру в РНК-ручке и подвергает основания действию растворителя. EMBO J. 1994 1 июля; 13 (13): 3158–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Compans RW, Content J, Duesberg PH. Структура рибонуклеопротеина вируса гриппа. Дж Вирол. 1972 г., октябрь; 10 (4): 795–800. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Мурти К.Г., Вебстер Р.Г., Джонс И.М. Локализация РНК-полимераз на рибонуклеопротеинах вируса гриппа с помощью мечения иммунозолотом. Вирусология. 1988 г., июнь; 164 (2): 562–6. [PubMed] [Google Scholar]
16. Pappas C, Aguilar PV, Basler CF, Solorzano A, Zeng H, Perrone LA, et al. Одногенные реассортанты определяют критическую роль PB1, HA и NA в высокой вирулентности 1918 пандемический вирус гриппа. Proc Natl Acad Sci U S A. 2008 Feb 26;105(8):3064–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Одногенные реассортанты определяют критическую роль PB1, HA и NA в высокой вирулентности 1918 пандемический вирус гриппа. Proc Natl Acad Sci U S A. 2008 Feb 26;105(8):3064–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Tumpey TM, Basler CF, Aguilar PV, Zeng H, Solorzano A, Swayne DE, et al. Характеристика реконструированного вируса пандемии испанского гриппа 1918 года. Наука. 2005 г., 7 октября; 310 (5745): 77–80. [PubMed] [Google Scholar]
18. Ахмед Р., Олдстоун М.Б., Палезе П. Защитный иммунитет и восприимчивость к инфекционным заболеваниям: уроки пандемии гриппа 1918 года. Нат Иммунол. 2007 ноябрь; 8 (11): 1188–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Couceiro JN, Paulson JC, Baum LG. Штаммы вируса гриппа избирательно распознают сиалилоолигосахариды на респираторном эпителии человека; роль клетки-хозяина в выборе специфичности рецептора гемагглютинина. Вирус Рез. 1993 г., август; 29 (2): 155–65. [PubMed] [Google Scholar]
20. Матросович М.Н., Матросович Т.Ю., Грей Т., Робертс Н.А., Кленк Х.Д. Вирусы гриппа человека и птиц нацелены на разные типы клеток в культурах эпителия дыхательных путей человека. Proc Natl Acad Sci U S A. 30 марта 2004 г .; 101 (13): 4620–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Матросович М.Н., Матросович Т.Ю., Грей Т., Робертс Н.А., Кленк Х.Д. Вирусы гриппа человека и птиц нацелены на разные типы клеток в культурах эпителия дыхательных путей человека. Proc Natl Acad Sci U S A. 30 марта 2004 г .; 101 (13): 4620–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Беар А.С., Вебстер Р.Г. Репликация вирусов птичьего гриппа в организме человека. Арх Вирол. 1991;119(1–2):37–42. [PubMed] [Google Scholar]
22. Murphy BR, Hinshaw VS, Sly DL, London WT, Hosier NT, Wood FT, et al. Вирулентность вирусов птичьего гриппа А для беличьих обезьян. Заразить иммун. 1982 г., сен; 37 (3): 1119–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Tian SF, Buckler-White AJ, London WT, Reck LJ, Chanock RM, Murphy BR. Гены нуклеопротеинов и мембранных белков связаны с ограничением репликации вируса гриппа A/Mallard/NY/78 и его реассортантов в дыхательных путях беличьих обезьян. Дж Вирол. 1985 марта; 53 (3): 771–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Gambotto A, Barratt-Boyes SM, de Jong MD, Neumann G, Kawaoka Y. Заражение человека высокопатогенным вирусом гриппа H5N1. Ланцет. 2008 г., 26 апреля; 371 (9622): 1464–75. [PubMed] [Google Scholar]
Gambotto A, Barratt-Boyes SM, de Jong MD, Neumann G, Kawaoka Y. Заражение человека высокопатогенным вирусом гриппа H5N1. Ланцет. 2008 г., 26 апреля; 371 (9622): 1464–75. [PubMed] [Google Scholar]
25. Wilson IA, Skeheel JJ, Wiley DC. Структура гликопротеина мембраны гемагглютинина вируса гриппа при разрешении 3 А. Природа. 1981 г., 29 января; 289 (5796): 366–73. [PubMed] [Google Scholar]
26. Webster RG, Laver WG, Air GM. Антигенная изменчивость среди вирусов гриппа типа А. В: Palese P, Kingsbury DW, редакторы. Генетика вирусов гриппа. Вена: Springer-Verlag; 1983. стр. 127–68. [Google Scholar]
27. Штайнхауэр Д.А. Роль расщепления гемагглютинина в патогенности вируса гриппа. Вирусология. 1999 г., 25 мая; 258 (1): 1–20. [PubMed] [Google Scholar]
28. Sieczkarski SB, Whittaker GR. Вирусный вход. Курр Топ Микробиол Иммунол. 2005; 285:1–23. [PubMed] [Google Scholar]
29. Стегманн Т. Механизмы слияния мембран: парадигма гемагглютинина гриппа и ее значение для внутриклеточного слияния.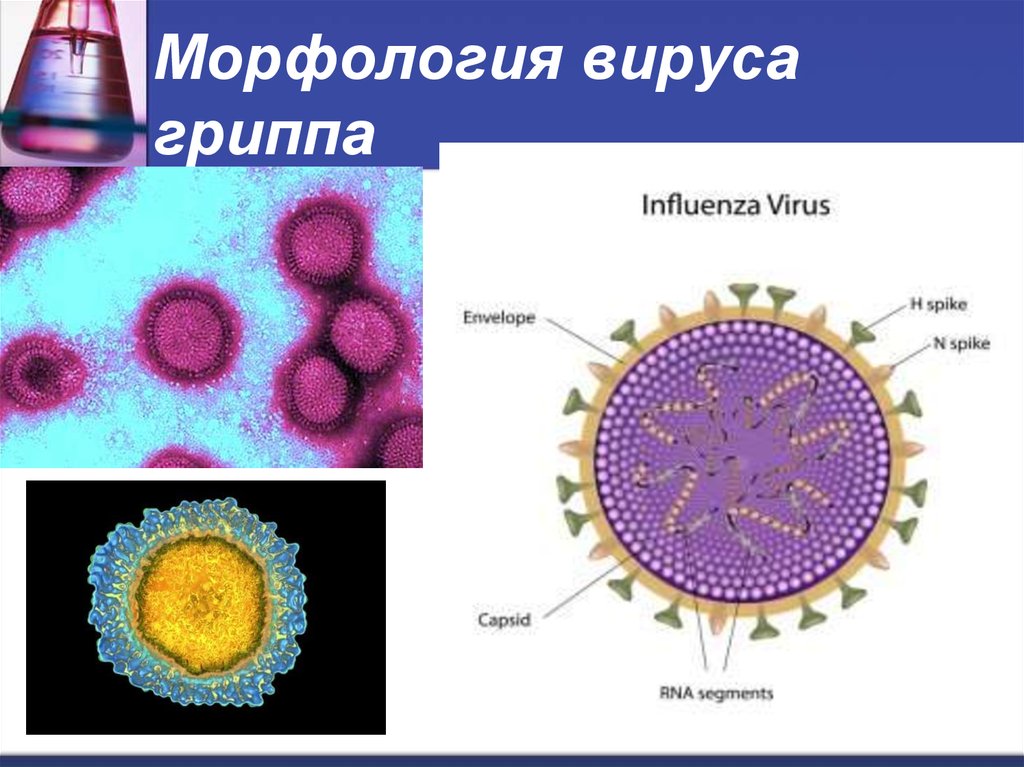 Трафик. 2000 г., август; 1 (8): 598–604. [PubMed] [Академия Google]
Трафик. 2000 г., август; 1 (8): 598–604. [PubMed] [Академия Google]
30. Пинто Л.Х., Холсингер Л.Дж., Лэмб Р.А. Белок М2 вируса гриппа обладает активностью ионного канала. Клетка. 1992 г., 1 мая; 69 (3): 517–28. [PubMed] [Google Scholar]
31. Wharton SA, Belshe RB, Skeheel JJ, Hay AJ. Роль белка вириона М2 в снятии оболочки вируса гриппа: специфическое снижение скорости слияния мембран между вирусом и липосомами амантадином. Джей Ген Вирол. 1994 г., апрель 75 (часть 4): 945–8. [PubMed] [Google Scholar]
32. Neirynck S, Deroo T, Saelens X, Vanlandschoot P, Jou WM, Fiers W. Универсальная вакцина против гриппа А на основе внеклеточного домена белка M2. Нат Мед. 1999 октября; 5 (10): 1157–1163. [PubMed] [Google Scholar]
33. Слепушкин В.А., Кац Дж.М., Блэк Р.А., Гэмбл В.К., Рота П.А., Кокс Н.Дж. Защита мышей от заражения вирусом гриппа А путем вакцинации белком М2, экспрессируемым бакуловирусом. вакцина. 1995;13(15):1399–402. [PubMed] [Google Scholar]
34. Мартин К., Хелениус А. Транспорт поступающих нуклеокапсидов вируса гриппа в ядро. Дж Вирол. 1991 г., январь; 65 (1): 232–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мартин К., Хелениус А. Транспорт поступающих нуклеокапсидов вируса гриппа в ядро. Дж Вирол. 1991 г., январь; 65 (1): 232–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Cros JF, Palese P. Перемещение вирусной геномной РНК в ядро и из ядра: вирусы гриппа, болезни Тогото и Борна. Вирус Рез. 2003 Сентябрь; 95(1–2):3–12. [PubMed] [Google Scholar]
36. Li X, Palese P. Характеристика сигнала полиаденилирования РНК вируса гриппа. Дж Вирол. 1994 г., февраль; 68 (2): 1245–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Luo GX, Luytjes W, Enami M, Palese P. Сигнал полиаденилирования РНК вируса гриппа включает участок уридинов, за которым следует дуплекс РНК в виде ручки-попрошайки. Дж Вирол. 1991 июнь; 65 (6): 2861–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Robertson JS, Schubert M, Lazzarini RA. Сайты полиаденилирования мРНК вируса гриппа. Дж Вирол. 1981 апреля; 38 (1): 157–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Круг РМ. Праймирование транскрипции РНК вируса гриппа кэпированными гетерологичными РНК. Курр Топ Микробиол Иммунол. 1981; 93: 125–49. [PubMed] [Google Scholar]
Круг РМ. Праймирование транскрипции РНК вируса гриппа кэпированными гетерологичными РНК. Курр Топ Микробиол Иммунол. 1981; 93: 125–49. [PubMed] [Google Scholar]
40. Bancroft CT, Parslow TG. Доказательства сегментно-неспецифической упаковки генома вируса гриппа А. Дж Вирол. 2002 г., июль; 76 (14): 7133–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Duhaut SD, Dimmock NJ. Дефектные РНК сегмента 1, которые препятствуют продукции инфекционного вируса гриппа А, требуют не менее 150 нуклеотидов 5′-последовательности: свидетельство системы, управляемой плазмидами. Джей Ген Вирол. 2002 г., февраль; 83 (часть 2): 403–11. [PubMed] [Академия Google]
42. Enami M, Sharma G, Benham C, Palese P. Вирус гриппа, содержащий девять различных сегментов РНК. Вирусология. 1991 ноябрь; 185 (1): 291–8. [PubMed] [Google Scholar]
43. Fujii Y, Goto H, Watanabe T, Yoshida T, Kawaoka Y. Селективное включение сегментов РНК вируса гриппа в вирионы. Proc Natl Acad Sci U S A.