Хирургическая диагностика диффузных поражений легких и внутригрудных лимфаденопатий. Состояние вопроса | Мотус И.Я., Баженов А.В., Раевская Н.В., Цвиренко А.С., Басыров Р.Т.
В статье приводится состояние вопроса хирургической диагностики диффузных поражений легких и внутригрудных лимфаденопатий
Введение
Диффузные поражения легких (ДПЛ) и внутригрудные лимфаденопатии (ЛАП) – обширная группа самых различных по этиологии болезней, диагностика которых является комплексным процессом, включающим клинические, лучевые, лабораторные исследования. Диагностические технологии в последние годы развиваются чрезвычайно динамично, но в то же время результат биопсии остается если не основой диагноза, то, во всяком, случае важнейшим фактором в его построении.В настоящей работе мы попытались осмыслить результаты биопсийных исследований в этом направлении, сделать некоторые выводы и наметить перспективы дальнейшей работы.
Материал и методы
В исследование включены 558 пациентов с синдромом ДПЛ/ЛАП, направленных в клиники Уральского НИИ фтизиопульмонологии с целью морфологической верификации патологического процесса и установления диагноза. Схема обследования была следующей. После общеклинического обследования выполнялась компьютерная томография (КТ), задачей которой было уточнить локализацию поражения (легкие/лимфатические узлы/средостение) и наметить путь биопсийной диагностики по принципу «от простого к сложному».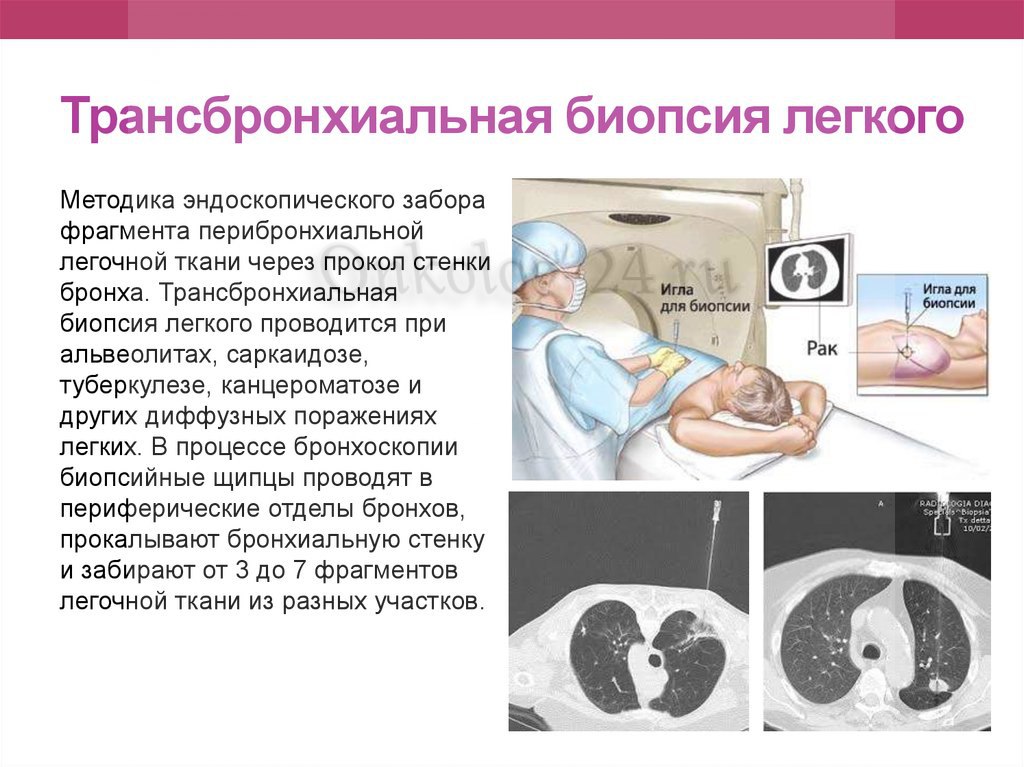
Отсутствие в биоптате информативного материала являлось показанием к применению хирургических методов диагностики. Выбор конкретного метода хирургической диагностики осуществляли на основании синдромного принципа.
1. При увеличении лимфатических узлов центрального средостения и отсутствии признаков ДПЛ – медиастиноскопию по Карленсу.
2. При увеличении лимфатических узлов центрального средостения и наличии признаков ДПЛ – парастернальную медиастиноплевроскопию (ПМС), либо видеоторакоскопию (ВТС).
3. При увеличении лимфатических узлов переднего средостения – ПМС.
4. При наличии симптомов ДПЛ без признаков ЛАП – ВТС или открытую биопсию легкого (ОБЛ).
Не будем вдаваться в детали хирургической техники вышеперечисленных вмешательств, поскольку это описано в соответствующих руководствах [1, 2]. Остановимся лишь на некоторых деталях, представляющихся нам существенными в рассматриваемой проблеме.
Что предпочесть при увеличении лимфатических узлов центрального средостения и наличии признаков ДПЛ? При ПМС доступны биопсии передние и верхние бронхопульмональные, а также трахеобронхиальные лимфатические узлы, но зона биопсии легкого ограничена медиальными сегментами.
При лимфопролиферативных опухолевых процессах поражение практически всегда начинается с передних медиастинальных лимфатических узлов. Если опухоль прилегает к грудной стенке, методом выбора является пункционная биопсия под УЗ-контролем. В остальных случаях пункции выполняют под контролем КТ. Внедрение данного метода биопсии позволяет в большинстве случаев избежать хирургических методов диагностики. Это особенно важно при таком осложнении данных заболеваний, как синдром медиастинальной компрессии. Пункция здесь практически безопасна, в то время как хирургические методы диагностики неизбежно усугубляют компрессию и могут привести к тяжелым осложнениям. Критерии, по которым мы считаем применение хирургических методов диагностики недопустимым, включают выраженный синдром верхней полой вены и сдавление трахеи и/или главных бронхов более чем на 1/3.
Результаты
ТББЛ выполнена у 378 пациентов. Информативность ее при ДПЛ представлена в таблице 1.В таблице 2 представлены результаты хирургических методов диагностики при синдроме ДПЛ/ЛАП. Всего выполнено 117 операций (медиастиноскопии по Карленсу – 33, ПМС – 39, ВТС – 34, ОБЛ – 11).
В таблице 3 приведены результаты биопсийной диагностики заболеваний, поражающих лимфатические узлы переднего средостения. Информативный материал, обеспечивающий постановку морфологического диагноза, был получен во всех случаях.
Осложнения отмечены в 17 (3,0%) случаях среди всех пациентов, включенных в исследование.
 Травматический пневмоторакс случился у 11 (2,9%) пациентов после ТББЛ и у 3-х (2,6%) – после хирургических методов диагностики. Во всех случаях пневмоторакс был ликвидирован путем консервативных мероприятий (покой, наблюдение, пункция). В 3-х случаях после ПМС при медиастинальных лимфомах, осложненных синдромом медиастинальной компрессии, имело место нарастание компрессии с угрожающими расстройствами дыхания и невозможностью экстубации. Осложнения купировались введением 0,8–1,0 циклофосфана, что приводило к быстрой регрессии, компрессии и благополучному исходу.
Травматический пневмоторакс случился у 11 (2,9%) пациентов после ТББЛ и у 3-х (2,6%) – после хирургических методов диагностики. Во всех случаях пневмоторакс был ликвидирован путем консервативных мероприятий (покой, наблюдение, пункция). В 3-х случаях после ПМС при медиастинальных лимфомах, осложненных синдромом медиастинальной компрессии, имело место нарастание компрессии с угрожающими расстройствами дыхания и невозможностью экстубации. Осложнения купировались введением 0,8–1,0 циклофосфана, что приводило к быстрой регрессии, компрессии и благополучному исходу.Обсуждение
Говоря о данной проблеме, следует начать с того, что постановка диагноза при ДПЛ – это комплексный процесс, в котором наряду с результатом морфологического исследования должны учитываться и другие характеристики, а именно: клинические, лучевые, иммунологические, функциональные. Соответственно в диагностическом процессе необходимо участие специалистов по всем перечисленным разделам диагностики. Это положение относится в первую очередь к группе идиопатических интерстициальных пневмоний (ИИП), где отсутствуют четкие морфологические признаки каждого варианта заболевания, а стремление к получению биоптата большего объема либо к повторным биопсиям не всегда оправдано у этой достаточно тяжелой группы больных. Кроме того, показано, что изменения в паренхиме легких при ИИП имеют неоднородный характер, и у одного и того же пациента могут быть разные варианты ИИП [3]. Согласительная комиссия ATS/ERS [4] предложила использовать рентгенологические критерии для определения вероятного диагноза без биопсии легких [4–9]. Из этих же соображений предлагают ставить диагноз ИИП «от противного», т. е. путем исключения других интерстициальных заболеваний, вызванных известными причинами [4–6]. Заметим, однако, что для надежного исключения указанных заболеваний требуется опять-таки биопсия. В этой связи актуален вопрос об адекватности минимально инвазивных и, следовательно, наименее травматичных методов биопсии, таких как трансбронхиальные и трансторакальные игловые биопсии и ТББЛ. Но данные методы биопсии приносят, как известно, наименьший объем биоптата. Как видно из таблицы 1, самая высокая информативность (90,2%) ТББЛ имела место при карциноматозе легких. Аналогичные цифры приводятся другими авторами [10]. Можно считать, что проблема верификации злокачественных ДПЛ решается с помощью ТББЛ достаточно успешно. Об этом говорит также и то, что на хирургическую диагностику поступало сравнительно мало больных с направительным диагнозом «карциноматоз».
В этой связи актуален вопрос об адекватности минимально инвазивных и, следовательно, наименее травматичных методов биопсии, таких как трансбронхиальные и трансторакальные игловые биопсии и ТББЛ. Но данные методы биопсии приносят, как известно, наименьший объем биоптата. Как видно из таблицы 1, самая высокая информативность (90,2%) ТББЛ имела место при карциноматозе легких. Аналогичные цифры приводятся другими авторами [10]. Можно считать, что проблема верификации злокачественных ДПЛ решается с помощью ТББЛ достаточно успешно. Об этом говорит также и то, что на хирургическую диагностику поступало сравнительно мало больных с направительным диагнозом «карциноматоз». ТББЛ, по нашим данным, обеспечивает материал, достаточный для постановки диагноза в 60,9% случаев, другие авторы приводят более высокую результативность за счет сочетания ТББЛ и бронхоальвеолярного лаважа – 82,9% [10]. Следовательно, около трети пациентов с клинико-рентгенологическим диагнозом «саркоидоз» будут нуждаться в хирургических методах диагностики. В случаях ЛАП без поражения легочной ткани достаточно выполнения медиастиноскопии по Карленсу.
Всегда ли нужна биопсия легкого?
Этот вопрос решается индивидуально. Для уточнения стадии заболевания это целесообразно, особенно, если клинико-рентгенологическая картина отличается от типичной.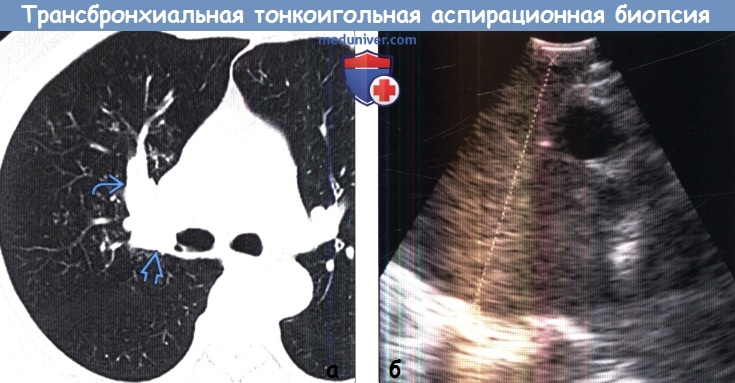 С другой стороны, современные методы лучевой диагностики, в частности КТ высокого разрешения, выявляют поражения паренхимы легких с высокой точностью и на ранних стадиях. Следовательно, в случаях, когда хирургическая биопсия легкого по каким-либо причинам представляет риск, ее можно избежать.
С другой стороны, современные методы лучевой диагностики, в частности КТ высокого разрешения, выявляют поражения паренхимы легких с высокой точностью и на ранних стадиях. Следовательно, в случаях, когда хирургическая биопсия легкого по каким-либо причинам представляет риск, ее можно избежать. При синдроме ДПЛ могут применяться два варианта диагностической операции: видеоторакоскопия и открытая биопсия легкого через торакотомный доступ. В работе Miller et al. [11] путем сравнения рандомизированных групп больных не выявлено каких-либо преимуществ того или иного из вышеупомянутых способов. Технический прогресс и накапливающийся опыт хирургов скорее всего решат этот вопрос в пользу ВТС.
Хирургическая эндоскопическая диагностика при медиастинальных лимфомах технических сложностей не представляет, за исключением случаев медиастинальной компрессии, когда мы наблюдали осложнения, описанные выше. Внедрение пункционных биопсий под контролем УЗ и КТ с иглами, позволяющими получать «столбик» ткани, практически вытеснило медиастиноскопию и существенно упростило диагностический процесс не в ущерб качеству диагностики. Данный факт также наглядно демонстрирует преимущества минимально инвазивных методик среди диагностических вмешательств.
Диагностические вмешательства, ведущие к излечению опосредованно, через установление правильного диагноза, безусловно, должны сопровождаться минимальным риском для пациента. Между тем сообщают о 4,4% летальности после ВТС-биопсий легкого у больных с ИИП [7]. Единственный способ избежать подобных неприятностей – тщательный выбор метода биопсии и правильная оценка риска предстоящей операции.
Выводы
1. Стратегия биопсийной диагностики при внутригрудных ЛАП и синдроме ДПЛ заключается в принципе «от простого к сложному», начиная с бронхологических и пункционных методов и заканчивая хирургическими методами диагностики. Показания к хирургическим методам возникают тогда, когда комплексная оценка данных обследования больного с ДПЛ, в т.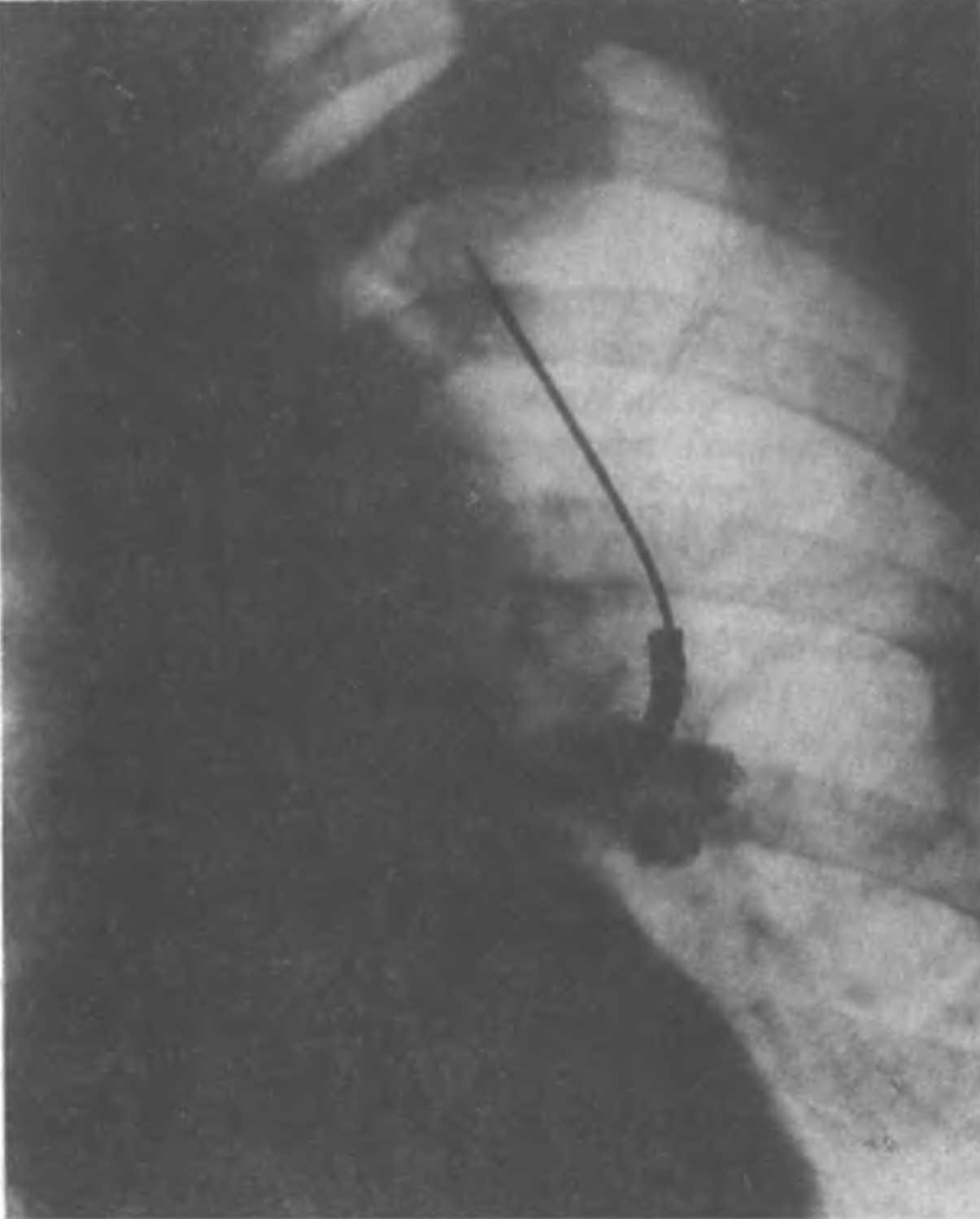 ч. заключение морфолога по биоптату, не приводит к диагнозу.
ч. заключение морфолога по биоптату, не приводит к диагнозу. 2. Диагноз саркоидоза и ИИП должен ставиться с учетом всех характеристик болезни: клинических, лучевых, лабораторных и морфологических.
3. Прогресс в биопсийной диагностике при синдромах ЛАП/ДПЛ должен идти по пути развития и совершенствования минимально инвазивных технологий, что повышает безопасность диагностических вмешательств не в ущерб их информативности.
.
The Bovine Lung in Biomedical Research: Visually Guided Bronchoscopy, Intrabronchial Inoculation and In Vivo Sampling Techniques
Ценности крупное животное Моделей в биомедицинских исследований
В современной междисциплинарной медико-биологических исследований, животные модели по-прежнему необходимы для выяснения сложных взаимодействий — связаны со здоровьем или статуса заболевания — в течение организмов млекопитающих. Несмотря +17 Нобелевских премий к присуждению ученых, которые изучали крупный рогатый скот, лошадей, овец или птицы в качестве моделей для биомедицинских исследований 1, в настоящее время подавляющее большинство экспериментов на животных проводятся с грызунами, а менее 1% исследований работают с домашними животными или животноводства.
Мелкие животные предлагают много практических преимуществ (то есть дешевые, генетическая пластичность, высокую пропускную способность, наличии многочисленных генетических и иммунологических инструменты и наборы), и генетически модифицированных мышиные модели, как правило, принимаются для выполнения механистические исследования обнаруживают, особые молекулярные пути. В медико-биологических исследований сложных систем, тон биологическое значение и клиническая эффективность моделей мышей становится все более и более сомнительной. Они могут вводить в заблуждение и несут риск упрощение биологического сложности 2-9.
Из-за особенностей межвидовых, ни один вид животных не будет полностью отражать человеческую ситуацию, а также использование более чем одной модели, кажется, быть полезным в междисциплинарной биомедицинских исследований подхода. В контексте трансляционной медицины, крупные животные предлагаем возможность служить сравнительные модели предоставления результатов с высокой биологической значимости двойного применения для здоровья человека и животных 1. Примечательно, что геном человека скорее напоминали по бычьей генома, чем геном лабораторных грызунов. Кроме того, недавно было подтверждено, что, по сравнению с других таксонов, геном мышей гораздо более переставить 10-12.
В контексте трансляционной медицины, крупные животные предлагаем возможность служить сравнительные модели предоставления результатов с высокой биологической значимости двойного применения для здоровья человека и животных 1. Примечательно, что геном человека скорее напоминали по бычьей генома, чем геном лабораторных грызунов. Кроме того, недавно было подтверждено, что, по сравнению с других таксонов, геном мышей гораздо более переставить 10-12.
В комплексе дизайна исследования, использование скота предлагает Uniqие возможность внутри отдельных долгосрочных исследованиях повторного сбора различных образцов в естественных условиях от одно-и-в-же индивида без ущерба для животного. Таким образом, функциональные, воспалительные и морфологические изменения можно отслеживать в этой же теме в течение определенного периода времени 13.
Легких крупного рогатого скота в качестве подходящего Респиратор модели
В связи с большим количеством существенных различий в легких анатомии, физиологии дыхания и легочной иммунологии, мыши не размножаются многие важные патофизиологические аспекты болезни легких человека. Это должно быть принято во внимание при использовании их в качестве моделей животных респираторных заболеваний 2,9,14-16. Хотя особенности анатомии и структуры существуют для каждого легкого млекопитающих, функциональные характеристики (т.е. объемы легких, воздушных потоков и дыхательных механика) лучше сопоставимы между взрослыми людьми и телят из-за подобных массы тела(50-100 кг).
Видоспецифических характеристик легких крупного рогатого скота можно резюмировать следующим образом: левое легкое состоит из двух долей (Lõbus cranialis, который разделен на два сегмента, и Лобус caudalis), в то время как правое легкое состоит из четырех лепестков (Лобус cranialis, Лобус мышца, Лобус caudalis и Лобус вспомогательный `орган). В отличие от легких анатомии большинства других млекопитающих, бронхов правых ветвей черепных лепестков непосредственно из правой боковой стороне трахеи. По отношению к subgross анатомии, легких крупного рогатого скота представляет высокую степень дольчатость и высокий процент интерстициальной ткани 17,18, ведущих к относительно низкой удельной податливости легких и более высокое сопротивление легочной ткани 19. Таким образом, требуется дыхание активность достаточно высока по сравнению с другими видами 20,21. Высокая степень дольчатость приводит к сильному независимости сегментов. Таким образом, инфlammatory процессы ограничивается соединительной ткани перегородками, и больные и здоровые сегменты часто лежат в пределах одной доли. В связи с отсутствием залоговых дыхательных путей, легких крупного рогатого скота особенно подходит для зеркалирования обструктивной дисфункции 13. Что касается сосудистой в легких крупного рогатого скота, маленькие легочные артерии показывают очень видных слоев гладких мышц. Таким образом, теленок может также служить солидной животной модели легочной гипертензии или ремоделирования сосудов 22-24.
По отношению к subgross анатомии, легких крупного рогатого скота представляет высокую степень дольчатость и высокий процент интерстициальной ткани 17,18, ведущих к относительно низкой удельной податливости легких и более высокое сопротивление легочной ткани 19. Таким образом, требуется дыхание активность достаточно высока по сравнению с другими видами 20,21. Высокая степень дольчатость приводит к сильному независимости сегментов. Таким образом, инфlammatory процессы ограничивается соединительной ткани перегородками, и больные и здоровые сегменты часто лежат в пределах одной доли. В связи с отсутствием залоговых дыхательных путей, легких крупного рогатого скота особенно подходит для зеркалирования обструктивной дисфункции 13. Что касается сосудистой в легких крупного рогатого скота, маленькие легочные артерии показывают очень видных слоев гладких мышц. Таким образом, теленок может также служить солидной животной модели легочной гипертензии или ремоделирования сосудов 22-24.
В отношении респираторных инфекций, встречающиеся в природе заболевания существуют в животноводстве, что много общего со сравнимой заболеваний человека. Типичными примерами являются туберкулез крупного рогатого скота 25, респираторно-синцитиальный вирус (RSV) инфекций у телят 26-28, или естественно приобретенные Chlamydia инфекции 29. Таким образом, крупные животные модели действительно очень напоминают ситуацию в естественной хозяина. Таким образом, они являются наиболее USEFул изучения хост-патогенных взаимодействия и сложную патофизиологию соответствующего заболевания людьми 30,31.
В биологически соответствующем модели респираторной инфекции Chlamydia psittaci, телята были выбраны, так как крупного рогатого скота представляют собой естественные хозяев за этого патогена 32-35. Информация, полученная из этой модели, по отношению к патогенезе заболевания или возможных путей передачи между животными и людьми, поможет расширить наши знания с ударом для обоих крупного рогатого скота и человека. Модель также может помочь проверить общепринятые и альтернативные терапевтические возможности для ликвидации легочной C. psittaci инфекции, которые, опять же, из интереса как к ветеринарному и медицине.
Модель также может помочь проверить общепринятые и альтернативные терапевтические возможности для ликвидации легочной C. psittaci инфекции, которые, опять же, из интереса как к ветеринарному и медицине.
Методы, применяемые к и образцы получены из бычьего дыхательной системы
Эта статья описывает и иллюстрирует методы и методы диагностики applicablе в легких крупного рогатого скота и использовали в нашей модели для оценки обоих эффектов патогена на легких млекопитающих и эффективности терапевтического вмешательства.
Бронхоскопия была выполнена в медицине с 1960 года и считается безопасной процедурой 36. В телят, экспериментальный бронхоскопии был описан в 1968 году впервые 37. Внутрибронхиального применение патогенов была предложена Potgieter соавт., Как надежный способ вызвать заболевание нижних дыхательных путей у телят 38 и в настоящее время является распространенным методом в коровьем исследования 34,39,40. Внутрибронхиального прививка определенного количества патогена под контролем видеоэндоскопических позволяет для селективного размещения инфекционного агента в легких. Это приводит к последовательной клинических и патологических у всех животных 34 и позволяет целевой выборки регионов легких, как ожидается, будут изменены из-за воздействия болезнетворных микроорганизмов.
жидкости бронхоальвеолярного лаважа (БАЛ) является хорошо описано показателем присутствия и тяжести воспаления легких. Бронхоальвеолярного лаважа (БАЛ) является стандартной процедурой в медицине для диагностики различных заболеваний органов дыхания 41. В живой скот, БАЛ был введен Уилки и Маркхэм в конце семидесятых годов прошлого века 42. Считалось безопасным и повторяемые методика исследования нижних дыхательных путей крупного рогатого скота. В связи с отсутствием достаточных данных о параметрах БАЛ у здоровых животных, в 1988 Прингл и др.. Выполняемой БАЛ на здоровых телят с гибкий волоконно-оптический бронхоскоп. Авторы также отметили необходимость стандартизировать протоколы БАЛ в экспериментальных условиях на приобретение сопоставимые результаты 43. БАЛ до сих пор используется в качестве в естественных условиях выборочного метода у телят 44-46.
Авторы также отметили необходимость стандартизировать протоколы БАЛ в экспериментальных условиях на приобретение сопоставимые результаты 43. БАЛ до сих пор используется в качестве в естественных условиях выборочного метода у телят 44-46.
Бронхиальная щеткой обычно используется в медицине какдиагностический инструмент, чтобы пробовать опухолевые поражения или для микробиологического анализа 36. Для исследовательских целей, первичных клеточных культур из эпителиальных клеток, полученных путем цитологического щеткой можно получить 47. У крупного рогатого скота, использование бронхиальных втулками для микробиологического анализа было описано охарактеризовать микробную среду легких 43.
Трансбронхиальная биопсия легкого предоставляет образцы легочной ткани и является ценным диагностическим инструментом для диффузного заболевания легких у людей. Ятрогенная пневмоторакс и порядок связанных кровоизлияния являются осложнения, связанные с этой техникой. Их частота, как сообщается, менее одного процента в человеческих пациентов 48. Трансбронхиальная биопсия легкого не является общим методом для использования в крупного рогатого скота, из-за высокой стоимости оборудования, необходимого и времени, необходимого для получения биопсии. Вместо этого, чрескожные биопсии легких более удобны в полевых условиях 49-51.
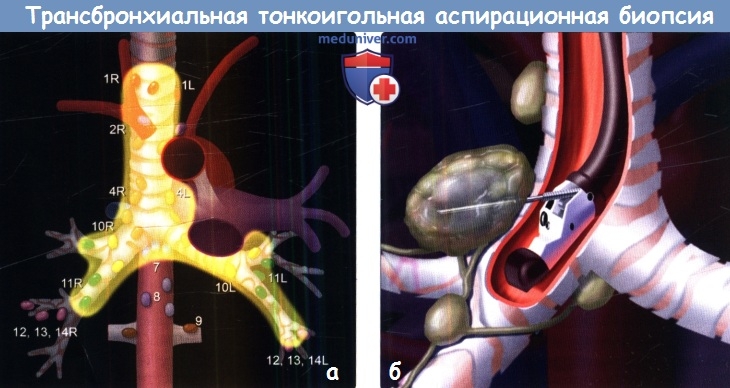
Эндобронхиальная ультрасонография с трансбронхиальной аспирационной тонкоигольной биопсией лимфатических узлов средостения
Сехниаидзе Д.Д.1, Петров В.Г.2, Десятов Е.Н.1, Зуев В.Ю.1, Синяков А.Г.1
1) ГБУЗ ТО Областной онкологический диспансер, г. Тюмень, Россия
2) Тюменская государственная медицинская академия, г. Тюмень, Россия
Опубликовано: Журнал «Онкохирургия», 2013, том 5, №3.
Эндобронхиальная ультрасонография с трансбронхиальной аспирационной тонкоигольной биопсией лимфатических узлов средостения (ЭБУС ТАБ) – новая технология, применяемая в диагностике лимфаденопатий средостения, в течение года в Тюменском областном онкологическом диспансере произведено 26 ЭБУС ТАБ пациентам с лимфаденопатиями средостения. Верификация достигнута у 21 больного. Чувствительность метода составила 81%, специфичность 100%. ЭБУС ТАБ является эффективным, малоинвазивным и безопасным методом морфологической верификации при лимфаденопатиях средостения.
Верификация достигнута у 21 больного. Чувствительность метода составила 81%, специфичность 100%. ЭБУС ТАБ является эффективным, малоинвазивным и безопасным методом морфологической верификации при лимфаденопатиях средостения.
Цель работы: оценить эффективность эндобронхиальной ультрасонографии с трансбронхиальной аспирационной тонкоигольной биопсией лимфатических узлов средостения (ЭБУС ТАБ) в морфологической верификации лимфаденопатий средостения (ЛАПС).
Материал и методы. В работе оцениваются результаты проведенных ЭБУС ТАБ 26 пациентам за период c 2011 по 2012 годы. В исследование вошли 20 мужчин и 6 женщин. Средний возраст составил 59,32 лет (44-79 лет). Большинство исследований (21) проведено больным раком легкого с целью определения стадии заболевания. 5 больным исследование выполнено в связи с подозрением на лимфому и саркоидоз. Средний размер пунктированных лимфатических узлов в исследуемой группе пациентов составил 22±11,5 мм.
У первых двух больных ЭБУС ТАБ выполняли под местной анестезией, у остальных (24) применяли метод комбинированной бронхоскопии в условиях операционной под общей анестезией с высокочастотной ИВЛ. Осложнений ЭБУС ТАБ не наблюдали.
Результаты. Из 26 пациентов, подвергнутых ЭБУС ТАБ, поражение лимфатических узлов верифицировано у 21. У пяти получен отрицательный результат. Анализ отрицательных результатов показал, что у двух больных ЭБУС ТАБ выполняли под местной анестезией, у двух в связи с производственной необходимостью была замена ассистента и только одно наблюдение не имеет косвенного влияния «человеческого фактора». Все эти больные оперированы, и у всех пяти диагноз подтвержден морфологически.
Получены следующие морфологические структуры: плоскоклеточный рак – 13, аденокарцинома – 3, бронхиолоальвеолярный рак – 1, мелкоклеточный рак – 3, недифференцированный рак – 1, саркоидоз – 3, неспецифическая гиперплазия ЛУ на фоне ХОБЛ – 1.
Нами проанализирована точность морфологической диагностики метастатического поражения лимфатических узлов средостения согласно классификации T. Naruke: 4R (n=10), 4L (n=4), 7 (n=10), 10R (n=1), 10L (n=1). Четыре ложноотрицательных результата из пяти были получены при исследовании лимфатических узлов 7 группы.
Выводы. ЭБУС ТАБ является малоинвазивным, эффективным и безопасным методом морфологической верификации при ЛАПС. Специфичность метода составляет 100%, чувствительность – 81%. Это позволяет рекомендовать ЭБУС ТАБ для морфологической верификации ЛАПС в качестве рутинного метода инвазивной диагностики в предоперационном обследовании больных раком легкого.
Ключевые слова: лимфаденопатия средостения; эндобронхиальная ультрасонография; трансбронхиальная биопсия лимфатических узлов средостения.
Лимфаденопатия средостения (ЛАПС) – термин, объединяющий увеличение лимфатических узлов средостения различной этиологии. Важнейшим вопросом ЛАПС является морфологическая верификация процесса, которая позволяет установить диагноз и назначить соответствующее лечение [2]. Особую актуальность имеет верификация ЛАПС при раке легкого, т.к. наличие метастазов в лимфатических узлах (ЛУ) средостения ухудшает прогноз заболевания и определяет тактику лечения. Получение материала из ЛУ средостения – непростая задача ввиду их анатомической локализации. Предложено несколько методов биопсии ЛУ средостения: диагностическая торакотомия, диагностическая видеоторакоскопия, передняя медиастинотомия, медиастиноскопия. Все эти методы являются хирургическими операциями, травматичны в большей или меньшей степени и несут в себе риск развития осложнений. Кроме того, описанные оперативные вмешательства имеют ограничения в биопсии некоторых групп ЛУ. Так, при диагностической видеоторакоскопии, торакотомии, передней медиастинотомии затруднена или невозможна оценка контрлатеральных ЛУ, при медиастиноскопии недоступны ЛУ корней легких. В связи с вышеуказанными недостатками интенсивное развитие в последние годы получили эндоскопические методы биопсии ЛУ средостения, такие как эндобронхиальная ультрасонография с тонкоигольной аспирационной биопсией ЛУ (ЭБУС ТАБ) [1, 3-5]. Специфичность метода ЭБУС ТАБ, как и всех других инвазивных методов, составляет 100%. Это объясняется тем, что ложно-положительных ответов, принимая во внимание морфологическую верификацию процесса, быть не может. Чувствительность ЭБУС ТАБ, по данным литературы, находится в пределах 71,8 (1) – 95% (2) [7, 8].
В связи с вышеуказанными недостатками интенсивное развитие в последние годы получили эндоскопические методы биопсии ЛУ средостения, такие как эндобронхиальная ультрасонография с тонкоигольной аспирационной биопсией ЛУ (ЭБУС ТАБ) [1, 3-5]. Специфичность метода ЭБУС ТАБ, как и всех других инвазивных методов, составляет 100%. Это объясняется тем, что ложно-положительных ответов, принимая во внимание морфологическую верификацию процесса, быть не может. Чувствительность ЭБУС ТАБ, по данным литературы, находится в пределах 71,8 (1) – 95% (2) [7, 8].
Цель работы: оценить эффективность ЭБУС ТАБ в морфологической верификации ЛАПС.
Материал и методы
В исследование были включены 26 пациентов (20 мужчин и 6 женщин). Средний возраст составил 59,3 лет (44-79 лет). Большинство исследований (21) выполнено больным раком легкого с целью определения стадии заболевания. У 5 пациентов исследование выполнено в связи с подозрением на лимфому и саркоидоз. Всем пациентам была выполнена МСКТ грудной клетки. Показаниями для включения в исследование были: ЛАПС неясной этиологии и подозрение на метастатическое поражение ЛУ при раке легкого. К увеличенным относили ЛУ более 1 см в наименьшем измерении по данным МСКТ. Средний размер пунктированных ЛУ у исследуемой группы пациентов составил 22±11,5 мм (5-45). В работе использовали классификацию ЛУ средостения и легких, предложенную T. Naruke [6].
У первых двух больных ЭБУС ТАБ выполняли под местной анестезией. Для исключения психосоматических реакций (кашлевого рефлекса, панических атак и т.д.) у последующих 24 пациентов применяли метод комбинированной бронхоскопии в условиях операционной под общей анестезией с высокочастотной ИВЛ аппаратом Monsoon+ (Acutronic, Швейцария). В трахею устанавливали универсальный дыхательный бронхоскоп c тубусом 8,5 мм (Karl Storz, Германия), через который проводили гибкий конвексный ультразвуковой бронхоскоп BF-UC160F-OL8 (Olympus, Япония). Выполняли ультразвуковое и допплеровское исследование ЛУ средостения, магистральных сосудов и их взаиморасположения с частотой 7,5 МГц на ультразвуковом блоке EU-C60 (Olympus, Япония). После идентификации измененного ЛУ проводили пункцию УЗИ-позитивными иглами диаметром 22G NA-201SX-4022 (Olympus, Япония) (у 20 больных) и ECHO-HD-22-EBUS-0 (Cook, Ирландия) (у 6). Материал отправляли на цитологическое исследование.
Выполняли ультразвуковое и допплеровское исследование ЛУ средостения, магистральных сосудов и их взаиморасположения с частотой 7,5 МГц на ультразвуковом блоке EU-C60 (Olympus, Япония). После идентификации измененного ЛУ проводили пункцию УЗИ-позитивными иглами диаметром 22G NA-201SX-4022 (Olympus, Япония) (у 20 больных) и ECHO-HD-22-EBUS-0 (Cook, Ирландия) (у 6). Материал отправляли на цитологическое исследование.
Все ЭБУС ТАБ выполнял один специалист (Десятов Е.Н.). Осложнений ЭБУС ТАБ не наблюдали. При отрицательном результате ЭБУС ТАБ производили оперативные вмешательства с биопсией ЛУ средостения.
Результаты и обсуждение
ЭБУС ТАБ – новый метод аспирационной тонкоигольной биопсии ЛУ средостения, появившийся сравнительно недавно и зарекомендовавший себя информативным и безопасным эндоскопическим вмешательством. В МНИОИ им. П.А. Герцена метод применяют с 2008 г., в Областном онкологическом диспансере г. Тюмени – с 2011 г.
Из 26 пациентов, подвергнутых ЭБУС ТАБ, поражение ЛУ верифицировано у 21. У пяти больных получен отрицательный результат. Анализ отрицательных результатов показал, что все они были получены при первых 10 ЭБУС ТАБ. Это может быть связано с периодом освоения методики и накоплением личного опыта. У двух первых больных ЭБУС ТАБ выполняли под местной анестезией, что технически существенно затрудняло манипуляцию, поэтому в последующем ее производили под общей анестезией. У всех в пяти больных с отрицательными результатами ЭБУС ТАБ с целью окончательной морфологической верификации процессов в ЛУ были произведены диагностические оперативные вмешательства: у 2 выполнена видеоторакоскопия (ВТС) с биопсией ЛУ, у 3 – диагностические торакотомии, и у всех диагноз был подтвержден морфологически.
У остальных пациентов (21) при проведении ЭБУС ТАБ получен достаточный материал для морфологического исследования.
Морфологические заключения поражения ЛУ средостения, полученные при хирургических доступах и ЭБУС ТАБ у исследуемых пациентов, представлены в таблице 1.
Таблица 1. Морфологические заключения, полученные при хирургических доступах
и ЭБУС ТАБ у исследуемых пациентов (n=26).
| Морфологическое заключение | Общее количество морфологических верификаций процессов в ЛУ (n) | Верификация метастатического поражения ЛУ при ЭБУС ТАБ (n) | Чувствительность ЭБУС ТАБ (%) |
|---|---|---|---|
| Плоскоклеточный рак | 13 | 10 | 78 |
| Мелкоклеточный рак | 3 | 3 | 100 |
| Аденокарцинома | 4 | 4 | 100 |
| Недифференцированный рак | 1 | 1 | 100 |
| Саркоидоз | 4 | 3 | 75 |
| Неспецифическая гиперплазия на фоне ХОБЛ | 1 | 1 | 100 |
| Всего | 26 | 25 | 81 |
Таблица 2. Группы исследованных лимфатических узлов (n=26).
| Группа лимфатических узлов | Количество исследований (n) | Верификация диагноза методом ЭБУС ТАБ (n) |
Чувствительность метода (%) |
|---|---|---|---|
| 4R | 10 | 9 | 90 |
| 4L | 4 | 4 | 100 |
| 7 | 10 | 6 | 60 |
| 10R | 1 | 1 | 100 |
| 10L | 1 | 1 | 100 |
| Всего | 26 | 21 | 81 |
Из таблицы видно, что четыре ложноотрицательных результата из пяти были получены при исследовании ЛУ 7 группы.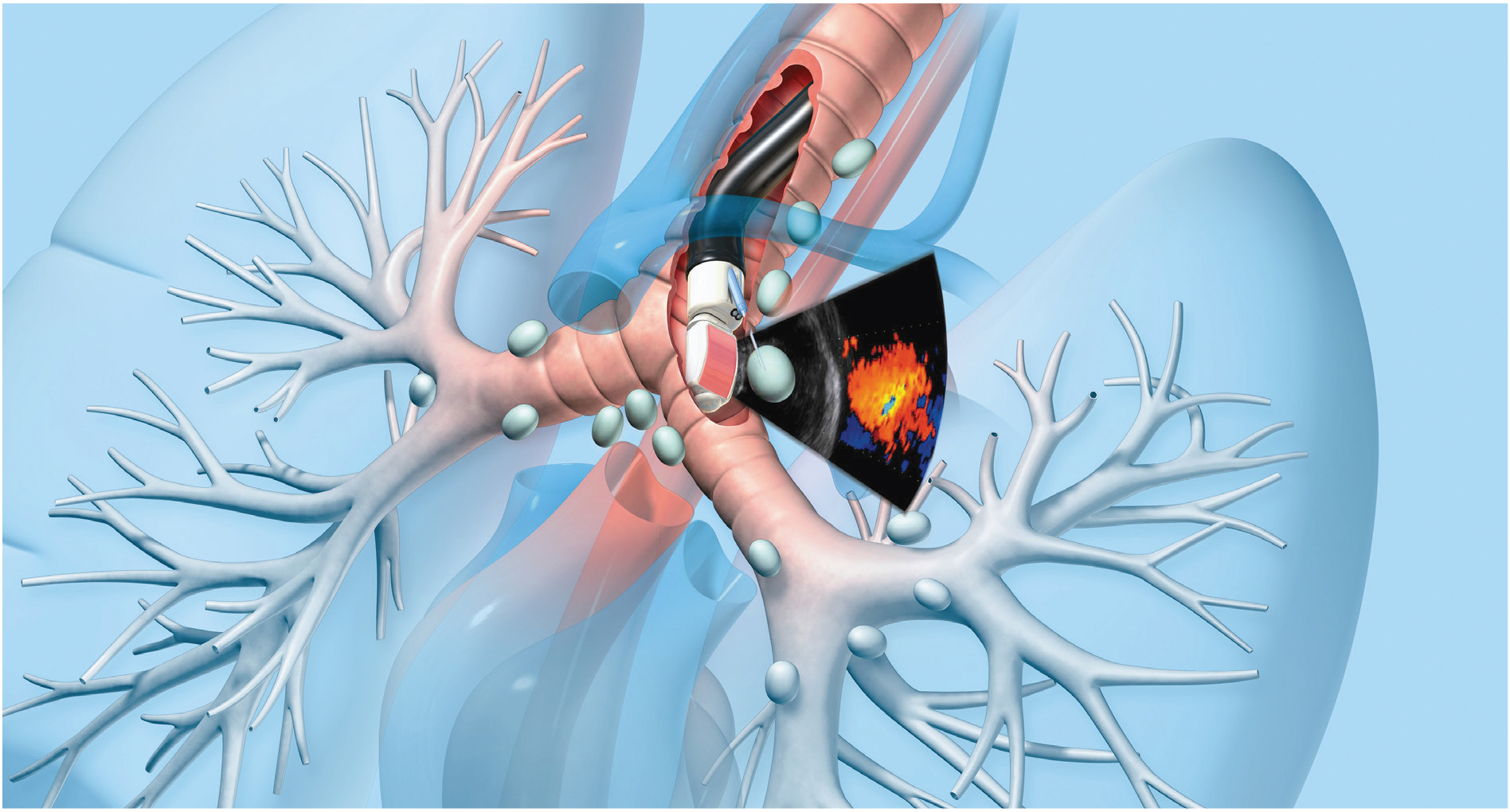 Несмотря на то, что эндоскопическим методам N-стадирования доступны все группы ЛУ легких, некоторые авторы отмечают снижение чувствительности при биопсии ЛУ левого легкого [8]. По нашим данным, при ЭБУС ТАБ левосторонних групп ЛУ чувствительность составила 100%.
Несмотря на то, что эндоскопическим методам N-стадирования доступны все группы ЛУ легких, некоторые авторы отмечают снижение чувствительности при биопсии ЛУ левого легкого [8]. По нашим данным, при ЭБУС ТАБ левосторонних групп ЛУ чувствительность составила 100%.
Выводы
ЭБУС ТАБ является малоинвазивным, эффективным и безопасным методом морфологической верификации при ЛАПС. Специфичность метода составляет 100%, чувствительность – 81%. Это позволяет рекомендовать ЭБУС ТАБ для морфологической верификации ЛАПС в качестве рутинного метода инвазивной диагностики в предоперационном обследовании больных раком легкого.
Литература
- Соколов В.В., Козакевич В.И., Телегина Л.В. Видеотрахеобронхологическое иссследование и эндотрахеобронхиальная ультрасонография. В кн.: Нейроэндокринные опухоли легких. Под ред. А.Х. Трахтенберга, В.И Чиссова, Г.А. Франка. М.: Практическая медицина, 2012: 80-5.
- Robinson LA, Ruckdeschel J, Wagner H, et al. Treatment of Non-small Cell Lung Cancer-Stage IIIA. ACCP Evidence-Based Clinical Practice Guidelines (2nd edition), 2007; 132: 243-65.
- Welter S, Cheufou D, Stamatis G. Lung Cancer Staging: What is the Actual Role of Mediastinoscopy? Zentralbl Chir 2012; 137(3): 242-7.
- Medford AR. Endobronchial ultrasound-guided transbronchial needle aspiration. Pol Arch Med Wewn 2010; 120: 459-66.
- Yasufuku K, Nakajima T, Fujiwara T, et al. Role of endobronchial ultrasound-guided transbronchial needle aspiration in the management of lung cancer. J Thor Cardiovasc Surg 2012; 56(6): 268-76.
- Naruke T, Suemasu K, Ischikawa S. Lymph node mapping and curability at various levels of metastasis in resected lung cancer. J Thor Cardiovasc Surg 1978; 76(1): 832-39.
- Ohnishi R, Yasuda I, Kato T, et al. Combined endobronchial and endoscopic ultrasound-guided fine needle aspiration for mediastinal nodal staging of lung cancer. Endoscopy 2011; 43(12): 1082-9.
- Lee BE, Kletsman E, Rutledge JR, et al. Utility of endobronchial ultrasound-guided mediastinal lymph node biopsy in patients with non-small cell lung cancer. J Thor Cardiovasc Surg 2012; 143(3): 585-90.
- Jhun BW Park HY, Jeon K, Koh WJ, Suh GY, Chung MP, Kim H, Kwon OJ, Han J, Um SW. Nodal stations and diagnostic performances of endobronchial ultrasound-guided transbronchial needle aspiration in patients with non-small cell lung cancer. J Korean Med Sci 2012; 27: 46-51.
Онкология
Ключевые слова: эндобронхиальная ультрасонография, периферические образования легких, трансбронхиальная биопсия.
© Е.С. Вакурова, М.И. Давыдов, Г.В. Унгиадзе, Б.К. Поддубный, О.В. Чистякова, К.Ю. Тополь, 2016
УДК 616-066.66, 616.24-006-07
Е.С. Вакурова, М.И. Давыдов, Г.В. Унгиадзе, Б.К. Поддубный, О.В. Чистякова, К.Ю. Тополь
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» МЗ РФ, г. Москва
Вакурова Елена Сергеевна ― кандидат медицинских наук, старший научный сотрудник отделения эндоскопического ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России
115478, г. Москва, Каширское шоссе, д. 23, тел.: (499) 324-62-09, +7-903-199-18-90, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Введение
Проблема диагностики злокачественных и доброкачественных опухолевых заболеваний легких является одной из актуальных в онкологии. Рак легкого в большинстве развитых стран продолжает оставаться наиболее распространенной злокачественной опухолью. В России, в структуре заболеваемости мужского населения, эта патология занимает 1-е ранговое место [1]. В мире рак легкого остается одной из основных причин смерти онкологических больных. В структуре собственно рака легкого особое место занимают периферические опухоли.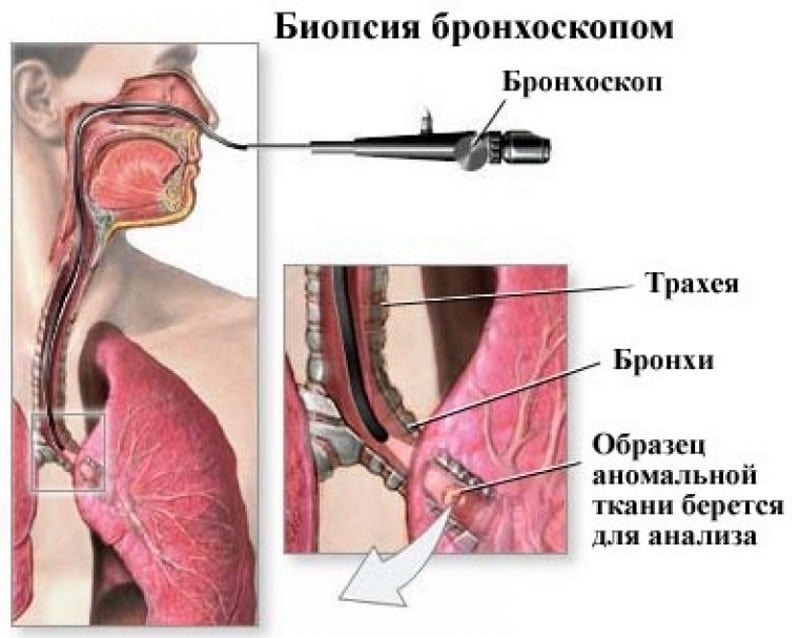
Периферический рак легких по данным компьютерной томографии характеризуются наличием шаровидного образования, локализующегося в легочной паренхиме. Длительное бессимптомное течение, отсутствие каких-либо патогномоничных признаков на начальном этапе заболевания делает раннюю диагностику исключительно сложной. Верификация периферических новообразований легких представляет сложную задачу, частично из-за их расположения, частично из-за небольшого размера. Эффективность эндоскопической трансбронхиальной биопсии легкого, выполняемой при бронхологическом исследовании даже при рентгеноскопическом контроле, не превышает 40% [3].
С внедрением эндосонографических радиальных датчиков стало возможным выполнение эндобронхиальной ультрасонографии (ЭБУС) с точным позиционированием и биопсией периферических образований легких. Однако показатели эффективности трансбронхиальных биопсий при ультразвуковой навигации, по данным разных авторов, значительно варьируют ― от 46 до 77% [4]. Чувствительность метода зависит от размеров опухоли и от местоположения ультразвукового зонда относительно опухоли. Так, при размере опухоли менее 10 мм чувствительность составляет 45%, от 10 до 30 мм ― 76%, свыше 30 мм ― 92%. При расположении ультразвукового зонда в области поражения диагноз верифицирован у 87% пациентов. Если зонд локализуется рядом с поражением ― верификация уменьшается до 42% [5].
Цель исследования ― изучить эффективность эндобронхиальной ультрасонографии в диагностике и морфологической верификации периферических образований легких.
Материал и методы
В анализ включено 114 пациентов, которым было выполнено эндобронхиальное ультразвуковое исследование с использованием радиального мини-зонда (ЭБУС) с частотой сканирования 20 МГц и направляющей оболочки. Исследование выполнено 45 женщинам и 69 мужчинам, средний возраст составил 61,8±12,2 лет. Перед исследованием определялось предполагаемая локализация образования на основании данных КТ или ПЭТ/КТ.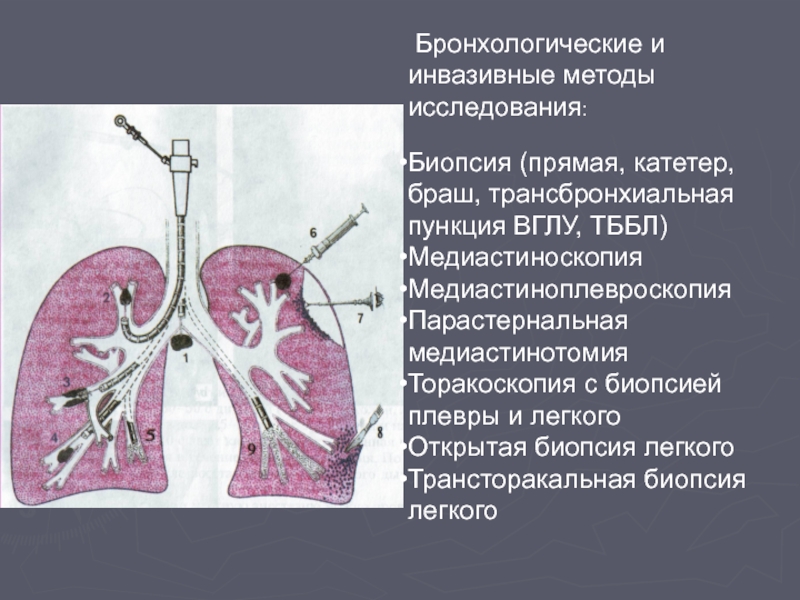 Локализация опухолевого процесса по сегментам представлена на рисунке 1. По данным литературы, периферические опухоли в большинстве случаев возникают в верхних долях, преимущественно в верхушечных, задних сегментах верхней доли, в верхушечных сегментах нижней доли, что объясняется особенностями аэродинамики и воздействиями внешних факторов на слизистую оболочку бронхиального дерева [2].
Локализация опухолевого процесса по сегментам представлена на рисунке 1. По данным литературы, периферические опухоли в большинстве случаев возникают в верхних долях, преимущественно в верхушечных, задних сегментах верхней доли, в верхушечных сегментах нижней доли, что объясняется особенностями аэродинамики и воздействиями внешних факторов на слизистую оболочку бронхиального дерева [2].
Всем пациентам ранее была выполнена диагностическая бронхоскопия с забором материала для морфологического исследования, который оказался недостаточно информативным. Характеристика больных, включенных в исследование, приведена в таблице 1.
Использовалось следующее оборудование: видеоэндоскопическая система EVIS EXERA II; универсальный эндоскопический ультразвуковой центр Olympus EUS-ME-1; гибкий волоконно-оптический бронхоскоп BF 1T-150; высокочастотный ультразвуковой механический радиальный мини-зондом UM-S20-20R с внешним диаметром 2.0 мм; направляющая оболочка из ПВХ; биопсийные шипцы и бронхиальная цитологическая щетка.
Исследование выполнялось под местной анестезией спреем лидокаина 10% (для анестезии слизистой оболочки полости носа и корня языка) и раствором лидокаина 2%. После осмотра бронхиального дерева в рабочий канал бронхоскопа проводился ультразвуковой мини-зонд с направляющей оболочкой (тубус-проводник). Осуществлялось последовательное сканирование субсегментарных бронхов, проходящих через опухолевое образование или максимально близко от него. При визуализации опухоли, ультразвуковой зонд извлекался, в направляющую оболочку проводился инструмент для биопсии. Забор материала для гистологического исследования осуществлялся посредством щипцовой биопсии, для цитологического исследования проводилась катетеризация с последующей аспирацией из целевого бронха и браш-биопсия. При выполнении эндобронхиального ультразвукового исследования производилась запись ультразвукового изображения.
Таблица 1. Характеристика больных
Характеристика больных
|
Параметр |
Значение |
|
Число пациентов |
114 |
|
Мужчины/женщины |
69/45 |
|
Средний возраст, лет |
61,8±12,2 |
|
Размеры образования, мм (данные КТ) максимальный минимальный |
38,4±19,5 29,0±16,0 |
|
Локализация образования верхняя доля правого легкого верхняя доля левого легкого нижняя доля правого легкого нижняя доля левого легкого средняя доля |
42 25 19 15 13 |
Рис. 1. Локализация опухолевого процесса по сегментам
Результаты
С помощью ЭБУС удалось визуализировать и определить местоположение патологического образования, далее выполнить щипцовую и браш-биопсию в 100 из 114 случаев. У 14 пациентов при ультразвуковом исследовании определить наличие опухолевого очага не удалось. Забор материала для цитологического исследования (аспирация и браш-биопсия) выполнен у 100 больных. У 63 пациентов из 100 выполнена щипцовая биопсия. Гистологическая верификация получена у 46 из 63 пациентов. В целом морфологическая верификация диагноза получена у 88 (88%) из 100 больных. Результаты морфологической верификации материала, полученного при эндоскопическом исследовании, подтверждены данными хирургических вмешательств с последующим исследованием операционного материала.
У 14 пациентов при ультразвуковом исследовании определить наличие опухолевого очага не удалось. Забор материала для цитологического исследования (аспирация и браш-биопсия) выполнен у 100 больных. У 63 пациентов из 100 выполнена щипцовая биопсия. Гистологическая верификация получена у 46 из 63 пациентов. В целом морфологическая верификация диагноза получена у 88 (88%) из 100 больных. Результаты морфологической верификации материала, полученного при эндоскопическом исследовании, подтверждены данными хирургических вмешательств с последующим исследованием операционного материала.
Результаты морфологической верификации представлены в таблице 2. Из таблицы видно, что первичный рак легкого диагностирован у 67 (67%) пациентов из 100. В большинстве случаев верифицирована аденокарцинома ― 37 человек, плоскоклеточный рак ― у 21, мелкоклеточный ― у 4, бронхоальвеолярный рак ― у 3, атипичный карциноид ― у 2. Метастатическое поражение легких выявлено у 13 (13%) пациентов, доброкачественные заболевания ― у 8 (8%). У 12 пациентов материал оказался не информативным по результатам цитологического и гистологического исследований.
Эффективность диагностики при использовании ЭБУС зависит размеров опухолевого образования, а также от расположения ультразвукового зонда по отношению к патологическому очагу. Результаты представлены в таблице 3. Так, при размерах очага больше 20 мм вероятность более четкой визуализации опухолевого очага и возможность выполнить забор материала для морфологического исследования значительно выше, чем при размерах опухоли менее 10 мм. При расположении ультразвукового датчика в центре очагового поражения, когда опухоль циркулярно прилежит к стенкам бронха и, возможно, на отдельных участках прорастает в слизистую оболочку бронха, эффективность диагностики при использовании ЭБУС также увеличивается (рис. 2-4). Осложнений во время проведения ЭБУС с биопсией (кровотечение, пневмоторакс) отмечено не было.
Таблица 2. Результаты морфологической верификации
Результаты морфологической верификации
|
Диагноз |
Количество |
|
Первичный рак легкого: Плоскоклеточный Аденокарцинома Мелкоклеточный рак Бронхоальвеолярный рак Атипичный карциноид Метастатическое поражение рака толстой кишки меланомы рака молочной железы рака шейки матки злокачественной фиброзной гистиоцитомы рака мочевого пузыря Доброкачественные заболевания Саркоидоз Туберкулез Гамартома Воспалительный инфильтрат Пневмосклероз Ретенционная киста Всего |
21 37 4 3 2
4 2 2 2 2 1
1 2 1 2 1 1 88 |
Таблица 3. Влияние эндосонографических параметров образований на информативность морфологической верификации
Влияние эндосонографических параметров образований на информативность морфологической верификации
|
Параметр |
Морфологическая верификация |
|
|
получена |
не получена |
|
|
Размер образования, мм до 10 (30/100) от 10-30 (45/100) больше 30 (25/100) |
21 37 23 |
9 8 2 |
|
Центральное положение датчика относительно образования (52/100) |
47 |
5 |
|
Краевое положение датчика относительно образования (48/100) |
34 |
14 |
Рис. 2. Пациент Л., 61 год. По данным КТ в S3 правого легкого опухоль неправильной формы 3,5х4,3 см с инфильтративным ростом и тяжами к костальной плевре и перибронхиальной инфильтрацией В3.
Рис. 3. Эндосонографическая картина периферической опухоли. Центральное положение мини-зонда относительно опухоли
Рис. 4. Цитологическое исследование ― аденокарцинома
Обсуждение
Проблема своевременной диагностики рака легкого наиболее актуальная в современной онкологии, так как у 70-80% первично выявленных больных заболевание диагностируется на III, IV стадиях, когда не представляется возможным применить радикальные методы лечения. Только 10-20% из вновь заболевших могут быть прооперированы, из них радикальная операция возможна у 70-80% больных. Все большее число отечественных и зарубежных онкологов, занимающихся проблемой рака легкого, приходят к выводу, что на сегодняшний день существенных сдвигов в улучшении результатов лечения рака легкого следует ожидать от совершенствования методов диагностики. Бронхоскопическое исследование позволяет не только оценить состояние бронхиального дерева, но и, что особенно важно, получить материал для морфологического изучения и установления гистологической структуры опухоли. Морфологическая верификация патологических образований имеет принципиально важное значение в выборе тактики лечения. Эндобронхиальная ультрасонография с последующей биопсией в последние годы занимает одно из ведущих мест в диагностике рака легкого [1, 6].
По нашим данным, суммарная информативность морфологической верификации эндобронхиального ультразвукового исследования с последующим забором материала, проведенного у 114 больных, составила 88%. В отделении эндоскопии продолжается работа по выполнению ЭБУС как с использованием направляющей оболочки, так и без нее.
Заключение
Эндобронхиальная ультрасонография является эффективным и безопасным методом контроля эндоскопической биопсии легкого при периферических образованиях легкого.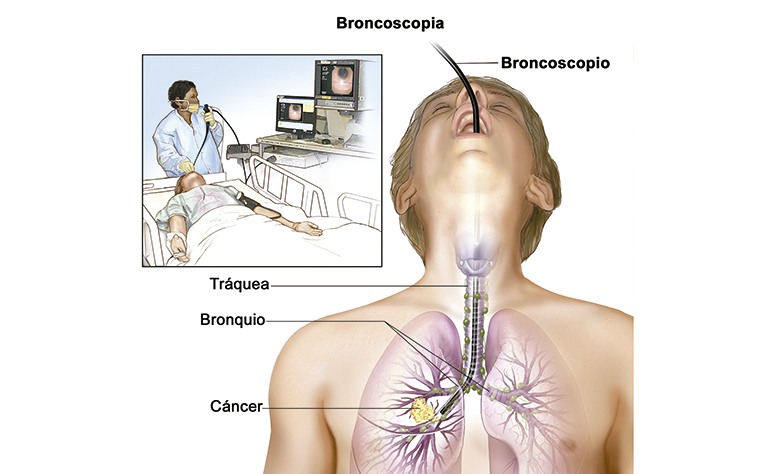
Прогностическими факторами эффективности биопсии являются: размеры образования ˃20 мм, наличие дренирующего бронха по данным КТ, центральное положение мини-зонда относительно образования.
Литература
- Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2001 г. ― М., 2003. ― С. 95-99.
- Бебезов Б.Х. Аденокарцинома легкого (клиника, диагностика, хирургическое лечение, биологические особенности и факторы прогноза): дис. … докт. мед. наук. ― М., 2002. ― С. 15.
- Rivera M.P., Mehta A.C. Initial diagnosis of lung cancer: ACCP evidence-based clinical practice guidelines // Chest. ― 2007. ― Vol. 132. ― P. 131-148.
- Herth F., Ernst A. Endobronchial ultrasound (EBUS) guided transbronchial lung biopsy in solitary pulmonary nodules and peripheral lesions // Eur. Respir. J. ― 2002. ― Vol. 20. ― P. 972-975.
- Kurimoto N., Miyazawa T. Endobronchial ultrasonography Using Guide Sheath Increases the ability to diagnose peripheral pulmonary lesions endoscopically // Chest. ― 2004. ― Vol. 126. ― P. 959-965.
- Torrington K.C., Kern J.D. The utility of fiberoptic bronchoscopy in the evaluation of the solitary pulmonary nodule // Chest. ― 1993. ― 104. ― P. 1021-1024.
Госпиталя Святого Винсента при католическом университете.
В Центре рака лёгких работает пациент-ориентированный медперсонал, обеспечивающий оптимальное лечение при раке, локализованном в грудной клетке, и повышение степени выживаемости пациентов, а также качество их жизни, разработку новых видов терапии и профилактики посредством систематических клинических исследований.
Центр рака лёгких, в медицинскую команду которого входят специалисты из семи сфер респираторной медицины, хирургии органов грудной клетки, онкологии, радиационной онкологии, патологии, рентгеноскопии и ядерной медицины, в своей деятельности берёт за основу устойчивую междисциплинарную кооперационную систему. Команда специалистов-медиков из семи отраслей, тесно сотрудничающих в течение двадцати лет, собираются по крайней мере раз в неделю для проведения междисциплинарных конференций. На таких конференциях команда принимает решение по оптимальному методу лечения по каждому отдельному пациенту. Иными словами, пациенту не нужно ходить из отделения в отделение, а медработник, оказывающий первичную помощь, передает основную суть информации по затронутым вопросам, полученной от медицинской команды. Центр рака лёгких стремится сократить время от постановки диагноза до лечения. Помимо этого, в случае, если пациенты не могут получить хирургическое лечение, координатор по вопросам разнообразия видов рака лёгких регулирует график лечения пациента таким образом, что лучевую терапию и противораковую терапию можно было начать как можно быстрее. Оперативный процесс лечения снижает беспокойство, страх и стресс, которые могут возникнуть у пациента, а также неудобство из-за необходимости посещения различных отделений для получения диагноза и лечения.
Команда специалистов-медиков из семи отраслей, тесно сотрудничающих в течение двадцати лет, собираются по крайней мере раз в неделю для проведения междисциплинарных конференций. На таких конференциях команда принимает решение по оптимальному методу лечения по каждому отдельному пациенту. Иными словами, пациенту не нужно ходить из отделения в отделение, а медработник, оказывающий первичную помощь, передает основную суть информации по затронутым вопросам, полученной от медицинской команды. Центр рака лёгких стремится сократить время от постановки диагноза до лечения. Помимо этого, в случае, если пациенты не могут получить хирургическое лечение, координатор по вопросам разнообразия видов рака лёгких регулирует график лечения пациента таким образом, что лучевую терапию и противораковую терапию можно было начать как можно быстрее. Оперативный процесс лечения снижает беспокойство, страх и стресс, которые могут возникнуть у пациента, а также неудобство из-за необходимости посещения различных отделений для получения диагноза и лечения.
С внешней точки зрения, обзорное исследование, проведённое Службой проверки и оценки медицинского страхования, объединило все результаты оценки лёгочных заболеваний, например, рака лёгких, хронического обструктивного заболевания лёгких и пневмонии, в группу 1. Под кредом «стремления внедрить ультрасовременные технологии и оборудование, а также сохранить человеко-ориентированный подход с точки зрения медицинской практики» Центр рака лёгких не только обеспечивает оптимальной лечение в соответствии с индивидуальным самочувствием пациентов, но и фокусируется на повышении качества их жизни, в то же время пытаясь предоставить человеко-ориентированное лечение.
Диагностика и Лечение Рака, Обследование, Анализы на Рак Московская городская онкологическая больница № 62
Эндосоноскопия — метод исследования с использованием специального минизонда или эндоскопа с встроенным ультразвуковым датчиком, позволяющим проводить ультразвуковое исследование из просвета внутренних органов. В нашей клинике данная методика широко применяется для решения большого спектра диагностических задач.
В нашей клинике данная методика широко применяется для решения большого спектра диагностических задач.
Эндосоноскопия органов панкреатобилиарной зоны позволяется оценить наличие опухолей поджелудочной железы, желчных протоков, а также состояние лимфатических узлов этой зоны, произвести пункцию образования с последующим получением материала для гистологического и цитологического исследования, что особенно важно для дифференциальной диагностики воспалительных изменений и злокачественных новообразований органов этой зоны. Пункция проводиться в условиях стационара под наркозом.
Эндосоноскопия минизондом или аппаратом с радиальным расположением датчика также используется для диагностики подслизистых образований (расположенных в стенке органа) и позволяет правильно определить его структуру, истинные размеры, взаимоотношение с соседними органами для выбора правильной лечебной тактики.
Уточнение распространенности первичной опухоли и выявление характера изменений в регионарных лимфатических узлах (стадирование) играют важную роль в определении тактики и лечения больных раком легкого. В нашей клинике в качестве уточняющей диагностики рака легкого используются метод эндоскопической ультрасонографии в различных ее вариантах: эндобронхиальная, транспищеводная, сочетанная ультрасонография с пункцией опухоли легкого и внутригрудных лимфоузлов. Исследование проводится в первой половине дня натощак, под общим обезболиванием с использованием ларингеальной маски. Эндобронхиальная ультрасонография проводится с помощью бронхоскопа с конвексным ультразвуковым датчиком и ультразвуковых мини-зондов. Сканирующая поверхность конвексного УЗ-датчика у бронхоскопа позволяет осмотреть стенки трахеи и пристеночное пространство крупных бронхов. Использование эхоэндоскопов с конвексным УЗ-датчиком позволяет совместить диагностический этап с выполнением тонкоигольной пункции опухоли, что повышает результативность морфологической верификации диагноза.
В нашей клинике несколько лет успешно применяется методика эндобронхиального ультразвука, при котором по каналу бронхоскопа проводиться УЗ-зонд и выполняется сканирование легочной ткани в глубине трахеобронхиального дерева. При обнаружении патологического очага, выполняется прицельная трансбронхиальная биопсия. Метод является передовым, безопасным и легковыполнимым в руках опытного специалиста. При анализе работы нашего отделения мы получили высокий процент морфологической верификации периферических опухолей легких на уровне ведущих мировых клиник.
Эффективность эндобронхиальной ультрасонографии в диагностике периферических новообраэований легких Текст научной статьи по специальности «Клиническая медицина»
© Е.С. Вакурова, М.И. Давыдов, Г.В. Унгиадзе, Б.К. Поддубный, О.В. Чистякова, К.Ю. Тополь, 2016
УДК 616-066.66, 616.24-006-07
эффективность эндобронхиальной ультрасонографии в диагностике периферических новообразований легких
Е.С. Вакурова, М.И. Давыдов, Г.В. Унгиадзе, Б.К. Поддубный, О.В. Чистякова, К.Ю. Тополь
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» МЗ РФ, г. Москва
EFFICIENCY OF ENDOBRONCHIAL ULTRAsONOGRAPHY IN THE
diagnosis of peripheral lesions of lungs
E.S. Vakurova, M.I. Davydov, G.V. Ungiadze, B.K. Poddubny, O.V. Chistyakova, K.Yu. Topol
N.N. Blokhin Russian Cancer Research Center, Moscow
Вакурова Елена Сергеевна — кандидат медицинских наук, старший научный сотрудник отделения эндоскопического ФГБУ «РОНЦ им.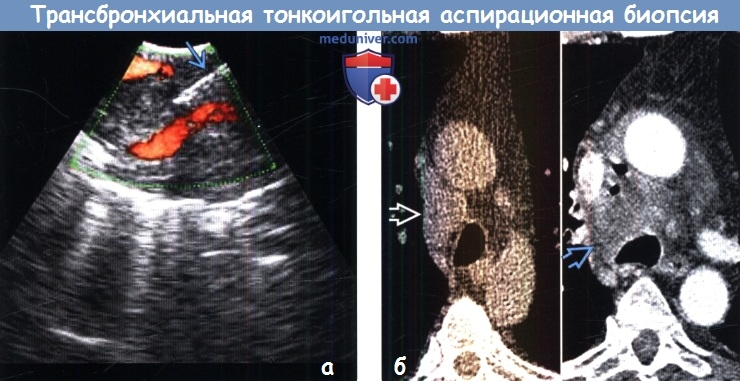 Н.Н. Блохина» Минздрава России
Н.Н. Блохина» Минздрава России
115478, г. Москва, Каширское шоссе, д. 23, тел.: (499) 324-62-09, +7-903-199-18-90, e-mail: [email protected]
Vakurova E.s. — Cand. Med. Sc., senior researcher of Endoscopy Department of the N.N. Blokhin Russian Cancer Research Center
23 Kashirskoe highway, Moscow, Russian Federation, 115478, tel.: (499) 324-62-09, +7-903-199-18-90, e-mail: [email protected]
реферат
целью работы явилась оценка использования эндобронхиальной ультрасонографии для диагностики периферических новообразований легких. В анализ включено 114 пациентов (69 мужчин и 45 женщин), которым выполнено эндобронхиальное ультразвуковое исследование радиальным мини-зондом (частота сканирования 20 МГц) с последующей трансбронхиальной биопсией визуализируемых образований легких. Используя радиальный мини-зонд, вводимый в рабочий канал бронхоскопа, удалось визуализировать патологические образования и выполнить трансбронхиальную биопсию легких в 100 из 114 случаев. Суммарная эффективность трансбронхиальной биопсии легких составила 88% (88 пациентов) из 100. Эндобронхиальная ультрасонография является эффективным методом визуализации периферических новообразований легких. Прогностическими факторами эффективности биопсии являются: размеры образования — 20 мм, наличие дренирующего бронха по данным КТ, центральное положение мини-зонда относительно образования. Ключевые слова: эндобронхиальная ультрасонография, периферические образования легких, трансбронхиальная биопсия.
Abstract
Objective to evaluate the effectiveness of endobronchial ultrasonography in the diagnostics of peripheral lesions of lungs. The analysis included 114 patients (69 men and 45 women) who underwent endobronchial ultrasound study using radial miniprobe (scanning frequency 20 MHz) with subsequent transbronchial biopsy of visualized lesions in lungs. Using the radial miniprobe entered into operator channel of bronchoscope, we managed to visualize pathological lesions and to perform transbronchial biopsy of lungs in 100 out of 114 cases. Total effectiveness of transbronchial biopsy of lungs was 88% (88 14 patients (20.9%) the material was not informative. Endobronchial ultrasonography is an effective method for visualization of peripheral neoplasms of the lungs. Prognostic factors of biopsy effectiveness are: size of the lesion — 20 mm, presence of draining bronchus based on CT data, central position of mini-probe relative to the lesion.
Using the radial miniprobe entered into operator channel of bronchoscope, we managed to visualize pathological lesions and to perform transbronchial biopsy of lungs in 100 out of 114 cases. Total effectiveness of transbronchial biopsy of lungs was 88% (88 14 patients (20.9%) the material was not informative. Endobronchial ultrasonography is an effective method for visualization of peripheral neoplasms of the lungs. Prognostic factors of biopsy effectiveness are: size of the lesion — 20 mm, presence of draining bronchus based on CT data, central position of mini-probe relative to the lesion.
Key words: endobronchial ultrasonography, peripheral neoplasms of the lungs, transbronchial biopsy.
Введение
Проблема диагностики злокачественных и доброкачественных опухолевых заболеваний легких является одной из актуальных в онкологии. Рак легкого в большинстве развитых стран продолжает оставаться наиболее распространенной злокачественной опухолью. В России, в структуре заболеваемости мужского населения, эта патология занимает 1-е ранговое ме-
сто [1]. В мире рак легкого остается одной из основных причин смерти онкологических больных. В структуре собственно рака легкого особое место занимают периферические опухоли.
Периферический рак легких по данным компьютерной томографии характеризуются наличием шаровидного образования, локализующегося в легочной паренхиме. Длительное бессимптомное течение, отсутствие каких-либо патогномоничных признаков
на начальном этапе заболевания делает раннюю диагностику исключительно сложной. Верификация периферических новообразований легких представляет сложную задачу, частично из-за их расположения, частично из-за небольшого размера. Эффективность эндоскопической трансбронхиальной биопсии легкого, выполняемой при бронхологическом исследовании даже при рентгеноскопическом контроле, не превышает 40% [3].
Эффективность эндоскопической трансбронхиальной биопсии легкого, выполняемой при бронхологическом исследовании даже при рентгеноскопическом контроле, не превышает 40% [3].
С внедрением эндосонографических радиальных датчиков стало возможным выполнение эндоброн-хиальной ультрасонографии (ЭБУС) с точным позиционированием и биопсией периферических образований легких. Однако показатели эффективности трансбронхиальных биопсий при ультразвуковой навигации, по данным разных авторов, значительно варьируют — от 46 до 77% [4]. Чувствительность метода зависит от размеров опухоли и от местоположения ультразвукового зонда относительно опухоли. Так, при размере опухоли менее 10 мм чувствительность составляет 45%, от 10 до 30 мм — 76%, свыше 30 мм -92%. При расположении ультразвукового зонда в области поражения диагноз верифицирован у 87% пациентов. Если зонд локализуется рядом с поражением — верификация уменьшается до 42% [5].
Цель исследования — изучить эффективность эн-добронхиальной ультрасонографии в диагностике и морфологической верификации периферических образований легких.
Материал и методы
В анализ включено 114 пациентов, которым было выполнено эндобронхиальное ультразвуковое исследование с использованием радиального мини-зонда (ЭБУС) с частотой сканирования 20 МГц и направляющей оболочки. Исследование выполнено 45 женщинам и 69 мужчинам, средний возраст составил 61,8±12,2 лет. Перед исследованием определялось предполагаемая локализация образования на основании данных КТ или ПЭТ/КТ. Локализация опухолевого процесса по сегментам представлена на рисунке 1. По данным литературы, периферические опухоли в большинстве случаев возникают в верхних долях, преимущественно в верхушечных, задних сегментах верхней доли, в верхушечных сегментах нижней доли, что объясняется особенностями аэродинамики и воздействиями внешних факторов на слизистую оболочку бронхиального дерева [2].
Всем пациентам ранее была выполнена диагностическая бронхоскопия с забором материала для морфологического исследования, который оказался недостаточно информативным. Характеристика больных, включенных в исследование, приведена в таблице 1.
Использовалось следующее оборудование: видеоэндоскопическая система EVIS EXERA II; универсальный эндоскопический ультразвуковой центр Olympus EUS-ME-1; гибкий волоконно-оптический бронхоскоп BF 1T-150; высокочастотный ультразвуковой механи-
Таблица 1. Характеристика больных
Параметр Значение
Число пациентов 114
Мужчины/женщины 69/45
Средний возраст, лет 61,8±12,2
Размеры образования, мм (данные КТ)
максимальный 38,4±19,5
минимальный 29,0±16,0
Локализация образования
верхняя доля правого легкого 42
верхняя доля левого легкого 25
нижняя доля правого легкого 19
нижняя доля левого легкого 15
средняя доля 13
Таблица 2. Результаты морфологической верификации
Рис. 1. Локализация опухолевого процесса по сегментам
ческий радиальный мини-зондом иМ-Б20-20К с внешним диаметром 2. 0 мм; направляющая оболочка из ПВХ; биопсийные шипцы и бронхиальная цитологическая щетка.
0 мм; направляющая оболочка из ПВХ; биопсийные шипцы и бронхиальная цитологическая щетка.
Исследование выполнялось под местной анестезией спреем лидокаина 10% (для анестезии слизистой оболочки полости носа и корня языка) и раствором лидокаина 2%. После осмотра бронхиального дерева в рабочий канал бронхоскопа проводился ультразвуковой мини-зонд с направляющей оболочкой (ту-бус-про вод ни к). Осуществлялось последовательное сканирование субсегментарных бронхов, проходящих через опухолевое образование или максимально близко от него. При визуализации опухоли, ультразвуковой зонд извлекался, в направляющую оболочку проводился инструмент для биопсии. Забор материала для гистологического исследования осуществлялся посредством щипцовой биопсии, для цитологического исследования проводилась катетеризация с последующей аспирацией из целевого бронха и браш-биопсия. При выполнении эндобронхиального ультразвукового исследования производилась запись ультразвукового изображения.
Результаты
С помощью ЭБУС удалось визуализировать и определить местоположение патологического образования, далее выполнить щипцовую и браш-биопсию в 100 из 114 случаев. У 14 пациентов при ультразвуко-
Диагноз Количество
Первичный рак легкого:
Плоскоклеточный 21
Аденокарцинома 37
Мелкоклеточный рак 4
Бронхоальвеолярный рак 3
Атипичный карциноид 2
Метастатическое поражение
рака толстой кишки 4
меланомы 2
рака молочной железы 2
рака шейки матки 2
злокачественной фиброзной гистиоцитомы 2
рака мочевого пузыря 1
Доброкачественные заболевания
Саркоидоз 1
Туберкулез 2
Гамартома 1
Воспалительный инфильтрат 2
Пневмосклероз 1
Ретенционная киста 1
Всего 88
вом исследовании определить наличие опухолевого очага не удалось. Забор материала для цитологического исследования (аспирация и браш-биопсия) выполнен у 100 больных. У 63 пациентов из 100 выполнена щипцовая биопсия. Гистологическая верификация получена у 46 из 63 пациентов. В целом морфологическая верификация диагноза получена у 88 (88%) из 100 больных. Результаты морфологической верификации материала, полученного при эндоскопическом исследовании, подтверждены данными хирургических вмешательств с последующим исследованием операционного материала.
Забор материала для цитологического исследования (аспирация и браш-биопсия) выполнен у 100 больных. У 63 пациентов из 100 выполнена щипцовая биопсия. Гистологическая верификация получена у 46 из 63 пациентов. В целом морфологическая верификация диагноза получена у 88 (88%) из 100 больных. Результаты морфологической верификации материала, полученного при эндоскопическом исследовании, подтверждены данными хирургических вмешательств с последующим исследованием операционного материала.
Результаты морфологической верификации представлены в таблице 2. Из таблицы видно, что первичный рак легкого диагностирован у 67 (67%) пациентов из 100. В большинстве случаев верифицирована аденокарцинома — 37 человек, плоскоклеточный рак
— у 21, мелкоклеточный — у 4, бронхоальвеолярный рак — у 3, атипичный карциноид — у 2. Метастатическое поражение легких выявлено у 13 (13%) пациентов, доброкачественные заболевания — у 8 (8%). У 12 пациентов материал оказался не информативным по результатам цитологического и гистологического исследований.
Эффективность диагностики при использовании ЭБУС зависит размеров опухолевого образования, а также от расположения ультразвукового зонда по отношению к патологическому очагу. Результаты представлены в таблице 3. Так, при размерах очага больше 20 мм вероятность более четкой визуализации опухолевого очага и возможность выполнить забор материала для морфологического исследования значитель-
но выше, чем при размерах опухоли менее 10 мм. При расположении ультразвукового датчика в центре очагового поражения, когда опухоль циркулярно прилежит к стенкам бронха и, возможно, на отдельных участках прорастает в слизистую оболочку бронха, эффективность диагностики при использовании ЭБУС также увеличивается (рис. 2-4). Осложнений во время проведения ЭБУС с биопсией (кровотечение, пневмоторакс) отмечено не было.
Обсуждение
Проблема своевременной диагностики рака легкого наиболее актуальная в современной онкологии, так как у 70-80% первично выявленных больных за-
Таблица 3. Влияние эндосонографических параметров образований на информативность морфологической верификации
Параметр Морфологическая верификация
получена не получена
Размер образования, мм
до 10 (30/100) 21 9
от 10-30 (45/100) 37 8
больше 30 (25/100) 23 2
Центральное положение датчика относительно образования (52/100) 47 5
Краевое положение датчика относительно образования (48/100) 34 14
Рис. 2. Пациент Л., 61 год. По данным КТ в Б3 правого легкого опухоль неправильной формы 3,5х4,3 см с инфильтративным ростом и тяжами к костальной плевре и перибронхиальной инфильтрацией В3
Рис. 3. Эндосонографическая картина периферической опухоли. Центральное положение мини-зонда относительно опухоли
рис. 4. Цитологическое исследование — аденокарцинома
болевание диагностируется на III, IV стадиях, когда не представляется возможным применить радикальные методы лечения. Только 10-20% из вновь заболевших могут быть прооперированы, из них радикальная операция возможна у 70-80% больных. Все большее число отечественных и зарубежных онкологов, занимающихся проблемой рака легкого, приходят к выводу, что на сегодняшний день существенных сдвигов в улучшении результатов лечения рака легкого следует ожидать от совершенствования методов диагностики.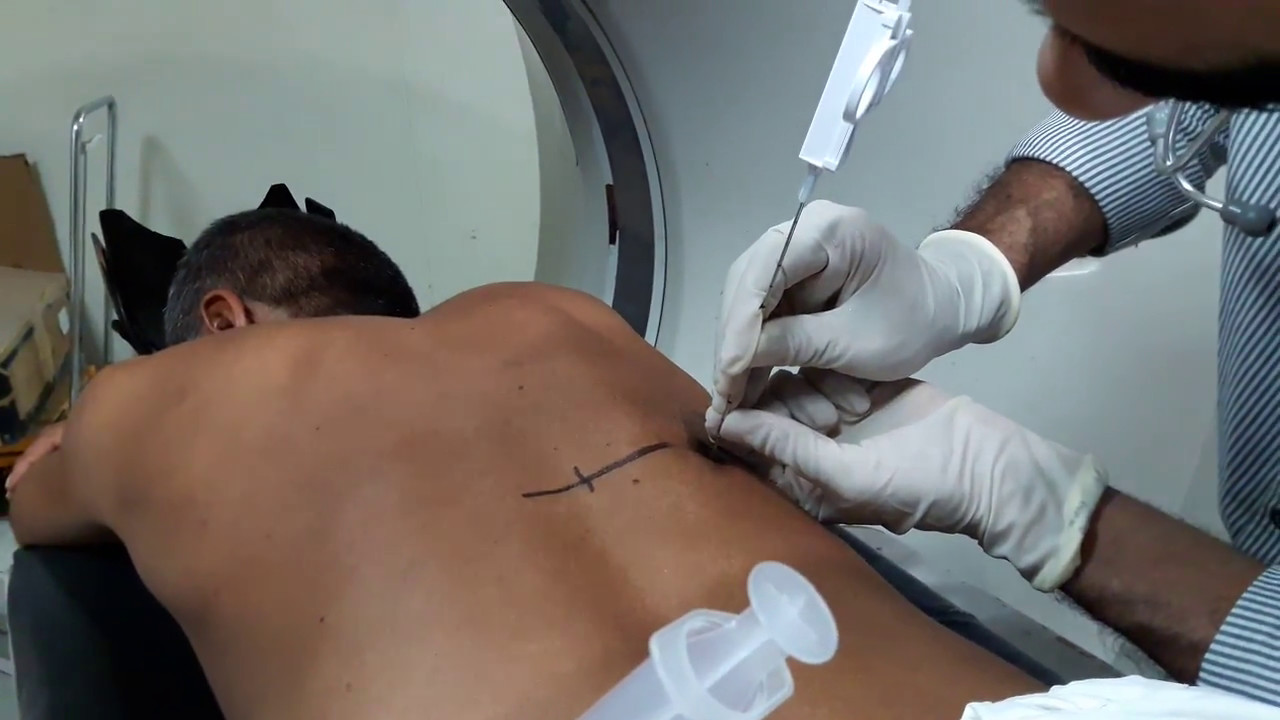 Бронхоскопическое исследование позволяет не только оценить состояние бронхиального дерева, но и, что особенно важно, получить материал для морфологического изучения и установления гистологической структуры опухоли. Морфологическая верификация патологических образований имеет принципиально важное значение в выборе тактики лечения. Эндо-бронхиальная ультрасонография с последующей биопсией в последние годы занимает одно из ведущих мест в диагностике рака легкого [1, 6].
Бронхоскопическое исследование позволяет не только оценить состояние бронхиального дерева, но и, что особенно важно, получить материал для морфологического изучения и установления гистологической структуры опухоли. Морфологическая верификация патологических образований имеет принципиально важное значение в выборе тактики лечения. Эндо-бронхиальная ультрасонография с последующей биопсией в последние годы занимает одно из ведущих мест в диагностике рака легкого [1, 6].
По нашим данным, суммарная информативность морфологической верификации эндобронхиального ультразвукового исследования с последующим забором материала, проведенного у 114 больных, составила 88%. В отделении эндоскопии продолжается
работа по выполнению ЭБУС как с использованием направляющей оболочки, так и без нее.
заключение
Эндобронхиальная ультрасонография является эффективным и безопасным методом контроля эндоскопической биопсии легкого при периферических образованиях легкого.
Прогностическими факторами эффективности биопсии являются: размеры образования -20 мм, наличие дренирующего бронха по данным КТ, центральное положение мини-зонда относительно образования.
Литература
1. Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2001 г. — М., 2003. — С. 95-99.
2. Бебезов Б.Х. Аденокарцинома легкого (клиника, диагностика, хирургическое лечение, биологические особенности и факторы прогноза): дис. … докт. мед. наук. — М., 2002. — С. 15.
3. Rivera M.P., Mehta A.C. Initial diagnosis of lung cancer: ACCP evidence-based clinical practice guidelines // Chest.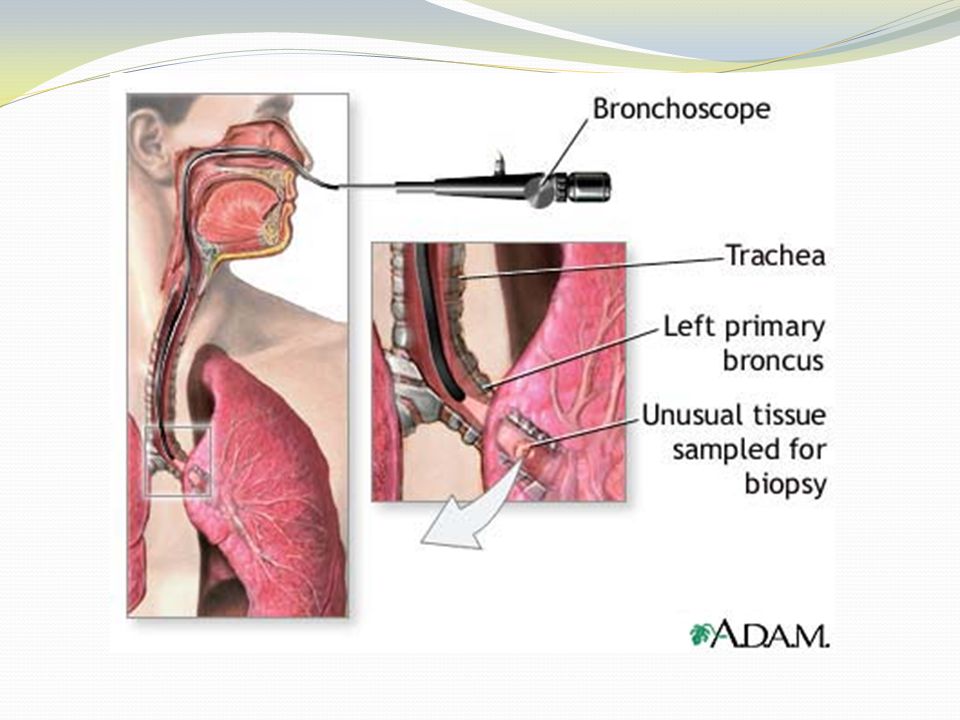 — 2007. — Vol. 132. — P. 131-148.
— 2007. — Vol. 132. — P. 131-148.
4. Herth F., Ernst A. Endobronchial ultrasound (EBUS) guided transbronchial lung biopsy in solitary pulmonary nodules and peripheral lesions // Eur. Respir. J. — 2002. — Vol. 20. — P. 972-975.
5. Kurimoto N., Miyazawa T. Endobronchial ultrasonography Using Guide Sheath Increases the ability to diagnose peripheral pulmonary lesions endoscopically // Chest. — 2004. — Vol. 126. -P. 959-965.
6. Torrington K.C., Kern J.D. The utility of fiberoptic bronchoscopy in the evaluation of the solitary pulmonary nodule // Chest. — 1993. — 104. -P. 1021-1024.
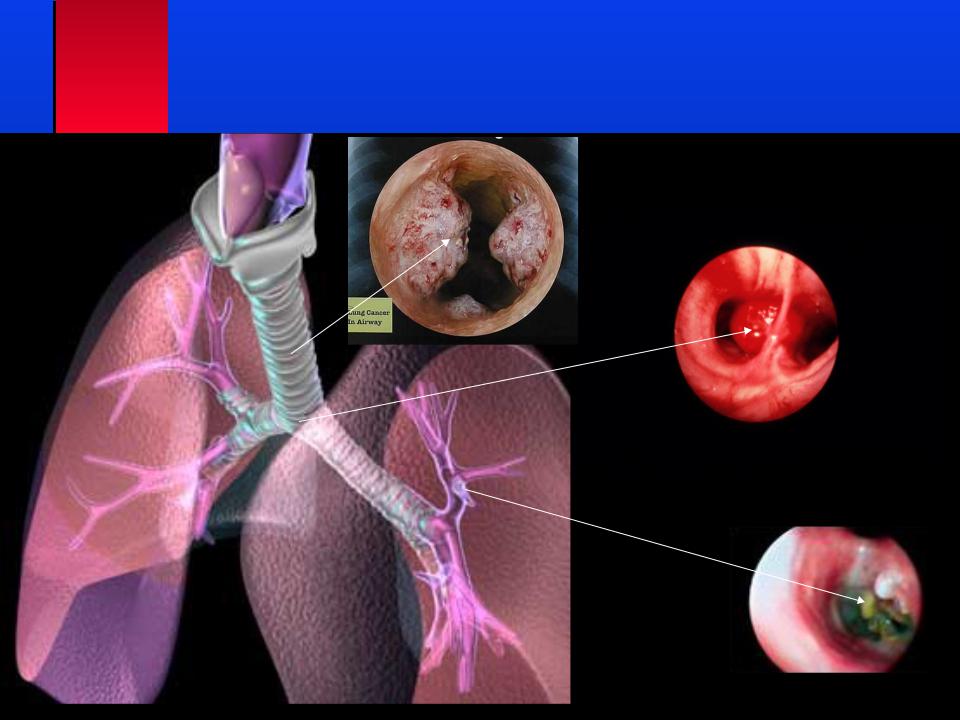
Бронхоскопия с трансбронхиальной биопсией — UCLA Lung Cancer, Лос-Анджелес, CA
Обучение пациентов — Программа рака легких в UCLA
Узнайте больше о раке легких:
Процедуры: бронхоскопия с трансбронхиальной биопсией
Бронхоскопия с трансбронхиальной биопсией
Определение
Бронхоскопия с трансбронхиальной биопсией — это процедура, при которой бронхоскоп вводится через нос или рот для сбора нескольких кусочков легочной ткани.
Альтернативные названия
Биопсия легкого бронхоскопическая
Как проводится тест
Специалист по легким (пульмонолог), обученный проводить бронхоскопию, распыляет местный анестетик в рот и горло. Сначала это вызовет кашель, который прекратится, когда подействует анестетик. Когда эта область кажется «толстой», она достаточно онемела.
Чтобы расслабиться, вам могут ввести успокаивающее средство внутривенно.Это лекарство может вызвать сонливость и снизить беспокойство по поводу процедуры. Иногда процедура также может выполняться под общим наркозом, во время которого вы находитесь без сознания и безболезненно.
Если бронхоскопия проводится через нос, анестетик вводится в одну ноздрю. Когда ноздря немеет, через ноздрю вводится зонд, пока он не пройдет через горло в трахею и бронхи. Обычно используется гибкий бронхоскоп.Этот инструмент представляет собой трубку шириной менее 1/2 дюйма и длиной около 2 футов.
Поскольку бронхоскоп используется для исследования дыхательных путей ваших легких, образцы секрета легких могут быть получены для отправки на лабораторный анализ. Физиологический раствор можно использовать для промывания пораженного участка и сбора клеток, которые, возможно, потребуется проанализировать патологом.
Процедура трансбронхиальной биопсии выполняется с помощью крошечных щипцов, которые вводятся через канал бронхоскопа в легкие. Вам будет предложено медленно выдохнуть, когда пульмонолог возьмет небольшой образец легочной ткани.Этот шаг обычно повторяется до тех пор, пока не будет получено несколько образцов ткани для анализа. Иногда во время бронхоскопии используется рентген грудной клетки в режиме реального времени (рентгеноскопия), чтобы направить щипцы в нужную область легкого.
Как подготовиться к тесту
Этот тест может потребовать ночевки в больнице. Вы должны подписать форму информированного согласия.
Не ешьте за 6–12 часов до обследования. Вам могут посоветовать избегать аспирина, нестероидных противовоспалительных препаратов (НПВП), таких как ибупрофен, или антикоагулянтов, таких как варфарин, в течение определенного периода времени перед процедурой.Всегда проконсультируйтесь с вашим лечащим врачом, прежде чем менять или прекращать прием любых лекарств.
Организовать транспортировку в больницу и обратно. Многие люди хотят отдохнуть на следующий день, поэтому позаботьтесь о работе, уходе за детьми или других обязательствах.
Как будет выглядеть тест
Местная анестезия используется для расслабления мышц горла. Вы можете почувствовать жидкость, стекающую по задней стенке горла, и почувствовать, что вам нужно кашлять или давиться, пока анестетик не подействует.
Несмотря на анестезию, вы можете ощущать давление или легкое дергание, когда трубка движется через трахею. Многие пациенты испытывают чувство удушья, когда трубка находится в горле, но риск удушья отсутствует. Постарайтесь сохранять спокойствие. Если вы кашляете во время теста, вам будет добавлено больше анестетика.
Рентген часто делают после удаления бронхоскопа. Когда действие анестетика закончится, в горле может появиться чесотка в течение нескольких дней. После теста кашлевой рефлекс вернется через 1-2 часа, после чего можно будет нормально есть и пить.
Обычно после трансбронхиальной биопсии откашливается небольшое количество мокроты с оттенком крови в течение дня. Пульмонолог даст вам инструкции, к кому обращаться, если вы откашляете значительное количество крови.
Почему проводится тест
Трансбронхиальная биопсия чаще всего выполняется при диффузном инфильтративном заболевании легких, опухолях, отторжении пересаженного легкого или тяжелом заболевании, которое не позволяет использовать открытую биопсию легкого.
Нормальные результаты
Трахея и бронхи обычно кажутся розовыми и гладкими, с минимальной секрецией и без инородных тел, новообразований, препятствий или инфекций. Образец, полученный при трансбронхиальной биопсии, должен представлять собой нормальную ткань выстилки бронха и воздушных мешков (альвеол).
Что означают аномальные результаты
- Патологии бронхов, опухоли
- Эндобронхиальная масса
- Аденома (опухоль)
- Инфекция, такая как:
- Аспергиллез
- Кокцидиомикоз
- Актиномикоз
- Грибковые инфекции
- Инфекции гистоплазмоза
- Анаэробные бактериальные инфекции
- Туберкулез или микобактерии
- ЦМВ пневмония
- Пневмоцистная пневмония (Pneumocystis carinii pneumonia)
- Гиперчувствительный пневмонит (воспаление легких, связанное с реакциями аллергического типа)
- Ревматоидная болезнь легких
- Васкулит
- Альвеолярные аномалии, такие как альвеолярный протеиноз
- Гранулемы
- Некротическое гранулематозное воспаление
- Некротическая гранулема (гранулярная опухоль)
- Казеатные гранулемы
- Саркоидоз
- Перибронхиальные гранулемы
Риски
Пневмоторакс встречается примерно в 2% трансбронхиальных биопсий. Обычно за этим следует повторная рентгенография грудной клетки, если пневмоторакс не настолько велик, чтобы потребовалось введение грудной клетки для декомпрессии легкого.
Обычно за этим следует повторная рентгенография грудной клетки, если пневмоторакс не настолько велик, чтобы потребовалось введение грудной клетки для декомпрессии легкого.
При проведении биопсии существует риск кровотечения. Некоторое кровотечение является обычным явлением, и техник или медсестра будут контролировать его количество.
Инфекция легких может возникнуть после любой бронхоскопии.
Также существует небольшой риск:
- Нарушение сердечного ритма (аритмии)
- Сердечный приступ
- Низкий уровень кислорода в крови (гипоксемия)
При использовании общей анестезии также существует некоторый риск:
- Тошнота и рвота
- Боль в горле
- Мышечные боли
- Проблемы с дыханием
- Пониженная частота пульса
- Изменение артериального давления
- Повреждение почек
Существует значительный риск удушья, если что-нибудь (включая воду) проглотит до того, как действие анестетика закончится.
Соображения
Чтобы проверить, вернулся ли ваш рвотный рефлекс, приложите ложку к задней части языка и слегка надавите на нее на несколько секунд. Если вы не подавитесь, подождите 15 минут и попробуйте еще раз.
Не используйте маленькие или острые предметы для проверки рвотного рефлекса. Позвоните своему врачу или немедленно обратитесь в отделение неотложной помощи, если после этой процедуры у вас возникла одышка или боль в груди.
Трансбронхиальная биопсия: предпосылки, показания, противопоказания
Palka W, Lessnau K.Новый метод двойной бронхоскопии для криобиопсии. Представлено на 19-м Всемирном Конгрессе WCBIP / WCBE, Флоренция, Италия . 8-11 мая 2016г.
Sriprasart T, Aragaki A, Baughman R, Wikenheiser-Brokamp K, Khanna G, Tanase D, et al. Опыт единого центра США в области трансбронхиальной криобиопсии легких для диагностики интерстициальной болезни легких с помощью 2-осевой техники. J Bronchology Interv Pulmonol . 2017 24 апреля (2): 131-135. [Медлайн].
J Bronchology Interv Pulmonol . 2017 24 апреля (2): 131-135. [Медлайн].
Sheth JS, Belperio JA, Fishbein MC, Kazerooni EA, Lagstein A, Murray S, et al.Использование трансбронхиальной биопсии по сравнению с хирургической биопсией легкого в диагностике подозреваемого фибротического интерстициального заболевания легких. Сундук . 2017 Февраль 151 (2): 389-399. [Медлайн].
Hautmann H, Henke MO, Bitterling H. Высокая диагностическая ценность трансбронхиальной биопсии одиночных легочных узелков с использованием КТ-наведения с низкими дозами. Респирология . 2010 май. 15 (4): 677-82. [Медлайн].
Цусима К, Соне С, Ханаока Т, Такаяма Ф, Хонда Т, Кубо К.Сравнение бронхоскопической диагностики периферических легочных узелков под рентгеноскопическим контролем с контролем КТ. Респир Мед . 2006 апр. 100 (4): 737-45. [Медлайн].
Wall CP, Gaensler EA, Carrington CB, Hayes JA. Сравнение трансбронхиальной и открытой биопсии при хронических инфильтративных заболеваниях легких. Am Rev Respir Dis . 1981, март, 123 (3): 280-5. [Медлайн].
Прокладка HS, Park MS, Park IK. Гистопатологические данные трансбронхиальной биопсии при обычной интерстициальной пневмонии. Патол Инт . 2010 май. 60 (5): 373-7. [Медлайн].
Wu WJ, Mo HY, Liu H. Трансбронхиальная криобиопсия легких для интерстициальной болезни легких, связанной с заболеванием соединительной ткани, и интерстициальной пневмонии с аутоиммунными особенностями: серия ретроспективных случаев в одном центре. Clin Rheumatol . 2021 г. 3 марта [Medline].
Davidsen JR, Skov IR, Louw IG, Laursen CB. Проведение трансбронхиальной криобиопсии легких в специализированном специализированном центре интерстициальных заболеваний легких: когортное исследование диагностической эффективности, осложнений и кривых обучения. BMC Pulm Med . 2021 25 февраля. 21 (1): 67. [Медлайн]. [Полный текст].
Проведение трансбронхиальной криобиопсии легких в специализированном специализированном центре интерстициальных заболеваний легких: когортное исследование диагностической эффективности, осложнений и кривых обучения. BMC Pulm Med . 2021 25 февраля. 21 (1): 67. [Медлайн]. [Полный текст].
Гилман MJ, Ван КП. Трансбронхиальная биопсия легкого при саркоидозе. Подход к определению оптимального количества биопсий. Am Rev Respir Dis . 1980 ноябрь 122 (5): 721-4. [Медлайн].
Стовер Д.Е., Заман М.Б., Хайду С.И., Ланге М., Голд Дж., Армстронг Д. Бронхоальвеолярный лаваж в диагностике диффузных легочных инфильтратов у иммунодепрессантов. Энн Интерн Мед. .1984 июл.101 (1): 1-7. [Медлайн].
Bae KM, Lim SC, Kim HH, Lee WJ, Yun NR, Kim CM и др. Актуальность биопсии у больных туберкулезом без инфицирования вирусом иммунодефицита человека. Ам Дж. Троп Мед Хиг . 2015 Март 92 (3): 636-40. [Медлайн].
Ussavarungsi K, Kern RM, Roden AC, Ryu JH, Edell ES. Трансбронхиальная криобиопсия при диффузной паренхиматозной болезни легких: ретроспективный анализ 74 случаев. Сундук . 2017 Февраль.151 (2): 400-408. [Медлайн].
Ehab A, Reissfelder F, Laufer J, Kempa AT. Трансбронхиальная криобиопсия легких, проведенная при острой пневмонии COVID-19: первое сообщение. Адв Респир Мед . 2021. 89 (1): 72-74. [Медлайн].
Пузыренко А., Феликс Дж. С., Сунь Й., Руи Х., Шейнин Ю. Острый пневмонит SARS-CoV-2 с цитотоксическими CD8-положительными Т-лимфоцитами: клинический случай и обзор литературы. Патол Рес Прак . 2021 15 февраля. 220: 153380.[Медлайн]. [Полный текст].
webmd.com»> Roethe RA, Fuller PB, Byrd RB, Hafermann DR. Трансбронхоскопическая биопсия легкого при саркоидозе. Оптимальное количество и сайты для диагностики. Сундук . 1980 марта 77 (3): 400-2. [Медлайн].
[Руководство] Дю Рэнд И.А., Блейкли Дж., Бутон Р., Чаудхури Н., Гупта В., Халид С. и др. Руководство Британского торакального общества по диагностической гибкой бронхоскопии у взрослых: аккредитовано NICE. Грудь . 2013 Август.68 Дополнение 1: i1-i44. [Медлайн]. [Полный текст].
Смит CM, Stead RJ. Обследование гибкой фиброоптической бронхоскопии в Соединенном Королевстве. Eur Respir J . 2002 19 марта (3): 458-63. [Медлайн].
Rittirak W, Sompradeekul S. Диагностическая ценность трансбронхиальной биопсии легкого под контролем рентгеноскопии при неэндобронхиальном поражении легкого. J Med Assoc Thai . 2007 ноябрь 90 Дополнение 2: 68-73. [Медлайн].
Андерс Г.Т., Джонсон Дж. Э., Буш Б. А., Мэтьюз Дж.Трансбронхиальная биопсия без рентгеноскопии. Семилетняя перспектива. Сундук . 1988 сентябрь 94 (3): 557-60. [Медлайн].
Wang KP, Wise RA, Terry PB, Kaplan J, Britt EJ, Haponik EF, et al. Сравнение стандартных и больших щипцов для трансбронхиальной биопсии легкого в диагностике инфильтратов легких. Эндоскопия . 1980 июл.12 (4): 151-4. [Медлайн].
Casoni GL, Gurioli C, Chhajed PN, Chilosi M, Zompatori M, Olivieri D, et al.Значение трансбронхиальной биопсии легкого с использованием больших щипцов и жесткого бронхоскопа при диффузном заболевании легких. Арочный сундук Мональди Dis . 2008 июнь 69 (2): 59-64. [Медлайн].
webmd.com»> Peschke A, Wiedemann B, Höffken G, Koschel D. Щипцы для биопсии и отсасывающий катетер для отбора проб из легочных узелков и инфильтратов. Eur Respir J . 2012 июн. 39 (6): 1432-6. [Медлайн].
Gruden JF, Webb WR, Naidich DP, McGuinness G. Многоузловая болезнь: анатомическая локализация при КТ тонких срезов — оценка простого алгоритма с помощью нескольких читателей. Радиология . 1999 Март 210 (3): 711-20. [Медлайн].
Gex G, Pralong JA, Combescure C, Seijo L, Rochat T, Soccal PM. Диагностическая ценность и безопасность электромагнитной навигационной бронхоскопии для узлов в легких: систематический обзор и метаанализ. Дыхание . 2014. 87 (2): 165-76. [Медлайн].
Leong S, Ju H, Marshall H, Bowman R, Yang I, Ree AM и др. Электромагнитная навигационная бронхоскопия: описательный анализ. Дж. Торак Дис . 2012 г. 1. 4 (2): 173-85. [Медлайн]. [Полный текст].
Штейнфорт Д.П., Хор Ю.Х., Мансер Р.Л., Ирвинг Л.Б. Эндобронхиальное ультразвуковое исследование с радиальным зондом для диагностики периферического рака легких: систематический обзор и метаанализ. Eur Respir J . 2011 Апрель 37 (4): 902-10. [Медлайн].
Hsia DW, Jensen KW, Curran-Everett D, Musani AI. Диагностика узелков в легких с помощью периферической / радиальной эндобронхиальной трансбронхиальной биопсии под контролем УЗИ. J Bronchology Interv Pulmonol . 2012 19 января (1): 5-11. [Медлайн].
Chenna P, Chen AC. Эндобронхиальное ультразвуковое исследование с радиальным зондом и новые методы навигационной биопсии. Semin Respir Crit Care Med . 2014 декабрь 35 (6): 645-54. [Медлайн].
Эделл Э., Криер-Морроу Д. Навигационная бронхоскопия: обзор технологии и практические соображения — новые текущие коды процедурной терминологии, вступающие в силу с 2010 г. Chest .2010 Февраль 137 (2): 450-4. [Медлайн]. [Полный текст].
Becker HD, Herth F, Ernst A, Schwarz Y. Бронхоскопическая биопсия периферических поражений легких под электромагнитным контролем: пилотное исследование. J Bronchol Intervent Pulmonol . 2005 Январь 12: 5. [Полный текст].
Gildea TR, Mazzone PJ, Karnak D, Meziane M, Mehta AC. Электромагнитная навигационная диагностическая бронхоскопия: перспективное исследование. Am J Respir Crit Care Med . 2006 г. 1 ноя.174 (9): 982-9. [Медлайн]. [Полный текст].
Эберхардт Р., Анантам Д., Херт Ф., Феллер-Копман Д., Эрнст А. Электромагнитная навигационная диагностическая бронхоскопия при периферических поражениях легких. Сундук . 2007 июн.131 (6): 1800-5. [Медлайн]. [Полный текст].
Болтон В. Д., Ричи Дж., Бен-Ор С., Хейл А. Л., Юинг Дж. А., Стивенсон Дж. Электромагнитная навигационная бронхоскопия: безопасный и эффективный метод размещения реперных маркеров у пациентов с раком легких. Am Surg . 2015 Июль 81 (7): 659-62. [Медлайн]. [Полный текст].
Избицки Г., Ромем А., Ариш Н., Кахан С., Азулай Н., Чен-Шуали С. и др. Избегать рутинной рентгенографии грудной клетки после трансбронхиальной биопсии безопасно. Дыхание . 2016. 92 (3): 176-81. [Медлайн].
Завала ДК. Легочное кровотечение при фиброоптической трансбронхиальной биопсии. Сундук . 1976 Ноябрь 70 (5): 584-8. [Медлайн].
Трансбронхиальная биопсия верхних долей легких связана с повышенным риском пневмоторакса — ретроспективное исследование | BMC Pulmonary Medicine
Главный вывод этого исследования заключался в том, что TBB левой верхней доли легкого, BMI и более 4 взятых образцов были значительно связаны с повышенными шансами постпроцедурного PTX.Напротив, шансы постпроцедурного PTX были самыми низкими с TBB, выполненным из правой нижней доли.
В нашем исследовании частота PTX составила 6,16%, что сопоставимо с данными из руководства BTS (частота PTX составляет 1–6%) [3], Sindhwani et al. исследование (10,2%) [8], исследование COMET (7,2%) [9] и исследование Ibrahim et al. исследование (9,8%) [10]. В нашу когорту вошли 48% пациентов с узловыми поражениями, и была незначительная тенденция к увеличению количества узловых поражений TBB в группе PTX.Узловые поражения тесно связаны с наличием эмфиземы легких и наоборот [11], что может повышать риск развития ПТКС после медицинских процедур [9, 12]. Действительно, по сравнению с пациентами без PTX, у пациентов с PTX также была незначительная тенденция к увеличению эмфиземы легких в нашей когорте. Идеальное количество образцов TBB, которое следует брать при каждой процедуре, остается спорным, некоторые авторы пришли к выводу, что это не имеет отношения к риску постпроцедурного PTX [9]. В нашем анализе количество образцов, взятых во время TBB, было в значительной степени связано с развитием PTX и оставалось важным фактором развития PTX также в анализе логистической регрессии.
В нашем исследовании шансы развития PTX были самыми высокими у пациентов с TBB, выполненным из левой верхней доли. Напротив, шансы были самыми низкими у пациентов с TBB, выполненным из правой нижней доли. Наблюдаемую апико-базальную разницу можно объяснить вертикальным градиентом плеврального давления. У здорового человека в вертикальном положении плевральное давление самое низкое (т. Е. Наиболее отрицательное) в апикальных частях и самое высокое (т. Е. Наименее отрицательное) в базальных частях. Перепад давления между верхушкой легкого (около -12 см H 2 O) и основанием (около -2 см H 2 O) может достигать 8–10 см H 2 O [6].Следовательно, более отрицательное давление в апикальных частях может способствовать более легкому развитию PTX у пациентов, перенесших TBB из верхних долей легких. Интересно, что разница в плевральном давлении между правым и левым легким также наблюдается. Правое легкое тяжелее, а плевральное давление в базальной части правого легкого выше, чем в базальных частях левого легкого [13]. Эта боковая разница может объяснить ассоциацию TBB правой нижней доли с наименьшими шансами развития PTX.
Более высокая частота PTX у субъектов с TBB из верхней доли согласуется с исследованием Huang et al. и Фернандес-Бюсси и др. [12, 14]. В исследовании Huang et al., 13 случаев постпроцедурного ПТКС из 399 были зарегистрированы после эндобронхиального ТБК под контролем УЗИ [12]. В этом исследовании однофакторный анализ показал, что эмфизема легких связана с повышенным риском PTX. Важно отметить, что из 13 случаев PTX 10 событий произошли после TBB в верхних долях и только 3 — в средних и нижних долях.Однако эта четкая тенденция была статистически незначимой ( p = 0,084), вероятно, из-за низкого числа случаев PTX в когорте. В том же исследовании многомерный анализ показал, что эмфизема легких была самым сильным независимым фактором риска пост-TBB PTX с OR 55,09 ( p <0,001), в то время как локализация поражения в верхних долях имела OR 3,34, хотя и незначительно ( p = 0,149) из-за небольшого количества случаев PTX [12].
В исследовании Fernandez-Bussy et al., процедура на верхней или средней доле оказалась независимым фактором риска постоперационных осложнений (OR 1,69) [14]. Это не достигло статистической значимости, так как исследование было недостаточно мощным; только 3 случая PTX были зарегистрированы [14].
В отличие от нашего исследования, Izbicki et al. сообщили о 8 случаях постпроцедурного ПТКС, из которых ни один не возник в результате TBB верхней доли легкого [15]. Однако в большинстве исследований место отбора проб TBB не оценивалось в связи с развитием PTX [2, 9, 12, 16].
Диагностическая ценность TBB (без рентгеноскопии) в нашей когорте составила 52,9% для диффузных паренхиматозных заболеваний легких и 40,5% для узловых поражений соответственно. Это сопоставимо с предыдущими отчетами, в которых: Hernandez Borge et al. сообщили об общей диагностической ценности 42% [17], в швейцарском исследовании (Descombes et al.) диагностическая ценность диффузных патологий легких составила 50% [18]. Напротив, в руководстве BTS цитируются 2 исследования, в которых чувствительность достигала 67–74% [3].Для периферических поражений легких сообщалось об очень широком диапазоне вариаций в различных исследованиях (16–80%) [19]. В рекомендациях BTS диагностическая точность TBB для злокачественных новообразований составляла около 45%, в то время как в швейцарском исследовании (Descombes et al.) Только около 29% [18].
У нашего исследования было несколько ограничений. Во-первых, это было ретроспективное исследование. Поэтому комментировать причинно-следственную связь между сайтом разработки TBB и PTX сложно. Во-вторых, в нашей когорте наблюдалась незначительная тенденция к увеличению TBB узловых поражений в группе PTX.Следовательно, несколько TBB в нашей когорте не могли быть выполнены из нижних долей, чтобы предотвратить развитие PTX. Мы предполагаем, что в случае, если TBB невозможно выполнить из нижних долей, это должно, по крайней мере, повысить осведомленность о развитии PTX.
В-третьих, во всех процедурах, включенных в настоящее исследование, выполнялась трансбронхиальная биопсия без рентгеноскопии. Неизвестно, применимы ли эти результаты к центрам, которые используют рентгеноскопию как часть своей стандартной практики, однако нет никаких доказательств того, что рентгеноскопия изменяет частоту или локализацию пневмоторакса во время TBB [3, 15, 20, 21, 22].
Наконец, это было ретроспективное исследование, и мы не смогли измерить расстояние от узелков до висцеральной плевры у всех пациентов с узловыми поражениями, так как некоторые компьютерные томограммы больше не были доступны для обзора. У пациентов с периферическими поражениями риск развития PTX может быть выше, чем у пациентов с более центральными поражениями. Тем не менее, мы полагаем, что большинству пациентов с периферическими поражениями была проведена трансторакальная игольчатая биопсия под контролем КТ, как рекомендовано [23], оставив в основном пациентов с более центрально расположенными поражениями в нашей когорте исследования.Действительно, у пациентов с узловым поражением и с PTX (все 30 пациентов имели компьютерную томографию, доступную для обзора), среднее расстояние поражения от висцеральной плевры составляло 31 мм против 29 мм для пациентов без PTX ( p = 0,08 ).
Эндобронхиальная трансбронхиальная биопсия легкого под контролем УЗИ при одиночных легочных узелках и периферических поражениях
Реферат
Трансбронхиальная биопсия (TBBX) при поражении периферических легких обычно выполняется с помощью рентгеноскопии, но ее результат варьируется в широких пределах.Это технико-экономическое обоснование было направлено на оценку способности эндобронхиального ультразвука (EBUS) обеспечивать руководство по визуализации TBBX.
В проспективном исследовании 50 последовательных пациентов, направленных на TBBX по поводу периферических поражений, прошли TBBX под контролем рентгеноскопии и EBUS в случайном порядке. Результаты диагностики сравнивались для обоих методов, и осуществимость была оценена для EBUS.
Диагностический материал был получен у 80% пациентов с EBUS и 76% пациентов с рентгеноскопией.Была незначительная тенденция того, что EBUS лучше, чем рентгеноскопия, для поражений <3 см в диаметре. Четыре очага поражения не удалось визуализировать с помощью EBUS. Не было серьезных осложнений, связанных с использованием EBUS.
Возможна эндобронхиальная трансбронхиальная биопсия под контролем УЗИ. Это, по крайней мере, эквивалентно рентгеноскопии без сопутствующего радиационного облучения. Необходимы дальнейшие крупномасштабные исследования для оценки возможной роли эндобронхиального ультразвука как потенциального метода визуализации при биопсии периферических поражений легких.
Бронхоскопия использовалась более 30 лет для оценки одиночных легочных узелков (SPN) и периферических поражений легких. Гибкая бронхоскопия (ФБ) часто выполняется пациентам с такими поражениями для установления диагноза. Обычно процедура выполняется как трансбронхиальная биопсия (TBBX) под контролем рентгеноскопии. Частота осложнений, как правило, невысока, но пациенты и персонал, безусловно, подвергаются радиационному облучению. Кроме того, диагностическая ценность FB широко варьируется (18–75%) 1, 2.Предыдущие исследования SPN и периферических поражений неизменно показали, что размер поражения и его расположение влияют на диагностическую точность бронхоскопии 1, 3–5. Поэтому во многих учреждениях пациенты проходят первичные хирургические процедуры биопсии, такие как грудная хирургия с помощью видеосъемки. Чтобы избавить пациентов от необходимости в оперативных процедурах, было бы желательно использовать новые технологии визуализации и наведения. В настоящем исследовании оценивали эндобронхиальное ультразвуковое исследование (EBUS) и его способность направлять TBBX при периферических поражениях легких.EBUS привлекает все большее внимание в других бронхоскопических процедурах, таких как трансбронхиальная пункционная аспирация (TBNA) 4, 6. Это первый отчет об использовании EBUS для проведения трансбронхиальной биопсии.
Методы
Пациенты и методы
В проспективное перекрестное исследование с ноября 2000 г. по февраль 2001 г. было включено 50 последовательных пациентов с периферическими поражениями, направленных на диагностическую бронхоскопию. Все компьютерные томографы грудной клетки были просмотрены, и размер поражений был записан по их наибольшему диаметру.После письменного информированного согласия пациентам была проведена бронхоскопия. Процедуры проводились под общим наркозом или под седацией в сознании стандартным образом. Использовались различные фиброоптические бронхоскопы (модели BF 1T-30, BF 1T 40 и BF XT 20; Olympus Co., Токио, Япония). Биопсию выполняли обычными одноразовыми щипцами для биопсии. Пинцет меняли между EBUS и рентгеноскопическим исследованием, чтобы избежать перекрестной контаминации клеток. После полного обследования бронхиального дерева, включая субсегментарные бронхи, TBBX выполняли последовательно под EBUS и рентгеноскопическим контролем в случайном порядке у каждого пациента.Рентгеноскопия выполнялась с использованием монопланарной С-дуги (Suprer 50 CP, Philipps Co., Амстердам, Нидерланды). EBUS выполнялась с помощью гибкого зонда и процессора (UM-3R, UM-4R, US20-20R, Olympus), как описано ниже. Гистологический диагноз фиброза считался недиагностическим. Гистологические результаты сравнивали для двух методов.
Методика трансбронхиальной биопсии легкого
Рентгеноскопия
После флюороскопической локализации поражения щипцы (FB-20C, Olympus) были продвинуты по направлению к поражению.Затем открывали чашки щипцов и продвигали их в пораженное место. Было взято минимум четыре образца.
Эндобронхиальное УЗИ
Зонды вводили, как щипцы, в разные бронхи, где предполагалось поражение. В отличие от беловатого изображения воздухосодержащей ткани легких, похожего на метель, твердые поражения кажутся более темными и более однородными. Обычно они хорошо дифференцируются от легочной ткани по яркой границе из-за разницы в сопротивлении (рис.1⇓). После локализации поражения зонд был удален из канала для биопсии, а щипцы были введены в соответствующий субсегментарный бронх, и было выполнено ≥4 биопсии.
Рис. 1.—Эндобронхиальное ультразвуковое изображение (EBUS) периферического легкого, заполненного воздухом, которое обычно «похоже на метель» (слева). Справа показано изображение, полученное при попадании твердой ткани на периферию. Можно оценить определенный гипоэхогенный сигнал (обведен стрелками).
Статистический анализ
Ранговая корреляция Спирмена для непараметрических образцов использовалась для корреляции различных классификаций с гистологическими результатами. Данные представлены как среднее ± стандартное отклонение.
Результаты
Было обследовано 37 мужчин и 13 женщин со средним возрастом 62,5 ± 10,5 года (диапазон 25–81 год) (таблица 1⇓). 43 пациента (86%) курили. Средний диаметр поражения составил 3.31 ± 0,92 см (диапазон 2–6 см). Локализация аномалии — правая средняя доля у четырех пациентов (8%), левая верхняя доля у 11 (22%), правая верхняя доля у 27 (54%), левая нижняя доля у шести (12%). и правая нижняя доля — две (4%). Среднее количество полученных образцов составило 4,34 ± 0,55 под контролем EBUS и 4,56 ± 0,61 при рентгеноскопии (статистически не значимо).
Таблица 1—Диагноз установлен у всех пациентов
Диагноз TBBX под контролем EBUS установлен у 40 пациентов (80%).В четырех случаях поражение не удалось локализовать; все они были локализованы в правой верхней доле. Под рентгеноскопическим контролем диагноз удалось установить у 38 пациентов (76%). Все узелки удалось локализовать при рентгеноскопии. Всем пациентам, у которых не удалось установить точный диагноз, выполнено хирургическое вмешательство. Таблицы 1⇑ и 2⇓ показывают доходность в зависимости от расположения поражений и окончательного диагноза. Существенной разницы между EBUS и рентгеноскопией не было. Как и ожидалось, размер поражения повлиял на урожайность, и детали перечислены в таблице 3⇓.Кроме того, не было различий в диагностической эффективности при анализе подгрупп пациентов по возрасту, полу или курению.
Таблица 2—Расположение очагов
Таблица 3—Размер поражения и диагностическая ценность обоих методов бронхоскопической биопсии
У пяти пациентов (10%) гистология была доброкачественной, а у 45 (90%) образцы были злокачественными (таблица 2⇑). У девяти пациентов (18%) диагноз, полученный при бронхоскопии, спас от хирургической процедуры (саркоидоз 2, туберкулез 2, инфекция 1, метастатическое заболевание 1 и мелкоклеточный рак легкого 3).
Самоограниченное кровотечение наблюдалось в двух случаях. В этом исследовании не наблюдалось сильного кровотечения. У одного пациента развился пневмоторакс (2%), который лечили трубочной торакостомией. При диагностике смертельных исходов не было.
Обсуждение
Наиболее распространенной бронхоскопической процедурой у пациентов с периферическими узелками является TBBX 2 под контролем рентгеноскопии. Диагностическая эффективность этой техники сильно зависит от размера поражения и колеблется в пределах 20–75% 2, 7.Кроме того, пациенты и персонал подвергаются радиационному облучению. Эти недостатки приводят к частому использованию процедур первичной хирургической биопсии.
Чтобы избавить пациентов от ненужных операций и повысить диагностическую ценность эндоскопических процедур, необходимы новые технологии визуализации и наведения.
Насколько известно авторам, это первое проспективное исследование по применению EBUS при периферических поражениях легких.
EBUS позволяет получать подробные изображения нескольких слоев бронхиальной стенки и парабронхиальных структур 7, а также может быть полезен при проведении TBNA.Поскольку воздух действует как изолятор для ультразвуковых волн 8, потенциал для исследования периферических легких под контролем EBUS казался ограниченным, когда был введен этот метод визуализации. При проведении EBUS на периферии авторы отметили четкую разницу при введении зонда в солидную опухоль по сравнению с альвеолами, заполненными воздухом. Это побудило авторов выполнить данное технико-экономическое обоснование.
Интересно, что в этом раннем исследовании с помощью EBUS-контроля можно было получить тот же результат, что и с TBBX под контролем рентгеноскопии; и даже несмотря на то, что статистически не значимо, выход для поражений размером <3 см, как правило, был лучше, чем при рентгеноскопии.Для более крупных поражений EBUS не был таким хорошим, но эти результаты испорчены невозможностью локализовать некоторые из этих поражений в правой верхней доле. Интересно, что такой высокий выход TBBX под контролем EBUS может быть достигнут, даже если зонд нужно было удалить перед введением щипцов для биопсии. Можно предположить, что различные установки, позволяющие получать изображения с помощью EBUS при получении биопсии, могут значительно повысить успешность эндоскопической биопсии.
TBBX под контролемEBUS прост в исполнении и не требует больше времени, чем процедура, выполняемая с помощью рентгеноскопии (∼6 мин для каждой процедуры в этом исследовании).Очевидно, что кривая обучения интерпретации EBUS — это факт, и авторы настоящего исследования обнаружили, что необходимо выполнить 40–50 процедур EBUS, чтобы почувствовать себя комфортно.
Авторы осведомлены об ограничении исследования, поскольку оба метода применялись к одному и тому же пациенту, даже если они выполнялись последовательно случайно. Смещение не может быть исключено, поскольку местоположение поражения могло быть установлено соответствующим первым методом. Это смещение было минимизировано с помощью перекрестного дизайна в этом исследовании.Авторы не считают, что предшествующая рентгеноскопия улучшила способность определять местонахождение поражений с помощью EBUS, о чем свидетельствует тот факт, что три из четырех поражений, не обнаруженных при EBUS, были ранее обнаружены при рентгеноскопии.
Таким образом, результат этого технико-экономического обоснования показывает, что гистологическая диагностика одиночных легочных узелков и периферических поражений легких с помощью трансбронхиальной биопсии может быть эффективно достигнута с помощью эндобронхиального ультразвукового контроля для трансбронхиальной биопсии без необходимости использования радиологического оборудования и радиационного воздействия.Дальнейшие исследования могут быть полезны для установления твердой роли эндобронхиального ультразвукового руководства для трансбронхиальной биопсии при бронхоскопических процедурах.
- Получено 2 января 2002 г.
- Принято 27 мая 2002 г.
Список литературы
- ↵
Torrington KG, Kern JD. Польза фибробронхоскопии при оценке одиночных легочных узелков. Сундук 1993; 104: 1021–1024.
- ↵
Gasparini S, Ferretti M, Bichi Secchi E, Baldelli S, Zuccatosa L, Gusella P.Интеграция трансбронхиального и чрескожного доступа в диагностику периферических легочных узелков или новообразований. Опыт работы с 1027 случаями. Chest 1995; 108: 131–137.
- ↵
Baaklini WA, Reinoso MA, Gorin AB, Sharafkaneh A, Manian P. Диагностическая ценность фибробронхоскопии при оценке одиночных легочных узелков. Chest 2000; 117: 1049–1054.
- ↵
Херт Ф, Беккер HD. Эндобронхиальное УЗИ (EBUS) — оценка нового диагностического инструмента в бронхоскопии.Онкология 2001; 24: 151–155.
- ↵
Ван КП. Стадия бронхогенной карциномы при бронхоскопии. Chest 1994; 106: 588–593.
- ↵
Shannon JJ, Bude RO, Orens JB, et al. Эндобронхиальная игла под контролем УЗИ при аденопатии средостения. Am J Respir Crit Care Med 1996; 153: 1424–1430.
- ↵
Lillington GA.Лечение одиночных легочных узелков. Dis Mon 1991; 37: 271–318.
- ↵
Кремкау FW, Тейлор KLW. Артефакты в ультразвуковой визуализации. J Ultrasound Med 1986; 5: 227–237.
Методы биопсии легких и клиническое значение Статья
Непрерывное образование
Биопсия легкого — широко распространенная процедура диагностики легочных заболеваний путем взятия образцов легочной ткани.Помимо узелков и новообразований в легких, с помощью биопсии легких можно диагностировать широкий спектр легочных заболеваний, включая интерстициальные заболевания легких, гиперчувствительный пневмонит, саркоидоз и инфекции, такие как туберкулез. В этом упражнении описаны различные методы биопсии легких, показания, противопоказания, осложнения и роль комплексного междисциплинарного командного подхода, который обсуждался для выполнения различных задач, связанных с процедурой, включая помощь медсестры и предоперационное обучение пациентов.
Целей:
- Определите соответствующие показания биопсии легкого.
- Опишите оборудование, персонал, подготовку и технику биопсии легкого.
- Опишите соответствующую оценку потенциальных осложнений и их клиническое значение при биопсии легкого.
- Просмотрите важность стратегий межпрофессиональной команды для улучшения результатов биопсии легкого.
Введение
Узелки и новообразования в легких иногда бывает сложно диагностировать и часто требуют инвазивных процедур. [1] Биопсия легкого — это популярная и широко распространенная процедура получения образцов легочной ткани для диагностики широкого спектра легочных заболеваний. Ткань легкого может быть получена для гистопатологического исследования следующими методами: [2]
- Чрескожная трансторакальная биопсия легкого (PTLB): Этот тип биопсии может также называться чрескожной или трансторакальной иглой биопсией, при которой вводится игла. вводится через грудную стенку с помощью компьютерной томографии или рентгеноскопии в подозрительную область для получения образца ткани.[1]
- Открытая биопсия легкого (OLB) : Хирургическое удаление ткани легкого для гистопатологического и микробиологического анализа под общим наркозом.
- Видео-ассистированная торакальная хирургия (VATS): Эндоскопическое удаление легочной ткани через грудную стенку, которое также может называться VATS.
- Трансбронхиальная биопсия (TBLB): Биопсия с использованием гибкой бронхоскопии трансназальным или трансоральным путем, обычно предпочтительным для центральных (доступных) поражений.
- Криобиопсия (Cryo-TBB): Трансбронхиальная криобиопсия включает замораживание и удаление ткани с использованием закиси азота и специального гибкого зонда.
Эта статья направлена на обзор различных методов биопсии легкого. Обсуждается комплексный междисциплинарный командный подход для выполнения различных задач, связанных с процедурой, включая помощь медсестры и предоперационное обучение пациентов.
Анатомия и физиология
Анатомия, имеющая отношение к биопсии легкого, обсуждалась в этом разделе.
Бронхолегочный сегмент: Это независимых единиц легкого, снабжаемых (третичным) сегментарным бронхом, третичной ветвью легочной артерии и ветвью бронхиальной артерии. В правом легком десять бронхолегочных сегментов, в левом — 8. Бронхолегочный добавочный сегмент может присутствовать в определенном проценте популяций.
Правое легкое имеет косые и горизонтальные трещины, разделяющие его на три доли с десятью сегментами.
- Правая верхняя доля
- Апикальный сегмент
- Задний сегмент
- Передний сегмент
- Правая средняя доля
- Боковой сегмент
- Средний сегмент
- Правая нижняя доля
- Высший сегмент
- Средний сегмент
- Передний сегмент
- Боковой сегмент
- Задний сегмент
Левое легкое имеет косую щель, разделяющую его на две доли.
- Левая верхняя доля
- Сегмент Apicoposterioir
- Передний сегмент
- Верхний язычный сегмент
- Нижний язычный сегмент
- Левая нижняя доля
- Высший сегмент
- Переднемедиальный сегмент
- Боковой сегмент
- Задний сегмент
Лимфодренаж легких: Как правило, лимфодренаж от всего легкого отводится в правый лимфатический проток, за исключением левой верхней доли, которая отводится в грудной проток через левую подключичную вену.Обширная субплевральная сеть поверхностных лимфатических сосудов впадает в бронхолегочные узлы. Глубокое лимфатическое сплетение проходит вдоль бронхиального дерева, и легочные сосуды сначала стекают в легочные узлы, а затем в бронхолегочные узлы. Затем они стекают в трахеобронхиальные лимфатические узлы и, наконец, в грудной проток.
- Станции и зоны лимфатических узлов: Расположение лимфатических узлов нанесено на карту в 14 станций и семь зон в соответствии с их отношением к различным хирургическим ориентирам, таким как трахея, бронхи, плевра, магистральные сосуды.
Надключичная зона
Верхняя зона (верхние средостенные узлы)
- Станция 2 (верхняя паратрахеальная зона)
- Станция 3 (преваскулярная, ретротрахеальная)
- Станция 4 (нижняя паратрахеальная)
Узлы аорты
- Станция 5 (субаортальная)
- Станция 6 (парааортальная)
Нижний средостение
- Станция 7 (субкаринальная)
- Станция 8 (параэзофагеальная)
- Станция 9 (легочная связка)
Узлы N1
- станция 10 (хилар)
- станция 11 (междолевой)
- ст.12 (лобар)
- ст. 13 (сегмент.)
- ст. 14 (подсегментарная)
Грудная стенка: Грудная стенка состоит из грудной клетки, которая образует костную стенку скелета и кожу, нижележащие мышцы и фасцию.От поверхностного до глубокого грудная стенка содержит следующие слои:
- Кожа
- Поверхностная фасция
- Глубокая фасция
- Зубчатая мышца передняя
- Ребра и межреберные мышцы
- Эндоторакальная фасция
Показания
Новые очаги поражения при визуализации грудной клетки должны быть оценены многопрофильной командой, в которую входят специалисты в области грудной клетки, хирурги и радиологи, чтобы выбрать следующий лучший вариант лечения.[3] Биопсия легкого требуется, когда необходимо установить конкретный диагноз.
Показания для PTLB в соответствии с руководящими принципами BTS (почти дословно) следующие: [3]
- Новое или увеличивающееся образование или единичный узелок на рентгенографии грудной клетки, который не поддается диагностике с помощью КТ или бронхоскопии, показывает вряд ли будет доступен при бронхоскопии.
- Множественные узелки у пациента без злокачественных новообразований в анамнезе, у которого была длительная ремиссия или более одного первичного злокачественного образования.
- Стойкие очаговые инфильтраты, диагноз которых не был поставлен по мокроте, бронхоскопии, посеву крови, серологии.
- Масса хилара.
Трансторакальная игольчатая биопсия (TTNB) показана для оценки недиагностированного легочного узелка или массы в зависимости от предтестовой вероятности рака и наличия или отсутствия метастазов. TTNB также полезен для оценки новообразований средостения, прикорневых новообразований, которые не диагностируются после бронхоскопии, а также для диагностики инфекционных заболеваний, проявляющихся в виде узелков или уплотнений.[4]
Трансбронхиальная биопсия (TBLB) полезна при диффузных и локализованных легочных заболеваниях и часто является основным методом диагностики центрилобулярных поражений, таких как саркоидоз, интерстициальное заболевание легких, гиперчувствительный пневмонит, эозинофильная пневмония или инфекционная этиология, например туберкулез или заболевание легких. подозревается неясная этиология. [5] [6]
VATS предпочтительнее традиционной хирургии из-за меньшего количества осложнений и раннего выздоровления. Он показан для биопсии средостения лимфатических узлов, биопсии плевры, биопсии легочной ткани / лимфатического узла и неустановленного интерстициального заболевания легких.[7] [8]
Традиционно открытая или хирургическая биопсия (OLB) считалась золотым стандартом диагностики паренхиматозных поражений легких. Однако обычно предпочтение отдается менее инвазивному методу, если только нет серьезных противопоказаний, и OLB следует рассматривать только в том случае, если получение диагноза изменит линию лечения, а основное заболевание не имеет высокой смертности. [9]
Противопоказания
Существует множество относительных противопоказаний для PTLB, как описано в руководящих принципах BTS (почти дословно): [3]
- Отсутствие информированного согласия является противопоказанием для процедуры в соответствии с руководящими принципами, и необходимо использовать альтернативный метод диагностики. быть на рассмотрении.
- Пневмонэктомия в анамнезе является противопоказанием. Однако, если биопсийное поражение находится на плевральной основе, то процедура может быть предпринята до тех пор, пока легочная ткань не пересечена.
- Если при КТ подозревается сосудистое поражение или АВМ, процедура не должна рассматриваться, и должно быть проведено собрание мультидисциплинарной группы, чтобы определить следующий шаг в лечении.
- Для пациентов, находящихся на ИВЛ, биопсия легкого может быть невозможна из-за ограниченного доступа.
- Несмотря на предоперационное консультирование, некоторые пациенты могут отказываться от сотрудничества и двигаться во время процедуры. Следовательно, в этих случаях необходимо рассмотреть другой метод диагностики.
- Нарушение функции легких или показателей коагуляции во время оценки перед процедурой.
Для трансторакальной биопсии, помимо кровоточащего диатеза, другие противопоказания включают тяжелую эмфизематозную болезнь, наличие пузырей, препятствующих биопсии, пациентов с трудноизлечимым кашлем, пациентов на искусственной вентиляции легких и пациентов с легочной гипертензией.[4] Противопоказания для получения биоптатов с помощью гибкой бронхоскопии включают отсутствие информированного согласия, тяжелый кровоточащий диатез, который нельзя исправить до процедуры, тяжелую гипоксемию, уремию, тромбоцитопению и легочную гипертензию. [10] [11]
Помимо плохого общего состояния, коагулопатии и недавнего инфаркта миокарда, VATS противопоказан пациентам с непереносимостью вентиляции одного легкого. [12]
Оборудование
Чрескожная биопсия легкого под контролем КТ : В зависимости от решения о выполнении корешковой биопсии отдельно или вместе с FNA доступны несколько вариантов игл для чрескожной биопсии легкого, включая аспирационные и режущие иглы.Выбор иглы также зависит от таких факторов, как размер поражения, траектория иглы и предпочтения оператора. [13] Типичная коаксиальная установка будет включать иглу Chiba 22-го калибра для FNA или пистолет 20-го калибра для получения основной биопсии. Процедура выполняется с подробной визуализацией под контролем рентгеноскопии или компьютерной томографии. Команда, состоящая из радиолога и цитопатолога, должна быть доступна для процедуры и проверять соответствие образца.
Трансбронхиальная биопсия: Основное оборудование включает гибкий бронхоскоп взрослого размера с источником света и видеонаблюдением.Образцы тканей берутся с помощью щипцов для биопсии, которые помещаются в контейнеры для образцов. Должны быть в наличии аспирационные аппараты, подача кислорода, а также оборудование для сердечно-легочной реанимации.
Cryo-TBB: Специальный гибкий зонд используется для замораживания и отбора проб легочной ткани до -89 F с использованием закиси азота.
VATS: Установка для процедуры VATS включает видеоторакоскоп, ручку для диатермии, зажим для губки и щипцы для биопсии, эндоскопические устройства для перемещения скоб, жесткую или гибкую канюлю троакара, лоток для торакотомии, грудную трубку с водяным затвором и источник аспирации. с трубкой.
Открытая биопсия легкого: Это инвазивная оперативная процедура под общей анестезией, и все предполагаемое оборудование должно быть подготовлено перед процедурой, включая лоток для торакотомии, щипцы, сшивающие устройства и дополнительные инструменты.
Персонал
В зависимости от типа процедуры и настроек может потребоваться следующий персонал:
- Сундук-специалист
- Радиолог
- Хирург
- Анестезиологи
- Медперсонал
- Помощники
- Студенты / стажеры / резиденты
- Техники
Препарат
Предоперационная оценка: Перед процедурой следует оценить показатели коагуляции, включая протромбиновое время (ПВ), активированное частичное тромбопластиновое время (АЧТВ), количество тромбоцитов.Пациентам с числом тромбоцитов перед процедурой менее 100 000 / м2 и соотношением APPT или PT более 1,4 требуется консультация гематолога, что является относительным противопоказанием для процедуры. В случае PTLB необходимо прекратить прием пероральных антикоагулянтов перед процедурой в соответствии с рекомендациями по периоперационной антикоагуляции. [3]
Для пациентов с ВРЭ менее 35%, прогнозируемых недавней спирометрией, должна быть проведена многопрофильная бригада с рентгенологом и пульмонологом, как минимум, следует проконсультироваться для оценки риска по сравнению спреимущество продолжения процедуры. Должны быть доступны как недавние, так и предыдущие рентгенограммы, чтобы решить, является ли процедура полезной. В случае бронхоскопической биопсии процедура не должна выполняться в течение шести недель после инфаркта миокарда. [3]
Детали процедуры должны быть объяснены пациенту и предоставлены в письменной форме. Перед процедурой необходимо получить письменное информированное согласие. Должен быть организован соответствующий персонал для наблюдения за пациентом до, во время и после процедуры.[3]
Техника
Чрескожная биопсия легких под контролем КТ : Желательно, при умеренной седации, делать снимки с помощью компьютерной томографии или рентгеноскопии и планировать путь доступа. Иногда можно использовать коаксиальную технику, чтобы минимизировать количество проколов плевры. После подтверждения положения с помощью компьютерных томографов проводится либо FNA, либо керн-биопсия, и образец немедленно передается либо цитопатологу, либо цитотехнику.[13] Могут использоваться другие продвинутые методы, такие как трансгрудинный доступ и трансвенозный доступ.
Трансбронхиальная биопсия: Бронхоскопия остается ключевой в диагностике поражений центральных дыхательных путей. Последовательность событий для проведения трансбронхиальной биопсии следующая:
- После местной анестезии гибкий бронхоскоп перемещается через трансоральный или трансназальный путь.
- Проводится тщательный осмотр всех сегментов легких с двух сторон.
- Идентифицируется область для биопсии, и гибкий бронхоскоп вклинивается в сегментарный бронх.
- Биопсийные щипцы пропускают через рабочий канал гибкого бронхоскопа по направлению к периферии поражения до тех пор, пока не встретится сопротивление, после чего щипцы слегка отводят и открывают челюсти. Челюсти выдвигаются к более ранней зоне сопротивления и закрываются.
- Щипцы для биопсии надежно втягиваются с вращательными движениями или без них, а полученный образец помещается в формалин для гистопатологического исследования.
- Обычно от четырех до шести образцов TBLB получают из областей легкого, которые, по-видимому, участвуют в визуализации. Если легкие поражены равномерно, проводится биопсия как верхней, так и нижней доли. Одним из ограничений TBLB является небольшой размер образцов ткани, которые склонны к разрушению артефактов.
Cryo-TBB: Трансбронхиальная криобиопсия (крио-TBB) выполняется при умеренной седации с использованием специального гибкого зонда, который использует закись азота для быстрого охлаждения наконечника до -89 ° C, таким образом замораживая соседние ткани, которые затем удаляются, прикрепленные к кончик зонда.
VATS: Анестезия вводится пациенту в положении лежа на спине перед процедурой, и вставляется двухпросветная трубка (DLT), которая обычно является предпочтительным дыхательным путем. В переднем доступе делаются три разреза и обычно создаются три порта, включая камеру и операционные порты, которые проверяются с помощью видеоторакоскопа. Дальнейшие действия указаны в зависимости от выполняемой конкретной процедуры. В послеоперационном периоде необходимо обеспечить соответствующий обезболивающий, респираторный и дренажный зонд.[7]
Открытая биопсия легкого: Под общей анестезией, когда пациент лежит на спине, делается разрез на 2–3 см латеральнее линии соска. Плевру вводят между пятым и шестым ребром, и проводят тупую диссекцию, чтобы вывести легочную ткань в операционное поле. Диагностическая резекция клина выполняется с помощью линейного степлера. Образцы биопсии отправляются гистопатологу для обработки в формалине.
Осложнения
Такие события, как массивное кровохарканье, легочное кровотечение, воздушная эмболия легочных вен и обширный гемоторакс, вызывают смертность от PTLB.Пневмоторакс (наиболее частое осложнение), легочное кровотечение, гемоторакс, тампонада сердца и посев вместе с ходом иглы вызывают осложнения [3].
При трансбронхиальной биопсии реакция на местный анестетик, травма, вызванная ЭТ-трубкой, ларингоспазм, бронхоспазм, гиповентиляция, пневмоторакс и кровотечение являются одними из потенциально серьезных осложнений. Благодаря своему профилю безопасности, более быстрому периоду восстановления и меньшему количеству осложнений, VATS в значительной степени заменил открытую торакотомию во всем мире.Однако потенциальные осложнения после VATS включают послеоперационную боль и утечку воздуха, гипоксемию, ателектаз, кровотечение и раневую инфекцию. [7]
Клиническая значимость
Биопсия легких выполняется как в плановых, так и в экстренных случаях. Необходимость биопсии легкого в каждом случае должна определяться мультидисциплинарным коллективным подходом, по крайней мере, с участием пульмонолога и радиолога.
При интерстициальных заболеваниях легких биопсия легкого рекомендуется, если рентгенологическая картина не является классической для UIP или возможного UIP.Биопсия легкого также важна для пациентов с такими клиническими особенностями, как возраст менее 50 лет, потеря веса, лихорадка, кровохарканье или признаки васкулита. Он также показан пациентам с прогрессирующим течением заболевания, атипичными или быстро меняющимися результатами КТВР, необъяснимыми внелегочными проявлениями или легочными сосудистыми заболеваниями неясного происхождения. Специфические неопластические и инфекционные процессы, которые могут имитировать хронические прогрессирующие ILD, также могут быть исключены из биопсии легкого. У иммунокомпетентных пациентов плановая и срочная биопсия легких приводит к терапевтическим изменениям и имеет приемлемые показатели операционной смертности.Экстренная биопсия редко приводит к терапевтическим изменениям и имеет высокий уровень операционной смертности. [14]
Чрескожная биопсия под контролем КТ — безопасный и эффективный метод диагностики промежуточных поражений легких. Он показан при поражениях, которые выглядят злокачественными, и в случаях с высоким подозрением на злокачественные новообразования. Первоначальная компьютерная томография помогает определить доступность поражения и риск пневмоторакса. Результаты предыдущих исследований биопсии легких под контролем КТ небольших поражений дали безопасные и точные результаты, но менее точны по сравнению с крупными поражениями.[15] По сравнению с FNA, стержневая биопсия имеет немного более высокую общую чувствительность, специфичность и точность с улучшением окончательной диагностики доброкачественных образований. Однако центральная биопсия не рекомендуется при поражениях размером <10 мм из-за увеличения частоты осложнений и снижения диагностической точности [13].
Что касается TBLB, то он долгое время считался общепринятым методом биопсии легких для лечения широкого спектра заболеваний, включая ILD, сосудистые заболевания, болезни легких дыхательных путей и злокачественные новообразования.Это безопасная процедура с низкой общей смертностью 0,1% по сравнению с хирургической биопсией легкого (1%). Еще одним преимуществом является то, что процедура не требует общей анестезии и может выполняться амбулаторно. [16] Его можно использовать при центральных (доступных) поражениях. Однако процедура не так чувствительна, как чрескожная биопсия, при поражениях менее 2 см. По сравнению с этим чрескожная и хирургическая биопсия легкого имеет более высокую диагностическую ценность. CryoTBB безопасен и обычно не вызывает серьезных осложнений.Помимо риска массивного кровотечения, постпроцедурный пневмоторакс составляет от 2,6 до 30%, умеренное кровотечение — от 4 до 78% и редко — смерть (0,3%).
Хотя VATS предпочтительнее хирургической биопсии легкого, существуют ситуации, такие как тяжелое заболевание плевры, ожидаемое кровотечение или более тяжелое респираторное нарушение, которое способствует использованию SLB-торакотомии. Пациенты с тяжелой гипоксемией или искусственной вентиляцией легких не являются хорошими кандидатами для ВАТС, поскольку для этого требуется период вентиляции одного легкого.
Последние достижения в интервенционной пульмонологии произвели дальнейшую революцию в диагностике новообразований в легких, узелков, лимфаденопатии и заболеваний плевры. Теперь доступны новые диагностические методы, такие как RP EBUS (эндобронхиальное ультразвуковое исследование с радиальным зондом) или ENB (электромагнитная навигационная бронхоскопия). Эффективность этих новых методов сопоставима с результатами биопсии под контролем КТ с меньшими осложнениями. CP-EBUS (центральный зонд эндобронхиального ультразвука), RP-EBUS и ENB также более эффективны при лечении рака, чем бронхоскопия.Эти вмешательства помогают в ранней диагностике и лечении пациентов. [17]
Улучшение результатов команды здравоохранения
Как обсуждалось ранее, решение о биопсии легкого и конкретном типе процедуры должно приниматься многопрофильной командой, состоящей из радиолога, хирурга и специалиста по грудной клетке. [3]
Мониторинг медсестер, смежного здравоохранения и межпрофессиональной группы
Медперсонал должен контролировать жизненно важные функции после процедуры в течение нескольких часов после процедуры и принимать соответствующие меры с помощью дренажной трубки, если таковая имеется.
(Щелкните изображение, чтобы увеличить)
Бронхолегочные сегменты
Предоставлено доктором Пранавом Моди, MBBS (Источник: https://en.wikipedia.org/wiki/Bronchopulmonary_segment#/media/File:Bronchopulmonary_segments.png)
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Значение комбинированной трансбронхиальной биопсии легкого под радиальным эндобронхиальным ультразвуковым контролем и метагеномного секвенирования нового поколения для периферических инфекционных поражений легких
Предпосылки . Метагеномное секвенирование следующего поколения (mNGS) — это новая технология, которая позволяет беспристрастно обнаруживать патогены. Тем не менее, имеется немного сообщений о mNGS биопсии тканей легкого для диагностики легочной инфекции. Кроме того, радиальное эндобронхиальное ультразвуковое исследование (R-EBUS) широко используется для обнаружения периферических поражений легких (PPL), но редко используется для диагностики периферических инфекций легких. Цель . Настоящее исследование направлено на оценку комбинированного применения трансбронхиальной биопсии легкого (TBLB) под контролем R-EBUS и mNGS для диагностики периферических инфекционных поражений легких. Методы . С июля 2018 года по апрель 2019 года в этом проспективном рандомизированном исследовании был включен 121 пациент из больницы общего профиля Тяньцзиньского медицинского университета с диагнозом PPL и легочной инфекцией. После того, как поражение было обнаружено, у случайно выбранных пациентов выполняли TBLB или TBLB под контролем R-EBUS, а для обнаружения патогенов в тканях биопсии легких применяли mNGS.Результаты mNGS сравнивали между группой TBLB и группой TBLB под контролем R-EBUS. Кроме того, были проанализированы клинические характеристики и изображения EBUS 61 пациента, получавшего бронхоскопию для выявления инфекций периферических легких, и сопоставлены с результатами mNGS. Результатов . Частота положительности mNGS в TBLB под контролем R-EBUS была (78,7%, 48/61), что было значительно выше, чем (60,0%, 36/60) в группе TBLB. Различие в положении зонда R-EBUS и характеристиках изображения инфекционных поражений периферических легких повлияли на частоту положительности mNGS.Ткань, собранная с помощью R-EBUS в пределах поражения, давала более высокий показатель положительности, чем образцы, собранные рядом с поражением (отношение шансов 17,742; 95% доверительный интервал от 1,325 до 237,645). Безэховые области и светящиеся области характеристик ультразвукового изображения коррелировали с более низким показателем положительности mNGS (соответственно, отношение шансов 17,878; 95% доверительный интервал от 1,595 до 200,399; отношение шансов 16,745; 95% доверительный интервал от 1,106 до 253,479). . Выводы . TBLB под контролем R-EBUS — это безопасный и эффективный метод диагностики периферических инфекционных поражений легких.R-EBUS значительно облегчает точное введение бронхоскопа в очаги поражения, что повышает эффективность анализа mNGS при обнаружении патогенов. Положение зонда R-EBUS в очаге поражения давало более высокую степень положительности анализа mNGS. Тем не менее, наличие безэховых и светящихся областей на ультразвуковом изображении коррелировало с низкой частотой положительности mNGS.
1. Введение
Легочная инфекция является ведущей причиной смерти и заболеваемости во всем мире [1]. Однако точный диагноз возбудителя является сложной задачей из-за сложности микробиоты дыхательных путей.Сотни патогенов связаны с легочными инфекциями, включая бактерии, вирусы и грибы [2–4]. Методы идентификации патогенов, требующие больших затрат времени, не только способствуют увеличению заболеваемости и смертности от легочных инфекций, но и неизбирательному применению антибиотиков широкого спектра действия, что препятствует применению противомикробных препаратов. Кроме того, чувствительность и специфичность обычных методов обнаружения патогенов снижаются после введения антибактериальной терапии. Быстрое и точное обнаружение патогенов и выявление легочных инфекций имеет решающее значение для своевременной противомикробной терапии.
Идентификация патогенов с помощью mNGS основана на объективном обнаружении нуклеиновых кислот, выделенных из клинических образцов, включая, помимо прочего, ткани, биологические жидкости, мазки и бронхоальвеолярный лаваж, стул или полимикробные абсцессы [5]. Применение mNGS в диагностике инфекционных заболеваний включает отслеживание клонов, обнаружение генов лекарственной устойчивости и исследование микробиома [6–10]. Однако сообщений о применении мНГС к тканям биопсии легких при лечении легочной инфекции мало.
Обследование этиологии PPL является сложной задачей по сравнению с центральными поражениями легких из-за ограничений в получении гистопатологических образцов. Обычная бронхоскопия затрудняет определение точного местоположения поражений в периферическом легком. Чрескожная биопсия под контролем КТ связана с более высоким риском осложнений, включая пневмоторакс или кровохарканье [11, 12]. После того, как она усложнена, продолжить пункционную биопсию легкого совсем по-другому или даже невозможно. TBLB под контролем R-EBUS была продемонстрирована как безопасная и стабильная процедура и широко используется при лечении периферических заболеваний легких, особенно при периферическом раке легких [13–19].TBLB под контролем R-EBUS редко применяется в диагностике инфекционных поражений периферических легких. Целью настоящего исследования было изучить значение комбинированного TBLB и mNGS под контролем R-EBUS в обнаружении патогенов для диагностики периферических легочных инфекционных поражений.
2. Методы и предметы
2.1. Субъекты
Проспективное рандомизированное исследование бронхоскопических процедур было проведено в больнице общего профиля Тяньцзиньского медицинского университета в период с июля 2018 г. по апрель 2019 г. В течение этого периода бронхоскопия была проведена у 151 пациента, у которых с помощью спиральной КТ грудной клетки подозревалась периферическая инфекция легких.Среди этих пациентов 30 пациентов были исключены из исследования из-за гистопатологического диагноза рака легких, а у 121 пациента в конечном итоге были диагностированы легочные инфекции. Среди этих пациентов 61 пациенту был поставлен диагноз TBLB под контролем R-EBUS, а другим 60 пациентам — TBLB. Идентификацию патогенов в тканях биопсии легкого проводили с помощью mNGS. Поражение легкого считалось PPL, когда его локализация находилась за сегментарным бронхом [18]. Размер периферического поражения легких измеряли по среднему диаметру поражения в настройках осевого окна легкого по изображениям КТ.Также регистрировали расположение и расстояние каждого PPL от реберной и висцеральной плевры. Поражение было классифицировано как узелок или кавитация, сливное / пятнистое уплотнение и матовое стекло (GGO) в соответствии с методом визуальной оценки, основанным на затухании КТ и измененным по сравнению с предыдущим исследованием [20]. Критерии включения пациентов были следующие: (I) пациенты с PPL, определенные как аномальный рост, обнаруженный с помощью компьютерной томографии и диагностированный как инфекционные заболевания, и (II) возраст ≥18 лет. Критерии исключения были следующими: (I) возраст <18 лет; (II) пациенты, перенесшие операции на легких в анамнезе; и (III) пациенты с тяжелыми структурными заболеваниями легких, сердечно-сосудистыми и цереброваскулярными заболеваниями и другими причинами, которые не могут получить TBLB.Окончательный диагноз периферической легочной инфекции должен сочетаться со спиральной КТ грудной клетки, традиционными лабораторными методами, гистопатологией и результатами mNGS. После лечения антимикробными препаратами клинические симптомы пациента уменьшились или уменьшились. Пациенты наблюдались после выписки, рецидивов у них не было. Спиральная компьютерная томография грудной клетки показала улучшение или абсорбцию поражений легких.
2.2. Аппарат
Электронный видеобронхоскоп (Olympus BF-F260 или Olympus BF-P-260F, Olympus, Токио, Япония), ультразвуковой хост (MAJ-935, Olympus, Токио, Япония), R-EBUS с 1.Диаметр 4 мм (UM-S20-17S, Olympus, Токио, Япония) и щипцы для биопсии (JHY-FB-18-105-O-O-A1, Changzhou Jiuhong) использовались при выполнении TBLB или TBLB под контролем R-EBUS.
3. Порядок действий
3.1. TBLB и процедура TBLB под контролем R-EBUS
TBLB выполнялась в соответствии с диагностическим руководством по гибкому бронхоскопическому применению (издание 2008 г.), опубликованным Китайской медицинской ассоциацией респираторных заболеваний [21]. Бронхоскопические процедуры проводились под местной анестезией лидокаином и внутримышечно меперидином под наблюдением терапевта.На протяжении всего исследования седация сознания не применялась. Пульсоксиметрия использовалась для контроля оксигенации во время процедуры, кислород вводился через носовой канюль всякий раз, когда это необходимо для поддержания насыщения кислородом> 90%.
Поражения были локализованы путем изучения КТ грудной клетки. Процедуру биопсии повторяли до тех пор, пока легочная ткань не разлилась по поверхности щипцов для биопсии. В группе TBLB оператор подвел бронхоскоп к подозреваемым бронхам как можно дальше, пока не встретил сопротивление, а затем провел биопсию щипцами.В группе TBLB под контролем R-EBUS зонд EBUS вводили в предполагаемые бронхи через рабочий канал бронхоскопа до тех пор, пока не возникло сопротивление для обнаружения PPL. Как только поражение было обнаружено, R-EBUS проводилась через рабочий канал бронхоскопа до тех пор, пока не возникло сопротивление. Затем зонд EBUS был вставлен в предполагаемые бронхи для обнаружения PPL перед выполнением TBLB под контролем R-EBUS. Все патологические результаты были проверены двумя опытными патологоанатомами.Чтобы определить, развился ли ятрогенный пневмоторакс, через 4 часа после процедуры были сделаны первоначальные рентгенограммы грудной клетки, а на следующий день — контрольные рентгеновские снимки грудной клетки.
3.2. Сбор и обработка образцов
Биопсии легких были отдельно отправлены в лаборатории клинической микробиологии и гистопатологии в течение 2 часов для анализа. Оставшиеся или оставшиеся гомогенаты ткани хранили при -70 ° C для mNGS.
Биоптаты легких были разрезаны на мелкие кусочки в соответствии со стандартными процедурами.Микроцентрифужную пробирку объемом 1,5 мл с 0,7 мл буфера для лизиса и кусочки образца ткани и 1 ° g 0,5 мм стеклянную бусину прикрепляли к горизонтальной платформе на вихревой мешалке и энергично перемешивали со скоростью 2800–3200 об / мин в течение 30 мин. Образец объемом 0,3 мл разделяли в новую микроцентрифужную пробирку объемом 1,5 мл и экстрагировали ДНК с помощью набора TIANamp Micro DNA Kit (DP316, TIANGEN BIOTECH) в соответствии с рекомендациями производителя. При экстракции РНК использовались те же процедуры сбора ткани, что и упомянутые выше, набор для экстракции QIAamp Viral RNA Mini Kit (52904 #, QIAGEN) был использован для экстракции РНК, а затем была создана комплементарная ДНК (кДНК) из матрицы РНК путем обратной транскрипции.
БиблиотекиДНК были сконструированы посредством ДНК-фрагментации, восстановления концов, лигирования адаптера и амплификации ПЦР. Биоанализатор Agilent 2100 (Agilent Technologies, Санта-Клара, Калифорния) использовался для контроля качества библиотек ДНК. Квалифицированные библиотеки были секвенированы с помощью платформы BGISEQ-50 [22]. Для каждого образца было получено не менее 20 млн считываний. Данные высококачественного секвенирования были получены путем удаления низкокачественных и коротких (длина <35 п.н.) считываний с последующим компьютерным вычитанием последовательностей человека-хозяина, сопоставленных с эталонным геномом человека (hg19) с использованием выравнивания Барроуза-Уиллера [23].Остальные данные путем удаления считываний низкой сложности были классифицированы путем одновременного сопоставления с четырьмя базами данных микробного генома, состоящими из вирусов, бактерий, грибов и паразитов. Базы данных по классификации были загружены из NCBI (ftp://ftp.ncbi.nlm.nih.gov/genomes/). RefSeq содержит 4061 полногеномную последовательность вирусных таксонов, 2473 бактериальных генома или каркаса, 199 грибов, связанных с инфекцией человека, и 135 паразитов, связанных с заболеваниями человека. Сочетая результаты контролей и калибраторов, использовались алгоритмы анализа данных для исключения микроорганизмов, которые не имели существенного отношения к инфекции.Сообщалось о микроорганизмах, имеющих клиническое значение, при чтении секвенирования микроорганизмов, обнаруженных на уровне рода / вида.
3.3. Оценка результатов mNGS в тканях биопсии легкого
Результаты подхода, основанного на mNGS, оценивали 2 независимых клинических специалиста, не связанных с исследованием.
3.4. Статистический анализ
SPSS (версия 17.0, SPSS Inc, Чикаго, Иллинойс) использовался для статистического анализа. Данные выражены в виде среднего значения (стандартное отклонение).Парные тесты t были использованы для сравнения средних значений независимых переменных. Для категориальной переменной использовался критерий хи-квадрат Пирсона или точный критерий Фишера. Тесты многомерной логистической регрессии использовались для дальнейшего подтверждения результатов анализа независимых переменных. Значение <0,05 считалось статистически значимым.
4. Результаты
4.1. Популяция исследования
Всего в проспективное рандомизированное исследование был включен 121 пациент с инфекционными поражениями периферических легких, 60 пациентов в группе TBLB и 61 пациент в группе TBLB под контролем R-EBUS.Их исходные характеристики показаны в таблице 1. Не наблюдалось значительных различий в исходных характеристиках между группой TBLB и группой TBLB, управляемой R-EBUS,.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| GGO, матовое стекло непрозрачность. MTBC, микобактерии туберкулезного комплекса.Данные представлены как нет. (%) или среднее значение ± стандартное отклонение, если не указано иное. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.2. Диагностическая ценность mNGS
Окончательный диагноз целевых поражений показан в таблице 2. В группе TBLB бактериальная инфекция была выявлена у 30 пациентов (50%), вирусная инфекция — у 12 пациентов (20%), грибковая инфекция — у 18 пациентов ( 30%), атипичная инфекция патогена у 6 пациентов (10%) и инфекция микобактериями туберкулеза (MTBC) у 9 пациентов (15%). В группе TBLB под контролем R-EBUS бактериальная инфекция была выявлена у 33 пациентов (54.1%), вирусная инфекция у 11 пациентов (18%), грибковая инфекция у 21 пациента (34,4%), инфекция атипичным патогеном у 7 пациентов (11,5%) и инфекция MTBC у 10 пациентов (16,4%). mNGS успешно идентифицировал патогены у 48 из 61 пациента (78,7%) в группе TBLB под контролем R-EBUS и у 36 из 60 пациентов (60,0%) в группе TBLB. Наблюдалась значительная разница в частоте положительных результатов между группой R-EBUS-TBLB и группой TBLB (78,7% / 60,0%,).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PPL, периферические поражения легких. R-EBUS, радиальное эндобронхиальное ультразвуковое исследование. TBLB, трансбронхиальная биопсия легкого. mNGS, метагеномное секвенирование следующего поколения.Данные представлены как нет. (%) если не указано иное. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.3. Наиболее часто идентифицируемые mNGS патогены у пациентов с иммунодефицитом и без иммунодефицита
Более половины из 121 включенного пациента имели гематологические злокачественные новообразования, в том числе 70 человек с ослабленным иммунитетом и 51 человек с иммунодефицитом. Люди с ослабленным иммунитетом были более восприимчивы к легочным инфекциям, чем иммунокомпетентные. Наиболее распространенные патогены, обнаруживаемые с помощью mNGS, показаны в таблице 3.
| ||||||||||||||||||||||||||||||||||||||
| mNGS, метагеномное секвенирование нового поколения. MTBC, микобактерии туберкулезного комплекса. EBV, вирус Эпштейна – Барра. ЦМВ, цитомегаловирус. Данные представлены как нет. (%) если не указано иное. | ||||||||||||||||||||||||||||||||||||||
4.4. Взаимосвязь между характеристиками поражений и диагностической эффективностью mNGS в группе R-EBUS
В группе R-EBUS диаметр области поражения> 3 см был связан со значительно более высокой диагностической эффективностью при однофакторном анализе (Таблица 2, отношение шансов 6,080 ; 95% доверительный интервал (ДИ) от 1,630 до 22,685). Однако значимость была потеряна после многомерного анализа в сочетании с положением зонда R-EBUS и характеристиками изображений EBUS (таблица 2,, отношение шансов 8.757; 95% доверительный интервал (ДИ) от 0,858 до 89,417). Расстояние от грудной стенки поражения не было связано с диагностической эффективностью mNGS (Таблица 2,). Присутствие зонда в поражении было связано со значительно большей диагностической эффективностью при радиальном EBUS, чем когда зонд был обнаружен рядом с поражением (Таблица 2,, отношение шансов 17,742; 95% доверительный интервал (ДИ) от 1,325 до 237,645).
На EBUS-изображении нормальной паренхимы легких, окружающей бронхиальные структуры, наблюдались неоднородные и многочисленные гиперэхогенные частицы, которые обычно называли метелью [24].Частицы однородных внутренних эхо-изображений были единодушны по размеру, эхогенности и распределению, а эхогенность неизменно была несколько ниже, чем в нормальной паренхиме легкого [24]. Основными поражениями с однородным внутренним эхом была пневмония, характеризующаяся альвеолами, заполненными экссудатом [25] (рис. 1). Неоднородные внутренние эхо-сигналы отображали мозаичный узор в отображении распределения частиц, и частицы различались по размеру. На изображениях представлены участки без эха, соответствующие гистопатологическим характеристикам участков некроза [26] (рис. 2).Светящиеся области выглядели как слияние огромных сверкающих точек разного размера и формы, что могло быть результатом разрушения бронхов, образования конденсата в некротических областях или кальцификации (рис. 3). Несветящиеся области, вероятно, не были опухолевыми [25]. Изображения EBUS поражений GGO включали чистый и частично твердый GGO, которые называли метелью или смешанной метелью, часто злокачественными. Чистый тип обычно демонстрирует легкое, но заметное увеличение интенсивности и радиуса беловатой акустической тени нормального легкого на EBUS.В смешанном знаке метели (рис. 4) внутреннее эхо поражений продемонстрировало диффузную неоднородность с несколькими гиперэхогенными точками, линейными дугами и сосудами, которые были распределены нерегулярно или в сочетании со знаком метели [27, 28].
В нашем исследовании патогены были успешно обнаружены с помощью мНГС в основном в очаге поражения с однородными внутренними эхосигналами (35 из 48 случаев, 72,9%), а 4 очага поражения (4 из 13 случаев, 30,8%) с однородными внутренними эхосигналами были отрицательными при мНГС анализ. Более половины случаев имели характеристики безэховой зоны в отрицательных случаях mNGS (8 из 13 случаев, 61.5%), в то время как только 5 случаев имели положительные результаты mNGS с анэхогенными участками, включая 1 случай туберкулеза легких и 1 абсцесс легкого. Было обнаружено 8 случаев с участием светящихся областей с положительными результатами mNGS (8 из 48 случаев, 16,7%) и 8 случаев с отрицательными mNGS (8 из 13 случаев, 38,5%). Однородные внутренние эхо-сигналы коррелировали с лучшей диагностической эффективностью mNGS из тканей биопсии легкого с помощью одномерного анализа (таблица 2; отношение шансов 6,058; 95% доверительный интервал (ДИ) от 1,588 до 23,107). Однако значимость была потеряна после многомерного анализа в сочетании с положением зонда R-EBUS и характеристиками изображений EBUS (таблица 2,, отношение шансов 8.598; 95% доверительный интервал (ДИ) от 0,903 до 81,885). Безэховые области и светящиеся области характеристик ультразвукового изображения коррелировали с более низкой диагностической эффективностью mNGS (таблица 2, соответственно, отношение шансов 17,878; 95% доверительный интервал (ДИ) от 1,595 до 200,399; отношение шансов 16,745; 95% доверительный интервал (CI) от 1,106 до 253,479).
4.5. Осложнения
В целом осложнения, относящиеся к группе TBLB, возникли у 4 пациентов (6,6%): легкое кровотечение развилось у 2 пациентов (3.3%) и пневмоторакс развился у 2 пациентов (3,3%). У одного пациента (1,6%) развилось легкое кровотечение, и у одного пациента (1,6%) развился пневмоторакс в группе TBLB под контролем R-EBUS. Кровотечение уменьшилось после местного применения норадреналина и внутривенного капельного введения вазопрессина. Пневмоторакс разрешился спонтанно без дренирования дренажа грудной клетки. После процедуры ни у одного пациента не было сильного кровотечения, воздушной эмболии, дыхательной недостаточности или легочной инфекции. Не было преждевременного прекращения процедуры, и ни один из пациентов не умер из-за ее применения.Не было обнаружено значительных различий в частоте возникновения осложнений между группой TBLB и группой TBLB под контролем R-EBUS (Таблица 1,).
5. Обсуждение
Отсутствие точного этиологического диагноза остается основной причиной высокой заболеваемости и смертности при легочных инфекциях, что увеличивает расходы на здравоохранение. mNGS — это беспристрастный и быстрый метод, способный одновременно обнаруживать широкий спектр патогенных бактерий, вирусов, грибков и паразитов в клинических образцах. R-EBUS — безопасный и ценный метод, который, как было продемонстрировано, увеличивает диагностическую ценность PPL [29].В настоящее время R-EBUS используется в клинической практике, главным образом, для локализации периферических поражений легких перед биопсией. Сообщений о mNGS в диагностике легочных инфекций с помощью биопсии тканей легкого остается немного, и нет сообщений о комбинированном периферическом ультразвуковом исследовании для диагностики периферических легочных инфекционных заболеваний [30–32]. Ли и др. применили mNGS для обнаружения присутствия патогенных микробов в тканях биопсии легкого посредством пункции легкого, и результаты показали, что диагностическая ценность mNGS составила 75% (15 из 20 случаев) [33].Многочисленные исследования показали, что EBUS помогает точно определить местоположение области PPL и повышает диагностическую точность трансбронхиальной биопсии (TBB) [25, 34–36]. В этом исследовании mNGS успешно идентифицировал патогены у 48 из 61 пациента в группе R-EBUS-TBLB и у 37 из 60 пациентов в группе TBLB. Между двумя группами была значительная разница в диагностической ценности (78,7% / 60,0%). В предыдущих исследованиях сообщалось, что диагностическая эффективность использования EBUS с проводником или биопсии под EBUS при PPL составляла 53–75.9% [13–18, 37]. Наше исследование дает лучшие диагностические результаты, чем предыдущие исследования. Результаты показывают, что R-EBUS полезен для подтверждения точного введения бронхоскопа в очаги поражения и может улучшить показатель положительности mNGS при обнаружении патогенов.
Это исследование показало, что диагностическая ценность обнаружения патогенов с помощью mNGS с TBLB не связана с размером поражения и его расстоянием до грудной стенки очагов периферической инфекции; это не согласуется с предыдущими исследованиями [13–18, 33, 36].Причина может заключаться в том, что у нас не было достаточного размера выборки. В нашем исследовании присутствие зонда внутри поражения было связано со значительно большей диагностической эффективностью с R-EBUS, чем когда зонд был обнаружен рядом с поражением, что согласуется с предыдущими исследованиями [13–18, 33, 36]. Эти данные свидетельствуют о том, что, когда зонд находился в центре поражения, наблюдалась трансмуральная экссудация и инвазия бронха инфекцией, чем когда он находился рядом с поражением.
Наше исследование показало, что характеристики ультразвукового изображения инфекционных поражений периферических легких коррелировали с диагностической эффективностью mNGS. Изображение безэховых областей и светящихся областей характеристик ультразвукового изображения коррелировали с худшей диагностической эффективностью mNGS из тканей биопсии легкого. Поражения с безэхогенными участками и светящимися участками могут быть результатом некроза, когда воспаление дыхательных путей слабое, патогенная нагрузка невысока и поражения имеют тенденцию к хроническому характеру. Следовательно, диагностическая ценность подходов mNGS после TBLB низкая.
У нашего исследования было несколько ограничений. Во-первых, он проводился в одном институте из-за трудностей с набором субъектов, поэтому выборки не было достаточного размера. Во-вторых, у большинства пациентов были гематологические злокачественные новообразования, и потенциальная ошибка отбора могла повлиять на результаты. В-третьих, мы не использовали рентгеноскопию, бронхоскопию с электромагнитной навигацией или виртуальную бронхоскопию с R-EBUS, все из которых могли бы еще больше повысить диагностическую точность биопсии под лучевым EBUS.Принимая во внимание медицинские расходы, включенные пациенты не получали одновременно mNGS-анализ жидкости бронхоальвеолярного лаважа или серологические анализы. Требовалось дальнейшее изучение вопроса о том, превосходит ли mNGS легочной ткани жидкость бронхоальвеолярного лаважа или серологические исследования у пациентов с легочной инфекцией. Кроме того, для подтверждения результатов этого исследования необходимы исследования, разработанные как многоцентровые.
6. Заключение
Пневмония — распространенная инфекция, при которой часто не удается диагностировать патогены.Быстрое и точное обнаружение патогенов и идентификация патогенов имеют решающее значение для точной антибактериальной терапии. Многие пациенты получают антибактериальную терапию, что ограничивает результаты посевов. Таким образом, мы надеемся на скорейшее использование тестирования mNGS для выявления патогена в повседневной клинической практике. Для PPL мы можем комбинировать с R-EBUS. Учитывая высокую стоимость теста mNGS, мы рекомендуем раннее использование тестирования mNGS в случаях неудачного эмпирического лечения и тяжелых случаях.
Несмотря на некоторые ограничения, наше исследование сначала продемонстрировало, что диагностика патогенов инфекционных поражений периферических легких с помощью mNGS в TBLB была значимой и что TBLB под контролем R-EBUS полезен для подтверждения точного введения бронхоскопа в PPL, что улучшает диагностику доходность МНГС.Положение зонда R-EBUS в очаге поражения коррелировало с более высокой диагностической эффективностью mNGS из тканей биопсии легкого. EBUS-паттерны периферических поражений легких с безэхогенными и светящимися областями коррелировали с диагностической эффективностью mNGS.
Доступность данных
Все данные полностью доступны без ограничений.
Этическое разрешение
Все субъекты подписали информированное согласие. Это исследование было одобрено этическим комитетом больницы общего профиля Тяньцзиньского медицинского университета (ссылка IRB2019-133-01).
Раскрытие информации
Авторы заявляют об отсутствии потенциальных конфликтов интересов в отношении исследования, авторства и / или публикации этой статьи.
