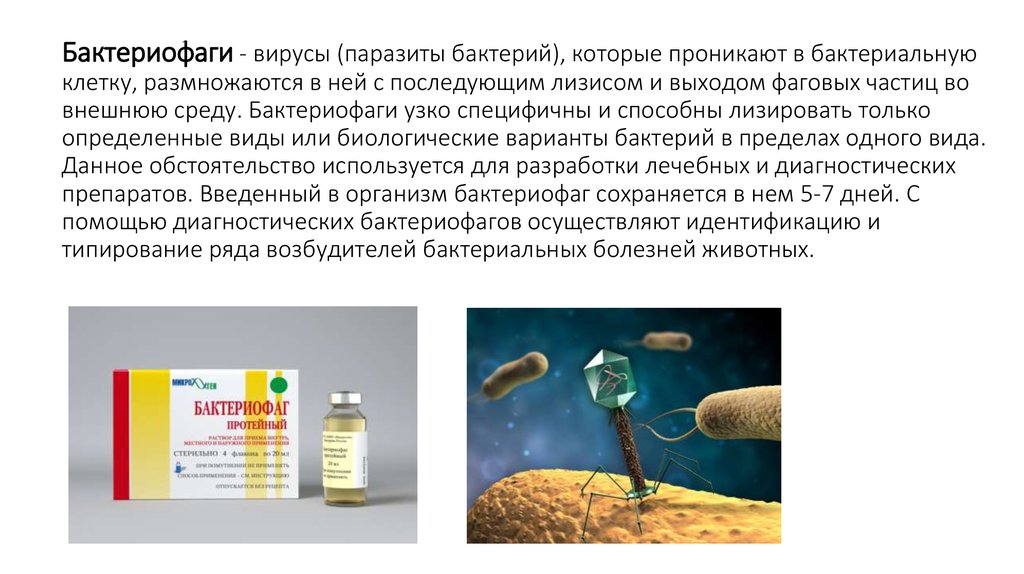
Бактериофаги: как принимать лекарственные препараты бактериофаги для лечения детей и взрослых
Инфекционные болезниГнойные заболеванияИнфекции желудочно-кишечного трактаМужские болезниДетские инфекцииЖенские болезниЛОР заболевания
Кишечная палочкаКлебсиелла озенаКлебсиелла окситокаКлебсиелла пневмонииКлебсиелла риносклеромыПротей вульгарисПротей мирабилисСальмонелла серогруппы АСальмонелла серогруппы BСальмонелла серогруппы ССальмонелла серогруппы DСальмонелла серогруппы ECальмонелла тифимуриумСинегнойная палочкаСтафилококкиCтрептококкиШигелла ЗоннеШигелла Флекснера 1, 2, 3, 4,6 серотиповЭнтерококки
УфаНижний НовгородПермь
По популярностиА-ЯЯ-А
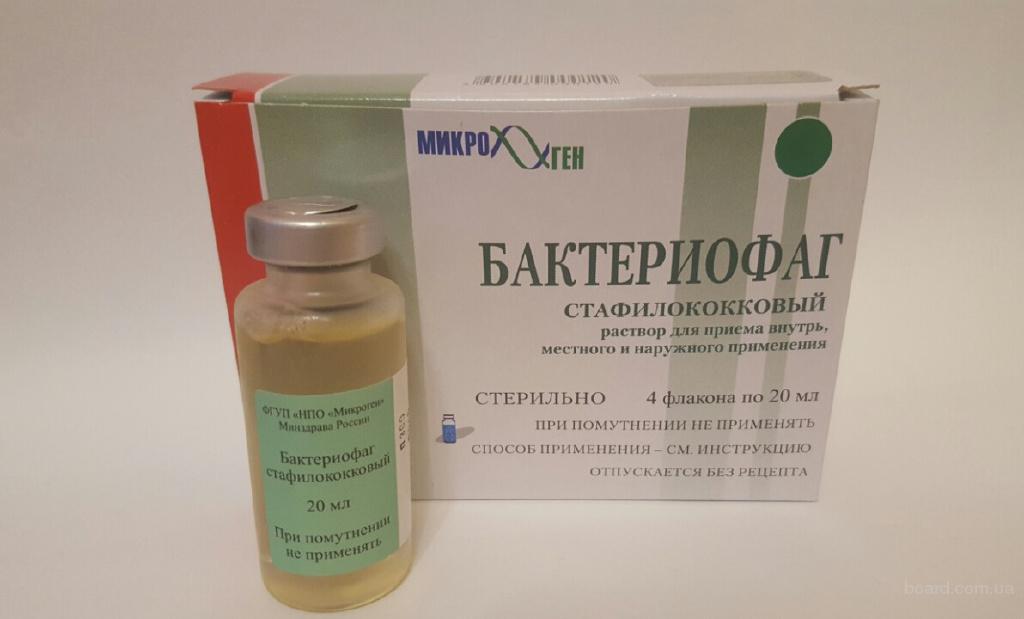
Секстафаг® Пиобактериофаг поливалентный жидкий
Препарат показан для: лечения и профилактики гнойно-воспалительных и энтеральных заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками Перейти на сайт препаратаформы выпуска препарата
Интестифаг® (Интести-бактериофаг)
Препарат показан для: лечения и профилактики заболеваний желудочно-кишечного тракта, вызванных бактериями дизентерии, сальмонеллами, эшерихиями коли, протеем, энтерококками, стафилококками, псевдомонас аэрогиноза или их сочетанием Перейти на сайт препаратаПиофаг® (Пиобактериофаг комплексный жидкий)
Препарат показан для: лечения и профилактики гнойно-воспатлительных и кишечных заболеваний, вызванных стафилококками, энтерококками, стрептококками, синегнойной палочкой, клебсиеллами, патогенной кишечной палочкой различных серогрупп, протеемСтрептофаг® (Бактериофаг стрептококковый)
Препарат показан для: лечения и профилактики заболеваний, вызванных бактериями стрептококкаПиобактериофаг поливалентный очищенный
Препарат показан для: лечения и профилактики гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями стафилококками, стрептококками, протеем, синегнойной палочкой, клебсиеллой пневмонии, кишечной палочкойБактериофаг дизентерийный поливалентный
Препарат показан для: лечения и профилактики бактериальной дизентерии, вызванной шигеллой Флекснера 1, 2, 3, 4,6 серотипов и шигеллой ЗоннеСтафилофаг® (Бактериофаг стафилококковый)
Препарат показан для: лечения и профилактики гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями рода стафилококковБактериофаг псевдомонас аеругиноза (синегнойный)
Препарат показан для: лечения и профилактики заболеваний, вызванных синегнойной палочкойформы выпуска препарата
Бактериофаг сальмонеллезный групп A,B,C,D,E
Препарат показан для: лечения и профилактики заболеваний и бактерионосительства, вызванных сальмонеллами серотипов груп А, В,С,D,ЕКлебсифаг® (Бактериофаг клебсиелл поливалентный очищенный)
Препарат показан для: лечения и профилактики заболеваний, вызванных бактериями клебиселлы пневмонии, клебсиеллы озена, клебсиеллы риносклеромыБактериофаг протейный жидкий
Препарат показан для: Лечение и профилактика гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями Р. vulgaris, Р. mirabilis в составе комплексной терапии
vulgaris, Р. mirabilis в составе комплексной терапииформы выпуска препарата
Бактериофаг коли
Препарат показан для: Лечение и профилактика заболеваний, вызванных бактериями Е. coli в составе комплексной терапииБактериофаг клебсиелл пневмонии очищенный
Препарат показан для: Лечение и профилактика заболеваний, вызванных бактериями Klebsiella pneumoniae в составе комплексной терапииБактериофаг колипротейный
Препарат показан для: лечения и профилактики гнойно-воспалительных и энтеральных заболеваний, дисбактериозов, вызванных бактериями протея и энтеропатогенной кишечной палочкиСимптомы и лечение дисбактериоза у грудничка
Нарушение здоровой микрофлоры кишечника – частая проблема новорождённых.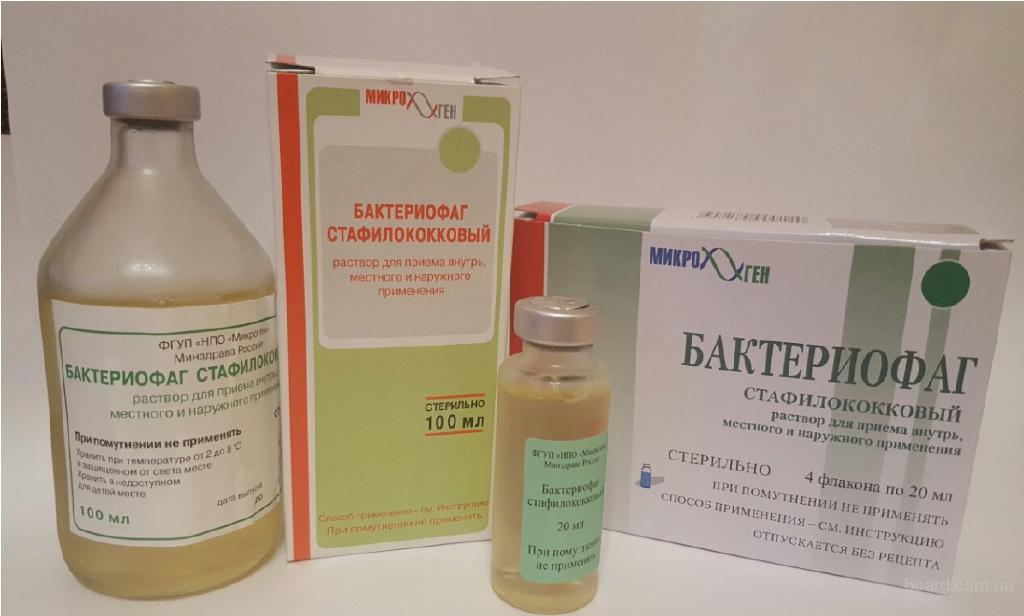 Дисбактериоз у грудничка сопровождается расстройством стула, многократным срыгиванием, болями в животе и вздутием кишечника. Своевременное лечение позволяет избежать усугубления состояния и развития серьёзных патологий пищеварительной системы.
Дисбактериоз у грудничка сопровождается расстройством стула, многократным срыгиванием, болями в животе и вздутием кишечника. Своевременное лечение позволяет избежать усугубления состояния и развития серьёзных патологий пищеварительной системы.
Содержание
- Причины дисбактериоза у грудного ребёнка
- Симптомы дисбактериоз у грудничка
- Степени дисбактериоза
- Диагностика
- Лечение бактериоза у грудничков
- Чем опасен дисбактериоз?
- Профилактика дисбактериоза у грудных детей
- Комаровский о дисбактериозе у грудничков
Причины дисбактериоза у грудного ребёнка
У новорождённых детей проблемы с кишечником чаще возникают из-за нехватки полезных бактерий. Это транзиторный дисбактериоз – заселение бифидобактерий и вытеснение патогенной среды. Физиологический процесс длится с момента рождения и до 10-15 дней жизни.
Дети до года страдают от дисбиоза по таким причинам, как:
- неправильно подобранное питание – частые смены смесей, ранний прикорм, злоупотребление молочными продуктами при непереносимости лактозы;
- антибактериальная терапия – после приёма антибиотиков происходят негативные изменения в микрофлоре кишечника, так как препараты пагубно влияют не только на болезнетворные микроорганизмы, но и на здоровые бактерии;
- инфекционные заболевания – ротавирус, сальмонеллёз, дизентерия;
- гельминтные инвазии, лямблиоз.
Важно! Дисбактериоз у ребёнка на грудном вскармливание встречается намного реже, чем при кормлении смесями. Объясняется это тем, что с материнским молоком младенец получает иммуноглобулин и здоровые микроорганизмы. Причиной водянистого стула, срыгивания и колик в первые 3-5 суток является присутствие в организме вредных клеток, которые вытесняются здоровой микрофлорой в течение 7-10 дней.
Симптомы дисбактериоз у грудничка
Дисбаланс здоровых и болезнетворных бактерий в слизистой кишечника всегда сопровождается ярко выраженной клинической картиной.
Таблица «Проявления дисбиоза у младенцев»
| Признак | Характеристика |
| Стул | Частые поносы (реже запоры). В кале видны остатки непереваренной пищи, комочки слизи, творожные крупинки. Гнилостный запах фекалий |
| Срыгивание | Малыш часто и обильно срыгивает, его тошнит, что нередко заканчивается рвотой |
| Высыпание на коже | Появляется мелкая сыпь по телу (крапивница, атопический дерматит), кожа краснеет, шелушиться, развиваются опрелости |
| Аппетит | Ребёнок плохо ест, исчезает интерес к пище |
| Вес | Младенец слабо набирает в весе или прибавки отсутствуют полностью |
| Дискомфорт в животе | У новорождённых возникает боль, колики, затрудняется отхождение газов, что проявляется чувством распирания в животе, тяжестью |
| Изменения в ротовой полости | У ребёнка появляется тёмный налёт на зубах, дёсна кровоточат, болят. Запах изо рта неприятный. На языке налёт белого, серого цвета Запах изо рта неприятный. На языке налёт белого, серого цвета |
По мере усугубления проблемы, у грудных детей секутся и выпадают волосы, слоятся ногти, кожа на лице и теле бледнеет (видно на фото).
Степени дисбактериоза
Тяжесть протекания дисбиоза у младенцев имеет несколько степеней и зависит от количественного и видового состава микрофлоры кишечника.
- 1 степень – среда анаэробная (нормальная), основу которой составляют лакто- и бифидобактерии (не меньше 105-109). Допускается присутствие условно-патогенных микроорганизмов (до 104 КОЕ в 1 г кала), но не более 2 типов.
- 2 степень – соотношение аэробной (свойственна для болезнетворных клеток) и нормальной флоры 50:50. Наблюдается вытеснение E. Coli (обычной кишечной палочки) патогенными штаммами — лактозонегативные и гемолизирующие энтеробактерии повышены, их концентрация достигает 108 КОЕ/г и больше.
- 3 степень – молочнокислые бактерии значительно снижены, условно-патогенные микроорганизмы замещают здоровую флору.
 Аэробная среда занимает большую часть микрофлоры.
Аэробная среда занимает большую часть микрофлоры. - 4 степень – полное вытеснение здоровой микрофлоры. Условно-патогенные бактерии обладают высокой устойчивостью к антибиотическому воздействию. Развиваются острые кишечные инфекции, возможен сепсис.
Начальная стадия не требует специального лечения. Достаточно скорректировать питание ребёнка или матери (при грудном вскармливании).
Диагностика
Распознать дисбаланс в микрофлоре кишечника помогает анализ на дисбактериоз – бакпосев кала. Материал сдаётся с утра, фекалии собираются в соответствии с требованиями лаборатории. Исследование даёт возможность определить типы болезнетворных бактерий, их чувствительность к конкретным антибиотикам.
Дополнительно назначается биохимический анализ кала. С его помощью определяется степень поражения слизистой оболочки кишечника и уровень метаболитов летучих жирных кислот, производимых патогенными микроорганизмами.
Определить причину дисбактериоза помогают инструментальные методы диагностики и дополнительные анализы:
- гастроскопия;
- УЗИ органов брюшины;
- анализ кала на наличие глистов и лямблий;
- печёночные пробы.

Важно! Комплексная диагностика даёт возможность точно поставить диагноз дисбактериоз, исключив язвенный колит, острую кишечную инфекцию, и выявить источник патологического состояния. Расшифровкой анализов занимается специалист.
Лечение бактериоза у грудничков
При дисбактериозе важную роль играет питание ребенка:
- при грудном вскармливании стараться как можно дольше не переводить младенца на смеси;
- при искусственном кормлении подобрать смесь, которая содержит лакто- и бифидобактерии.
Вылечить дисбиоз реально, если правильно подобрать терапию. Устранить болезнетворные микроорганизмы и восстановить микрофлору кишечника у ребёнка помогают несколько групп препаратов.
- Бактериофаги – удаляют патогенную флору – Интестифаг.
- Пробиотики – содержат здоровые бактерии – Энтерол, Аципол, Линекс, Хилак-форте, Бифилиз.
- Пребиотики – стимулируют рост молочнокислых бактерий – Дюфалак, Инулин, Лактулоза.
Укрепляют ослабленный болезнью иммунитет иммуностимулирующие средства – Анаферон, Полиоксидоний, Амиксин. Все лекарства подбираются индивидуально, с учётом особенностей организма и степени тяжести заболевания.
Все лекарства подбираются индивидуально, с учётом особенностей организма и степени тяжести заболевания.
Чем опасен дисбактериоз?
Дисбаланс здоровых и патогенных бактерий в микрофлоре кишечника – серьёзное отклонение, не лечение которого опасно развитием осложнений:
- нарушается работа внутренних органов;
- процессы гниения в кишечники провоцируют острую интоксикации организма;
- повышается склонность к аллергическим заболеваниям;
- снижается иммунитет, что ведёт к частым простудам;
- нарушается сон, появляется раздражительность, капризность;
- наблюдается отставание в развитии.
Профилактика дисбактериоза у грудных детей
Уберечь ребёнка от неприятных проблем с кишечником помогают простые меры профилактики.
- Отдавать предпочтение грудному вскармливанию, при этом мамам строго следить за собственным питанием.
- При невозможности грудного вскармливания тщательно подбирать смеси, используя те, в составе которых присутствуют пре- и пробиотики.
 Стараться пользоваться одним видом смеси.
Стараться пользоваться одним видом смеси. - Не вводить прикорм слишком рано. В норме первое знакомство со взрослой пищей происходит в 6 месяцев.
- Следить за здоровьем малыша, вести здоровый образ жизни, вовремя проходить профилактические медосмотры.
Профилактика позволяет не допустить развитие дисбиоза или устранить его на ранних стадиях развития. Заболевание намного легче предотвратит, чем вылечить.
Комаровский о дисбактериозе у грудничков
Доктор Комаровский утверждает, что дисбактериоз – это не болезнь. Невозможно по составу кала определить истинную работу кишечника и внутренних органов. По мнению известного врача основная проблема дисбиоза – необоснованные и надуманные переживания родителей, из-за чего они пристают к совершенно нормальному ребёнку, у которого появились незначительные изменения в кале.
Главное лечение такого состояния – не пичкать малыша едой и как можно больше гулять на свежем воздухе. А визиты к врачу, анализы на дисбактериоз, медикаменты для эффективной терапии – пустая трата времени и денег.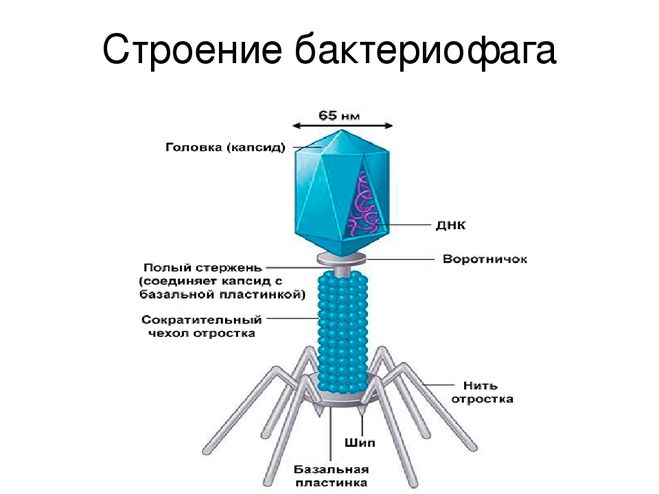
Дисбактериоз – это результат преобладания условно-патогенных микроорганизмов над здоровой микрофлорой в кишечнике. Болезнь наиболее часто встречается у новорожденных детей и грудничков, что связано с незрелостью желудка и кишечника или неправильным питанием. Яркими проявлениями выступают жидкий пенистый стул с запахом гнили и зеленоватым оттенком слизи, кожные высыпания, обильные срыгивания, потеря в весе. Для постановки точного диагноза требуется бакпосев кала. Лечение назначается индивидуально и включает применение бактериофагов, про- и пребиотиков.
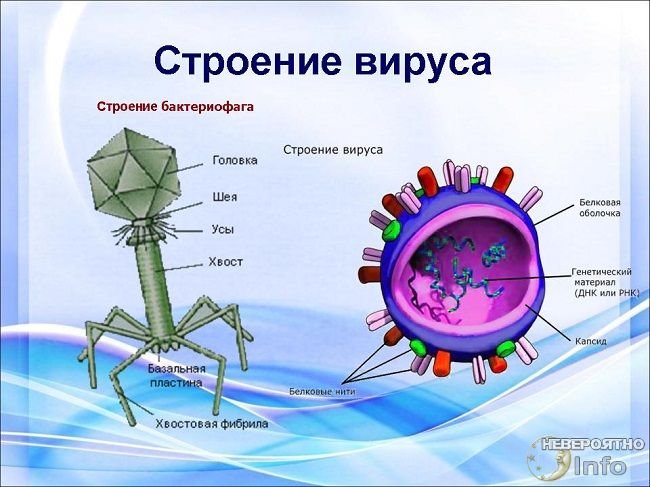
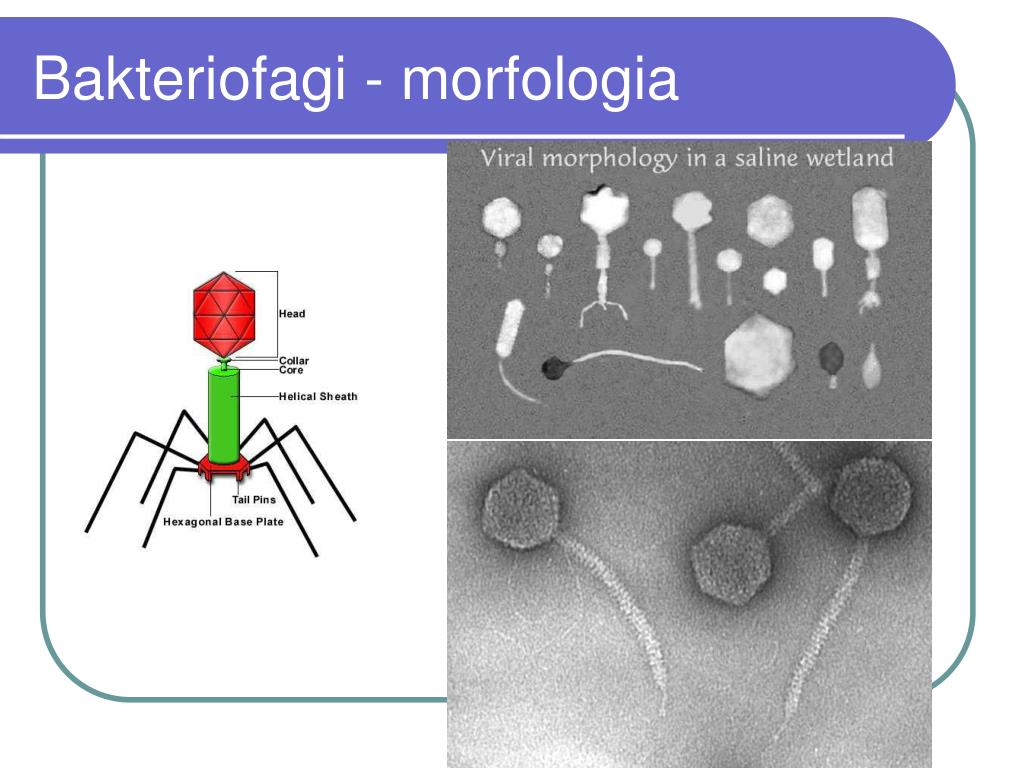
Новый модуль способствует горизонтальному переносу генов у Azorhizobium caulinodans ORS571
1. Heinemann J.A., Sprague G.F. Jr. Бактериальные конъюгативные плазмиды мобилизуют перенос ДНК между бактериями и дрожжами. Природа. 1989; 340: 205–209. doi: 10.1038/340205a0. [PubMed] [CrossRef] [Google Scholar]
2. Чен И., Дубнау Д. Поглощение ДНК при трансформации бактерий.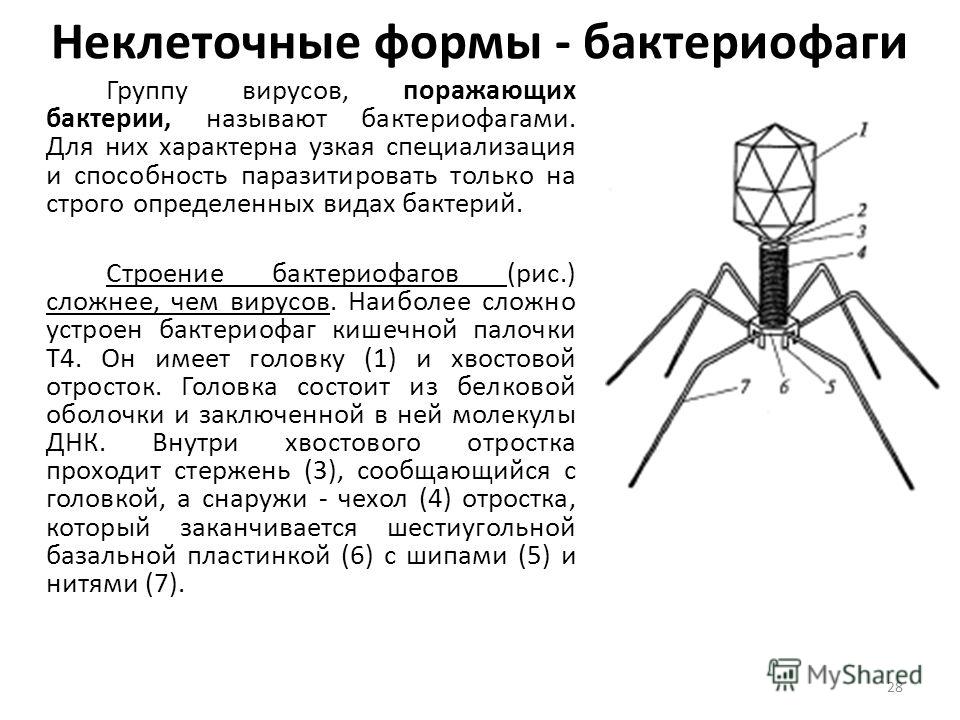 Нац. Преподобный Микробиолог. 2004; 2: 241–249. doi: 10.1038/nrmicro844. [PubMed] [CrossRef] [Google Scholar]
Нац. Преподобный Микробиолог. 2004; 2: 241–249. doi: 10.1038/nrmicro844. [PubMed] [CrossRef] [Google Scholar]
3. Goh S. Phage Transduction. Методы Мол. биол. 2016;1476:177–185. [PubMed] [Академия Google]
4. Абэ К., Номура Н., Судзуки С. Биопленки: горячие точки горизонтального переноса генов (ГПГ) в водной среде с акцентом на новый механизм ГПГ. ФЭМС микробиол. Экол. 2020;96:fiaa031. doi: 10.1093/femsec/fiaa031. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Dubey G., Ben-Yehuda S. Межклеточные нанотрубки опосредуют бактериальную коммуникацию. Клетка. 2011; 144: 590–600. doi: 10.1016/j.cell.2011.01.015. [PubMed] [CrossRef] [Google Scholar]
6. Ochman H., Lawrence J.G., Groisman E.A. Боковой перенос генов и природа бактериальных инноваций. Природа. 2000;405:299–304. doi: 10.1038/35012500. [PubMed] [CrossRef] [Google Scholar]
7. Даган Т., Арци-Рандруп Ю., Мартин В. Модульные сети и кумулятивное влияние латерального переноса на эволюцию генома прокариот. проц. Натл. акад. науч. США. 2008; 105:10039–10044. doi: 10.1073/pnas.0800679105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 2008; 105:10039–10044. doi: 10.1073/pnas.0800679105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Bansal A.K., Meyer T.E. Эволюционный анализ путем сравнения всего генома. Дж. Бактериол. 2002;184:2260–2272. doi: 10.1128/JB.184.8.2260-2272.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Gao C., Ren X., Mason A.S., Liu H., Xiao M., Li J., Fu D. Горизонтальный перенос генов у растений. Функц. интегр. Геномика. 2014;14:23–29. doi: 10.1007/s10142-013-0345-0. [PubMed] [CrossRef] [Google Scholar]
10. Килинг П.Дж., Палмер Дж.Д. Горизонтальный перенос генов в эукариотической эволюции. Нац. Преподобный Жене. 2008; 9: 605–618. doi: 10.1038/nrg2386. [PubMed] [CrossRef] [Google Scholar]
11. Суси С.М., Хуанг Дж., Гогартен Дж. Горизонтальный перенос генов: создание сети жизни. Нац. Преподобный Жене. 2015; 16: 472–482. дои: 10.1038/nrg3962. [PubMed] [CrossRef] [Google Scholar]
12. Арнольд Б. Дж., Хуанг И.Т., Ханаге В. Горизонтальный перенос генов и адаптивная эволюция у бактерий. Нац. Преподобный Микробиолог. 2022; 20: 206–218. doi: 10.1038/s41579-021-00650-4. [PubMed] [CrossRef] [Google Scholar]
Дж., Хуанг И.Т., Ханаге В. Горизонтальный перенос генов и адаптивная эволюция у бактерий. Нац. Преподобный Микробиолог. 2022; 20: 206–218. doi: 10.1038/s41579-021-00650-4. [PubMed] [CrossRef] [Google Scholar]
13. Moulin L., Munive A., Dreyfus B., Boivin-Masson C. Клубенькообразование бобовых представителями бета-подкласса Proteobacteria . Природа. 2001; 411:948–950. дои: 10.1038/35082070. [PubMed] [CrossRef] [Академия Google]
14. Олдройд Г.Е. Говори, дружи и входи: сигнальные системы, которые способствуют полезным симбиотическим ассоциациям у растений. Нац. Преподобный Микробиолог. 2013; 11: 252–263. doi: 10.1038/nrmicro2990. [PubMed] [CrossRef] [Google Scholar]
15. Пул П., Рамачандран В., Терполелли Дж. Ризобии: от сапрофитов к эндосимбионтам. Нац. Преподобный Микробиолог. 2018;16:291–303. doi: 10.1038/nrmicro.2017.171. [PubMed] [CrossRef] [Google Scholar]
16. Martinezromero E. Последние разработки в таксономии Rhizobium. Растительная почва. 1994;161:11–20. doi: 10.1007/BF02183081. [CrossRef] [Google Scholar]
1994;161:11–20. doi: 10.1007/BF02183081. [CrossRef] [Google Scholar]
17. Мартинес Э., Паласиос Р., Санчес Ф. Азотфиксирующие клубеньки, индуцированные Agrobacterium tumefaciens , содержащими плазмиды Rhizobium Phaseoli . Дж. Бактериол. 1987; 169: 2828–2834. doi: 10.1128/jb.169.6.2828-2834.1987. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Геддес Б.А., Кирсли Дж., Мортон Р., Финан Т.М. Геномы ризобий, в достижениях ботанических исследований. Эльзевир; Амстердам, Нидерланды: 2020. стр. 213–249.. [Google Scholar]
19. Келли С., Салливан Дж., Ронсон С., Тиан Р., Брой Л., Мунк С., Гудвин Л., Хан С., Войк Т., Редди Т. и др. . Последовательность генома Lotu ssp. микросимбионт Mesorhizobium loti штамм R7A. Стоять. Геномная наука. 2014;9:6. дои: 10.1186/1944-3277-9-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Джонсон С.М., Гроссман А.Д. Интегративные и сопряженные элементы (ICE): что они делают и как они работают. Анну. Преподобный Жене. 2015;49: 577–601. doi: 10.1146/annurev-genet-112414-055018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Анну. Преподобный Жене. 2015;49: 577–601. doi: 10.1146/annurev-genet-112414-055018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Remigi P., Zhu J., Young J.P.W., Masson-Boivin C. Симбиоз внутри симбиоза: эволюция азотфиксирующих бобовых симбионтов. Тенденции микробиол. 2016;24:63–75. doi: 10.1016/j.tim.2015.10.007. [PubMed] [CrossRef] [Google Scholar]
22. Салливан Дж. Т., Ронсон К. В. Эволюция ризобий путем приобретения симбиозного острова размером 500 т.п.н., который интегрируется в ген phe-тРНК. проц. Натл. акад. науч. США. 1998;95:5145–5149. doi: 10.1073/pnas.95.9.5145. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Салливан Дж. Т., Патрик Х. Н., Лоутер В. Л., Скотт Д. Б., Ронсон К. В. Клубеньковые штаммы Rhizobium loti возникают в результате хромосомного симбиотического переноса генов в окружающей среде. проц. Натл. акад. науч. США. 1995; 92: 8985–8989. doi: 10.1073/pnas.92.19.8985. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Марчетти М., Капела Д., Глю М., Крувеллер С., Чане-Вун-Минг Б., Грис К., Массон-Бойвен C. Экспериментальная эволюция фитопатогена в бобовый симбионт. PLoS биол. 2010;8:e1000280. doi: 10.1371/journal.pbio.1000280. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Марчетти М., Капела Д., Глю М., Крувеллер С., Чане-Вун-Минг Б., Грис К., Массон-Бойвен C. Экспериментальная эволюция фитопатогена в бобовый симбионт. PLoS биол. 2010;8:e1000280. doi: 10.1371/journal.pbio.1000280. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Грэм П.Х., Вэнс С. Бобовые: важность и препятствия для более широкого использования. Завод Физиол. 2003; 131: 872–877. doi: 10.1104/стр.017004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26. Смил В. Азот в растениеводстве: учет глобальных потоков. Глоб. Биогеохим. Циклы. 1999; 13: 647–662. doi: 10.1029/1999GB5. [CrossRef] [Google Scholar]
27. Джексон Л.Э., Бургер М., Каваньяро Т.Р. Корни, превращения азота и экосистемные услуги. Анну. Преподобный завод биол. 2008;59: 341–363. doi: 10.1146/annurev.arplant.59.032607.092932. [PubMed] [CrossRef] [Google Scholar]
28. Dreyfus B.L., Elmerich C., Dommergues Y.R. Свободноживущий штамм Rhizobium, способный расти на n(2) как на единственном источнике азота.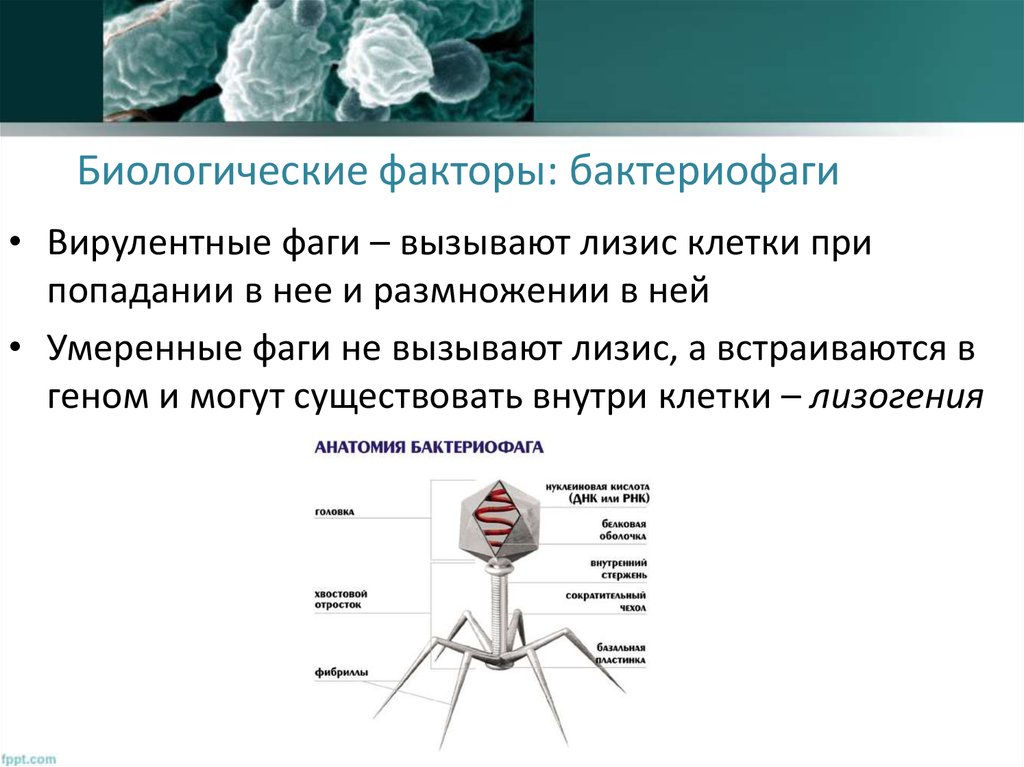 заявл. Окружающая среда. микробиол. 1983; 45: 711–713. doi: 10.1128/aem.45.2.711-713.1983. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
заявл. Окружающая среда. микробиол. 1983; 45: 711–713. doi: 10.1128/aem.45.2.711-713.1983. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Салливан Дж. Т., Тшебятовски Дж. Р., Круикшенк Р. В., Гоузи Дж., Браун С. Д., Эллиот Р. М., Ронсон К. В. Сравнительный анализ последовательности симбиозного острова Mesorhizobium loti штамм R7A. Дж. Бактериол. 2002; 184:3086–3095. doi: 10.1128/JB.184.11.3086-3095.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Нгуен А.Н.Т., Вудс Л.С., Горрелл Р., Раманан С., Квок Т., Макдональд М.Дж. Рекомбинация снижает стоимость горизонтального переноса генов в экспериментальных популяциях Helicobacter pylori . проц. Натл. акад. науч. США. 2022;119:e211
19. doi: 10.1073/pnas.21119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 31. Кристенсен С., Сербус Л.Р. Агенты переноса генов у симбиотических микробов. Результаты Пробл. Ячейка отличается. 2020;69:25–76. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
32. Одетт Г.Ф., Манчак Дж., Битти П., Климке В.А., Фрост Л.С. Исключение входа в F-подобные плазмиды требует интактного TraG у донора, который распознает родственный ему TraS у реципиента. Микробиология. 2007; 153 Пт. 2: 442–451. doi: 10.1099/mic.0.2006/001917-0. [PubMed] [CrossRef] [Google Scholar]
33. Геддес Б.А., Кирсли Дж.В., Хуанг Дж., Замани М., Мухаммед З., Сатер Л., Финан Т.М. Минимальный набор генов от Sinorhizobium (Ensifer) meliloti pSymA необходим для эффективного симбиоза с Medicago. проц. Натл. акад. науч. США. 2021;118:e2018015118. doi: 10.1073/pnas.2018015118. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Унай Дж., Перре X. Минимальный генетический пароль для открытия многих дверей бобовых к корневой клубеньке с помощью Rhizobia . Гены. 2020;11:521. doi: 10.3390/genes11050521. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Ling J., Wang H., Wu P.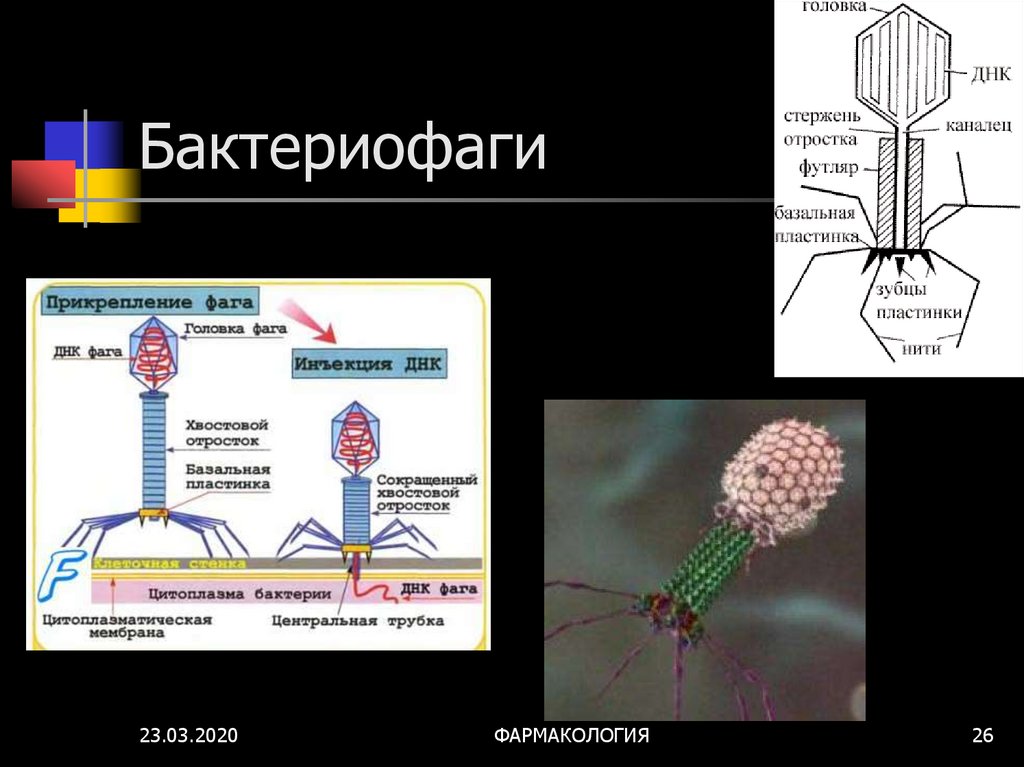 , Li T., Tang Y., Naseer N., Zhu J. Индукторы образования клубеньков растений усиливают горизонтальный перенос генов Azorhizobium caulinodans Остров симбиоза. проц. Натл. акад. науч. США. 2016;113:13875–13880. doi: 10.1073/pnas.1615121113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Li T., Tang Y., Naseer N., Zhu J. Индукторы образования клубеньков растений усиливают горизонтальный перенос генов Azorhizobium caulinodans Остров симбиоза. проц. Натл. акад. науч. США. 2016;113:13875–13880. doi: 10.1073/pnas.1615121113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Haskett T.L., Paramasivan P., Mendes MD, Green P., Geddes B.A., Knights HE, Jorrin B., Ryu M., Brett P. , Voigt C.A., et al. Инженерный контроль растений за ассоциативной азотфиксацией. проц. Натл. акад. науч. США. 2022;119:e2117465119. doi: 10.1073/pnas.2117465119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Ватугала Н.Д., Хемананда К.М., Йип К.Б., Хайнс М.Ф. Определение требований для конъюгативного переноса Rhizobium leguminosarum плазмиды pRleVF39b. Микробиология. 2020; 166: 318–331. doi: 10.1099/микрофон 0.000885. [PubMed] [CrossRef] [Google Scholar]
38. López-Fuentes E., Torres-Tejerizo G., Cervantes L., Brom S. Гены, кодирующие консервативные гипотетические белки, локализованные в области конъюгативного переноса плазмиды pRet42a из Rhizobium etli CFN42 участвуют в модулировании переноса и влияют на конъюгацию от разных доноров. Передний. микробиол. 2014;5:793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Передний. микробиол. 2014;5:793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Ding H., Yip C.B., Hynes M.F. Генетическая характеристика новой системы конъюгации ризобиальных плазмид в Rhizobium leguminosarum bv. viciae штамм VF39SM. Дж. Бактериол. 2013; 195:328–339. doi: 10.1128/JB.01234-12. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Wang X., Lv S., Liu T., Wei J., Qu S., Lu Y., Liu H. Геном CRISPR/Cas9 редактирования показывает важную роль гена AZC_2928 в азотфиксирующих бактериях растений. Функц. интегр. Геномика. 2020; 20: 657–668. doi: 10.1007/s10142-020-00739-8. [PubMed] [CrossRef] [Google Scholar]
41. Писторио М., Торрес Техеризо Г.А., Дель Папа М.Ф., де лос Анхелес Джусти М., Лозано М., Лагарес А. rptA, новый ген из Ensifer ( Sinorhizobium ) meliloti участвует в супружеской передаче. ФЭМС микробиол. лат. 2013; 345:22–30. doi: 10.1111/1574-6968.12177. [PubMed] [CrossRef] [Google Scholar]
42. Si Y., Guo D., Deng S., Lu X., Zhu J., Rao B., Zhu J. Ohr и OhrR имеют решающее значение для устойчивости к органическим пероксидам. и Симбиоз в Azorhizobium caulinodans ORS571. Гены. 2020;11:335. doi: 10.3390/genes11030335. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Si Y., Guo D., Deng S., Lu X., Zhu J., Rao B., Zhu J. Ohr и OhrR имеют решающее значение для устойчивости к органическим пероксидам. и Симбиоз в Azorhizobium caulinodans ORS571. Гены. 2020;11:335. doi: 10.3390/genes11030335. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Bailey T.L., Boden M., Buske F.A., Frith M., Grant C.E., Clementi L., Noble W.S. MEME SUITE: инструменты для обнаружения и поиска мотивов. Нуклеиновые кислоты. Рез. 2009; 37:W202–W208. doi: 10.1093/nar/gkp335. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Metcalf W.W., Jiang W., Daniels L.L., Kim S.K., Haldimann A., Wanner B.L. Условно-репликативные и конъюгативные плазмиды, несущие lacZ альфа, для клонирования, мутагенеза и замены аллелей у бактерий. Плазмида. 1996;35:1–13. doi: 10.1006/plas.1996.0001. [PubMed] [CrossRef] [Google Scholar]
45. Hoang T.T., Karkhoff-Schweizer R.R., Kutchma A.J., Schweizer H.P. Система рекомбинации Flp-FRT с широким кругом хозяев для сайт-специфического вырезания хромосомно расположенных последовательностей ДНК: применение для выделения немаркированных мутантов Pseudomonas aeruginosa .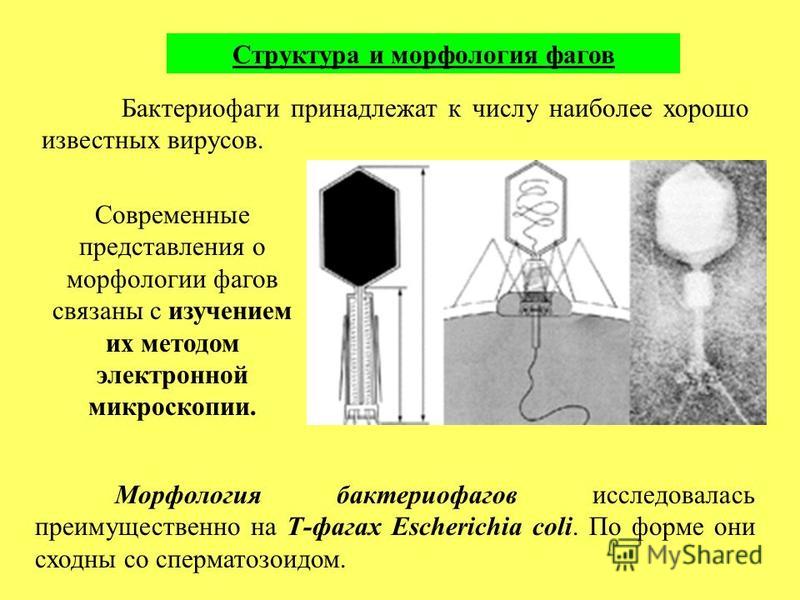 Ген. 1998; 212:77–86. doi: 10.1016/S0378-1119(98)00130-9. [PubMed] [CrossRef] [Google Scholar]
Ген. 1998; 212:77–86. doi: 10.1016/S0378-1119(98)00130-9. [PubMed] [CrossRef] [Google Scholar]
46. Chart H., Smith H., La Ragione R., Woodward M. Исследование патогенных свойств Escherichia coli , штаммы BLR, BL21, DH5alpha и EQ1. Дж. Заявл. микробиол. 2000; 89: 1048–1058. doi: 10.1046/j.1365-2672.2000.01211.x. [PubMed] [CrossRef] [Google Scholar]
47. Ferrières L., Hémery G., Nham T., Gueerout A.-M., Mazel D., Beloin C., Ghigo J.-M. Молчаливое зло: бактериофаг Mu вставки загрязняют продукты случайного мутагенеза Escherichia coli , выполненного с использованием суицидальных плазмид для доставки транспозонов, мобилизованных конъюгативным механизмом RP4 с широким диапазоном хозяев. Дж. Бактериол. 2010;192:6418–6427. doi: 10.1128/JB.00621-10. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Goethals K., Van Montagu M., Holsters M. Консервативные мотивы в расходящейся кивковой коробке Azorhizobium caulinodans ORS571 обнаруживают общую структуру промоторов регулируется белками LysR-типа. проц. Натл. акад. науч. США. 1992; 89: 1646–1650. doi: 10.1073/pnas.89.5.1646. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 1992; 89: 1646–1650. doi: 10.1073/pnas.89.5.1646. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
49. Zhao Y., Nickels L.M., Wang H., Ling J., Zhong Z., Zhu J. OxyR-регулируемая активность каталазы имеет решающее значение для окислительных процессов. стрессоустойчивость, нодуляция и азотфиксация в Azorhizobium caulinodans . ФЭМС микробиол. лат. 2016;363:fnw130. doi: 10.1093/femsle/fnw130. [PubMed] [CrossRef] [Google Scholar]
50. Miller J. Experiments in Molecular Genetics 1972 Cold Spring Harbour. Лаборатория Колд-Спринг-Харбор; Лорел Холлоу, Нью-Йорк, США: 1972. стр. 431–433. [Google Scholar]
51. Калогераки В.С., Винанс С.С. Самоубийственные плазмиды, содержащие беспромоторные репортерные гены, могут одновременно разрушать и создавать слияния с генами-мишенями различных бактерий. Ген. 1997;188:69–75. doi: 10.1016/S0378-1119(96)00778-0. [PubMed] [CrossRef] [Google Scholar]
52. Jiang G., Yang J., Li X., Cao Y. , Liu X., Ling J., Wang H., Zhong Z., Zhu J. Alkyl гидропероксидредуктаза важна для устойчивости к окислительному стрессу и симбиоза у Azorhizobium caulinodans . ФЭМС микробиол. лат. 2019;366:fnz014. doi: 10.1093/femsle/fnz014. [PubMed] [CrossRef] [Google Scholar]
, Liu X., Ling J., Wang H., Zhong Z., Zhu J. Alkyl гидропероксидредуктаза важна для устойчивости к окислительному стрессу и симбиоза у Azorhizobium caulinodans . ФЭМС микробиол. лат. 2019;366:fnz014. doi: 10.1093/femsle/fnz014. [PubMed] [CrossRef] [Google Scholar]
53. Guo M., Feng H., Zhang J., Wang W., Wang Y., Li Y., Gao C., Chen H., Feng Y., Он З.-Г. Анализ путей регуляции транскрипции с помощью новой бактериальной одногибридной репортерной системы. Геном Res. 2009 г.;19:1301–1308. doi: 10.1101/gr.086595.108. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
54. Wang P., Chen H., Qian G., Liu F. LetR представляет собой фактор транскрипции семейства TetR из Lysobacter , контролирующий биосинтез противогрибкового антибиотика. заявл. микробиол. Биотехнолог. 2017;101:3273–3282. doi: 10.1007/s00253-017-8117-8. [PubMed] [CrossRef] [Google Scholar]
55. Xu K., Shen D., Yang N., Chou S.H., Gomelsky M., Qian G. Координированный контроль пилей типа IV и c-di-GMP- зависимая продукция противогрибковых антибиотиков в Lysobacter регулятором ответа PilR. Мол. Завод Патол. 2021; 22: 602–617. doi: 10.1111/mpp.13046. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мол. Завод Патол. 2021; 22: 602–617. doi: 10.1111/mpp.13046. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Аллеманн М.Н., Аллен Э.Э. Генетическая регуляция бактериального пути биосинтеза полиненасыщенных жирных кислот омега-3. Дж. Бактериол. 2020;202:e00050-20. doi: 10.1128/JB.00050-20. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Гуан Г., Дай П.-Х., Осборн Т.Ф., Ким Дж.Б., Шехтер И. Множественные элементы последовательности участвуют в транскрипционной регуляции Ген скваленсинтазы человека. Дж. Биол. хим. 1997;272:10295–10302. doi: 10.1074/jbc.272.15.10295. [PubMed] [CrossRef] [Google Scholar]
58. Liu M., Hao G., Li Z., Zhou Y., Garcia-Sillas R., Li J., Wang H., Kan B., Zhu J. , CitAB Двухкомпонентное системно регулируемое использование цитрата Способствует Vibrio cholerae конкурентоспособности с кишечной микробиотой. Заразить. Иммун. 2019;87:e00746-18. doi: 10.1128/IAI.00746-18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Shao X., Zhang X., Zhang Y., Zhu M., Yang P., Yuan J., Zhou Y.X.T., Wang W., Чен С., Лян Х. и др. RpoN-зависимая прямая регуляция определения кворума и система секреции типа VI в Pseudomonas aeruginosa PAO1. Дж. Бактериол. 2018;200:e00205-18. doi: 10.1128/JB.00205-18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Shao X., Zhang X., Zhang Y., Zhu M., Yang P., Yuan J., Zhou Y.X.T., Wang W., Чен С., Лян Х. и др. RpoN-зависимая прямая регуляция определения кворума и система секреции типа VI в Pseudomonas aeruginosa PAO1. Дж. Бактериол. 2018;200:e00205-18. doi: 10.1128/JB.00205-18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Ян К.Э., Чарковски А.О., Уиллис Д.К. Оценка методов выделения и целостности РНК для количественного определения бактериальной РНК. Дж. Микробиол. Методы. 2008; 75: 318–324. doi: 10.1016/j.mimet.2008.07.004. [PubMed] [CrossRef] [Google Scholar]
61. Livak K.J., Schmittgen T.D. Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и 2 −ゔゔCT Метод. Методы. 2001; 25: 402–408. doi: 10.1006/meth.2001.1262. [PubMed] [CrossRef] [Google Scholar]
62. Schmittgen T.D., Livak K.J. Анализ данных ПЦР в реальном времени сравнительным методом C(T). Нац. протокол 2008;3:1101–1108. doi: 10. 1038/nprot.2008.73. [PubMed] [CrossRef] [Google Scholar]
1038/nprot.2008.73. [PubMed] [CrossRef] [Google Scholar]
63. Браун Б.Л., Вуд Т.К., Пети В. Ребекка Стр. специфика регуляции транскрипции. Дж. Биол. хим. 2011; 286:2285–2296. doi: 10.1074/jbc.M110.172643. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
64. Талавера А., Тамман Х., Айнело А., Конийненберг А., Хаджи С., Соботт Ф., Гарсия-Пино А., Хырак Р., Лорис Р. Двойная роль неупорядоченного N-конца токсина GraT в регуляции и токсичности. Нац. коммун. 2019;10:972. doi: 10.1038/s41467-019-08865-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Wang HC, Ko T., Wu M., Ku S., Wu H., Wang A. Консервативный белок Neisseria DMP19представляет собой белок-имитатор ДНК, который предотвращает связывание ДНК с гипотетическим фактором транскрипции, реагирующим на азот. Нуклеиновые Кислоты Res. 2012;40:5718–5730. doi: 10.1093/nar/gks177. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Ramsay J.P., Major A.S., Komarovsky V.M., Sullivan J. T., Dy R.L., Hynes M.F., Salmond G.P.C., Ronson C.W. и перенос островков симбиоза у Mesorhizobium loti посредством экспрессии нового антиактиватора. Мол. микробиол. 2013;87:1–13. doi: 10.1111/mmi.12079. [PubMed] [CrossRef] [Google Scholar]
T., Dy R.L., Hynes M.F., Salmond G.P.C., Ronson C.W. и перенос островков симбиоза у Mesorhizobium loti посредством экспрессии нового антиактиватора. Мол. микробиол. 2013;87:1–13. doi: 10.1111/mmi.12079. [PubMed] [CrossRef] [Google Scholar]
67. Ramsay J.P., Tester L.G.L., Major A.S., Sullivan J.T., Edgar C.D., Kleffmann T., Patterson-House J.R., Hall D.A., Tate W.P., Hynes M.F., et al. Сдвиг рамки считывания рибосом и антиактивация двойной мишени ограничивают передачу мобильного генетического элемента, активируемую определением кворума. проц. Натл. акад. науч. США. 2015; 112:4104–4109. doi: 10.1073/pnas.1501574112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Канеко Т., Накамура Ю., Сато С., Минамисава К., Утиуми Т., Сасамото С., Ватанабэ А., Идесава К. , Иригучи М., Кавасима К. и др. Полная геномная последовательность азотфиксирующей симбиотической бактерии Bradyrhizobium japonicum USDA110. Рез. ДНК 2002; 9: 189–197. doi: 10.1093/dnares/9. 6.189. [PubMed] [CrossRef] [Google Scholar]
6.189. [PubMed] [CrossRef] [Google Scholar]
69. Shimada T., Hirao K., Kori A., Yamamoto K., Ishihama A. RutR является чувствительным к урацилу/тимину главным регулятором набора генов для синтеза. и расщепление пиримидинов. Мол. микробиол. 2007; 66: 744–757. doi: 10.1111/j.1365-2958.2007.05954.x. [PubMed] [CrossRef] [Google Scholar]
70. Лох К.Д., Хирао К., Кори А., Ямамото К., Исихама А. Ранее неописанный путь катаболизма пиримидинов. проц. Натл. акад. науч. США. 2006; 103: 5114–5119. doi: 10.1073/pnas.0600521103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Гогартен Дж., Таунсенд Дж. Горизонтальный перенос генов, инновации генома и эволюция. Нац. Преподобный Микробиолог. 2005; 3: 679–687. doi: 10.1038/nrmicro1204. [PubMed] [CrossRef] [Google Scholar]
72. Wang X., Yang J., Chen L., Wang J., Cheng Q., Dixon R., Wang Y. Использование синтетической биологии для выявления и преодоления нормативных и функциональные барьеры, связанные с азотфиксацией. ПЛОС ОДИН. 2013;8:e68677. doi: 10.1371/journal.pone.0068677. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2013;8:e68677. doi: 10.1371/journal.pone.0068677. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Макклоски Д., Сюй С., Сандберг Т.Е., Бранк Э., Хефнер Ю., Шубин Р., Файст А.М. Palsson Evolution штаммов E. coli с нокаутом гена выявляет регуляторную архитектуру, регулируемую метаболизмом. Нац. коммун. 2018;9:3796. doi: 10.1038/s41467-018-06219-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Ryu M.H., Zhang J., Khokhani TTD, Geddes B.A., Mus F., Garcia-Costas A., Peters J.W., Poole P.S., Ané J. , Контроль азотфиксации у бактерий, которые ассоциируют со злаками. Нац. микробиол. 2020;5:314–330. doi: 10.1038/s41564-019-0631-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Doin de Moura G.G., Remigi P., Masson-Boivin C. Delphine Capela Экспериментальная эволюция бобовых симбионтов: чему мы научились? Гены. 2020;11:339. doi: 10.3390/genes11030339. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
76. Иномура К., Брэгг Дж., Фоллоус М. Дж. Количественный анализ прямых и косвенных затрат на фиксацию азота: модель на основе Azotobacter vinelandii . ISME J. 2017; 11: 166–175. doi: 10.1038/ismej.2016.97. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Иномура К., Брэгг Дж., Фоллоус М. Дж. Количественный анализ прямых и косвенных затрат на фиксацию азота: модель на основе Azotobacter vinelandii . ISME J. 2017; 11: 166–175. doi: 10.1038/ismej.2016.97. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Taylor B.N., Menge D.N.L. Свет, снабжение азотом и соседние растения диктуют затраты и преимущества фиксации азота для сеянцев тропического азотфиксирующего дерева. Новый Фитол. 2021; 231: 1758–1769. doi: 10.1111/nph.17508. [PubMed] [CrossRef] [Google Scholar]
78. Bañuelos-Vazquez LA, Tejerizo G.T., la Luz LC, Girard L., Romero D., Brom S. Конъюгативный перенос между эндосимбионтами Rhizobium etli внутри корневого клубенька. Окружающая среда. микробиол. 2019;21:3430–3441. дои: 10.1111/1462-2920.14645. [PubMed] [CrossRef] [Google Scholar]
79. Liu X., Zhang K., Liu Y., Zou D., Wang D., Xie Z. Влияние систем обнаружения кальция и сигналов на Azorhizobium caulinodans Biofilm Формирование и колонизация хозяев. Передний. микробиол. 2020;11:563367. doi: 10.3389/fmicb.2020.563367. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Передний. микробиол. 2020;11:563367. doi: 10.3389/fmicb.2020.563367. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Папенфорт К., Басслер Б.Л. Системы сигнал-ответ кворума у грамотрицательных бактерий. Нац. Преподобный Микробиолог. 2016; 14: 576–588. doi: 10.1038/nrmicro.2016.89. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Liu W., Li Y., Bai X., Wu H., Bian L., Hu X. Регулятор типа LuxR AclR1 из Azorhizobium caulinodans Регулирует циклический ди-ГМФ и многочисленные фенотипы в свободноживущих и симбиотических состояниях. Мол. Растение. Взаимодействие микробов. 2020; 33: 528–538. doi: 10.1094/MPMI-10-19-0306-R. [PubMed] [CrossRef] [Google Scholar]
82. Mølbak L., Molin S., Kroer N. Рост корней и продукция экссудата определяют частоту горизонтального переноса плазмид в ризосфере. ФЭМС микробиол. Экол. 2007;59: 167–176. doi: 10.1111/j.1574-6941.2006.00229.x. [PubMed] [CrossRef] [Google Scholar]
83. Kroer N. , Barkay T., Sørensen S., Weber D. Влияние корневых экссудатов и метаболической активности бактерий на конъюгальный перенос генов в ризосфере болотного растения. ФЭМС микробиол. Экол. 1998; 25: 375–384. doi: 10.1111/j.1574-6941.1998.tb00489.x. [CrossRef] [Google Scholar]
, Barkay T., Sørensen S., Weber D. Влияние корневых экссудатов и метаболической активности бактерий на конъюгальный перенос генов в ризосфере болотного растения. ФЭМС микробиол. Экол. 1998; 25: 375–384. doi: 10.1111/j.1574-6941.1998.tb00489.x. [CrossRef] [Google Scholar]
84. Рашид М.М., Икава Ю., Цугэ С. GamR, регулятор метаболизма галактозы типа LysR, регулирует экспрессию генов hrp посредством транскрипционной активации двух ключевых регуляторов hrp, HrpG и HrpX, в Xanthomonas oryzae pv. ориза. заявл. Окружающая среда. микробиол. 2016; 82: 3947–3958. doi: 10.1128/AEM.00513-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Майкл Хайнс | Профили Калгари
Должности
Профессор
Факультет естественных наук, отделение биологических наук
Образование
Б. С.
Биологические науки,
Университет Акадия,
1980
С.
Биологические науки,
Университет Акадия,
1980
Доктор Философии генетическая биология, Университет Билефельда, 1986
РС.
Виды деятельности
Исследовательская деятельность включала изучение симбиотической фиксации азота и разработку векторов и систем переноса генов для различных бактерий, имеющих сельскохозяйственное значение (бактерии рубца, агенты биологической борьбы, бактерии, стимулирующие рост растений). Наши основные усилия были направлены на понимание роли очень больших плазмид в свободноживущей и симбиотической жизни Rhizobium spp. которые образуют азотфиксирующие клубеньки на корнях различных бобовых растений-хозяев. Кодируемые плазмидой локусы, участвующие в катаболизме широкого спектра источников углерода, были идентифицированы в
Наши основные усилия были направлены на понимание роли очень больших плазмид в свободноживущей и симбиотической жизни Rhizobium spp. которые образуют азотфиксирующие клубеньки на корнях различных бобовых растений-хозяев. Кодируемые плазмидой локусы, участвующие в катаболизме широкого спектра источников углерода, были идентифицированы в 
| Номер курса | Название курса | Семестр |
|---|---|---|
| СМБ 421 | Вирусология | Осень 2022 |
| СМБ 443 | Микробная физиология | Осень 2022 |
- Награда Великого Руководителя, 2014
- Научная премия CSM Fisher,
1994 г.
Публикации
Ссылка на Академию Google
- Vrdonk CJ, Sullivan JT, Williman KM, Nicholson L, Bastholm TR, Hynes MF, Ronson CW, Bond CS, Ramsay JP (2019) Очерчивание областей прикрепления интегразы и начала переноса симбиозного острова ICEMlSymR7A Plasmid 104 :102416. doi: 10.1016/j.plasmid.2019.102416
- Ramsay JP, Hynes MF, Sullivan JT, Ronson CW, Symbiosis Islands, In Reference Module in Life Sciences, Elsevier, 2017, ISBN: 978-0-12-809633-8, http://dx.doi.org/10.1016/B978-0-12-809633-8.07223-X
- Шарф Б.Е., Хайнс М.Ф., Александр Г.М. (2016)Сигнальные системы хемотаксиса в модели полезных ассоциаций растений и бактерий. Завод Молек. биол. 90:549-559 doi: 10.1007/s11103-016-0432-4
- Halmillawewa AP, Restrepo-Córdoba M, Perry BJ, Yost CK, Hynes MF (2016) Характеристика умеренного фага vB_RleM_PPF1 и его сайт-специфическая интеграция в геном Rhizobium leguminosarum F1.
 Мол. Жене. Геном. 291:349-362 (doi:10.1007/s00438-015-1113-8)
Мол. Жене. Геном. 291:349-362 (doi:10.1007/s00438-015-1113-8) - Ramsay JP, Tester LGL, Major AS, Sullivan JT, Edgar CD, Kleffmann T, Patterson-House JR, Hall DA, Tate WP, Hynes MF, Ronson CW (2015)Рибосомальный сдвиг рамки и антиактивация двойной цели ограничивают восприятие кворума активированный перенос мобильного генетического элемента. проц. Натл. акад. науч. США . 112:4104-4109 (doi:10.1073/pnas.1501574112)
- Halmillawewa AP, Restrepo-Córdoba M, Yost CK, Hynes MF (2015) Геномная и фенотипическая характеристика Rhizobium gallicum фаг vB_RglS_P106B. Микробиология 61:611-620. (doi: 10.1099/микрофон 0.000022)
- Yip CB, Ding H, Hynes MF (2015)Контртранскрибируемые РНК плазмид Rhizobium leguminosarum repABC проявляют эффекты несовместимости только при высокой экспрессии. Плазмида 78:37-47 (doi:10.1016/j.plasmid.2014.12.003)
- Тамбало Д. Д., Йост К. К. и Хайнс М. Ф. (2015) Подвижность и хемотаксис у ризобий, В: Биологическая фиксация азота под редакцией Франса Де Брейна.
 Wiley and Sons, Хобокен, Нью-Джерси, глава 33, страницы 337–348
Wiley and Sons, Хобокен, Нью-Джерси, глава 33, страницы 337–348 - Tambalo, DD, Vanderlinde EM, Robinson S, Halmillawewa A, Hynes MF, and Yost CK (2014) Экстракты семян бобовых и экстракты Physcomitrella patens влияют на поведение роения у Rhizobium leguminosarum . Может. Дж. Микробиол. 60:15-24
- Vanderlinde EM, Hynes MF, and Yost CK (2014) Катаболизм гомосерина с помощью Rhizobium leguminosarum bv. viciae 3841 требуется переносимый плазмидой генный кластер, который также влияет на конкурентоспособность клубеньков. Окружающая среда. микробиол. 16:205-217 DOI: 10.1111/1462-2920.12196
- Ронсон К.В., Хайнс М.Ф., Рамзи Дж.П. и Салливан Дж.Т. (2013) Острова симбиоза. В «Энциклопедии генетики Бреннера», 2-е издание, под редакцией С. Малой и К. Хьюз. Издательство Эльзевир. стр. 598-600. DOI 10.1016/B978-0-12-374984-0.01497-2
- Ding H, Yip CB и Hynes MF (2013) Генетическая характеристика новой системы конъюгации ризобиальной плазмиды в Rhizobium leguminosarum bv.
 viciae штамм VF39SM. Дж. Бактериол. 195:328-339. (DOI: 10.1128/JB.01234-12)
viciae штамм VF39SM. Дж. Бактериол. 195:328-339. (DOI: 10.1128/JB.01234-12) - Рамзи Дж. П., Майор А. С., Комаровский В. Л., Салливан Дж. Т., Дай Р., Хайнс М. Ф., Салмонд Г. П., Ронсон К. В. (2013) Широко консервативный молекулярный переключатель контролирует восприятие кворума и перенос островков симбиоза у Mesorhizobium loti посредством экспрессии нового антиактиватора. . Мол. микробиол. 87:1-13. (DOI doi: 10.1111/mmi.12079)
- Ding H, Yip CB, Geddes BA, Oresnik IJ и Hynes MF (2012) Утилизация глицерола Rhizobium leguminosarum требует транспортера ABC и влияет на конкуренцию за образование клубеньков. Микробиология 158:1369-1378. doi: 10.1099/мик.0.057281-0
- Tambalo DD, Bustard DE, Del Bel KL, Koval SF, Khan MF, and Hynes MF (2010) Характеристика и функциональный анализ семи генов флагеллинов в Rhizobium leguminosarum BMC Microbiology 10:219 doi:10.1186/1471-2180-10 -219
- Тамбало Д.Д., Йост К.К. и Хайнс М.

