Разрешенные антибиотики при грудном вскармливании
Как известно, при лактации мама должна соблюдать определенного рода диету. Вся съедаемая пища, точнее ее компоненты, частично оказываются в грудном молоке. То же самое касается и лекарственных средств. Именно поэтому далеко не все препараты возможно применять во время лактации. Но как быть, если женщина вдруг заболела, и без приема лекарств не обойтись? Давайте попробуем разобраться в подобной ситуации, и выделим из множества антибиотиков те группы, которые относят к разрешенным при грудном вскармливании.
Какие из антибактериальных препаратов можно использовать при лактации?
В первую очередь необходимо отметить, что прием любого лекарства в обязательном порядке должен быть согласован с врачом, который должен указать дозировку, кратность и продолжительность приема.
Если же конкретно говорить о том, какие антибиотики можно принимать при грудном вскармливании, необходимо выделить следующие группы данного рода препаратов:
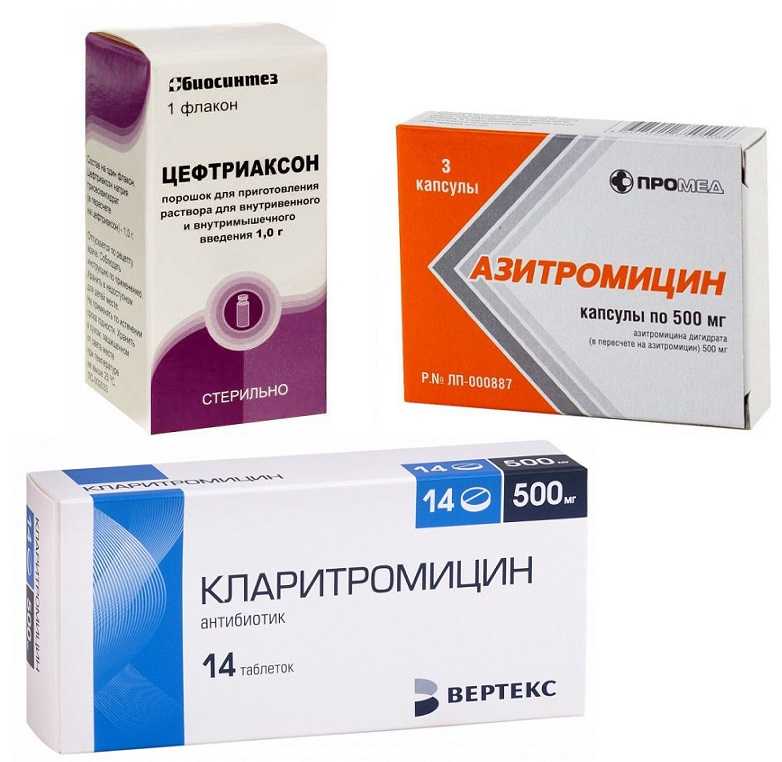
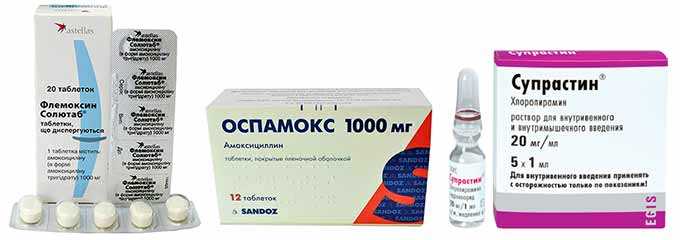
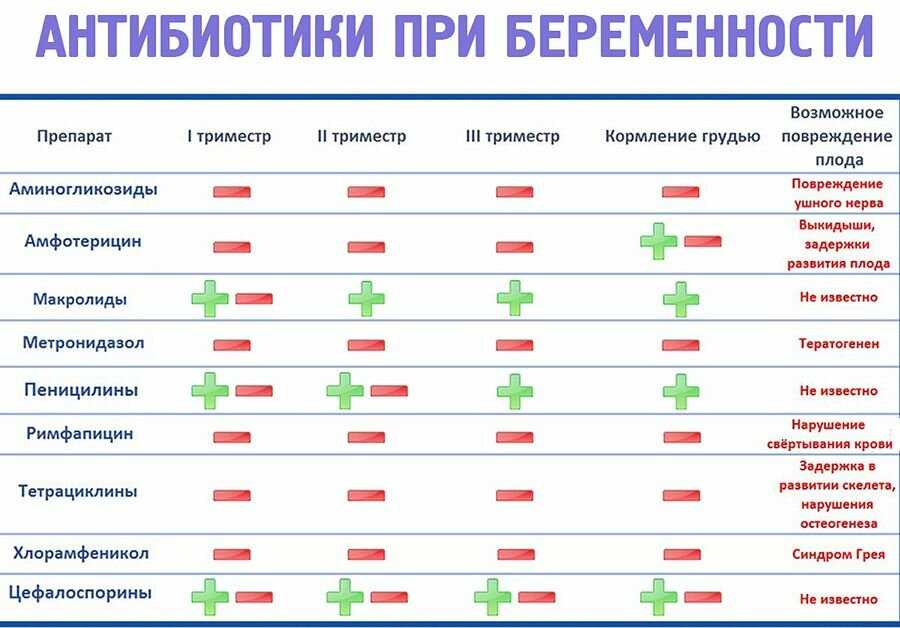
- Пенициллины (Аугментин, Оспамокс, Амоксициллин и др.
 ) — нередко назначаются кормящим мамам. Данные препараты в достаточно малых концентрациях проникают в грудное молоко. Однако стоит учитывать, что эти антибиотики обладают способностью вызывать аллергические явления у малыша и кормящей. Поэтому мама должна следить внимательно за реакцией со стороны малыша. Из побочных эффектов стоит отметить послабление стула.
) — нередко назначаются кормящим мамам. Данные препараты в достаточно малых концентрациях проникают в грудное молоко. Однако стоит учитывать, что эти антибиотики обладают способностью вызывать аллергические явления у малыша и кормящей. Поэтому мама должна следить внимательно за реакцией со стороны малыша. Из побочных эффектов стоит отметить послабление стула. - Цефалоспорины (Цефрадин, Цефуроксим, Цефтриаксон). Обладают малой токсичностью и не проникают в грудное молоко. Не оказывают влияние на малыша.
- Макролиды (Азитромицин, Кларитромицин, Эритромицин). Несмотря на то, что компоненты данных антибактериальных препаратов все же попадают в грудное молоко, они никак не влияют на организм малыша. Эта группа лекарственных средств является так называемыми препаратами выбора, при развитии аллергии на употребление пенициллинов и цефалоспоринов.
Как правильно осуществлять прием антибиотиков при грудном вскармливании?
Разобравшись с тем, какие антибиотики совместимы с грудным вскармливанием, расскажем о том, как их правильно пить.
Несмотря на то, что большинство из перечисленных препаратов не оказывает отрицательного воздействия на маленький организм, мама должна придерживаться определенных правил, чтобы снизить возможность развития аллергической реакции у малыша.
Во-первых, для того чтобы выяснить, какой антибиотик можно пить в данном случае при грудном вскармливании, необходимо обратится к врачу. Ведь подбор лекарств проводится исключительно после определения типа возбудителя.
Во-вторых, необходимо строго соблюдать дозировку и частоту приема препарата, для того чтобы лечение было эффективным.
В-третьих, пить антибиотик лучше непосредственно при кормлении грудью или сразу после него. Это позволит сделать так, чтобы прием лекарства осуществлялся перед максимальным промежутком между кормлениями.
Таким образом, как видно из статьи, антибиотики при грудном вскармливании использовать можно, однако стоит ли делать это в конкретном случае, — должен решать врач. Кормящая мама, в свою очередь, должна строго следовать его указаниям.
Статьи по теме:
Свечи Релиф при грудном вскармливании Часто женщины в послеродовый период испытывают проблемы с походом в туалет, и у них нередко развивается геморрой. В таких случаях молодых мам интересует эффективное средство, разрешенное при кормлении. |
Выпадают волосы при грудном вскармливании – что делать? После родоразрешения женщина часто испытывает проблемы с потерей волос – они осыпаются и мама не представляет, как вернуть красоту и густоту своей прическе. Обсудим, что же делать кормящей. |
|
Вазоспазм при грудном вскармливании Такое явление, как вазоспазм, иногда случается с кормящими мамочками в период вскармливания малютки грудью. Что это, как лечить проблему и что делать, чтобы избегать ее проявления, — обсудим подробно далее. | Какие обезболивающие можно при грудном вскармливании? При ГВ, подход к выбору лекарств остается все такой же осторожный, как и при беременности. Если возникла потребность в обезболивающем препарате, то нужно четко знать, какие из них разрешены в период лактации. |
можно ли принимать, какие антибиотикиможно разрешены при беременности
Содержание
- Перечень разрешенных антибиотиков
- Список запрещенных антибиотиков при ГВ
- Разрешенные и условно-разрешенные антибиотики при ГВ
- Случаи, когда назначаются антибиотики
Содержание статьи: Самолечение, а тем более беспорядочный прием антибиотиков при грудном вскармливании, не допустимо. Лекарственные препараты – это вынужденная мера, когда более щадящие средства не могут справиться с заболеванием. Список разрешённых медикаментов очень узок, и антибиотики из этого перечня назначаются только в крайних случаях и под строгим контролем специалистов.
Перечень разрешенных антибиотиков
Ответ на вопрос можно ли антибиотики при грудном вскармливании, вы можете получить уже с инструкции препарата. В графе беременность и период лактации может быть указано, что препарат противопоказан, разрешен, условно-разрешен или действие на организм малыша и кормящей мамы не изучено. Соответственно, запрещенные и неизученные препараты принимать в период кормления грудью нельзя, единственный выход в данной ситуации – отказ от грудного вскармливания или временная остановка такого кормления.
Список запрещенных антибиотиков при ГВ
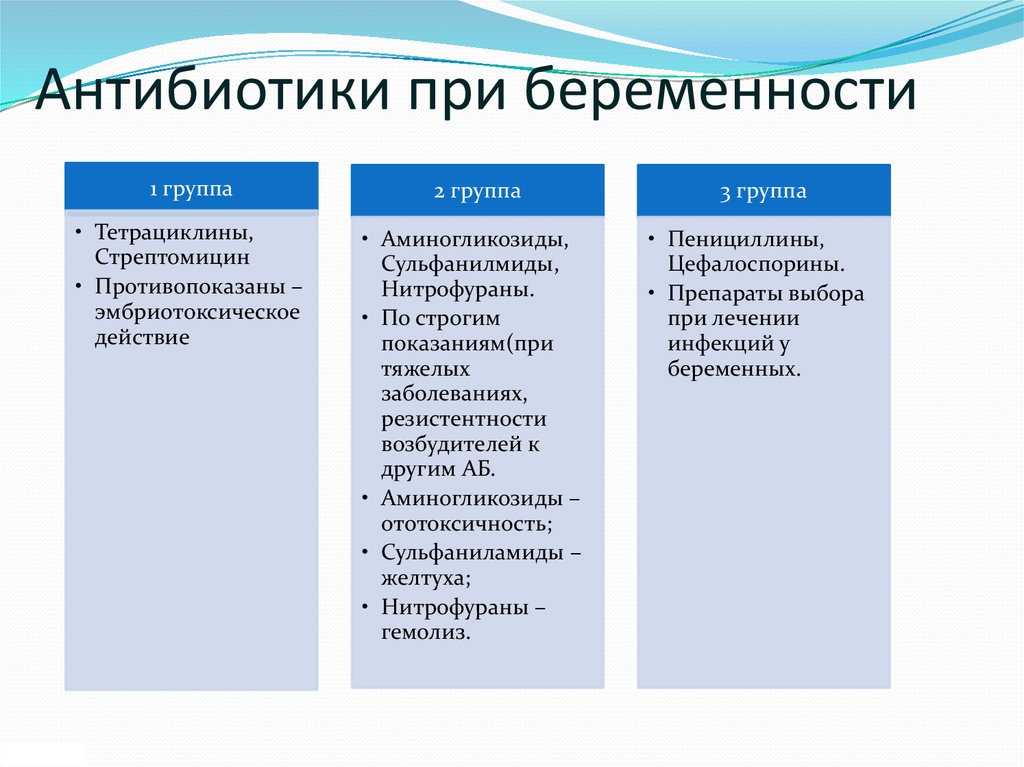
Перечень запрещенных антибиотиков при грудном вскармливании обширный, сюда входят наиболее распространенные антибактериальные и антигрибковые препараты. • Аминогликозиды (Стрептомицин, Гентамицин, Амикацин) незаменимы при борьбе с маститами, перитонитами, абсцессами внутренних органов, применяются при лечении туберкулеза. Однако при ГВ противопоказаны, проникают в грудное молоко, имеют высокую токсичность, вызывают кишечные расстройства у грудничка, негативно влияет на органы зрения, вплоть до поражения зрительного нерва. • Левомицитины (Синтомицетин, Левомицитин) – популярный противомикробный и противопаразитный препарат широкого действия, при ГВ проникает в молоко, и следовательно, в организм младенца, вызывает цинозы и снижение артериального давления, негативно влияет на кроветворную функцию костного мозга. • Тетрациклины (Доксициклин, Тетрациклин) – антибактериальный препарат, действенный против хламидиозных и микоплазменных инфекциях, назначаются при бронхитах, пневмониях. Но при кормлении грудью прием запрещен, например, Доксициклин при грудном вскармливании препарат проникает в молоко, вызывает у младенца кандидоз, кишечные расстройства, кроме того негативно влияет на костные ткани, особенно зачатки зубов еще неокрепший скелет. • Группа фторхинолонов (Офлоксацин, Авелокс, Левофлоксацин, Спарфлоксацин, Моксифлоксацин) применяются в урологии, но противопоказаны при ГВ, потому что вызывают деформацию суставов и задержки в росте грудничка. • Метронидазол, Клиндамицин зачастую назначаются при бактериальном вагинозе, но антибактериальные препараты легко проникают в молоко и могут вызвать нарушение белкового обмена у грудничка.
• Левомицитины (Синтомицетин, Левомицитин) – популярный противомикробный и противопаразитный препарат широкого действия, при ГВ проникает в молоко, и следовательно, в организм младенца, вызывает цинозы и снижение артериального давления, негативно влияет на кроветворную функцию костного мозга. • Тетрациклины (Доксициклин, Тетрациклин) – антибактериальный препарат, действенный против хламидиозных и микоплазменных инфекциях, назначаются при бронхитах, пневмониях. Но при кормлении грудью прием запрещен, например, Доксициклин при грудном вскармливании препарат проникает в молоко, вызывает у младенца кандидоз, кишечные расстройства, кроме того негативно влияет на костные ткани, особенно зачатки зубов еще неокрепший скелет. • Группа фторхинолонов (Офлоксацин, Авелокс, Левофлоксацин, Спарфлоксацин, Моксифлоксацин) применяются в урологии, но противопоказаны при ГВ, потому что вызывают деформацию суставов и задержки в росте грудничка. • Метронидазол, Клиндамицин зачастую назначаются при бактериальном вагинозе, но антибактериальные препараты легко проникают в молоко и могут вызвать нарушение белкового обмена у грудничка. • Линкомицин, относящийся к группе линкозамидов, попадая в молоко, нарушают работу кишечника у грудничка и вызывают повышенную чувствительность к внешним раздражителям. • Сульфамиламиды (Стрептоцит) при попадании в молоко, могут спровоцировать желтуху у младенца, с последующим осложнением в виде дисфункции мозга. Ряд антибиотиков (Карбапенемы, Оксазолидиноны, Нитрофураны, Полимиксины) не прошли тестирование на мамах относительно реакции и влияния на младенцев в период грудного кормления. Говорить об их безопасности, как и отрицательном влиянии, нет возможности, поэтому от их приема в период ГВ нужно отказаться.
• Линкомицин, относящийся к группе линкозамидов, попадая в молоко, нарушают работу кишечника у грудничка и вызывают повышенную чувствительность к внешним раздражителям. • Сульфамиламиды (Стрептоцит) при попадании в молоко, могут спровоцировать желтуху у младенца, с последующим осложнением в виде дисфункции мозга. Ряд антибиотиков (Карбапенемы, Оксазолидиноны, Нитрофураны, Полимиксины) не прошли тестирование на мамах относительно реакции и влияния на младенцев в период грудного кормления. Говорить об их безопасности, как и отрицательном влиянии, нет возможности, поэтому от их приема в период ГВ нужно отказаться.
Разрешенные и условно-разрешенные антибиотики при ГВ
Лечение антибиотиками при грудном вскармливании назначается в исключительных случаях, даже когда препарат находится в разрешенной или условно-разрешенной группе. Всегда есть риск развития побочных эффектов, об этом производители предупреждают в инструкции к антибиотикам. • Пенициллины (Пенициллин, Амоксиклав, Ампициллин, Амоксициллин), практически не попадают в молоко, но накапливаясь, способны вызвать колики, вздутие у малыша, часто провоцируют сыпь и аллергическую реакцию у младенцев. • Цефалоспорины (Цефалексин, Цефокситин, Цефазолин, Цефтриаксон) проникают в молоко в низких долях, но могут вызвать кишечные расстройства и аллергические реакции и грудничка. А о реакции организма малыша на антибиотики данной группы Цефиксим и Цефтибутен вообще нет никакой информации. • Макролиты (Азитромицин, Сумамед, Эритромицин) принимаются при хламидиозе, токсоплазмозе. Нет данных о негативном влиянии на грудничка. Однако разрешение к применению касается не всех препаратов данной группы. Джозамицин, Кларитромицин, Спирамицин запрещается при ГВ. Влияние антибиотиков при грудном вскармливании на ребёнка существенно зависит от дозировки и правил приёма препарата. Передозировка даже разрешенными препаратами чревата побочными эффектами. Также можно варьировать концентрацию токсинов в молоке, пропуская кормления в период приема препаратов группы антибиотики.
• Цефалоспорины (Цефалексин, Цефокситин, Цефазолин, Цефтриаксон) проникают в молоко в низких долях, но могут вызвать кишечные расстройства и аллергические реакции и грудничка. А о реакции организма малыша на антибиотики данной группы Цефиксим и Цефтибутен вообще нет никакой информации. • Макролиты (Азитромицин, Сумамед, Эритромицин) принимаются при хламидиозе, токсоплазмозе. Нет данных о негативном влиянии на грудничка. Однако разрешение к применению касается не всех препаратов данной группы. Джозамицин, Кларитромицин, Спирамицин запрещается при ГВ. Влияние антибиотиков при грудном вскармливании на ребёнка существенно зависит от дозировки и правил приёма препарата. Передозировка даже разрешенными препаратами чревата побочными эффектами. Также можно варьировать концентрацию токсинов в молоке, пропуская кормления в период приема препаратов группы антибиотики.
Случаи, когда назначаются антибиотики
Антибиотики могут назначаться в период кормления грудью, когда другие лекарственные препараты не в состоянии противостоять заболеванию. Так против бактерий и патогенных инфекций никакие другие медикаменты, как антибиотики, не действенны. Антибиотики при ангине Ангина – заболевание, которое вызвано стрептококковыми или стафилококковыми инфекциями, а, следовательно, без антибиотиков не обойтись. При легкой форме идеальным вариантом будут препараты пенициллиновой группы. Одни из таких – Амоксиклав. При наличии аллергической реакции или индивидуальной непереносимости на данные антибиотики, при ангине женщинам, кормящим грудью, назначаются макролиты или цефалоспорины первого или второго поколения. Лечение гайморита антибиотиками Гайморит – заболевание, которое опасно своими осложнениями, кислородным голоданием и проникновением болезнетворных бактерий в кровь, а, следовательно, и в грудное молоко. Зачастую без антибиотиков при гайморите не обойтись. Врач может назначить Аугментин или Амоксиклав, при непереносимости пенициллиновых антибиотиков – макролиты и цефалоспорины. Местные антибиотики, применяемые для лечения синуситов и гайморитов, например, Биопарокс или Полидекс, не прошли тестирование, и информация относительно влияние на ребенка отсутствует.
Так против бактерий и патогенных инфекций никакие другие медикаменты, как антибиотики, не действенны. Антибиотики при ангине Ангина – заболевание, которое вызвано стрептококковыми или стафилококковыми инфекциями, а, следовательно, без антибиотиков не обойтись. При легкой форме идеальным вариантом будут препараты пенициллиновой группы. Одни из таких – Амоксиклав. При наличии аллергической реакции или индивидуальной непереносимости на данные антибиотики, при ангине женщинам, кормящим грудью, назначаются макролиты или цефалоспорины первого или второго поколения. Лечение гайморита антибиотиками Гайморит – заболевание, которое опасно своими осложнениями, кислородным голоданием и проникновением болезнетворных бактерий в кровь, а, следовательно, и в грудное молоко. Зачастую без антибиотиков при гайморите не обойтись. Врач может назначить Аугментин или Амоксиклав, при непереносимости пенициллиновых антибиотиков – макролиты и цефалоспорины. Местные антибиотики, применяемые для лечения синуситов и гайморитов, например, Биопарокс или Полидекс, не прошли тестирование, и информация относительно влияние на ребенка отсутствует. Лечение бронхитов при ГВ Антибиотики при бронхите назначаются, только если заболевание вызвано бактериями. В списке разрешенные медикаменты из группы пенициллиновых, цефалоспоринов и макролитов. Лечение циститов Антибиотики при цистите в период кормления грудью допускаются. Амоксиклав, Зиннат, Монурал – самые популярные из списка разрешенных антибиотиков. А вот традиционные урологические препараты группы фторхинолонов в зоне табу. Маститы при ГВ Маститы – частые спутники грудного вскармливания, и при бактериальной природе их лечение требует приема антибиотиков. При мастите необходимы препараты, которые воздействуют на золотистый стафилококк, а это Амоксиклав, Цефалексин, Клиндомицин, Клоксациллин. Специалисты советуют не прекращать естественную лактацию, так как она является одной из составляющих результативного лечения маститов.
Лечение бронхитов при ГВ Антибиотики при бронхите назначаются, только если заболевание вызвано бактериями. В списке разрешенные медикаменты из группы пенициллиновых, цефалоспоринов и макролитов. Лечение циститов Антибиотики при цистите в период кормления грудью допускаются. Амоксиклав, Зиннат, Монурал – самые популярные из списка разрешенных антибиотиков. А вот традиционные урологические препараты группы фторхинолонов в зоне табу. Маститы при ГВ Маститы – частые спутники грудного вскармливания, и при бактериальной природе их лечение требует приема антибиотиков. При мастите необходимы препараты, которые воздействуют на золотистый стафилококк, а это Амоксиклав, Цефалексин, Клиндомицин, Клоксациллин. Специалисты советуют не прекращать естественную лактацию, так как она является одной из составляющих результативного лечения маститов.
Бета-лактамные антибиотики — StatPearls
Непрерывное обучение
Бета-лактамные антибиотики используются для контроля и лечения бактериальных инфекций. В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие отношение к членам межпрофессиональной медицинской бригады при лечении пациентов.
В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие отношение к членам межпрофессиональной медицинской бригады при лечении пациентов.
Цели:
Определите механизм действия бета-лактамных антибиотиков.
Опишите возможные побочные эффекты бета-лактамных антибиотиков.
Опишите соответствующий мониторинг пациентов, принимающих бета-лактамные антибиотики.
Обобщить стратегии межпрофессиональной команды по улучшению координации помощи и коммуникации для продвижения бета-лактамных антибиотиков и улучшения результатов.
Показания
Бета-лактамные антибиотики относятся к одному из наиболее часто назначаемых классов препаратов с многочисленными клиническими показаниями. Их появление, начиная с 30-х годов ХХ века, коренным образом изменило борьбу с бактериальными инфекционными заболеваниями. В настоящее время подсчитано, что ежегодные расходы на эти антибиотики составляют примерно 15 миллиардов долларов США, что составляет 65% всего рынка антибиотиков.[1] Однако их использование сталкивается с тревожным феноменом устойчивости к противомикробным препаратам, который представляет собой глобальную проблему здравоохранения.
Их появление, начиная с 30-х годов ХХ века, коренным образом изменило борьбу с бактериальными инфекционными заболеваниями. В настоящее время подсчитано, что ежегодные расходы на эти антибиотики составляют примерно 15 миллиардов долларов США, что составляет 65% всего рынка антибиотиков.[1] Однако их использование сталкивается с тревожным феноменом устойчивости к противомикробным препаратам, который представляет собой глобальную проблему здравоохранения.
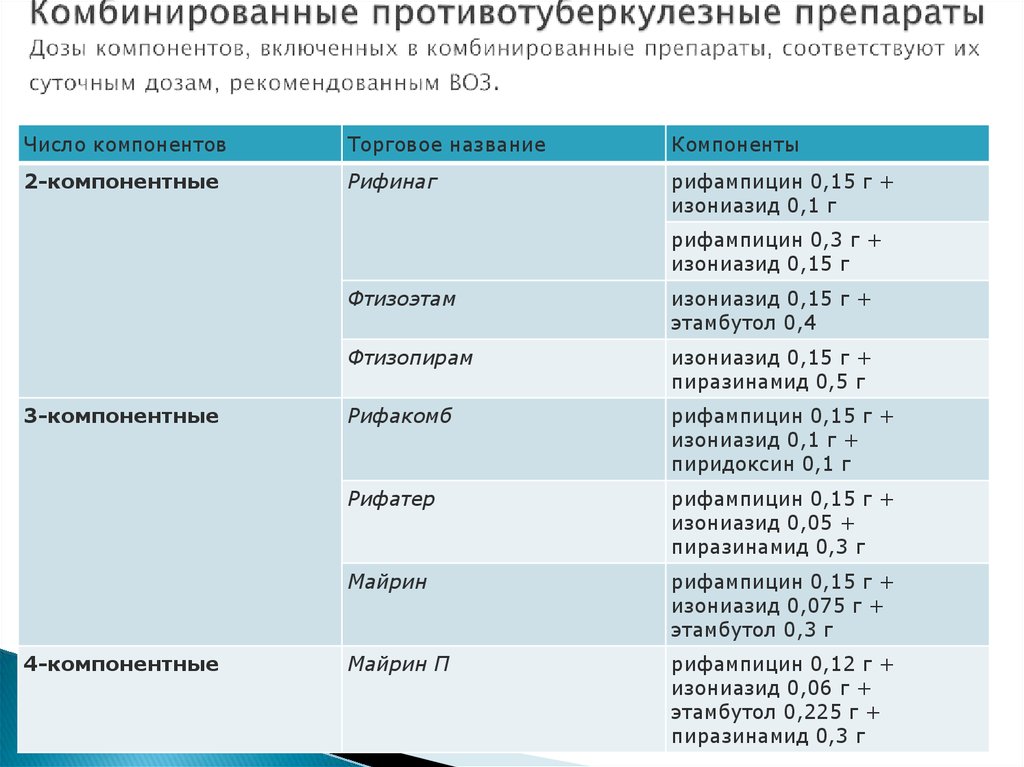
С биохимической точки зрения эти препараты имеют общую черту, состоящую из 3 атомов углерода и 1 атома азота (бета-лактамное кольцо), обладающих высокой реакционной способностью. Этот класс включает:
Пенициллины. Эти антибиотики (большинство из которых заканчиваются суффиксом — циллин ) содержат ядро из кольца 6-анипенициллановой кислоты (лактам плюс тиазолидин) и другие кольцевые цепи. В эту группу входят природные пенициллины, агенты, устойчивые к бета-лактамазам, аминопенициллины, карбоксипенициллины и уреидопенициллины.

Цефалоспорины. Они содержат ядро из 7-аминоцефалоспорановой кислоты и боковую цепь, содержащую 3,6-дигидро-2Н-1,3-тиазановые кольца. Цефалоспорины традиционно подразделяются на пять классов или поколений, хотя эта терминология не является универсальной.
Карбапенемы. Их определяющая структура представляет собой карбапенем, связанный с бета-лактамным кольцом, которое обеспечивает защиту от большинства бета-лактамаз, хотя устойчивость к этим соединениям является серьезной проблемой и встречается в основном среди грамотрицательных патогенов (например, 9).0039 Klebsiella pneumoniae , Pseudomonas aeruginosa и Acinetobacter baumannii),
Монобактамы. Бета-лактамное кольцо стоит отдельно и не сливается с другим кольцом.
Ингибиторы бета-лактамазы. Они действуют в основном за счет инактивации сериновых бета-лактамаз, представляющих собой ферменты, гидролизующие и инактивирующие бета-лактамное кольцо (особенно у грамотрицательных бактерий).
 Эти агенты включают ингибиторы бета-лактамаз первого поколения (клавулановая кислота, сульбактам и тазобактам), а также более новые авибактам и ваборбактам, которые активны против карбапенемазы, такие как
Эти агенты включают ингибиторы бета-лактамаз первого поколения (клавулановая кислота, сульбактам и тазобактам), а также более новые авибактам и ваборбактам, которые активны против карбапенемазы, такие как
Механизм сопротивления
Устойчивость к бета-лактамам является тревожным и растущим явлением и, в свою очередь, проблемой общественного здравоохранения. Это касается, прежде всего, Streptococcus pneumoniae и отдельных грамотрицательных палочек, таких как Pseudomonas aeruginosa . С появлением резистентности к антибиотикам имеет смысл изучить механизмы резистентности, поскольку это может помочь решить, какие лекарства назначать в различных сценариях и как преодолеть их. Хотя резистентность бактерий к бета-лактамам в основном выражается в продукции бета-лактамаз, задействованы и другие механизмы. Ниже приведены механизмы резистентности[2]:
Инактивация за счет продукции бета-лактамаз
Снижение проникновения в целевой участок (например, резистентность Pseudomonas aeruginosa
.Истечение из периплазматического пространства через специальные насосные механизмы
 , пенициллинорезистентность пневмококков)
, пенициллинорезистентность пневмококков)Показания к применению бета-лактамных антибиотиков
Показания к применению бета-лактамных антибиотиков многочисленны и различаются в зависимости от рассматриваемого подкласса[3]
Пенициллины
Натуральные пенициллины [пенициллин G (в/в), пенициллин V (п/о)] используются для лечения отдельных грамположительных и грамотрицательных инфекций:
Чувствительные к пенициллину Streptococcus pneumonia и менингит
1 ng 005Эндокардит 9Инфекции кожи и мягких тканей Агенты, устойчивые к бета-лактамазам
Эти препараты [оксациллин (в/в), нафциллин (в/в), диклоксациллин (в/в)] активны в отношении грамположительных микроорганизмов. Несмотря на широко распространенную резистентность стафилококков, они остаются антибиотиками выбора при лечении метициллин-чувствительных стафилококков (MSSA):
Инфекции кожи и мягких тканей (MSSA)
Серьезные инфекции, вызванные MSSA
Аминопенициллины
Эти антибиотики обладают активностью против грамположительных и грамотрицательных бактерий (например, многих Enterobacteriaceae ) анаэробных организмов.
 Они обычно используются вместе с ингибиторами бета-лактамаз.
Они обычно используются вместе с ингибиторами бета-лактамаз.Амоксициллин (п/о), ампициллин (п/о/в/в):
Инфекции верхних дыхательных путей (синусит, фарингит, средний отит)
Enterococcus faecalis инфекции
инфекции Listeria
Инфекции верхних дыхательных путей (синусит, средний отит)
Интраабдоминальные инфекции
Уреидопенициллины
Пиперациллин (уреидопенициллин) обладает активностью против устойчивых к аминопенициллину грамотрицательных бактерий ( Pseudomonas aeruginosa ). Их обычно комбинируют с ингибиторами бета-лактамаз.
Цефалоспорины
Цефалоспорины первого поколения
Цефазолин (в/в), цефалексин (п/о), цефадроксил (п/о)
Инфекции кожи и мягких тканей серьезные инфекции, вызванные MSSA
Периоперационная хирургическая профилактика Цефалоспорины второго поколения
Цефуроксим (в/в/п/о), цефокситин (в/в), цефотетан (в/в), цефаклор (в/в) цефпрозил (в/в)
Инфекции верхних дыхательных путей (синусит, средний отит)
Цефокситин, цефотетан-гинекологические инфекции,
Периоперационная хирургическая профилактика
Внебольничная пневмония, менингит
Инфекции мочевыводящих путей
Стрептококковый эндокардит
Гонорея
Тяжелая форма болезни Лайма.
Внутрибольничные инфекции-пневмония
Менингит
Осложненные внутрибрюшные инфекции (ЦИАИ) [цефтазолон плюс ингибитор бета-лактамазы]
Осложненные инфекции мочевыводящих путей (оИМП) [цефтазолон плюс
- ингибитор бета-лактамазы 9000] 7
Цефалоспорины против метициллин-резистентного золотистого стафилококка (MRSA)
Цефтаролин (в/в), цефтобипрол (в/в) [Также описывается как «пятое поколение»]
Внебольничная пневмония
Внутрибольничная пневмония (за исключением вентиляторной пневмонии)
Инфекция кожи и мягких тканей
Карбапенемы
Имипенем/циластатин (в/в), меропенем (в/в), дорипенем (в/в)
Внутрибольничные инфекции — пневмония, интраабдоминальные инфекции, инфекции мочевыводящих путей
Менингит (особенно меропенем) 7 0 4
Эртапенем ( IV)
Внебольничные инфекции
Внутрибольничные инфекции.

Монобактамы
Азтреонам (IV). Он эффективен только против аэробных грамотрицательных микроорганизмов, но не проявляет активности против грамположительных бактерий или анаэробов.
Внутрибольничные инфекции, например, пневмония
Инфекции мочевыводящих путей я, цефтазидим /авибактам, меропенем/ваборбактам, имипенем/циластатин/релебактам, азтреонам/авибактам), цефалоспорины, конъюгированные сидерофором (цефидерокол), и монобактамы, конъюгированные сидерофором, были разработаны и представляют собой варианты лечения сложных инфекций, особенно в отделении интенсивной терапии. .[4][5]
Механизм действия
Пептидогликан или муреин является важным компонентом клеточной стенки бактерий, обеспечивающим ей механическую стабильность. Это чрезвычайно консервативный компонент как грамположительных, так и грамотрицательных оболочек. Тем не менее, пептидогликан представляет собой толстую структуру у грамположительных бактерий (≥10 слоев) и тонкую (один или два слоя) у грамотрицательных.
 Что касается его структуры, пептидогликан состоит из гликановых цепей, состоящих из субъединиц дисахарида N-ацетилглюкозамина и N-ацетилмурамовой кислоты; N-ацетилмурамовая часть связана с высококонсервативными пентапептидными или тетрапептидными стеблями (l-аланин-d-изоглутамин-l-лизин-d-аланин-[d-аланин]).0005
Что касается его структуры, пептидогликан состоит из гликановых цепей, состоящих из субъединиц дисахарида N-ацетилглюкозамина и N-ацетилмурамовой кислоты; N-ацетилмурамовая часть связана с высококонсервативными пентапептидными или тетрапептидными стеблями (l-аланин-d-изоглутамин-l-лизин-d-аланин-[d-аланин]).0005Бета-лактамные антибиотики ингибируют последнюю стадию синтеза пептидогликана, ацилируя транспептидазу, участвующую в сшивке пептидов, с образованием пептидогликана. Мишени действия бета-лактамных антибиотиков известны как пенициллин-связывающие белки (ПСБ). Это связывание, в свою очередь, прерывает терминальный процесс транспептидации и вызывает потерю жизнеспособности и лизис, в том числе посредством аутолитических процессов внутри бактериальной клетки.[6]
Введение
При пероральном введении следует учитывать, что пища может повлиять на пероральное всасывание. Более того, абсорбция некоторых молекул, таких как цефуроксим и цефподоксим, снижается под действием Н3-блокаторов или невсасывающихся антацидов.
 Введение этих агентов может осуществляться разными путями.
Введение этих агентов может осуществляться разными путями.Пенициллин V предпочтительнее для приема внутрь за 30 минут до еды или через 2 часа после нее.
Пенициллин G доступен в виде 2 парентеральных препаратов: бензатин и прокаин.
Пенициллин G бензатин дозируют один раз в месяц, так как он имеет более длительный период полувыведения.
Пенициллин G прокаин назначают один раз в день из-за более короткого периода полувыведения.
Ни один из них не следует вводить внутривенно во избежание серьезной токсичности.
Резистентные к пенициллиназе пенициллины (оксациллин, клоксациллин и диклоксациллин) доступны в пероральных и парентеральных препаратах.
Аминопенициллины: ампициллин и амоксициллин доступны как для перорального, так и для парентерального введения, хотя амоксициллин предпочтительнее перорально.
Антисинегнойные пенициллины: пиперациллин доступен только для парентерального введения.

Большинство цефалоспоринов легко всасываются после приема внутрь; введение других может быть внутримышечным или внутривенным.
Поскольку действие бета-лактамных антибиотиков на эрадикацию бактерий зависит от времени (длительность воздействия антибиотика на патоген имеет решающее значение для эрадикации бактерий), их непрерывные инфузии могут иметь преимущества по сравнению со стандартным прерывистым болюсным дозированием. Этот терапевтический подход особенно эффективен, особенно когда патогены имеют более высокие минимальные ингибирующие концентрации (МПК) [7]. Таким образом, время, в течение которого свободные концентрации лекарственного средства остаются выше МИК (fT > МИК), становится лучшим предиктором гибели.
Побочные эффекты
По сравнению с другими классами бета-лактамные препараты обычно безопасны и хорошо переносятся.[8] Наиболее частыми побочными эффектами являются аллергические реакции, частота которых варьируется от 0,7% до 10%.
 Эти реакции могут возникать при приеме любой лекарственной формы пенициллина и в основном представляют собой пятнисто-папулезную сыпь, тогда как сообщения об анафилаксии появляются у 0,004–0,015% пациентов.[9] Помимо аллергических реакций, бета-лактамы могут вызывать и другие побочные эффекты. В частности, это:
Эти реакции могут возникать при приеме любой лекарственной формы пенициллина и в основном представляют собой пятнисто-папулезную сыпь, тогда как сообщения об анафилаксии появляются у 0,004–0,015% пациентов.[9] Помимо аллергических реакций, бета-лактамы могут вызывать и другие побочные эффекты. В частности, это:Пенициллин G и пиперациллин также связаны с нарушением гемостаза из-за нарушения агрегации тромбоцитов.
Внутривенная инъекция бензатина пенициллина G коррелирует с кардиореспираторной остановкой и смертью.
Цефалоспорины связаны с редкими случаями угнетения функции костного мозга, включая гранулоцитопению.
Некоторые цефалоспорины потенциально нефротоксичны и коррелируют с некрозом почечных канальцев. Цефтриаксон может вызывать желтуху у новорожденных, вытесняя билирубин из альбумина.
Может также привести к билиарному псевдолитиазу из-за высокого сродства к желчному кальцию.
Цефепим коррелирует с энцефалопатией и бессудорожным эпилептическим статусом при высоких дозах или у пациентов с почечной дисфункцией.

Имипенем вызывает судороги при введении в высоких дозах пациентам с поражениями ЦНС или почечной недостаточностью.[10]
Противопоказания
Пенициллины противопоказаны пациентам с предшествующими анафилактическими реакциями или серьезными кожными реакциями, например, синдромом Стивенса-Джонсона и токсическим эпидермальным некрозом[8].
Мониторинг
Большинство доступных пенициллинов имеют короткий период полувыведения, в основном менее часа. Введение парентеральных средств проводят каждые четыре часа, обычно при лечении тяжелых системных инфекций с нормальной функцией почек. Пиперациллин и ампициллин требуют коррекции дозы при назначении пациентам с почечной недостаточностью (СКФ менее 10 мл/мин). Другие препараты, такие как нафциллин, оксациллин, клоксациллин и диклоксациллин, выводятся гепатобилиарно и поэтому не требуют модификации при почечной недостаточности.
Все пенициллины достигают терапевтических уровней в плевральной, перикардиальной, перитонеальной, синовиальной жидкости и моче.
 Следует отметить, что проникновение спинномозговой жидкости (СМЖ) плохое при отсутствии воспаления, но достигает терапевтического уровня при менингите.[11]
Следует отметить, что проникновение спинномозговой жидкости (СМЖ) плохое при отсутствии воспаления, но достигает терапевтического уровня при менингите.[11]Улучшение результатов медицинских бригад
Пенициллины являются наиболее часто используемыми антибиотиками широкого спектра действия многими клиницистами, в том числе поставщиками первичной медико-санитарной помощи, терапевтами, экспертами по инфекционным заболеваниям и практикующими медсестрами. Внутри подгрупп пенициллинов существуют различия между антибиотиками по фармакокинетике, охвату, безопасности и стоимости, что дает достаточный выбор при выборе препарата для использования.
Их использование по-прежнему требует координации межпрофессиональной команды. Вышеупомянутые клиницисты будут назначать/назначать препараты, но уход за больными часто будет осуществляться (в стационаре) или консультировать по вопросам введения (амбулаторно). Фармацевты должны участвовать в согласовании лекарств, поиске взаимодействий и подкреплении инструкций по применению.
 Медсестры часто будут первой линией контакта в случае нежелательных явлений, а также имеют хорошие возможности для оценки терапевтической эффективности. Фармацевты должны проверить дозировку и продолжительность терапии и связаться с назначающим врачом при обнаружении любого несоответствия. Все члены медицинской бригады должны помнить об анафилактических реакциях на бета-лактамные агенты и возможности перекрестной аллергии и сообщать об этом бригаде, когда они присутствуют.
Медсестры часто будут первой линией контакта в случае нежелательных явлений, а также имеют хорошие возможности для оценки терапевтической эффективности. Фармацевты должны проверить дозировку и продолжительность терапии и связаться с назначающим врачом при обнаружении любого несоответствия. Все члены медицинской бригады должны помнить об анафилактических реакциях на бета-лактамные агенты и возможности перекрестной аллергии и сообщать об этом бригаде, когда они присутствуют.Хотя использование бета-лактамов очень распространено, их эффективное назначение требует подхода межпрофессиональной команды для достижения оптимальных результатов для пациентов. [Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Thakuria B, Lahon K. Бета-лактамные антибиотики как эмпирическая терапия в развивающихся странах: обновленная информация об их текущем состоянии и рекомендации по противодействию устойчивости к ним.
 J Clin Diagn Res. 2013 июнь;7(6):1207-14. [Бесплатная статья PMC: PMC3708238] [PubMed: 23
J Clin Diagn Res. 2013 июнь;7(6):1207-14. [Бесплатная статья PMC: PMC3708238] [PubMed: 233]
- 2.
Ибрагим М.Э., Аббас М., Аль-Шахрай А.М., Эламин Б.К. Фенотипическая характеристика и закономерности резистентности к антибиотикам грамотрицательных бактерий расширенного спектра β и AmpC β -лактамаз, продуцирующих грамотрицательные бактерии в специализированной больнице, Саудовская Аравия. Может ли J заразить Dis Med Microbiol. 2019; 2019: 6054694. [Бесплатная статья PMC: PMC6617866] [PubMed: 31346353]
- 3.
Пробст-Кеппер М., Гегинат Г. [Новые антибиотики для лечения высокорезистентных грамотрицательных бактерий]. Анастезиол Интенсивмед Нотфалмед Шмерцтер. 2018 июль; 53 (7-08): 529-542. [PubMed: 30036899]
- 4.
Леоне С., Дамиани Г., Пезоне И., Келли М.Э., Касселла М., Альфьери А., Пейс М.С., Фиоре М. Новые противомикробные варианты лечения сложных внутрибрюшных инфекций. Eur J Clin Microbiol Infect Dis.
 2019 май; 38(5):819-827. [PubMed: 30
2019 май; 38(5):819-827. [PubMed: 30- 8]
- 5.
Леоне С., Касселла М., Пезоне И., Фиоре М. Новые антибиотики для лечения серьезных инфекций у пациентов отделения интенсивной терапии. Curr Med Res Opin. 201935 августа (8): 1331-1334. [PubMed: 30760041]
- 6.
Eckburg PB, Lister T, Walpole S, Keutzer T, Utley L, Tomayko J, Kopp E, Farinola N, Coleman S. Безопасность, переносимость, фармакокинетика и потенциал взаимодействия с лекарственными средствами SPR741, внутривенного потенцирующего средства, после однократного и многократного возрастания доз и в сочетании с β-лактамными антибиотиками у здоровых субъектов. Противомикробные агенты Chemother. 63(9) сентября 2019 г. [Бесплатная статья PMC: PMC6709486] [PubMed: 31262767]
- 7.
Лодисе Т.П., Ломаэстро Б.М., Друсано Г.Л., Общество фармацевтов-инфекционистов. Применение антимикробных фармакодинамических концепций в клинической практике: внимание к бета-лактамным антибиотикам: взгляды Общества фармацевтов-инфекционистов.
 Фармакотерапия. 2006 сен; 26 (9): 1320-32. [PubMed: 16945055]
Фармакотерапия. 2006 сен; 26 (9): 1320-32. [PubMed: 16945055]- 8.
Chiriac AM, Rerkpattanapipat T, Bousquet PJ, Molinari N, Demoly P. Оптимальные ступенчатые дозы для тестов на провокацию лекарств для подтверждения бета-лактамной гиперчувствительности. Аллергия. 2017 Апрель; 72 (4): 552-561. [В паблике: 27569064]
- 9.
Miller RL, Shtessel M, Robinson LB, Banerji A. Достижения в области лекарственной аллергии, крапивницы, ангионевротического отека и анафилаксии в 2018 году. J Allergy Clin Immunol. 2019 авг; 144(2):381-392. [Бесплатная статья PMC: PMC6688939] [PubMed: 31247266]
- 10.
Podlecka D, Jerzynska J, Malewska-Kaczmarek K, Stelmach I. Случай ребенка с несколькими анафилактическими реакциями на лекарства. Глоб Педиатр Здоровье. 2019;6:2333794X19855287. [Бесплатная статья PMC: PMC6587380] [PubMed: 31259207]
- 11.
Mortensen JS, Jensen BP, Zhang M, Doogue M. Преаналитическая стабильность пиперациллина, тазобактама, меропенема и цефтазидима в плазме и цельной крови с использованием жидкостной хроматографии и тандемной масс-спектрометрии.
 Мониторинг наркотиков. 2019 авг; 41 (4): 538-543. [PubMed: 31306394]
Мониторинг наркотиков. 2019 авг; 41 (4): 538-543. [PubMed: 31306394]- 12.
Хань М.Л., Лю С., Велков Т., Линь Ю.В., Чжу И., Крик Д.Дж., Барлоу К.К., Ю. Х.Х., Чжоу З., Чжан Дж., Ли Дж. Сравнительная метаболомика раскрывает ключ Пути, связанные с синергетическим уничтожением комбинации колистина и сульбактама против множественной лекарственной устойчивости Acinetobacter baumannii . Фронт Фармакол. 2019;10:754. [Бесплатная статья PMC: PMC6620532] [PubMed: 31333468]
Антибиотики — StatPearls — NCBI Bookshelf
Continuing Education Activity
Антибиотики широко используются в современном здравоохранении. Так было не всегда. С древних времен люди искали способы лечения больных инфекциями. Считалось, что красители, плесень и даже тяжелые металлы обещают исцеление. Медицинское значение имеют различные микроорганизмы, включая бактерии, вирусы, грибки и паразиты. Антибиотики — это соединения, которые нацелены на бактерии и, таким образом, предназначены для лечения и предотвращения бактериальных инфекций.
 В ходе этого мероприятия будут изучены различные классы антибиотиков, механизмы их действия, восприимчивость бактерий и потенциальные побочные эффекты.
В ходе этого мероприятия будут изучены различные классы антибиотиков, механизмы их действия, восприимчивость бактерий и потенциальные побочные эффекты.Цели:
Определите различные классы антибиотиков.
Объясните различные механизмы действия различных классов антибиотиков.
Рассмотрите потенциальные неблагоприятные эффекты как антибиотиков в целом, так и побочных эффектов, специфичных для класса.
Обобщите требования к мониторингу пациентов, получающих антибактериальную терапию.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Антибиотики широко используются в современной медицине. Так было не всегда. С древних времен люди искали способы лечения больных инфекциями. Считалось, что красители, формы и даже тяжелые металлы обещают исцеление.[1] Медицинское значение имеют различные микроорганизмы, включая бактерии, вирусы, грибки и паразиты.
 Антибиотики — это соединения, которые нацелены на бактерии и, таким образом, предназначены для лечения и предотвращения бактериальных инфекций.
Антибиотики — это соединения, которые нацелены на бактерии и, таким образом, предназначены для лечения и предотвращения бактериальных инфекций.Функция
Классификация
Фармакология антибиотиков включает разрушение бактериальной клетки либо путем предотвращения размножения клеток, либо путем изменения необходимой клеточной функции или процесса внутри клетки. Антимикробные агенты классически подразделяются на две основные категории в зависимости от их действия на бактерии in vitro: бактерицидные и бактериостатические. Распространенное учение часто объясняет, что бактерицидные антибиотики «убивают» бактерии, а бактериостатические антибиотики «предотвращают рост» бактерий. Истинное определение не так просто. Чтобы точно определить каждую категорию, необходимо понимать минимальную ингибирующую концентрацию (МИК) и минимальную бактерицидную концентрацию (МБК). Самая низкая концентрация, которая подавляет видимый рост бактерий через 24 часа, — это МИК.[2] MBC — это концентрация антибиотика, которая снижает плотность бактерий в 1000 раз за 24 часа.
 [2]
[2]Бактериостатическая активность дополнительно определяется отношением МБК к МПК более 4, тогда как отношение МБК к МИК меньше или равное 4 является бактерицидным.[2] Клинические последствия эффективности антибиотиков в значительной степени зависят от многих факторов, не ограничиваясь ими: фармакокинетические и фармакодинамические принципы, конкретные бактерии, бактериальная нагрузка и место инфекции. Это еще более осложняется способностью некоторых бактериостатических антибиотиков проявлять бактерицидную активность в отношении определенных бактерий.[3] Таким образом, бактериостатические антибиотики также убивают бактерии, но лабораторное определение создает впечатление, что это не так. Например, бактериостатический антибиотик, такой как линезолид, может оказывать бактерицидное действие на Streptococcus pneumoniae .[3] Эта концепция работает в обратном порядке, и бактерицидные противомикробные препараты также могут быть бактериостатическими в отношении определенных бактериальных штаммов и состояний.
 Существуют противоречивые данные о необходимости применения бактерицидных антибиотиков для тяжелобольных пациентов или пациентов с ослабленным иммунитетом.[3]
Существуют противоречивые данные о необходимости применения бактерицидных антибиотиков для тяжелобольных пациентов или пациентов с ослабленным иммунитетом.[3]Типы противомикробных агентов [3]
Класс лекарств и специфические антибиотики
Бактериостатический
Глицилциклины: тигециклин
Тетрациклины: доксициклин, миноциклин
Линкозамиды: клиндамицин
- ромицин кларитромицин,
макролиды:
Оксазолидиноны: Линезолид
Сульфонамиды: Сульфаметоксазол
Бактерицидный
Аминогликозиды: тобрамицин, гентамицин, амикацин
Бета-лактамы (пенициллины, цефалоспорины, карбапенемы): амоксициллин, цефазолин, меропенем
Фторхинолоны: ципрофлоксацин, левофлоксацин, моксифлоксацин
:0
Циклические липопептиды: даптомицин
Нитроимидазолы: Метронидазол
Фармакокинетика и фармакодинамика
Фармакокинетические (ФК) и фармакодинамические (ФД) параметры используются вместе для максимизации эффективности противомикробной терапии за счет оптимизации дозирования у пациентов.
 Всасывание, распределение, метаболизм и выведение — это компоненты фармакокинетики, которые со временем влияют на концентрацию антибиотика.[4] Эти процессы описывают, как антибиотик перемещается по организму с момента его попадания в организм до тех пор, пока исходное лекарство или метаболиты не будут удалены. PD антибиотика описывает действие лекарства в организме, когда оно достигает мишени инфекции. Основными принципами, которыми руководствуется PD, являются процент времени, в течение которого свободное лекарство превышает МИК, количество площади свободного лекарственного средства под концентрацией МИК и максимальная концентрация МИК.[5]
Всасывание, распределение, метаболизм и выведение — это компоненты фармакокинетики, которые со временем влияют на концентрацию антибиотика.[4] Эти процессы описывают, как антибиотик перемещается по организму с момента его попадания в организм до тех пор, пока исходное лекарство или метаболиты не будут удалены. PD антибиотика описывает действие лекарства в организме, когда оно достигает мишени инфекции. Основными принципами, которыми руководствуется PD, являются процент времени, в течение которого свободное лекарство превышает МИК, количество площади свободного лекарственного средства под концентрацией МИК и максимальная концентрация МИК.[5]Бактерицидная активность зависит либо от концентрации, либо от времени. Если антибиотик проявляет зависимое от концентрации уничтожение, например, фторхинолоны или даптомицин, эффективность уничтожения бактерий увеличивается по мере увеличения концентрации антибиотика.[6] Пенициллины и тетрациклины зависят от времени; следовательно, продолжительность эффективной концентрации этих антибиотиков определяет бактерицидную активность.
 [6]
[6]После всасывания антибиотика его распределение влияет на степень противомикробной активности. Отношение общего количества препарата в организме к концентрации в сыворотке крови представляет собой объем распределения.[5] Уровень связывания с белками будет влиять на доступность активного препарата в месте инфекции. Если антибиотик в значительной степени связан с белками, свободного препарата для антимикробного действия будет меньше, как это наблюдается у пациентов с гипоальбуминемией.[5] Увеличение жировой ткани у пациента увеличивает объем распределения, если лекарство обладает высокими липофильными свойствами.[7]
Крайне важно отметить локализацию инфекции, поскольку некоторые антибиотики не подходят для лечения определенных инфекций. Например, при лечении менингита проникновение через гематоэнцефалический барьер имеет решающее значение, если нужно достичь терапевтических уровней антибиотиков в очаге инфекции, чтобы предотвратить неэффективность лечения.[5]
Проблемы, вызывающие озабоченность
Осложнения
Побочные реакции
Все лекарства могут вызывать побочные реакции, и антибиотики не являются исключением.
 Было показано, что у каждого пятого госпитализированного пациента развивается побочная реакция на антибиотик, и почти такая же доля посещений отделения неотложной помощи, связанных с приемом лекарств, связана с побочными реакциями на антибиотики.[8][9]] Иммуноопосредованная реакция или гиперчувствительность классифицируются как аллергия.[10] Это включает IgE-опосредованную анафилаксию и ангионевротический отек. Лекарства часто достигают вредных уровней в организме из-за снижения метаболизма и выведения, или режимы высоких дозировок могут вызывать токсичность из-за сверхтерапевтических уровней лекарств. [11] Если возникает реакция, не опосредованная иммунной системой и не связанная с уровнем препарата; тогда это считается побочным эффектом.[11]
Было показано, что у каждого пятого госпитализированного пациента развивается побочная реакция на антибиотик, и почти такая же доля посещений отделения неотложной помощи, связанных с приемом лекарств, связана с побочными реакциями на антибиотики.[8][9]] Иммуноопосредованная реакция или гиперчувствительность классифицируются как аллергия.[10] Это включает IgE-опосредованную анафилаксию и ангионевротический отек. Лекарства часто достигают вредных уровней в организме из-за снижения метаболизма и выведения, или режимы высоких дозировок могут вызывать токсичность из-за сверхтерапевтических уровней лекарств. [11] Если возникает реакция, не опосредованная иммунной системой и не связанная с уровнем препарата; тогда это считается побочным эффектом.[11]При начале антимикробной терапии оправдано ожидание побочных эффектов. Некоторые пациенты подвергаются более высокому риску, например, пожилые люди, пациенты с множественными сопутствующими заболеваниями и госпитализированные пациенты.[8] Важно следить за реакциями пациентов, поскольку многие из них развиваются со временем.
 Некоторые антибиотики требуют мониторинга уровня лекарственного средства для определения эффективности терапии и предотвращения побочных эффектов, таких как ванкомицин и аминогликозиды.[12] Почечная токсичность может развиться, если эти противомикробные препараты поддерживают высокие минимальные уровни; поэтому необходимо контролировать функцию почек и измерять уровень препарата.
Некоторые антибиотики требуют мониторинга уровня лекарственного средства для определения эффективности терапии и предотвращения побочных эффектов, таких как ванкомицин и аминогликозиды.[12] Почечная токсичность может развиться, если эти противомикробные препараты поддерживают высокие минимальные уровни; поэтому необходимо контролировать функцию почек и измерять уровень препарата.Побочные реакции, связанные с системами органов
Почечный Почечная недостаточность 004 Сердечный
Удлинение интервала QT[11]
Гематологические
Тромбоцитопения
Лейкопения
Агранулоцитоз
Аномальная агрегация тромбоцитов 027
Дерматологический
Сыпь
Многоформная эритема
Синдром Стивенса-Джонсона
Токсический эпидермальный некролиз 004 Неврологический
Ототоксичность
Вестибулярная дисфункция
Судороги
Периферическая невропатия[11]
5
- 4 Другое
Гепатотоксичность
Миопатия
Электролитные нарушения (например, гипокалиемия, гипогликемия)
- 04 Лекарственная лихорадка
Диарея, вызванная лекарствами[11]
Ферментативная модификация
Химическая деградация[14][15]
Мутация целевого сайта
Модификация антибиотика
Защита целевого сайта
Устранение целевого сайта[14][15]
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
- 1.
Гулд К. Антибиотики: от предыстории до наших дней. J Антимикробная химиотерапия. 2016 март; 71 (3): 572-5.
 [PubMed: 26851273]
[PubMed: 26851273]- 2.
Pankey GA, Sabath LD. Клиническая значимость бактериостатического и бактерицидного механизмов действия при лечении грамположительных бактериальных инфекций. Клин Инфекция Дис. 2004 15 марта; 38 (6): 864-70. [В паблике: 14999632]
- 3.
Nemeth J, Oesch G, Kuster SP. Бактериостатические и бактерицидные антибиотики у пациентов с серьезными бактериальными инфекциями: систематический обзор и метаанализ. J Антимикробная химиотерапия. 2015 г., февраль; 70(2):382-95. [PubMed: 25266070]
- 4.
Sy SK, Zhuang L, Derendorf H. Фармакокинетика и фармакодинамика в оптимизации дозы антибиотиков. Мнение эксперта Препарат Метаб Токсикол. 2016;12(1):93-114. [PubMed: 26652832]
- 5.
Онуфрак Н.Дж., Форрест А., Гонсалес Д. Фармакокинетические и фармакодинамические принципы противоинфекционного дозирования. Клин Тер. 2016 сен;38(9):1930-47. [Бесплатная статья PMC: PMC5039113] [PubMed: 27449411]
- 6.

Амброуз П.Г., Бхавнани С.М., Рубино К.М., Луи А., Гамбо Т., Форрест А., Друсано Г.Л. Фармакокинетика-фармакодинамика противомикробной терапии: это уже не только для мышей. Клин Инфекция Дис. 2007 01 января; 44 (1): 79-86. [PubMed: 17143821]
- 7.
Мэн Л., Муй Э., Голубар М.К., Дерезинский СК. Комплексное руководство по дозированию антибиотиков у взрослых с ожирением. Фармакотерапия. 2017 ноябрь;37(11):1415-1431. [PubMed: 28869666]
- 8.
Tamma PD, Avdic E, Li DX, Dzintars K, Cosgrove SE. Ассоциация нежелательных явлений с использованием антибиотиков у госпитализированных пациентов. JAMA Стажер Мед. 01 сентября 2017 г.; 177(9):1308-1315. [Бесплатная статья PMC: PMC5710569] [PubMed: 28604925]
- 9.
Шехаб Н., Патель П.Р., Шринивасан А., Будниц Д.С. Посещения отделений неотложной помощи в связи с нежелательными явлениями, связанными с антибиотиками. Клин Инфекция Дис. 2008 г., 15 сентября; 47(6):735-43.
 [PubMed: 18694344]
[PubMed: 18694344]- 10.
Гручалла Р.С., Пирмохамед М. Клиническая практика. Аллергия на антибиотики. N Engl J Med. 2006 г., 09 февраля; 354 (6): 601-9. [PubMed: 16467547]
- 11.
Грановиц Э.В., Браун Р.Б. Побочные реакции на антибиотики и лекарственные взаимодействия. Крит Уход Клин. 2008 Apr;24(2):421-42, xi. [В паблике: 18361954]
- 12.
Линч Т.Дж. Выбор оптимальной антимикробной терапии. Мед Клин Норт Ам. 2012 ноябрь; 96 (6): 1079-94. [PubMed: 23102478]
- 13.
Браунер А., Фридман О., Гефен О., Балабан Н.К. Различают резистентность, толерантность и устойчивость к антибиотикотерапии. Nat Rev Microbiol. 2016 апр;14(5):320-30. [PubMed: 27080241]
- 14.
Чен Л.Ф., Чопра Т., Кайе К.С. Возбудители устойчивы к антибактериальным препаратам. Заразить Dis Clin North Am. 2009 г.Декабрь 23(4):817-45, vii. [PubMed: 19
6]
- 15.
van Duijkeren E, Schink AK, Roberts MC, Wang Y, Schwarz S.

Устойчивость к антибиотикам
Более широкое использование противомикробных препаратов в клинической практике и других отраслях, таких как животноводство, привело к устойчивости бактерий к антибиотикам.
 Бактерии разработали механизмы, способствующие выживанию этой устойчивости.
Бактерии разработали механизмы, способствующие выживанию этой устойчивости.МИК бактериального изолята может служить показателем чувствительности бактерий к определенным антибиотикам.[13] Высокий уровень МИК выше порога чувствительности к антибиотику свидетельствует об устойчивой инфекции. Бактерии могут обладать устойчивостью к антимикробному агенту за счет внутренних или приобретенных свойств. Не все антибиотики эффективны против всех типов бактерий. Если бактерия не содержит мишени для конкретного антибиотика, известно, что она обладает внутренней резистентностью.[14] Ванкомицин, антибиотик, который, как известно, действует против грамположительных бактерий, не может проникать через клеточную стенку грамотрицательных бактерий.[15] Кроме того, бета-лактамным антибиотикам для функционирования требуется клеточная стенка, поэтому они не будут эффективны против таких бактерий, как 9.0039 Виды Mycoplasma , у которых отсутствует этот клеточный компонент.
Бактерии также обладают способностью приобретать устойчивость путем приобретения генов устойчивости от других бактерий или развития мутации, приводящей к снижению или полному исчезновению эффективности антибиотиков.
 Этот тип устойчивости известен как приобретенная устойчивость.[14]
Этот тип устойчивости известен как приобретенная устойчивость.[14]В бактериальном организме может присутствовать более одного типа бактериальной резистентности. Общие стратегии сопротивления перечислены здесь.
Механизмы резистентности и примеры
Снижение внутриклеточной концентрации антибиотиков
Инактивация антибиотиков
Изменение целевой площадки
Клиническая значимость
Подход к антимикробной терапии
Возбудители и источник инфекции не всегда известны при первом обращении пациента. Антибиотикотерапия часто начинается до установления точного диагноза инфекционного заболевания, и результаты микробиологического исследования уже доступны.
 Антибиотики, используемые таким образом, называются эмпирической терапией. Этот подход пытается охватить все потенциальные патогены. Когда результаты микробиологических тестов и чувствительность к антибиотикам известны, окончательное лечение антибиотиками может быть адаптировано к конкретной этиологии инфекции.
Антибиотики, используемые таким образом, называются эмпирической терапией. Этот подход пытается охватить все потенциальные патогены. Когда результаты микробиологических тестов и чувствительность к антибиотикам известны, окончательное лечение антибиотиками может быть адаптировано к конкретной этиологии инфекции.Профилактическая терапия используется для предотвращения инфекций у пациентов, у которых нет активной инфекции. Пациенты с ослабленным иммунитетом могут получать профилактику против определенных условно-патогенных микроорганизмов. Профилактические антибиотики также используются перед хирургическими вмешательствами и травматическими повреждениями, такими как открытые переломы и укусы животных.
Тяжесть потенциальной бактериальной инфекции будет определять уровень агрессивности антибиотикотерапии. Например, при опасном для жизни инфекционном заболевании, таком как сепсис, эмпирические парентеральные антибиотики широкого спектра действия следует вводить быстро после выявления сепсиса и продолжать до тех пор, пока не будет собрано больше информации об этиологии и возбудителях [12].
 Эмпирические антибиотики используются для охвата всех потенциальных бактерий до получения результатов посева. После того, как бактериальные культуры доступны и получены результаты, антибиотики могут быть деэскалированы до только того, что необходимо. Такой подход называется направленной антибактериальной терапией.[16] Часто эмпирические антибиотики имеют широкий спектр действия, что относится к препаратам, нацеленным на множество различных классов бактерий (например, грамположительные, грамотрицательные и анаэробные бактерии). При простой инфекции кожи и мягких тканей, не требующей госпитализации, антибиотики более узкого спектра можно назначать перорально.[12]
Эмпирические антибиотики используются для охвата всех потенциальных бактерий до получения результатов посева. После того, как бактериальные культуры доступны и получены результаты, антибиотики могут быть деэскалированы до только того, что необходимо. Такой подход называется направленной антибактериальной терапией.[16] Часто эмпирические антибиотики имеют широкий спектр действия, что относится к препаратам, нацеленным на множество различных классов бактерий (например, грамположительные, грамотрицательные и анаэробные бактерии). При простой инфекции кожи и мягких тканей, не требующей госпитализации, антибиотики более узкого спектра можно назначать перорально.[12]В дополнение к возможному источнику (источникам) инфекции, вероятным возбудителям и срочности ситуации следует учитывать различные факторы пациента.[12] Перед выбором антибиотика необходимо оценить возраст пациента, аллергию на лекарства, функцию почек и печени, историю болезни в прошлом, наличие иммунодефицита и недавнее использование антибиотиков.
 Многие из этих факторов пациента влияют на фармакодинамику и фармакокинетику антибиотиков, которые будут влиять на дозировку для оптимизации эффективности.
Многие из этих факторов пациента влияют на фармакодинамику и фармакокинетику антибиотиков, которые будут влиять на дозировку для оптимизации эффективности.Улучшение результатов работы команды здравоохранения
Несколько слов об управлении противомикробными препаратами
Сообщалось, что в Соединенных Штатах почти половина назначенных антибиотиков была так или иначе неверна, и почти одна треть антибиотиков была сочтена ненужной для госпитализированных пациентов.[17] Надлежащее использование антибиотиков стало проблемой общественного здравоохранения (CDC 19). Практика рационального использования противомикробных препаратов основана на концепции оптимизации противомикробной терапии и снижения нежелательных явлений с помощью экономически обоснованных методов.[18] Эти межпрофессиональные программы работают над определением способов улучшения результатов лечения пациентов. Программы управления становятся все более распространенными для решения проблем, связанных с использованием антибиотиков, включая борьбу с устойчивостью к противомикробным препаратам.
Антибиотикотерапия и сопутствующее управление требуют усилий межпрофессиональной медицинской бригады, в которую входят врачи (MD и DO), практикующие врачи среднего звена (NP и PA), фармацевты и средний медицинский персонал. Это включает в себя использование этих агентов только по клиническим показаниям, таргетную терапию, основанную на восприимчивости инфекционного организма, а также мониторинг побочных эффектов и, где указано, уровней лекарственного средства. Использование межпрофессиональных стратегий с открытым обменом информацией может улучшить терапевтические результаты антибиотикотерапии и свести к минимуму побочные эффекты. [Уровень 5]
Контрольные вопросы
Список литературы
7
Цефалоспорины третьего поколенияЦефотаксим (в/в), цефтриаксон (в/в), цефподоксим (п/о), цефиксим (п/о), цефдинир (п/о), цефдиторен (п/о), цефтибутен (п/о)
Антипсевдомонадные цефалоспорины
Цефтазидим (IV), цефтазидим/авибактам (IV), цефепим (IV) [четвертое поколение], цефтолозон/тазобактам (IV) [также описывается как «пятое поколение»]

 ) — нередко назначаются кормящим мамам. Данные препараты в достаточно малых концентрациях проникают в грудное молоко. Однако стоит учитывать, что эти антибиотики обладают способностью вызывать аллергические явления у малыша и кормящей. Поэтому мама должна следить внимательно за реакцией со стороны малыша. Из побочных эффектов стоит отметить послабление стула.
) — нередко назначаются кормящим мамам. Данные препараты в достаточно малых концентрациях проникают в грудное молоко. Однако стоит учитывать, что эти антибиотики обладают способностью вызывать аллергические явления у малыша и кормящей. Поэтому мама должна следить внимательно за реакцией со стороны малыша. Из побочных эффектов стоит отметить послабление стула.